Method Article
Espectrometria de Massa MALDI imagem de neuropeptídeos na Doença de Parkinson
Neste Artigo
Resumo
Farmacoterapia de reposição de dopamina uso de L-DOPA é o tratamento mais comumente utilizado sintomático da doença de Parkinson, mas é acompanhado por efeitos secundários, incluindo movimentos involuntários anormais, discinesia denominado 1. Aqui, um protocolo para imagiologia espectrometria de massa MALDI é apresentado que detecta alterações nos níveis de cérebro de rato de neuropeptídeos relacionadas com discinesia.
Resumo
MALDI imagem espectrometria de massa (IMS) é uma abordagem poderosa que facilita a análise espacial das espécies moleculares em amostras de tecidos biológicos 2 (Fig.1). A 12 uM secção de tecido fino é coberto com uma matriz de MALDI, o que facilita a dessorção e ionização de peptídeos e proteínas intactas que podem ser detectadas com um analisador de massa, tipicamente usando um TOF MALDI / TOF espectrómetro de massa. Geralmente centenas de picos podem ser avaliados em uma única secção de tecido de cérebro de rato. Em contraste com as técnicas de imagem comumente utilizados, esta abordagem não requer conhecimento prévio das moléculas de interesse e permite a análise não supervisionada e abrangente de múltiplas espécies moleculares, mantendo a especificidade molecular elevado e sensibilidade 2. Aqui nós descrevemos um método MALDI IMS baseada na elucidação de perfis específicos de cada região de distribuição de neuropeptídeos no cérebro do rato da doença de um modelo animal de Parkinson (DP).
PD é uma doença neurodegenerativa com uma prevalência de 1% para pessoas acima de 65 anos de idade 3,4. O tratamento mais comum sintomática baseia-se na reposição de dopamina uso de L-DOPA 5. No entanto, esta é acompanhada de efeitos colaterais graves, incluindo movimentos involuntários anormais, chamadas de L-DOPA induzida discinesias (LID) 1,3,6. Um dos mais proeminente mudança molecular em LID é uma regulação positiva do mRNA opióide precursor prodynorphin 7. Os peptídeos dinorfina modulam a neurotransmissão em áreas do cérebro que são essencialmente envolvidas no movimento de controle 7,8. No entanto, até à data os péptidos opióides exactas que se originam de processamento do precursor de neuropeptídeo não foram caracterizadas. Portanto, utilizamos MALDI IMS em um modelo animal da doença de Parkinson e experimental L-DOPA discinesia induzida.
MALDI imagiologia espectrometria de massa mostrou ser particularmente vantajoso em relação à caracterização neuropeptídeoção, uma vez que as abordagens de anticorpos normalmente utilizados baseados alvo sequências peptídicas conhecidas e anteriormente observadas modificações pós-translacionais. Por outro lado MALDI IMS pode desvendar novos produtos de processamento de peptídeos e, assim, revelar novos mecanismos moleculares de modulação neuropeptídeo de transmissão neuronal. Embora a quantidade absoluta de neuropeptídeos não pode ser determinado por MALDI IMS, a abundância relativa dos iões de péptidos pode ser delineada a partir dos espectros de massa, dando cerca de alterar os níveis de conhecimentos na saúde e na doença. Nos exemplos aqui apresentados, as intensidades de pico de dinorfina B, alfa-neoendorphin e substância P foram encontrados para ser significativamente aumentada no dorsolateral, mas não o corpo estriado, dorsomedial de animais com disquinésia grave envolvendo tronco, facial e músculos orolingual (Fig. 5). Além disso, MALDI IMS revelou uma correlação entre a gravidade da discinesia e os níveis de des-tirosina alfa-neoendorphin, representando um mecanismo previamente desconhecido de inactivação funcionalvação de dinorfinas no estriado como a remoção de N-terminal da tirosina reduz a capacidade da dinorfina do receptor opióide ligação 9. Este é o primeiro estudo sobre a caracterização neuropeptídeo em LID utilizando MALDI IMS e os resultados destacam o potencial da técnica para aplicação em todos os campos da pesquisa biomédica.
Protocolo
O protocolo é ajustado para efeitos de análise estatística dos dados MALDI IMS a partir de secções de ratos múltiplas cérebro, tipicamente 20-30 secções, e consiste em cinco etapas diferentes compreendendo preparação de tecido, a matriz de aplicação, MALDI-TOF MS análise, a avaliação de dados, e neuropeptídeo identificação. Os procedimentos são descritos e descrito em mais detalhada abaixo:
1. Preparação de tecido
Este procedimento inclui a coleta das amostras de tecidos respectivas, bem como o corte de tecido para análise IMS. Um objectivo particular em proteínas e análise péptido é para evitar a degradação proteolítica. Por isso, é essencial trabalhar rápido e diligente durante a dissecção do tecido.
- Sacrificar ratos (tipicamente 250-300 g) por decapitação, remover cérebro de rato dentro de um tempo pós-mortem máximo de 30 anos
- Cortar o tecido congelado sobre um micrótomo criostato a 12 fatias iM e secções de montagem descongelamento-tecido em lâminas de vidro condutoras MALDI (lâminas de estanho óxido de índio e revestidos, Bruker Daltonics) ou alvo MALDI (Fig. 2A-C).
- Secções secos para 15 min sob vácuo e as lâminas armazenar a -80 ° C até posterior utilização. Cortes de tecido devem ser analisados dentro do menor tempo possível, após o corte, mesmo que armazenadas a -80 ° C. Nós achamos que MS qualidade do sinal será reduzido consideravelmente depois de um ano em armazenamento. A fim de reduzir a oxidação de proteínas e peptídeos, o ar no recipiente de armazenamento pode ser substituído com um gás inerte (por exemplo, árgon ou azoto).
2. Matrix aplicação
A aplicação da matrizpasso tem um impacto significativo na qualidade do espectro e requer optimização de vários parâmetros, dependendo do tipo de tecido, bem como o analito de interesse. Estes factores incluem parâmetros químicos, tais como o tipo de matriz, a concentração da matriz, do pH, a lavagem de tecidos e modificadores orgânicos, bem como configurações instrumentais, incluindo o volume de depósito, a resolução lateral e número de deposições 10 (Fig. 2D). Para as experiências de grande escala, é de grande importância para reduzir a variância, por exemplo através da aplicação da matriz para todas as secções dentro de um dia e pelo mesmo operador. Embora existam muitas estratégias para aplicar a solução de matriz, tais como por sublimação ou por spray, a deposição automatizado de matrizes de gotículas de matriz pequenas, cerca de 100-150 picolitro em tamanho, tem sido usado com sucesso para a análise de proteínas pequenas e neuropeptídeos em vários tecidos , incluindo seções do cérebro 9, 10,11, 12, 13.
- Descongele as seções em um dessecador por 1 hnossa.
- Certifique-se que o experimento é cegado por uma pessoa que não seja o operador. Rotular novamente todas as amostras.
- Lavar secções 1x em etanol a 70% (EtOH, à temperatura ambiente, RT) durante 10 seg e duas vezes em 95% de EtOH (RT) durante 10 seg. Para as experiências de grande porte, realizar a lavagem para todo o vidro desliza em conjunto, utilizando uma cuvete de modo a minimizar a variação.
- Secam-se as secções num exsicador durante 10 min.
- Avaliar os cortes de tecido sob um microscópio e verificar se há distorção do tecido, microtears e pequenas fissuras que irá prejudicar MALDI MS qualidade (Fig. 2D).
- Preparar solução de matriz fresco consistindo de 50 mg / mL DHB em metanol a 50%, acetato de amónio 10% 150mm (Amac) e 0,3% de ácido trifluoroacético (TFA) em água.
- Aplicação de matriz é realizada por deposição de gotas discreto em um padrão retangular usando uma impressora a jato de tinta química (CHIP, Shimadzu). O primeiro passo consiste em optimizar os parâmetros experimentais de aplicação de matriz para análise neuropeptídeo includio número de gotículas ng por passagem, número de passagens. Este experimento é realizado através da aplicação de matrizes de matrizes múltiplas com diferentes parâmetros de aplicação na seção de mesmo tecido, garantindo que cada matriz está cobrindo regiões cerebrais similares, tais como corpo caloso, córtex e estriado. A mesma experiência tem de ser feitas a cada parâmetros de tempo são alterados, incluindo estruturas cerebrais diferentes, matrizes diferentes de segmentação analitos específicos, e se os solventes da matriz diferentes são necessários para a extracção de analitos específicos.
- Digitalizar o titular lâmina de vidro com a secção de tecido e alinhar a titular. Definir a matriz para a aplicação da matriz na secção de tecido e especificar o ponto ie resolução espacial de detectar à distância. Aplicar matriz usando o protocolo otimizado na impressora jato de tinta química. Para este experimento utilizou-se um protocolo otimizado para imagens de peptídeo com os parâmetros de impressão: 10 gotas (100 pL gota /), 10 aplicativo passa e um local para detectar distance de 300 mm.
- Digitalização final matriz manchado seções e salvar a imagem para registo prévio para MALDI aquisição de dados (passo 3.4).
- Armazenar as secções até à sua utilização num exsicador sob vácuo.
3. MALDI MS aquisição de dados e de processamento
A análise MS de neuropeptídeos é realizada em um tempo de MALDI instrumento de voo (Ultraflex II, Bruker Daltonics, Alemanha) que opera em modo reflector, usando o software de aquisição de dados assistida a partir de cada mancha única matriz 14. Portanto precisa ensino espacial é imperativa. É essencial que a optimização MALDI aquisição, e especialmente os experimentos de registo alvo são realizadas pelo mesmo operador que deve de preferência ser cegos para os grupos experimentais. Numa experiência em grande escala com lâminas de vidro múltiplas, os experimentos MALDI pode ser realizada por um operador, enquanto uma outra pessoa está a funcionar a impressora de jacto de tinta química.
- Carregar lâminas de vidro para o espectrómetro de massa.
- Verifique a calibração do método de aquisição MALDI usando uma mistura de baixo peso molecular padrão de calibração (Bruker Daltonics).
- Otimizar os parâmetros de aquisição.
- A fim de optimizar o sinal MS e para evitar a ablação de matriz a partir de depósitos de matriz vizinhos, o tamanho do laser e da focagem sobre o tecido deve ser determinada.
- A energia do laser é definido para assegurar a qualidade MS máximo a partir de depósitos como matriz o maior número possível sem elevar a linha de base, reduzindo a resolução dos picos ou saturar o detector.
- Avaliar o número máximo de fotos por local matriz até o ruído só é detectado, muitas vezes, 1000-2000 tiros. Estimar o número de tiros que devem ser acumulados eo número de disparos adquiridos antes da posição do laser dentro de um local deve mudar. A fim de amostra de cada mancha matriz uniformemente, que se acumulam 600 disparos em passos de 25 tiro, para um número total de 24 passos usando uma ranD. padrão de movimento, a partir de cada deposição de matriz.
- Registre-se a digitalização de todas as seções manchadas para coordenadas motor da fase MALDI usando o FlexImaging (v.2.0) 10 e realizar aquisição de dados em lote por software AutoXexuteBatchRunner.exe.
- Processar cada espectros único por meio de linha de base de subtração (Convex Hull V3), nivelamento e calibração externa (opcional), seguido por exportação como um arquivo ASCII (*. Dat, *. Txt ou *. Formato csv) 15.
4. Avaliação dos dados
Avaliação final dos dados compreende dados de pós-processamento e redução de dados por foco apenas em informações de pico, seguido de análise estatística.
- Como passo inicial, as secções MALDI IMS foram avaliados para efeitos overnormalization. Isto pode ser facilmente conseguido através do emprego de ferramentas de visualização de dados, tais como FlexImaging (Bruker Daltonics) ou Biomap (Novartis). Como passo inicial das imagens de íons totais são evaluated antes total de normalização de iões de corrente (TIC), seguido por inspecção manual de imagens de iões simples de distribuição de vários picos de péptidos proeminentes. Olhe para as distribuições de intensidade característicos de pico e se eles estão relacionados com características de tecido (Damages), manchando de qualidade ou normalização efeitos (Fig. 3).
- Delinear regiões de interesses (por exemplo, o striatum) de acordo com as características histológicas e exportar o espectro correspondente no formato de arquivo ascii. De preferência, a normalização dos espectros para a corrente total de iões (TIC) pode ser realizada nesta fase.
- Importar arquivos ASCII em um software de manipulação de dados, tais como Origem (V.8.1, Origin), MATLAB (MathWorks, Natick, MA, EUA) ou R 16. Detecção de pico pode ser realizado utilizando ferramentas de localização de pico incluídos no software, por exemplo, "análise de pico" na origem "ou" mspeaks em Matlab. Exportar os peaklists de todos os espectros como um único arquivo de texto delimitado por tabulação.
- A fim de determinar as fronteiras bin para o péptido detectadopicos, a análise binning é realizada utilizando ferramentas de software adequado (por exemplo pbin 17) ou in-house escrito roteiros para MATLAB ou R. Aqui, o único arquivo de texto contendo todos os dados pico escolhido é carregado para o software e os parâmetros para a determinação da fronteira de pico são especificados por exemplo, como muitas vezes um pico deve estar presente em espectros, a fim de ser relevante para a experiência. Por exemplo, o experimento contém 2 grupos de animais, 5 animais em cada grupo, e 100 espectros são recolhidos a partir de cada animal e região de interesse. Assuma um pico é potencialmente interessante se ele está presente em pelo menos a maioria dos animais em um grupo (3/5) e em pelo menos metade dos espectros dos animais (3x50 = espectros 150), isto irá dar uma percentagem total de 15% para os espectros de 150 positiva do total 1000 espectros (2x5x100). Utilizando a ferramenta pbin, este passo proporciona um arquivo binrange única contendo todas as larguras bin determinados a partir dos dados adquiridos. A fim de verificar se as fronteiras binsão adequados, é fácil de visualizar as caixas em origem, juntamente com os traços espectros originais.
- Peak área de integração pode reduzir a variância que é importante para análise estatística. Usamos um script in-house escrito para R para calcular a área sob a curva entre as fronteiras de pico determinadas no passo 4. Integrados áreas dos picos são importados para MS Excel (v.2007) e análise estatística por meio de testes não paramétricos não pareado, utilizando a ferramenta SAM é realizada 18.
5. Identificação Peptide
Verificação sequência das identidades de péptidos observados é essencial para concluir relevância biológica. A abordagem mais precisa incluir a determinação de cima para baixo verdadeiro diretamente a partir de tecido usando a fragmentação peptídeo por meio de espectrometria de massa (MS / MS), embora as concentrações de peptídeos elevados são necessários para este tipo de análise 12,13. Para peptídeos de baixo abundantes ou péptidos múltiplos com closin / z (valores ± 0,5%), sobre o tecido de análise é prejudicada e análise de tecido fora usando uma estratégia peptidomic é utilizada que inclui a separação de extracção, e MS identificação baseada de neuropeptídeos endógenos. Para a experiência aqui apresentado, o foco central era na detecção de péptidos opióides, que é um desafio particular uma vez que estes péptidos são bastante baixos abundante em comparação com outros neuropeptídeos nos espectros. Além disso, estes péptidos são bastante polar o que os torna relativamente hidrófilo e difícil reter com extracção de péptido comum e técnicas de separação .. Portanto foi aplicado um protocolo previamente relatados para a extracção de tecidos e prefraccionamento péptido opióide em combinação com LC-MS/MS padrão baseados péptido de identificação 9,19.
- Colete cortes coronais de estruturas alvo de interesse (núcleo accumbens, NAc; caudado putamen, CPU). Monte cérebro de rato congelado em um micrótomo criostato e remover o material cerebral circundante (cortex, septo, corpo caloso) com um bisturi. Colete seções (30 mm; n = 50) do NAC dissecados e CPU e degelo montar o NAC e peças da CPU do seções sobre lâminas de vidro diferentes.
- Extrair péptidos fora do tecido pela adição de 100 uL de TFA 5% ACN/0.1%, incubar durante dois minutos e recolher em tubos eppendorf de proteína de baixo custo de ligação. Repita esta etapa duas vezes.
- Realizar prefraccionamento péptido por meio de cromatografia de permuta catiónica forte usando eluição (n = 4) stepwise em força iónica aumentada 19. Secar as amostras sob vácuo usando um concentrador Speedvac.
- Analisar as frações peptídicas por meio de nanofluxo cromatografia líquida de fase reversa C18 (1100, Agilent Technologies, Santa Clara, CA) com interface para electrospray espectrometria de massa (LC-MS/MS). Os experimentos foram realizados em MS um híbrido linear iontrap / transformada de Fourier íon ciclotron de ressonância (FTICR) instrumento (LTQ FT 7T, Thermo Scientific, Waltham, MA,) Peptide fulscan espectros (m / z 150-2000) Foram adquiridos com o analisador de FTICR a uma resolução de massa de alta (100000) seguido por fragmentação subsequente dos 5 picos de péptidos mais intensas do iontrap por meio de dissociação induzida por colisão (CID) 9.
- De identificação da sequência peptídica é efectuada por emparelhamento base de dados e pode ser complementada por de-novo análise de sequenciação. Para a busca banco de dados, motores de busca disponíveis comercialmente (Mascote, XTandem ou Protein Prospector) são empregados 20. As buscas são normalmente realizadas em bancos de dados contendo seqüências de neuropeptídeos conhecidos ou previstos e seqüências de proteínas precursoras de neuropeptídeos 21.
6. Os resultados representativos
Espectrometria de massa MALDI de imagem de secções de tecido estriado como preparados de acordo com o protocolo descrito aqui resultou na detecção de mais de 1000 picos correspondendo a cerca de 300 monoisotópico espécies moleculares (Spectra média mostradona fig. 1). Visualização de dados para proeminentes picos de íons moleculares foi realizada pelo software de imagens Flex e apresentaram distribuições de pico de intensidade característicos que estão bem de acordo com características anatômicas (Fig. 3). Uma outra característica de MALDI IMS é a sua reprodutibilidade relativamente boa. Nesta experiência, o coeficiente total de variância para as intensidades de pico de todas as espécies moleculares detectadas foi de 30%, mas muitos picos exibida variação muito baixa e elevada reprodutibilidade dentro dos grupos de tratamento (Fig. 4). Os dados relativos pico de intensidade de quatro diferentes regiões de interesse, incluindo a parte dorsolateral e dorsomedial do striata tanto lesionado e intactos foram submetidos à análise estatística. A fim de ajustar para comparações múltiplas, simultaneamente, a análise estatística foi realizada por meio de testes não-paramétrico usando a ferramenta de SAM 18. As alterações mais proeminentes foram encontrados na parte dorsolateral da dopamina-desnervado estriado, parkinsoniana. Aqui si alterações gnificant em entre os diferentes grupos de tratamento foram observados para dois péptidos dinorfina; dinorfina B e alfa-neoendorphin (Fig.5). No detalhe, um aumento relativo de ambas as intensidades de pico dinorfina em 50-60% foi observada em animais de alto discinéticos comparação com baixos animais discinéticos e controles de lesão (p <0,05, F (2, 15) = 12,8 DynB, F = 5,7 Aneo; Fig. 5).
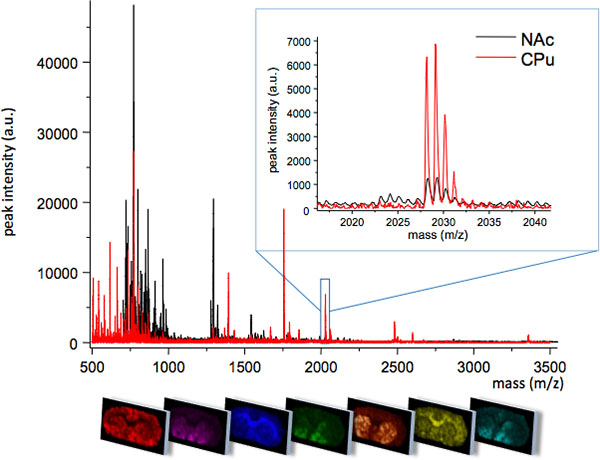
. Figura 1 Média MS traça obtido a partir de duas regiões estreitamente relacionadas do striatum; caudado putamen (CPu) e do núcleo accumbens (NAC). As duas regiões exibir diferentes perfis MS com algumas espécies moleculares excepcionalmente expressos em uma região, ou em diferentes níveis de intensidade de pico (inserção, m / z 2028). O padrão de distribuição espacial de cada pico pode ser visualizada utilizando o software de imagens especializado (painel inferior).
2.jpg "/>
A Figura 2 (A) O cérebro é montada sobre um mandril de criostato usando um meio de incorporação (OTC; seta)., É tomado o cuidado de que a OTC não contamina a área do cérebro a ser seccionado uma vez que a supressão de iões causa OTC de peptídeos. (B, C) secções finas (≈ espessura iM 12) são montados-descongelação em lâminas de vidro MALDI compatíveis e secou-se durante alguns segundos a fim de evitar danos causados por congelamento, como visto em C. (D) Microtears pode ser difícil de detectar a olho nu , mas prejudicar MALDI cristalização da matriz e obliterar MALDI sinal MS. A mesma seção coradas com cresil violeta revela microtears e rachaduras (fotomicrografia canto inferior direito).
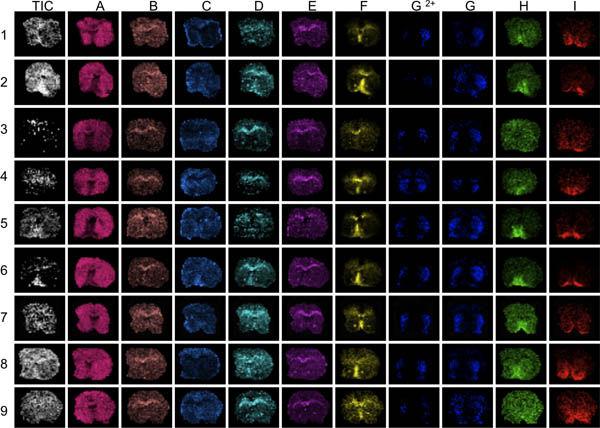
3 A Figura. O primeiro passo na avaliação de dados é visualizar vários picos diferentes em toda a gama de massa analisada (IA). Aqui, as seções estriado de 9 ratos foram fotografadas com MALDI MS. A visualização da média total ina atual vai revelar áreas de conspícuos intensidades de iões de alta ou baixa (setas). Estas áreas podem ser afetadas por sobre ou sob efeitos de normalização e análise de distorcer os dados comprometer os resultados. Definição anatômica pobres das distribuições de pico revelar seções com pico geralmente baixo sinal-ruído, por exemplo, seções 3 e 9, F picos através I.
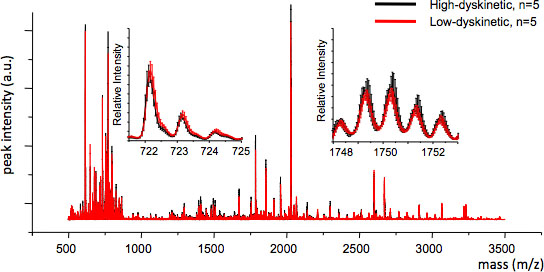
Figura 4. MS reprodutibilidade entre os grupos de tratamento pode ser avaliado por meio do cálculo da média MS traço eo erro padrão para cada valor de m / z (inserções, m / z 722 e 1749). Boa reprodutibilidade assegura análise estatística válido.
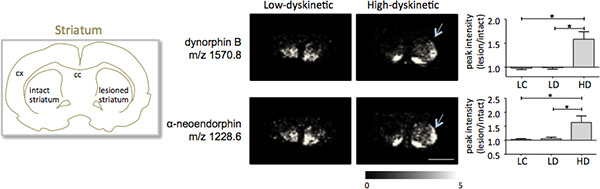
Figura 5. Dinorfina B e intensidades alfa-neoendorphin dos picos são significativamente mais elevadas no 6-OHDA-Lesionado, parkinsoniana, estriado de alta discinéticos animais (HD; setas) em comparação ao grupo controle de baixa discinéticos (LD) e lesão (LC). Intensidades máximas de peptídeos expressos como média fold-change do lado intacto ± SEM (lesão / intacto lado). * P <0,05; cx córtex; cc corpo caloso. Barra de escala de 5 mm.
Discussão
Existem várias vantagens do emprego de espectrometria de massa MALDI imagem no estudo de neuropeptídeos. Uma análise isenta de dados de MS pode revelar que os núcleos cérebro apenas específico, ou como nos resultados aqui apresentados, onde apenas a parte dorsolateral do estriado é associado com uma determinada condição fisiopatológica. Ao reter a informação espacial é então possível para redefinir regiões de interesse para executar a análise estatística com maior sensibilidade e menor variabilidade em comparação com a análise de secções de cérebro inteiro ou através de estudos de tradicionais peptidomics em extractos de péptidos. Além disso, é importante compreender MALDI IMS prontamente pode detectar anteriormente desconhecidos modificações pós-translacionais, mas análises estruturais devem seguir para determinar as posições de aminoácidos exactas que são modificados.
Armadilhas comuns em visualizar os dados MALDI IMS incluem o mapeamento da intensidade do pico máximo de uma escala linear óptico de blACK (0%) para a cor (100%) para todos e cada secção da série experimental (Figura 3), em vez de mapear todas as secções de uma escala comum absoluto onde 100% é a intensidade do pico máximo de todas as secções (Figura 5) . O último método permite a comparação de dados de grupo e visualização das diferenças entre os grupos de tratamento.
Um grande obstáculo na análise de MALDI IMS é a atribuição de peptídeos para picos de massa específicos. Em tecido-espectrometria de massa em tandem, às vezes é possível, mas muitas vezes torna-se bastante difícil 13,14. Nós descobrimos que uma abordagem mais tradicional, incluindo um fraccionamento preparativa em cromatografia de permuta catiónica forte, seguido por LC-MS/MS de fase reversa pode ser usado para neuropeptídeos com sucesso de sequência muitos péptidos e especialmente de opióides. Ainda não é incomum para obter boa qualidade espectros MS / MS que não encontrou nenhum entradas de banco de dados usando os motores de busca comuns, tais como mascote. Nestes casos, de novo seqüenciamento-mão é o onlopção y. A prova definitiva da identidade de pico pode ser obtido por MALDI IMS de secções de tecido a partir do rato knockout adequado, mas isto não é sempre disponível ou possível. Uma alternativa é a validar os resultados através de um método diametralmente diferente, por exemplo por imunotransferência Western ou imuno-histoquímica. Isto pode frequentemente incluir o aumento de anticorpos e uma quantidade significativa de trabalho validar os novos anticorpos.
A estratégia geral apresentado neste protocolo é otimizado para grandes escalas de neuropeptídeos experimentos MALDI IMS, incluindo várias seções e das condições experimentais. O protocolo foi optimizado especialmente para peptídeos opióides e terá grande impacto em estudos futuros, como empregado em diversas áreas da investigação, incluindo a dor e mecanismos subjacentes a resposta endógena para drogas de vício.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos Hanna Warner para contribuir os dados para a Figura 3 e Jonas Prof Bergquist de valiosa contribuição. O sueco Research Council (Grant 522-2006-6416 (MA), 521-2007-5407 (MA); Fundação Wiberg Åke (MA, JH), A Academia Real Sueca de Ciências (MA, JH), eo Chemical sueco Society (JH) são agradecem pelo apoio financeiro.
Materiais
1,1 coleta de amostras e preparação
- Isoflurano (Apoteksbolaget AB, Suécia)
- Os instrumentos cirúrgicos, dois pares de tesouras, uma Rongeur, espátula
- Finamente trituradas gelo seco
- Folha de alumínio e sacos plásticos para o armazenamento
- Criostato (Microm, Heidelberg, Alemanha)
- Índio-estanho óxido (ITO)-revestidos lâminas MALDI (Bruker Daltonics, Alemanha)
- médio da temperatura ideal de corte (PTU) (Sakura Finetek Europa, Países Baixos)
- exsicador de vácuo
1,2 aplicação Matrix
- Acetonitrilo (ACN), metanol (MeOH), etanol (EtOH) de pró-análise grau (Merck, Alemanha).
- Ácido trifluoroacético (TFA) (Sigma Aldrich, St. Louis, MO).
- A água foi purificado com um sistema de purificação de água Milli-Q (Millipore, Bedford, MA).
- CHIP-1000 (Shimadzu, Japão) ou Retrato 630 removedor (LabCyte, Sunnyvale, CA)
1,3 espectrometria de massa
- Ultraflex II (Bruker Daltonics)
- O software FlexImaging (v 2,0, Bruker Daltonics)
- Péptido ou proteína padrão de calibração (Bruker Daltonics)
1,4 processamento de dados
- Origem V.8.1 (OriginLab Corp, Norhampton, MA)
- Matlab versão 7.9.0.529 (MathWorks, Natick, MA)
- pBin ( http://www.vicc.org/biostatistics/software.php )
1,5 identificação Neuropeptídeo
- Sonicador ultra-som
- 10 kDa de peso molecular de corte de filtro (Millipore, Bedford, MA)
- SP Sephadex C 25 gel (Sigma, Alemanha)
- Hypersil coluna (ThermoFisher)
- Piridina, ácido fórmico (FA), acetonitrilo (ACN), metanol (MeOH), etanol (EtOH) de pró-análise grau (Merck, Alemanha).
- Ácido trifluoroacético (TFA) Sigma Aldrich (St. Louis, MO, EUA).
- Agilent 1100 nanofluxo LC, microWPS, coluna C18 (0,075x150mm)
- Agilent 1100 Micro-fractioncollector, placa-alvo Prespotted anchorchip (Bruker Daltonics)
- BioTools software (v 3.1 SR2, Bruker Daltonics)
- Bio software Works (v.3.3, Thermo Fisher; www.thermoscientific.com )
- Software Mascote (v 2.2, MatrixScience; www.matrixscience.com )
- Swepep banco de dados ( www.swepep.org )
Referências
- Obeso, J. A., Olanow, C. W., Nutt, J. G. Levodopa motor complications in Parkinson's disease. Trends Neurosci. 23, S2-S7 (2000).
- Caprioli, R. M., Farmer, T. B., Gile, J. Molecular imaging of biological samples: localization of peptides and proteins using MALDI-TOF MS. MALDI-TOF MS. Anal. Chem. 69, 4751-4760 (1997).
- Obeso, J. A. The evolution and origin of motor complications in Parkinson's disease. Neurology. 55, S13-S20 (2000).
- O, W. H. Noncommunicable Diseases and Mental Health Cluster, Noncommunicable Disease Prevention and Health Promotion Department, Ageing and Life Course. Active Ageing: A Policy framework. , (2002).
- Schapira, A. H. Movement disorders: advances in cause and treatment. Lancet Neurology. , 6-7 (2010).
- Obeso, J. A., Rodriguez-Oroz, M. C., Rodriguez, M., DeLong, M. R., Olanow, C. W. Pathophysiology of levodopa-induced dyskinesias in Parkinson's disease: problems with the current model. Ann. Neurol. 47, S22-S32 (2000).
- Cenci, M. A., Lee, C. S., Bjorklund, A. L-DOPA-induced dyskinesia in the rat is associated with striatal overexpression of prodynorphin- and glutamic acid decarboxylase mRNA. Eur. J. Neurosci. 10, 2694-2706 (1998).
- Andersson, M., Hilbertson, A., Cenci, M. A. Striatal fosB expression is causally linked with l-DOPA-induced abnormal involuntary movements and the associated upregulation of striatal prodynorphin mRNA in a rat model of Parkinson's disease. Neurobiol Dis. 6, 461-474 (1999).
- Hanrieder, J. Alterations of striatal neuropeptides revealed by imaging mass spectrometry. Molecular & Cellular Proteomics. , (2011).
- Cornett, D. S., Reyzer, M. L., Chaurand, P., Caprioli, R. M. MALDI imaging mass spectrometry: molecular snapshots of biochemical systems. Nat. Methods. 4, 828-833 (2007).
- Ljungdahl, Imaging Mass Spectrometry Reveals Elevated Nigral Levels of Dynorphin Neuropeptides in L-DOPA-Induced Dyskinesia in Rat Model of Parkinson's Disease. PLoS ONE. 6, e25653 (2011).
- Groseclose, M. R., Andersson, M., Hardesty, W. M., Caprioli, R. M. Identification of proteins directly from tissue: in situ tryptic digestions coupled with imaging mass spectrometry. J. Mass. Spectrom. 42, 254-262 (2007).
- Andersson, M., Groseclose, M. R., Deutch, A. Y., Caprioli, R. M. Imaging mass spectrometry of proteins and peptides: 3D volume reconstruction. Nat. Methods. 5, 101-108 (2008).
- Deininger, S. -. O., Setou, M. . Imaging Mass Spectrometry. , 199-208 (2010).
- Norris, J. L. Processing MALDI Mass Spectra to Improve Mass Spectral Direct Tissue Analysis. Int. J. Mass. Spectrom. 260, 212-221 (2007).
- Ihaka, R., Gentleman, R. R. A Language for Data Analysis and Graphics. Journal of Computational and Graphical Statistics. 5, 299-314 (1996).
- Tusher, V. G., Tibshirani, R., Chu, G. Significance analysis of microarrays applied to the ionizing radiation response. Proc. Natl. Acad. Sci. U.S.A. 98, 5116-5121 (2001).
- Bergstrom, L., Christensson, I., Folkesson, R., Stenstrom, B., Terenius, L. An ion exchange chromatography and radioimmunoassay procedure for measuring opioid peptides and substance P. Life. Sci. 33, 1613-1619 (1983).
- Falth, M. Neuropeptidomics strategies for specific and sensitive identification of endogenous peptides. Mol. Cell. Proteomics. 6, 1188-1197 (2007).
- Falth, M. SwePep, a database designed for endogenous peptides and mass spectrometry. Mol. Cell. Proteomics. 5, 998-1005 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados