Method Article
MALDI масс-спектрометрии изображений нейропептидов при болезни Паркинсона
В этой статье
Резюме
Допамин фармакотерапии замена с использованием L-ДОФА является наиболее часто используемым симптоматического лечения болезни Паркинсона, но сопровождается побочными эффектами, включая непроизвольные аномальные движения, называемые дискинезии 1. Здесь протокол для визуализации MALDI масс-спектрометрии представлены, который обнаруживает изменения в головном мозге крыс нейропептида уровня, связанных с дискинезии.
Аннотация
MALDI imaging mass spectrometry (IMS) is a powerful approach that facilitates the spatial analysis of molecular species in biological tissue samples2 (Fig.1). A 12 μm thin tissue section is covered with a MALDI matrix, which facilitates desorption and ionization of intact peptides and proteins that can be detected with a mass analyzer, typically using a MALDI TOF/TOF mass spectrometer. Generally hundreds of peaks can be assessed in a single rat brain tissue section. In contrast to commonly used imaging techniques, this approach does not require prior knowledge of the molecules of interest and allows for unsupervised and comprehensive analysis of multiple molecular species while maintaining high molecular specificity and sensitivity2. Here we describe a MALDI IMS based approach for elucidating region-specific distribution profiles of neuropeptides in the rat brain of an animal model Parkinson's disease (PD).
PD is a common neurodegenerative disease with a prevalence of 1% for people over 65 of age3,4. The most common symptomatic treatment is based on dopamine replacement using L-DOPA5. However this is accompanied by severe side effects including involuntary abnormal movements, termed L-DOPA-induced dyskinesias (LID)1,3,6. One of the most prominent molecular change in LID is an upregulation of the opioid precursor prodynorphin mRNA7. The dynorphin peptides modulate neurotransmission in brain areas that are essentially involved in movement control7,8. However, to date the exact opioid peptides that originate from processing of the neuropeptide precursor have not been characterized. Therefore, we utilized MALDI IMS in an animal model of experimental Parkinson's disease and L-DOPA induced dyskinesia.
MALDI imaging mass spectrometry proved to be particularly advantageous with respect to neuropeptide characterization, since commonly used antibody based approaches targets known peptide sequences and previously observed post-translational modifications. By contrast MALDI IMS can unravel novel peptide processing products and thus reveal new molecular mechanisms of neuropeptide modulation of neuronal transmission. While the absolute amount of neuropeptides cannot be determined by MALDI IMS, the relative abundance of peptide ions can be delineated from the mass spectra, giving insights about changing levels in health and disease. In the examples presented here, the peak intensities of dynorphin B, alpha-neoendorphin and substance P were found to be significantly increased in the dorsolateral, but not the dorsomedial, striatum of animals with severe dyskinesia involving facial, trunk and orolingual muscles (Fig. 5). Furthermore, MALDI IMS revealed a correlation between dyskinesia severity and levels of des-tyrosine alpha-neoendorphin, representing a previously unknown mechanism of functional inactivation of dynorphins in the striatum as the removal of N-terminal tyrosine reduces the dynorphin's opioid-receptor binding capacity9. This is the first study on neuropeptide characterization in LID using MALDI IMS and the results highlight the potential of the technique for application in all fields of biomedical research.
протокол
Протокол настраивается для статистического анализа данных МСМ MALDI из нескольких разделов мозга крысы, как правило, 20-30 секций и состоит из пяти различных этапов подготовки включает ткани, матрица приложения, MALDI-TOF MS анализа, оценки данных, а также нейропептида идентификации. Процедуры изложены и описаны более подробно описано ниже:
1. Ткань подготовки
Эта процедура включает в себя сбор соответствующих образцов тканей, а также ткани срезов для анализа IMS. Конкретной цели белков и пептидов анализа, чтобы избежать протеолитической деградации. Поэтому очень важно работать быстро и прилежным в ткани вскрытия.
- Жертвоприношение крыс (как правило, 250-300 г) путем обезглавливания, удалить мозга крыс в течение максимум посмертного время <30 и заморозить на порошкообразный сухого льда перед передачей в морозильной камере -80 ° C. Быстрая заморозка с использованием жидкого азотаувеличивают риск microtears в ткани головного мозга, которые негативно влияют на матрицу кристаллизации и тем самым снизить MS качества (рис. 2). Всего мозг может храниться в течение нескольких лет, прежде чем секционирования без потери качества сигнала MS.
- Вырезать замороженной ткани на криостате микротома до 12 мкм ломтиками и оттепель монтажа срезов тканей на проводящих стеклах MALDI (оксид индия и олова покрытием слайды, Bruker Daltonics) или MALDI мишени (рис. 2A-C).
- Сухой разделов в течение 15 мин под вакуумом и хранят слайды при температуре -80 ° C до дальнейшего использования. Срезы тканей должна быть проанализирована в кратчайшие сроки после секционирования, даже если хранится при температуре -80 ° C. Мы считаем, что MS качество сигнала будет заметно сократилось за год на хранение. Для того, чтобы уменьшить окисление белков и пептидов, воздух в контейнер для хранения может быть заменен инертным газом (например, аргон или азот).
2. Матрица применение
Матрица применениешаг оказывает существенное влияние на спектр и качество требует оптимизации нескольких параметров в зависимости от вида ткани, а также аналита интерес. Эти факторы включают в себя химические параметры, такие как тип матрицы, матрица концентрации, рН, ткани мытья и органических модификаторов, а также инструментальные параметры, включая месторождения объем, боковые разрешение и количество отложений 10 (рис. 2). Для больших экспериментов масштабе, очень важно, чтобы уменьшить дисперсию, например, путем применения матрицы для всех слоев в один день и одним и тем же оператором. Хотя существует много стратегий применяется матрица решений, таких как сублимацией или распылением, автоматизированные осаждения массивов мелких капель матрица, около 100-150 пиколитра в размере, успешно используется для анализа небольших белков и нейропептидов в различных тканях , в том числе мозга разделы 9, 10,11, 12, 13.
- Размораживание разделов в эксикаторе в течение 1 ч.наши.
- Убедитесь, что эксперимент ослеплен лицо, не являющееся оператором. Re-этикетка всех образцов.
- Вымойте разделы 1x в 70% этанола (этанол, при комнатной температуре, RT) на 10 секунд и дважды в 95% этанола (RT) на 10 сек. Для больших экспериментов, выполнить мытье всех стекол между собой с помощью кюветы для того, чтобы свести к минимуму изменения.
- Сухие участки в эксикаторе в течение 10 мин.
- Оцените срезах тканей под микроскопом, и проверить его на ткань искажения, microtears и небольшие трещины, которые ухудшают качество MALDI MS (рис. 2).
- Подготовить свежее решение матрицу, состоящую из 50 мг / мл DHB в 50% метанола, 10% 150 мМ ацетата аммония (AMAC) и 0,3% трифторуксусной кислоты (ТФК) в воде.
- Матрица приложение выполняется дискретное осаждения капли в прямоугольной картины с помощью принтера химических струйные (CHIP, Shimadzu). Первый шаг заключается в оптимизации параметров эксперимента матрицы приложение для нейропептида анализ includiнг количество капель за один проход, количество проходов. Этот эксперимент производится за счет применения нескольких массивов матрица с различными параметрами приложения на том же разделе ткани, а убедившись, что каждый массив, охватывающих аналогичные участки мозга, таких как мозолистого тела мозга, и полосатом теле. Тот же эксперимент должен быть выполнен каждый раз, изменении параметров, в том числе различных структур головного мозга, различные матрицы, ориентированные на конкретные аналитов, а если матрица различных растворителей, необходимых для извлечения конкретных аналитов.
- Сканирование держатель стекло с срез ткани и привести его владельца. Определите массив для матрицы заявку на срез ткани и указать место, т.е. пространственное разрешение, чтобы определить расстояние. Применение матрицы с использованием оптимизированного протокола о струйных принтеров химических веществ. Для этого эксперимента мы использовали оптимизированный протокол для пептида изображений со следующими параметрами печати: 10 капель (100 PL / падения), 10 приложений и передает места на место гistance 300 мкм.
- Сканирование окончательной матрицы заметил разделам и сохранить изображение на регистрацию до MALDI сбора данных (шаг 3.4).
- Хранить разделы до дальнейшего использования в эксикаторе под вакуумом.
3. MALDI MS сбора и обработки данных
MS анализа нейропептидов выполняется на время MALDI полета инструмента (Ultraflex II, Bruker Daltonics, Германия), работающей в режиме отражателя, используя программное обеспечение помощи сбора данных от каждого отдельного места матрицу 14. Поэтому точное пространственное обучение является обязательным условием. Важно, что оптимизация MALDI, приобретение и особенно эксперименты цель регистрации осуществляется одним и тем же оператором, желательно, быть ослепленным экспериментальной группы. В больших масштабах эксперимента с несколькими слайдами стекла, MALDI эксперименты могут быть выполнены одним оператором в то время как другой человек работает принтер химических струйной печати.
- Загрузка стеклах в масс-спектрометре.
- Проверьте калибровку метода MALDI приобретение использование низкомолекулярных стандартной смеси калибровки (Bruker Daltonics).
- Оптимизация параметров измерения.
- В целях оптимизации MS сигнала и избежать разрушающимся матрица из соседних месторождений матрицы, размер лазера и оптимальную фокусировку на ткани должен быть определен.
- Лазерной энергии устанавливается для обеспечения максимального качества МС из многих месторождений матрицы насколько это возможно без подъемной задней линии, снижение пика разрешение или насыщения детектора.
- Оцените максимальное количество кадров в матрице месте, пока только шум обнаруживается, зачастую 1000-2000 выстрелов. Оцените количество кадров, которые должны быть накоплены и количество снимков, приобретенных до лазерной позиции в месте должна измениться. Для того, чтобы попробовать каждую матрицу место равномерно, мы накапливаем 600 выстрелов в 25 шагов выстрелу, для общего числа в 24 шагов, используя РАНдом картина движения, от каждой матрицы осаждения.
- Регистрация сканирование всех разделов заметил двигатель координаты этап MALDI использованием FlexImaging (v.2.0) 10 и выполнять сбор данных в пакетном режиме, программное обеспечение AutoXexuteBatchRunner.exe.
- Обработка каждого отдельного спектра с помощью базовых вычитание (выпуклый корпус V3), сглаживание и внешней калибровкой (опция), а затем экспорт в текстовый файл (*. DAT, *. TXT или *. CSV формат) 15.
4. Оценка данных
Окончательная оценка данных включает в себя обработку данных и данных после сокращения внимания только на пике информации, после статистического анализа.
- В качестве первого шага, MALDI IMS разделы были оценены на overnormalization эффектов. Это может быть легко достигнута, используя средства визуализации данных, таких как FlexImaging (Bruker Daltonics) или BioMap (Novartis). В качестве первого шага всего изображений иона эваluated до полного ионного тока (TIC) нормализация, после ручной проверки одного распределения ионов изображения различных выраженные пики пептида. Посмотрите на характерное распределение интенсивности пика и, если они связаны с особенностями тканей (убытков), определение качества и нормализации эффектов (рис. 3).
- Очертить области интересов (например, полосатого тела) в зависимости от гистологических особенностей и экспорт соответствующих спектров в текстовом формате. Предпочтительно, нормализацию спектров полного тока ионов (TIC) могут быть выполнены на данном этапе.
- Импорт ASCII-файлы в программное обеспечение обработки данных, таких как происхождение (v.8.1, OriginLab), MATLAB (MathWorks, Натик, штат Массачусетс, США), R 16. Пик обнаружения можно выполнить с помощью пик поиске инструментов, включенных в программу, например, "пик анализа" в происхождении или "mspeaks" в Matlab. Экспорт peaklists от всех спектров как единый текстовый файл с разделителями табуляции.
- Для того чтобы определить границы для бен обнаружены пептидныепики, биннинга анализ осуществляется с помощью соответствующих программных средств (например, pbin 17) или в доме написаны сценарии для MATLAB или R. При этом один текстовый файл, содержащий все пике взял данные будут загружены в программное обеспечение и параметры для определения границ пика указаны например, как часто пик должен присутствовать в спектре для того, чтобы иметь отношение к эксперименту. Например, эксперимент состоит из 2 групп животных, 5 животных в каждой группе, 100 спектры собранных с каждого животного и область интересов. Предположим, что пик является потенциально интересным, если оно присутствует, по крайней мере, большинство животных в одной группе (3/5) и, по крайней мере половина спектров этих животных (3x50 = 150 спектров), это даст общий процент 15% для 150 положительных спектрах из общей 1000 (2x5x100) спектров. Используя инструмент pbin, этот шаг дает один файл, содержащий все binrange бен ширина определяется из полученных данных. Для того, чтобы убедиться, что бен границподходят, то легко представить себе в бункерах происхождения вместе с оригиналом следы спектров.
- Пик области интеграции могут уменьшить дисперсию, что важно для статистического анализа. Мы используем в доме написанный сценарий для R вычислить площадь под кривой между пиком границы определяются в пункте 4. Комплексная площади пика импортируются в MS Excel (v.2007) и статистического анализа, с помощью непараметрических непарный тестирования с использованием инструментов SAM выполняется 18.
5. Пептида идентификации
Последовательность проверки наблюдаемых тождества пептид необходимо для того, чтобы заключить биологической значимости. Наиболее точный подход включает истинно сверху вниз определения непосредственно от ткани с помощью пептидных фрагментации с помощью тандемной масс-спектрометрии (MS / MS), хотя высокая концентрация пептида, необходимые для такого анализа 12,13. При низких обильные пептидов или пептиды с несколькими Клосает / г значения (± 0,5%), на анализ ткани нарушается и с анализом ткани с помощью peptidomic стратегия используется, что включает в себя добычу, выделения и идентификации на основе MS эндогенных нейропептидов. Для эксперимента, представленные здесь, в центре внимания был на опиоидные обнаружения пептида, который является особой проблемой, так как эти пептиды являются достаточно низкими по сравнению с обильным других нейропептидов в спектрах. Кроме того, эти пептиды являются полярными, а что делает их относительно гидрофильных и трудно сохранить с общей добычей пептида и методов разделения .. Поэтому мы применяли ранее протокол для извлечения тканей и опиоидные prefractionation пептида в сочетании со стандартной LC-MS/MS основана пептида идентификации 9,19.
- Соберите корональных разделов целевой структуры интереса (прилежащем ядре, NAC, хвостатое скорлупы, процессор). Установите замороженных головного мозга крыс в криостате микротома и удалите окружающие мозг материала (соответствуеттекс, перегородки, мозолистое тело) с помощью скальпеля. Сбор секций (30 мкм, N = 50) расчлененный NAc и процессор и оттаивания установить NAc и процессор части разделов на разных слайдах стекла.
- Извлечение пептидов от ткани, добавив 100 мкл 5% ACN/0.1% TFA, инкубировать в течение двух минут и собирают в Эппендорф низкой связывания с белками труб. Повторите этот шаг дважды.
- Выполните пептид prefractionation с помощью сильной катионообменной хроматографии использованием ступенчатого (п = 4) элюирования на повышение ионной силы 19. Высушите вниз образцов в вакууме помощью speedvac концентратора.
- Анализ пептидных фракций путем nanoflow C18 обратная фаза жидкостной хроматографии (1100, Agilent Technologies, Санта-Клара, Калифорния), сопряжено с электрораспылением тандемной масс-спектрометрии (LC-MS/MS). MS Эксперименты проводились на гибридный линейный iontrap / преобразование Фурье ионного циклотронного резонанса (FTICR) инструмент (КТЛ FT 7T, Thermo Scientific, Waltham, MA) пептида fulscan спектра (т / г 150-2000) Были приобретены с FTICR анализатор с высоким разрешением массы (100000) с последующей фрагментацией 5 самых интенсивных пептидных пиков в iontrap путем столкновения индуцированной диссоциации (CID) 9.
- Пептида идентификации последовательности выполняемых базой данных соответствия и могут быть дополнены де-Ново анализ последовательности. Для поиска в базе данных, имеющихся в поисковых системах (Талисман, XTandem или белка старатель) используются 20. Обыски, как правило, выполняется по базам данных, содержащим последовательности известных или прогнозируемых нейропептидов и последовательности нейропептида белков предшественников 21.
6. Представитель Результаты
MALDI масс-спектрометрии изображений из полосатой ткани разделов, подготовленных в соответствии с протоколом, описанные здесь привели к обнаружению более 1000 пиков, соответствующих примерно 300 моноизотопный молекулярных (в среднем спектров показална рис. 1). Визуализация данных за выдающийся молекулярный ион пики были достигнуты с помощью программного обеспечения Flex изображений и показал характерный пик распределения интенсивности, которые также в соответствии с анатомическими особенностями (рис. 3). Еще одной особенностью MALDI IMS является его относительная хорошую воспроизводимость. В этом эксперименте, общий коэффициент дисперсии интенсивностей пиков всех обнаруженных молекулярных составил 30%, но многие пики отображается очень низкая изменчивость и высокая воспроизводимость в группах (рис. 4). Относительная интенсивность пика данные из четырех различных регионах, представляющих интерес, в том числе и дорсолатеральной дорсомедиального частью как пораженный и сохранности STRIATA были подвергнуты статистическому анализу. Для того, чтобы настроить для множественных сравнений одновременно, статистический анализ был выполнен с помощью непараметрического тестирования с использованием инструментов SAM 18. Наиболее существенные изменения были обнаружены в дорсолатеральной часть дофамина денервированного, паркинсонизма полосатом теле. Здесь си gnificant изменения между различными группами лечения не наблюдалось в течение двух пептидов динорфина; динорфина B и альфа-neoendorphin (рис.5). В деталях, относительное увеличение интенсивности и динорфином пика на 50-60% наблюдается в высоких дискинезии животных по сравнению с низким дискинезии животных и поражения контроля (р <0,05, F (2, 15) = 12,8 DynB, F = 5.7 aNeo; Рис. 5).
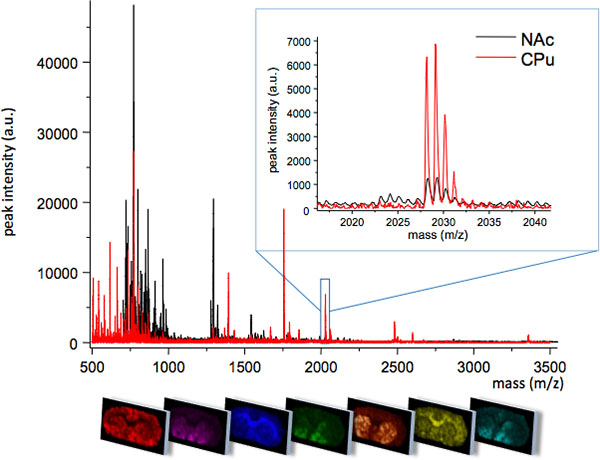
На рис. 1 Средний MS прослеживает получены из двух тесно связанных регионах стриатуме, хвостатое скорлупы (CPU) и прилежащем ядре (NAC). Двух регионов отображения различных профилей MS с некоторыми молекулярных однозначно выражается в одном регионе, или на различных уровнях интенсивности пика (вставка, т / г 2028 г.). Пространственной структуры распределения каждого пика могут быть визуализированы с помощью специализированного ПО для обработки изображений (нижняя панель).
2.jpg "/>
На рисунке 2 (А) мозга устанавливается на криостате патрон использованием вложение средств массовой информации (OTC, стрелка)., Принимаются меры, что внебиржевой не загрязняет области мозга, что секционные с ионной OTC причиной подавления пептидов. (B, C) тонких секций (≈ 12 мкм толщиной) являются оттепели установленный на MALDI совместимы стеклянные пластинки и сушат в течение нескольких секунд, чтобы избежать замораживания ущерб, как показано в С (D) Microtears может быть трудно обнаружить невооруженным глазом , но ухудшают MALDI матриц кристаллизации и уничтожить MALDI MS сигнала. В этом же разделе окрашивали крезиловый фиолетовый показывает microtears и трещин (в нижнем правом микрофотографии).
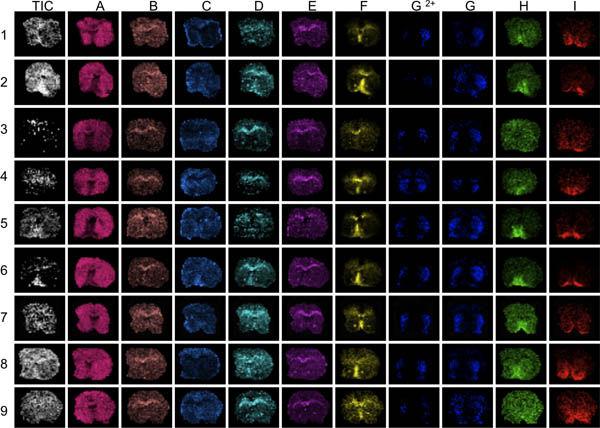
Рисунок 3. Первым шагом в оценке данных для визуализации различных пиков по всей области масс проанализированы (AI). Здесь полосатой разделы с 9 мышей, полученную с использованием MALDI MS. Визуализация среднего общего яна ток выявить области заметно высокой или низкой интенсивности ионного (стрелки). Эти области могут быть затронуты более или недостаточно нормализации эффекты и искажать данные анализа ущерба для результата. Плохо анатомические определения пик распределения выявить участки с низким пиком в целом сигнал-шум, например, разделы 3 и 9, пики F по I.
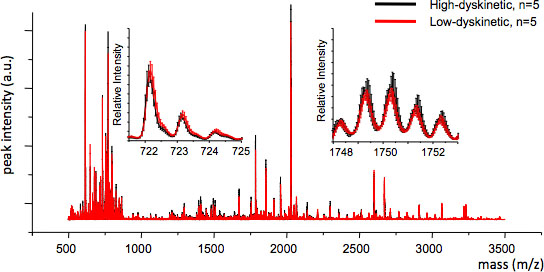
Рисунок 4. MS воспроизводимость между группами лечения можно оценить путем вычисления среднего MS след и стандартные ошибки для каждого т / г значение (вставки, м / з 722 и 1749). Хорошая воспроизводимость обеспечивает действительно статистического анализа.
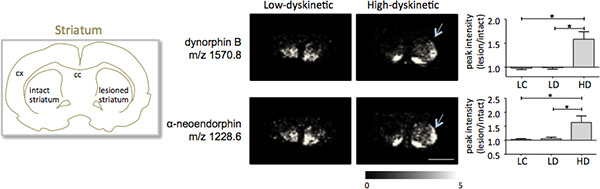
Рисунок 5. Динорфина B и альфа-neoendorphin пик интенсивности значительно увеличился в 6-OHDA-Пораженный, паркинсонизма, стриатуме высокой дискинезии животных (HD; стрелки) по сравнению с низким дискинезии (LD) и поражение контрольной группе (ТК). Пептиды пиковой интенсивности в виде среднем раз изменения интактной стороне ± SEM (поражение / интактной стороне). * Р <0,05; сх коры; вв мозолистого тела. Шкала бар 5 мм.
Обсуждение
Есть несколько преимуществ использования изображений MALDI масс-спектрометрии в исследовании нейропептидов. Непредвзятый анализ данных MS могу сообщить, что только определенные мозга ядер, или, как в результаты, представленные здесь, где только дорсолатеральной части полосатого тела связана с определенным патофизиологические состояния. Сохраняя пространственную информацию, тогда можно переопределить регионах, представляющих интерес для выполнения статистического анализа с высокой чувствительностью и более низкая вариабельность по сравнению с анализом целые разделы мозга или с помощью традиционных исследований peptidomics на пептидных экстрактов. Кроме того, важно понимать, MALDI IMS легко может обнаружить неизвестные ранее пост-трансляционной модификации, но и структурного анализа должны следовать, чтобы определить точное аминокислот в позициях, которые были изменены.
Распространенные ошибки в визуализации MALDI IMS данные включают отображение максимальной интенсивности пика линейных оптических шкале от блACK (0%) до цвета (100%) для каждого раздела в серии опытов (рис. 3), а отображение всех разделов общей абсолютной шкале, где 100% максимальной интенсивности пика всех разделов (рис. 5) . Последний метод позволяет сравнивать группы и визуализации данных различий между группами лечения.
Основным препятствием в анализ MALDI IMS является предоставление пептидов конкретные пики массы. На ткани тандем-масс-спектрометрии, иногда можно, но часто оказывается довольно сложно 13,14. Мы считаем, что более традиционного подхода, в том числе фракционирования препаративной на сильном катионообменной хроматографии с последующей обратной LC-MS/MS фаза может быть успешно использованы для последовательности многих нейропептидов и особенно опиоидных пептидов. До сих пор не редкость, чтобы получить хорошее качество MS / MS спектры, что не соответствует ни записей в базе данных с помощью обычных поисковых систем, таких, как талисман. В этих случаях де-Ново-последовательность на руку ONLУ варианта. Окончательное доказательство пик идентичность может быть получен MALDI IMS в срезах тканей с соответствующей мыши нокаутом, но это не всегда доступны или возможности. В качестве альтернативы можно проверить результаты диаметрально другой метод, например, западную иммуноблоттинга и иммуногистохимии. Это может часто включают в себя повышение антител и значительный объем работы, проверка новых антител.
Общей стратегии, представленные в этом протокол оптимизирован для крупномасштабных экспериментов MALDI нейропептида IMS в том числе несколько разделов и условий эксперимента. Протокол был оптимизирован специально для опиоидных пептидов и будет иметь большое влияние в будущих исследованиях, как, занятых в различных областях исследований, включая механизмы, лежащие боль и эндогенные реакции на препараты наркомании.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Мы благодарим Ханна Warner за вклад данные для 3 и профессор Йонас Бергквист за ценный вклад. Шведский Совет по исследованиям (грант 522-2006-6416 (MA), 521-2007-5407 (MA), Фонда Оке Виберг (MA, JH), Королевской академии шведского наук (MA, JH) и Шведское химическое Общество (JH) с благодарностью за финансовую поддержку.
Материалы
1.1 Сбор и подготовка образцов
- Изофлюран (Apoteksbolaget AB, Швеция)
- Хирургические инструменты, две пары ножниц, костные кусачки, шпатель
- Измельченных сухого льда
- Алюминиевой фольги и пластиковых мешков для хранения
- Криостат (Microm, Гейдельберг, Германия)
- Индия-олова (ITO) покрытием слайды MALDI (Bruker Daltonics, Германия)
- оптимальная температура среды резки (ОКТ) (Сакура Finetek Европа, Нидерланды)
- вакуум эксикаторе
1,2 Матрица применение
- Ацетонитрил (АКС), метанол (метанол), этиловый спирт (этанол), про-анализ степени (Merck, Германия).
- Трифторуксусной кислоты (ТФК) (Sigma Aldrich, Сент-Луис, штат Миссури).
- Вода очищается Milli-Q система очистки (Millipore, Bedford, MA).
- CHIP-1000 (Shimadzu, Япония) или портрет 630 наблюдателя (LabCyte, Саннивейл, Калифорния)
1,3 Масс-спектрометрия
- Улtraflex II (Bruker Daltonics)
- FlexImaging программное обеспечение (v 2.0, Bruker Daltonics)
- Пептид или белок калибровочный стандарт (Bruker Daltonics)
1,4 обработки данных
- Происхождение v.8.1 (OriginLab Corp, Norhampton, MA)
- Matlab версии 7.9.0.529 (MathWorks, Натик, штат Массачусетс)
- pBin ( http://www.vicc.org/biostatistics/software.php )
1,5 Нейропептид идентификации
- Ультразвуковое sonicator
- 10 кДа молекулярная масса отсечки фильтра (Millipore, Bedford, MA)
- SP Сефадекс C 25 гель (Sigma, Германия)
- Hypersil колонке (ThermoFisher)
- Пиридин, муравьиная кислота (FA), ацетонитрил (АКС), метанол (метанол), этиловый спирт (этанол), про-анализ степени (Merck, Германия).
- Трифторуксусной кислоты (ТФК) Sigma Aldrich (St. Louis, Миссури, США).
- Agilent 1100 nanoflow LC, microWPS, C18 колонке (0.075x150mm)
- Agilent 1100 Micro-fractioncollector, Prespotted целевой AnchorChip пластины (Bruker Daltonics)
- BioTools программное обеспечение (V 3.1 SR2, Bruker Daltonics)
- Биография Работы программного обеспечения (v.3.3, Thermo Fisher; www.thermoscientific.com )
- Талисман программного обеспечения (V 2.2, MatrixScience; www.matrixscience.com )
- Swepep базы данных ( www.swepep.org )
Ссылки
- Obeso, J. A., Olanow, C. W., Nutt, J. G. Levodopa motor complications in Parkinson's disease. Trends Neurosci. 23, S2-S7 (2000).
- Caprioli, R. M., Farmer, T. B., Gile, J. Molecular imaging of biological samples: localization of peptides and proteins using MALDI-TOF MS. MALDI-TOF MS. Anal. Chem. 69, 4751-4760 (1997).
- Obeso, J. A. The evolution and origin of motor complications in Parkinson's disease. Neurology. 55, S13-S20 (2000).
- O, W. H. Noncommunicable Diseases and Mental Health Cluster, Noncommunicable Disease Prevention and Health Promotion Department, Ageing and Life Course. Active Ageing: A Policy framework. , (2002).
- Schapira, A. H. Movement disorders: advances in cause and treatment. Lancet Neurology. , 6-7 (2010).
- Obeso, J. A., Rodriguez-Oroz, M. C., Rodriguez, M., DeLong, M. R., Olanow, C. W. Pathophysiology of levodopa-induced dyskinesias in Parkinson's disease: problems with the current model. Ann. Neurol. 47, S22-S32 (2000).
- Cenci, M. A., Lee, C. S., Bjorklund, A. L-DOPA-induced dyskinesia in the rat is associated with striatal overexpression of prodynorphin- and glutamic acid decarboxylase mRNA. Eur. J. Neurosci. 10, 2694-2706 (1998).
- Andersson, M., Hilbertson, A., Cenci, M. A. Striatal fosB expression is causally linked with l-DOPA-induced abnormal involuntary movements and the associated upregulation of striatal prodynorphin mRNA in a rat model of Parkinson's disease. Neurobiol Dis. 6, 461-474 (1999).
- Hanrieder, J. Alterations of striatal neuropeptides revealed by imaging mass spectrometry. Molecular & Cellular Proteomics. , (2011).
- Cornett, D. S., Reyzer, M. L., Chaurand, P., Caprioli, R. M. MALDI imaging mass spectrometry: molecular snapshots of biochemical systems. Nat. Methods. 4, 828-833 (2007).
- Ljungdahl, Imaging Mass Spectrometry Reveals Elevated Nigral Levels of Dynorphin Neuropeptides in L-DOPA-Induced Dyskinesia in Rat Model of Parkinson's Disease. PLoS ONE. 6, e25653 (2011).
- Groseclose, M. R., Andersson, M., Hardesty, W. M., Caprioli, R. M. Identification of proteins directly from tissue: in situ tryptic digestions coupled with imaging mass spectrometry. J. Mass. Spectrom. 42, 254-262 (2007).
- Andersson, M., Groseclose, M. R., Deutch, A. Y., Caprioli, R. M. Imaging mass spectrometry of proteins and peptides: 3D volume reconstruction. Nat. Methods. 5, 101-108 (2008).
- Deininger, S. -. O., Setou, M. . Imaging Mass Spectrometry. , 199-208 (2010).
- Norris, J. L. Processing MALDI Mass Spectra to Improve Mass Spectral Direct Tissue Analysis. Int. J. Mass. Spectrom. 260, 212-221 (2007).
- Ihaka, R., Gentleman, R. R. A Language for Data Analysis and Graphics. Journal of Computational and Graphical Statistics. 5, 299-314 (1996).
- Tusher, V. G., Tibshirani, R., Chu, G. Significance analysis of microarrays applied to the ionizing radiation response. Proc. Natl. Acad. Sci. U.S.A. 98, 5116-5121 (2001).
- Bergstrom, L., Christensson, I., Folkesson, R., Stenstrom, B., Terenius, L. An ion exchange chromatography and radioimmunoassay procedure for measuring opioid peptides and substance P. Life. Sci. 33, 1613-1619 (1983).
- Falth, M. Neuropeptidomics strategies for specific and sensitive identification of endogenous peptides. Mol. Cell. Proteomics. 6, 1188-1197 (2007).
- Falth, M. SwePep, a database designed for endogenous peptides and mass spectrometry. Mol. Cell. Proteomics. 5, 998-1005 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены