Method Article
Os pequenos extratos nucleares para ensaios funcionais da expressão gênica Machineries
Neste Artigo
Resumo
Um protocolo para a preparação de robusta, extratos de pequena escala HeLa nucleares é descrito. Este protocolo é valiosa para os ensaios que requerem o uso de pequenas populações de células, tais como as células tratadas com fármacos ou RNAi. O método deve ser aplicável a uma ampla variedade de ensaios de expressão génica e outros tipos celulares, incluindo células do paciente.
Resumo
Uma grande quantidade de progresso da expressão do gene compreensão foi feita utilizando sistemas in vitro. Para a maioria dos estudos, ensaios funcionais são realizadas utilizando extractos que são preparados em grandes quantidades a partir de 10-50 ou mais litros de células cultivadas em suspensão. No entanto, estas preparações em grande escala não são passíveis de se rapidamente a testar os efeitos in vitro que resultam de uma variedade de tratamentos celulares in vivo ou condições. Este artigo de vídeo revista mostra um método para a preparação funcionais em pequena escala extractos nucleares, utilizando células HeLa como um exemplo. Este método é realizado utilizando apenas três placas 150 mm de células cultivadas em monocamadas aderentes. Para ilustrar a eficácia dos extractos de pequena escala, mostramos que eles são tão activo como a granel extractos nucleares para acoplados a RNA polimerase II de transcrição / splicing reacções. Para demonstrar a utilidade do protocolo extracto, mostramos que splicing é abolida em extractos preparados a partir de células HeLas tratados com o inibidor de splicing droga E7107. O protocolo de pequena escala devem ser geralmente aplicável a qualquer processo ou tipo de célula que podem ser investigado in vitro utilizando extractos celulares. Estes incluem células do paciente que só estão disponíveis em quantidades limitadas ou células expostas a inúmeros agentes como as drogas, agentes de danificar o DNA, RNAi, ou transfecção, que requerem o uso de populações de células pequenas. Além disso, pequenas quantidades de células cultivadas de fresco são convenientes e / ou necessários para algumas aplicações.
Protocolo
1. Crescer células HeLa para a Extração Nuclear
- As células HeLa em três placas 150 mm com placas de meio DMEM suplementado com 10% de FBS e 1% de penicilina / estreptomicina. Crescer em um 37 ° C incubadora com 5% de CO 2 até que as células são confluentes a 90%.
Dica-Split células 1:10 de uma placa confluente e colheita 3 dias após a divisão.
Tip-uma placa extra podem ser cultivadas em caso não existem células suficientes, com três placas (por exemplo, se as células estão a menos de 90% confluentes).
2. Prepare e refrigere Solutions extrato nuclear
- Preparar soluções frescas como descrito na Tabela 2.
- Alíquota de 10 ml de tampão hipotónico em um tubo Falcon 15 ml. Alíquota de 1 ml de tampão salino de alta e 1 ml de tampão salino de baixo em tubos de 1,5 ml de Eppendorf. Relaxe os buffers no gelo. Adicionar os volumes apropriados de PMSF e DTT a cada tampão imediatamente antes da utilização (ver Tabela 1).
3. Coleta de células HeLa para Extração Nuclear
- Aspirar meios a partir das células e lava-se as células uma vez com 13 ml de PBS 1X temperatura ambiente por placa.
- Aspirar a lavagem PBS.
Tip-Aspirar o máximo de PBS quanto possível, por aspiração primeiro, em seguida, a placa de pé sobre o seu lado, à espera de alguns segundos, e aspirando o resto.
- Usando um levantador célula, raspar as células para a borda inferior das placas, e depois transferir as células para um tubo Eppendorf. Evite fazer bolhas. As 3 placas de células raspadas deve caber em um tubo Eppendorf de 1,5 ml.
Tip-É mais fácil para estimar o volume de células se um tubo de Eppendorf é usado. Para escala, utilizar tubos de Falcon.
- Centrifugar a 4 ° C numa microcentrífuga durante 5 min a 100 xg para sedimentar as células.
4. Inchar células HeLa em tampão hipotónico
- Aspirar cuidadosamente o PBS a partir do pellet celular e estimar o hematócrito (PCV), olhando para a gradação do tubo. Três placas confluentes de células HeLa render cerca de 500 uL de PCV.
- Adicionar 2X a PCV de tampão hipotónico para o sedimento de células. Agitar suavemente para ressuspender as células. Usar uma Pipetman P1000 suavemente para ressuspender as células por pipetagem de cima e para baixo, se necessário.
- Centrifugar a 4 ° C numa microcentrífuga durante 5 min a 100 xg para sedimentar as células. * As células terá começado a inchar por este tempo, eo volume da célula deve agora ser de cerca de 750 uL uL-1000.
- Cuidadosamente aspirar o tampão hipotónico e adicionar tampão hipotónico novo para um volume final de 1,5 ml. Ressuspender as células.
- Incubar as células ressuspensas inchados em gelo durante 10 min.
5. Lisar as células utilizando um homogeneizador Dounce
- Use tampão hipotónico para enxaguar o Dounce e, em seguida, chill-lo em gelo. Limpe a seco pilão com um wip tarefa delicadaer (por exemplo, Kimwipe). Remover o tampão remanescente a partir da Dounce utilizando uma micropipeta 1000 ponta uL estendida.
- Transferir as células inchadas no Dounce. Mova lentamente o pilão apertado do Dounce cima e para baixo 5 vezes para lisar as células, tendo o cuidado para evitar bolhas.
- Ensaio para a lise celular usando uma alíquota de 5 ul de células a partir da Dounce. Coloque a alíquota em um tubo de Eppendorf e adicionar um volume igual de azul de tripano. Colocar a mistura sobre uma lâmina e examinar as células utilizando um microscópio de luz. Os núcleos de células lisadas aparecerá azul. Cerca de 90% de lise é o ideal.
Tip-O número de vezes que as células devem ser dounced irá variar dependendo do aperto da Dounce. Ao efectuar este protocolo, pela primeira vez, determinar o número de vezes para Dounce através da realização de passo 5,3 após cada curso com o Dounce. Não excesso de Dounce, douncing excessiva irá destruir o núcleo.
- Transferir as células lisadas para uma pré-chilled tubo Eppendorf e centrifugação num 4 ° C de microcentrífuga durante 5 min a 1500 x g. O sedimento contém os núcleos. Transferir cuidadosamente o sobrenadante para um novo tubo, sem perturbar os núcleos. O sobrenadante contém o citoplasma.
Tip-O citoplasma podem ser utilizados como está ou processado para um S100 usando o rotação de alta velocidade mesmo utilizado para os extractos de massa (ver 1 para a preparação de um S100 activa a partir de extractos granel).
6. Salt-Extraia os Núcleos
- Estimar o Volume Globular Nuclear (PNV), olhando para a gradação do tubo. Um PCV de 500 uL tipicamente produz um PNV de 400 uL.
- Adicionar ½ X PNV de tampão salino baixo para o núcleo através da inserção de uma ponta micropipeta para o fundo do tubo e, lentamente, o buffer de injecção para o núcleo, enquanto misturando suavemente. Não pipete cima e para baixo. Agite suavemente os tubos para se certificar que o pelete é ressuspenso em completamente o tampão salino de baixa antes de prosseguir.
- Add ½ X PNV de tampão salino de alta e rapidamente misture 1 vez invertendo o tubo. Não agite. Rodar a 4 ° C durante 30 min.
Tip-Seja suave com os núcleos quando estão em tampão salino de alta para evitar a lise eles.
- Girar a 4 ° C numa microcentrífuga durante 15 min a 18.000 x g. O sobrenadante é o extrato salino de alta nuclear (HS-NE). Três placas de células normalmente produzem 500-600 ul de HS-NE.
7. Concentre-se e diálise do extrato nuclear
- Transferir 500 uL da HS-NE em refrigeradas mini-centricons (Amicon) e centrifugação durante 50 min a 4 ° C numa microcentrífuga a 14000 x g. Inverter o mini-centricon (Amicon) e colocá-lo em um tubo Eppendorf novo. Rotação durante 2 min a 4 ° C 1000 xg para recuperar o HS-NE. O HS-NE será concentrada para aproximadamente 115 uL.
- Usando um Pipetman P200, transferir alíquotas de 45 ul do HS-NE em mini-diálise slide-a Lyzers, e colocá-los em 500 ml de tampão de diálise refrigeradas. Assegure-se que a parte inferior da corrediça-A-Lyzer está alinhado com a parte inferior do flutuador. Agita-se durante 1-2 horas a 4 ° C. O NE aparecerá nublado após a diálise.
Tip-Não centrifugar para remover o precipitado turvo que é observada após a diálise, como esta centrifugação reduz a actividade do extracto.
- A NE pode ser usado imediatamente ou alíquotas. Alíquotas deve ser flash congelado em azoto líquido e armazenado a -80 ° C. O NE podem ser armazenados e submetidas a pelo menos dois ciclos de congelação-descongelação sem perder actividade.
8. Os resultados representativos
Recentemente, eficiente em sistemas in vitro para o acoplamento RNAP transcrição II splicing foram desenvolvidos 2-5. Estes sistemas empregues células HeLa cultivadas em grandes quantidades e, portanto, não são passíveis de se rapidamente testar os efeitos de tratamentos específicos celulares em amostras múltiplas. Com base nesta precisa de umnd a utilidade geral de um protocolo de extrato de pequena escala (ver discussão), foi estabelecido um robusto pequena escala método extrato nuclear. Os dados representativos comparando a RNAP II reacção de transcrição / splicing no extracto nuclear em pequena escala com o extracto nuclear grandes quantidades é mostrado na Figura 2. Uma construção de CMV-DNA, que contém o promotor CMV e codifica um substrato de splicing padrão (FTZ 3, Figura 2A) foi utilizado para a análise. Quando esta construção foi incubado na massa (pistas 1-3) ou pequena escala (pistas 4-6) do extracto, a níveis semelhantes de nascente pré-mRNA foram sintetizados por ponto de tempo de 5 minutos (Figura 2, pistas 1 e 4 ). Após a adição de α-amanitina para bloquear a transcrição adicional, os intermediários de splicing e produtos splicing acumulada ao longo do tempo com uma cinética semelhantes em ambos os tipos de extractos (Figura 2, pistas 2, 3, 5, 6). Estes resultados representativos mostram que a eficiência do golpe led RNAP II sistema de transcrição / splicing é semelhante nos extratos a granel e em pequena escala nucleares.
Para demonstrar a utilidade do método extracto de pequena escala, os extractos foram preparados a partir de células HeLa tratadas com o inibidor de splicing, E7107, ou o composto de controlo negativo pladienolide F 6,7 e, em seguida, o acoplamento RNAP II ensaio de transcrição / splicing foi realizada. Como mostrado na Figura 3, a transcrição por RNAP II ocorreu de forma eficiente em extractos preparados a partir de ambos os F Pladienolide e E7107 células tratadas (10 pontos de tempo min). Em contraste, o splicing ocorreu normalmente no extracto preparado a partir dos F-tratados Pladienolide células, mas foi abolido nas células E7107-tratados (Figura 3, pontos de tempo 20-60 min). Estes dados fornecem a prova de conceito de utilização dos extractos nucleares de pequena escala para o tratamento especial de células em pequena escala.
jpg "/>
Figura 1. Esquema de pequena escala Protocolo Extract. Passo P1. As células são cultivadas em monocamadas, colhido a partir de placas utilizando uma célula levantador e inchado pela adição de tampão hipotónico. Passo P2. As células são lisadas utilizando um homogeneizador Dounce e centrifugadas para sedimentar os núcleos. Passo P3. Os núcleos são separados a partir do citoplasma e submetidos a extracção de sal. Passo P4. O extracto nuclear é concentrada e dialisada. Passo P5. Os resultados são obtidos, que mostram que os extractos nucleares são funcionais (ver Figura 2 para maior detalhe).
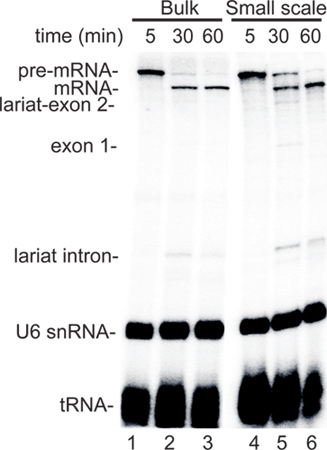
Figura 2. Os pequenos extratos nucleares são robustos em uma RNAP II acoplado ensaio de transcrição / splicing. A. Esquemática do molde de ADN de CMV-FTZ utilizado para acoplamento RNAP II transcrição / splicing. O promotor de CMV e os tamanhos dos exões e intrão estão indicados. B. Comparação de acoplado RNAPII ensaio de transcrição / splicing usando o extrato de massa nuclear ou de pequena escala extrato nuclear. α-amanitina foi adicionado após 5 min de transcrição e de splicing foi deixada a ocorrer para 30 e 60 min. O ARN foi extraído e fraccionado num gel de poliacrilamida 5% de desnaturação e detectados por phosphoimager. Os intermediários e os produtos de splicing estão indicados. A endógeno U6 snRNA e tRNA presentes no extracto, e que são de 32 P-rotulado durante a incubação são indicadas. Ver 3 para um protocolo detalhado sobre a II RNAP acoplado sistema de transcrição / splicing.
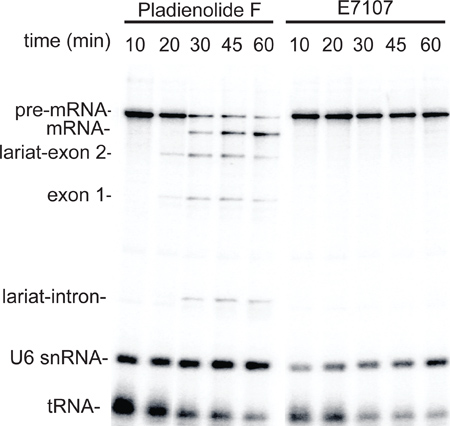
Figura 3. Em pequena escala extractos nucleares preparados a partir de células HeLa tratadas com o inibidor de splicing droga E7107 são defeituosos no splicing. As células foram tratadas com 3 Pladienolide iM F ou E7107 como6 descrito e depois usado para preparar pequena escala extractos nucleares. Um curso de tempo foi realizada utilizando o ensaio de transcrição / splicing mesma como na Figura 2. Os intermediários de splicing e produtos, e U6 snRNA e tRNA estão indicados.
Discussão
Nós estabelecemos um método rápido e reprodutível para a preparação de extractos nucleares a partir de pequenas quantidades de células HeLa cultivadas em monocamadas. Nós demonstramos que estes extractos são robustos, mostrando que a cinética e da eficiência de RNAP II de transcrição / splicing ensaios são semelhantes nos extractos de pequena escala e grandes quantidades nucleares. Nós mostramos a utilidade dos extractos, demonstrando que os extractos preparados a partir de células tratadas com um fármaco inibidor de splicing são activos para a transcrição mas defeituoso em splicing.
O nosso método para a preparação em pequena escala extractos nucleares foi estabelecida por combinação e optimização dos métodos previamente estabelecidos para a tomada de extractos de células HeLa cultivadas em suspensão em grande escala 1,8 e um método para a pequena preparação de extractos 9. Nós estabelecemos nosso protocolo porque os anteriores em pequena escala extractos não eram funcionais para alguns ensaios, tais como a transcrição acoplado / splicing ensaio. Uma diferença importante entre o anterior em pequena escala protocolo 9 e nossa é que nós otimizamos as condições para a lise de células usando uma mini-Dounce enquanto que o protocolo anterior lisadas células, empurrando-os através de uma pequena agulha de calibre 9. Os resultados agulha de lise-em bolhas, que podem explicar por que os extratos foram inativos e / ou difíceis de reproduzir para alguns ensaios. Nós também adicionamos um patamar de concentração ao nosso protocolo. Este passo aumenta a actividade dos extractos, que são extremamente sensíveis a concentração, e também limita a variabilidade entre extractos que é inerente à pequena escala preparações. Finalmente, a nossa preparação é rotineiramente realizados com apenas três placas 150 mm de monocamada de células, sem qualquer efeito significativo sobre a actividade em comparação com extractos granel. Assim, o procedimento é prontamente favorável para as preparações em pequena escala que requerem reagentes dispendiosos ou disponibilidade de células limitada. Por exemplo, nós preparamos small escala extratos de células knockdown de RNAi e de leucemia linfocítica crónica (LLC células) do paciente, e usou esses extratos para testes funcionais e / ou bioquímicos (EGF, JLH, TY e RR, inédito). Verificou-se que os extractos são valiosos para RNAi seguido por ensaios bioquímicos específicos, tais como immunopreciptations, westerns, e coloração com prata. Depois de estabelecer a eficácia de derrubando uma proteína particular, um estudo mais detalhado pode ser realizada fazendo uma knockdown estável de linha de células, o que pode ser usado para preparar extractos adicionais a baixo custo. Espectrometria de massa de proteínas presentes em imunoprecipitados obtida a partir destas linhas celulares knockdown será também uma aplicação útil do método. Além do ensaio acoplado transcrição / splicing que foi utilizado como um exemplo para a nossa descrição protocolo aqui, os extractos de pequena escala devem ser geralmente aplicável a vários ensaios funcionais e bioquímicas, tais como os utilizados para a r diferenteeps na expressão do gene (por exemplo, nivelamento, splicing, transcrição, processamento de poliadenilação microRNA,). O protocolo pode também ser adaptado para tipos de células do paciente, que pode ser obtida em suspensão (tal como as células CLL) ou cultivadas em cultura (tais como fibroblastos de pacientes). Finalmente, a fracção citoplasmática obtido durante o procedimento deve ser úteis para ensaios funcionais e bioquímicas que exigem que o citoplasma.
Divulgações
Produção e acesso gratuito a este artigo é patrocinado pela Abcam, Plc.
Agradecimentos
Somos gratos a E. M. Ibrahim Winkelbauer-Hurt,, P. Valencia, K. Dufu, H. Cheng para discussões úteis. As células HeLa foram obtidos a partir do National Cultura Celular Center (Minneapolis, MN). Agradecemos também a Eisai Co., Ltd para fornecer E7107 ea Nikon Imaging Center da Harvard Medical School de ajuda com microscopia de luz. Este trabalho foi financiado por uma concessão de NIH GM043375 para RR e EGF e companheirismo NRSA para JLH.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | O nome completo do reagente | Companhia | Número de catálogo |
| HEPES | 4 - (2-Hidroxietil) de ácido piperazina-1-etanossulf | Sigma | H3375-500G |
| MgCl 2 .6 H 2 O | Cloreto de magnésio hexahidratado | Sigma | M2670-500G |
| KCl | Cloreto de Potássio | Pescador | P335-212 |
| PMSF | Fluoreto Phenylmethanesulfonyl | Sigma | P7626-100G |
| TDT | Ditiotreitol | Americana Bioanalytical | AB00490-5G |
| EDTA | Etilenodiaminotetraacetato dissódico di-hidratado, | Americana Bioanalytical | AB00500-01000 |
| Glicerina | Biomedicals MP | 800689 | |
| DMEM | Meio Mínimo Essencial de Dulbecco | Invitrogen | 11995-073 |
| FBS | Soro Fetal Bovino | Gibco | 16140 |
| Penicilina / estreptomicina | Gibco | 15070 | |
| PBS | Tampão fosfato salino | Cellgro | 21-040-CV |
| Trypan azul 0,4% | Gibco | 15250 | |
| Levantadores de células | Corning | 29442-200 | |
| Placas de 150mm | VWR | 353025 | |
| Estendida Micropipeta Dica | Denville | P1126 | |
| Dounce homogeneizador, 1 ml, com pilão apertado | Wheaton | 357538 | |
| Slidealyzers, MWCO 10kDa | ThermoScientific | 69572 | |
| Mini-Centricons, MWCO 3 kDa | Millipore (Amicon) | UFC500396 |
Tabela 1. Reagentes e equipamentos específicos.
| Solução | Final | Estoque | Dispensar |
| Hipotônica | HEPES 10 mM, pH 7,9 | HEPES 1M, pH 7,9 | 5 ml |
| 1,5 mM de MgCl2 | 1M de MgCl2 | 750 ul | |
| 10 mM de KCl | 3M KCl | 1,67 ml | |
| 0,2 mM de PMSF | 200 mM de PMSF | 500 ul | |
| 0,5 mM DTT | 2M TDT | 125 ul | |
| Leve até 500 ml com água | |||
| Sal Baixo | HEPES 20 mM, pH 7,9 | HEPES 1M, pH 7,9 | 2 ml |
| 1,5 mM de MgCl2 | 1M de MgCl2 | 150 ul | |
| 20 mM de KCl | 3M KCl | 667 ul | |
| & Nbsp; | 0,2 mM de EDTA | EDTA 0,5 M | 40 uL |
| Glicerol 25% | Glicerina | 25 ml | |
| 0,2 mM de PMSF | 200 mM de PMSF | 100 ul | |
| 0,5 mM DTT | 2M TDT | 25 uL | |
| Leve até 100 ml com água | |||
| Sal de alta | HEPES 20 mM, pH 7,9 | HEPES 1M, pH 7,9 | 2 ml |
| 1,5 mM de MgCl2 | 1M de MgCl2 | 150 ul | |
| 1,4 M KCl | 3M KCl | 48 ml | |
| 0,2 mM de EDTA | EDTA 0,5 M | 40 uL | |
| Glicerol 25% | Glicerina | 25 ml | |
| 0,2 mM de PMSF | 200 mM de PMSF | 100 ul | |
| 0,5 mM DTT | 2M TDT | 25 uL | |
| Leve até 100 ml com água | |||
| Diálise | HEPES 20 mM, pH 7,9 | HEPES 1M, pH 7,9 | 10 ml |
| 100 mM de KCl | 3M KCl | 16,625 ml | |
| 0,2 mM de EDTA | EDTA 0,5 M | 200 ul | |
| Glicerol a 20% | Glicerina | 100 ml | |
| 0,2 mM de PMSF | 200 mM de PMSF | 500 ul | |
| 0,5 mM DTT | 2M TDT | 125 ul | |
| Leve até 500 ml com água |
Tabela 2. Soluções para Preparação Extrato Nuclear.
Referências
- Krainer, A. R., Maniatis, T., Ruskin, B., Green, M. R. Normal and mutant human beta-globin pre-mRNAs are faithfully and efficiently spliced in vitro. Cell. 36, 993-1005 (1984).
- Ghosh, S., Garcia-Blanco, M. A. Coupled in vitro synthesis and splicing of RNA polymerase II transcripts. Rna. 6, 1325-1334 (2000).
- Das, R. Functional coupling of RNAP II transcription to spliceosome assembly. Genes Dev. 20, 1100-1109 (2006).
- Hicks, M. J., Yang, C. R., Kotlajich, M. V., Hertel, K. J. Linking splicing to Pol II transcription stabilizes pre-mRNAs and influences splicing patterns. PLoS Biol. 4, e147(2006).
- Yu, Y., Das, R., Folco, E. G., Reed, R. A model in vitro system for co-transcriptional splicing. Nucleic Acids Res. 38, 7570-7578 (2010).
- Kotake, Y. Splicing factor SF3b as a target of the antitumor natural product pladienolide. Nat. Chem Biol. 3, 570-575 (2007).
- Folco, E. G., Coil, K. E., Reed, R. The anti-tumor drug E7107 reveals an essential role for SF3b in remodeling U2 snRNP to expose the branch point-binding region. Genes. 25, 440-444 (2011).
- Dignam, J. D., Lebovitz, R. M., Roeder, R. G. Accurate transcription initiation by RNA polymerase II in a soluble extract from isolated mammalian nuclei. Nucleic Acids Res. 11, 1475-1489 (1983).
- Lee, K. A., Bindereif, A., Green, M. R. A small-scale procedure for preparation of nuclear extracts that support efficient transcription and pre-mRNA splicing. Gene Anal. Tech. 5, 22-31 (1988).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados