Method Article
Triagem rápida de HIV transcriptase reversa e integrase Inibidores
Neste Artigo
Resumo
Aqui, descrevemos a citotoxicidade celular e ensaios de infecciosidade redondas únicas que permitem a triagem rápida e exacta de compostos para determinar a sua citotoxicidade celular (CC 50) e os valores de IC50 contra a WT e resistentes de HIV-1 da droga.
Resumo
Apesar de uma série de medicamentos anti HIV foram aprovados, ainda existem problemas com a toxicidade e resistência aos medicamentos. Isto demonstra a necessidade de identificar novos compostos que podem inibir a infecção pelas estirpes de HIV-1 resistentes aos fármacos comuns, com uma toxicidade mínima. Descrevemos aqui um ensaio eficiente que pode ser utilizado para determinar rapidamente a citotoxicidade celular e eficácia de um composto contra estirpes virais WT e mutantes.
A linha de células-alvo desejado é semeada numa placa de 96 poços e, após uma incubação de 24 horas, em série de diluições dos compostos a serem testados são adicionados. Não existem outras manipulações são necessárias para os ensaios de citotoxicidade celular; para anti HIV ensaia uma quantidade pré-determinada de qualquer um WT ou droga VIH-1 resistente vector que expressa luciferase é adicionada às células. A citotoxicidade é medida usando um ensaio de luminescência dependente de ATP e o impacto dos compostos sobre a infectividade é medido pela determinação da quantidade de luciferase na presença ou na ausência dos inibidores putativos.
Este ensaio de rastreio leva 4 dias para se completar e vários compostos podem ser pesquisadas em paralelo. Os compostos são rastreados, em triplicado, e os dados são normalizados para os níveis de infecciosidade / ATP na ausência de compostos alvo. Esta técnica proporciona uma medição rápida e precisa da eficácia e toxicidade de potenciais compostos anti HIV.
Introdução
A disponibilidade de drogas que visam vários passos essenciais do ciclo de vida viral do HIV-1 levou a terapia de combinação de drogas (chamada terapia anti retroviral altamente activa, ou HAART) que melhorou grandemente o tratamento de infecções pelo HIV-1, e a sobrevivência a longo prazo dos pacientes. HAART, que geralmente usa combinações de dois (RT) e inibidores ou um inibidor da protease ou um inibidor não nucleosídeo da transcriptase reversa nucleosídeo RT, agora convertido uma doença mortal para uma condição de vida longa 1-5. No entanto, apesar dos muitos sucessos da HAART em supressão sustentada da replicação viral, tem limitações. HAART não erradicar o HIV, para que os pacientes não são curados e terapia é vida longa. Há problemas de toxicidade de drogas e com o surgimento de cepas resistentes aos medicamentos. A resistência pode surgir de todos os medicamentos anti HIV aprovados, incluindo os medicamentos recém-aprovados que visam integrase do HIV (IN). A resistência às drogas provavelmente surge becauso de mutações espontâneas que ocorrem durante a replicação viral (taxa de erro de 3 x 10 -5 ciclo mutações / base / replicação) 6. Quando mutações surgem nos genes que codificam para os alvos de drogas anti-retrovirais, de um pequeno subconjunto destas mutações irá levar a uma redução da susceptibilidade da estirpe viral para os medicamentos. Para evitar o desenvolvimento de resistência à droga, as concentrações de droga deve ser mantida em níveis que suprimem completamente a replicação do HIV. A fraca adesão ao regime terapêutico agrava o problema, e pode levar ao desenvolvimento rápido de resistência de 7-9. Embora as concentrações de fármaco pode variar em pacientes diferentes, devido a absorção, metabolismo, distribuição, e os níveis de excreção, as concentrações elevadas de drogas pode levar à toxicidade 10. Desde que a terapia continua para a vida do paciente, existem sérias preocupações de segurança sobre a toxicidade a longo prazo de anti retrovirais. Os anti retrovirais usados em HAART podem ter efeitos adversos and tem havido incidentes onde os efeitos colaterais têm sido fatais 11-15. Os problemas encontrados com os pacientes do desenvolvimento da resistência e da toxicidade fundamentam a necessidade de desenvolver novas drogas que bloqueiam eficazmente a replicação de estirpes resistentes aos medicamentos comuns do vírus com pouca ou nenhuma toxicidade a longo prazo.
Assim, existe uma necessidade de um ensaio que pode rastrear compostos que bloqueiam os passos essenciais do ciclo de vida viral rapidamente. Descrevemos aqui um ensaio eficiente que pode ser utilizado para avaliar a citotoxicidade de um compostos e a sua capacidade de bloquear a replicação de ambos WT e estirpes de VIH resistentes aos fármacos, rápida e eficientemente. O ensaio usamos é semelhante a um ensaio que foi desenvolvido para o rastreio de resistência a drogas em vírus isolados a partir de pacientes 16-18.
Embora o ensaio pode ser usado sem modificação para o rastreio de compostos que podem bloquear a transcrição reversa do HIV, que se describe utilizando o ensaio para avaliar os inibidores de NO. IN é um enzima viral essencial que insere o ADN viral no genoma celular 19. Apesar de uma série de promissores em inibidores estão sendo desenvolvidos, alguns dos quais estão actualmente em fase de ensaios clínicos, apenas Isentress 20, 21 (também conhecido como Raltegravir ou RAL) e, mais recentemente, Elvitegravir (EVG) 22 e dolutegravir (DTG) 23 foram aprovado pela FDA. Estes compostos são activos tanto contra o VIH subtipos B e não B em cultura celular e em pacientes 24, 25. No entanto, o tratamento com RAL selecciona-resistentes a drogas de HIV-1 em mutantes, incluindo Y143R, N155H, e G140S/Q148H 24, 26-31. N155H e G140S/Q148H também reduzem a eficácia da EVG, que enfatiza a necessidade de projetar e desenvolver segunda geração inibidores de transferência de fio (INSTIs) que são eficazes contra estas mutações de resistência.
Protocolo
1. Preparação de Stocks mestre
- Fazer stocks mestres dos compostos a ser ensaiados em DMSO. Prepare ações a uma concentração padrão de 20 mm.
Nota: qualquer concentração acima de 10 mM pode ser utilizada. Os compostos que podem ser utilizados como controlos positivos para validar este ensaio incluem RAL, EVG e DTG. - Assegurar os compostos são dissolvidos em DMSO em vortex as soluções múltiplas vezes durante 15 seg e incubar à TA durante 1 hora. Armazenar as soluções de estoque 20 mM no escuro a -20 ° C até à sua utilização.
2. Preparação das placas de 96 poços para rastreio Composto
- Escolha da linha celular a ser testada (por exemplo, HOS ou TZM-bl), e semear 100 ml dessas células a uma densidade de 4 x 10 4 células / ml (4.000 células / poço) em meio (por exemplo, de Eagle modificado da ou DMEM meio de Dulbecco suplementado com 5% (v / v) de soro fetal bovino, 5% de soro de bezerro recém-nascido, e penicilina (50 unidades / ml) com estreptomycin).
3. Geração dos stocks de vírus
Produção de VSV-G pseudotipado-HIV através da transfecção de células 293 (como mostrado na Figura 1, passo 1) 32-34.
- No dia antes da transfecção, as células prato 293 sobre placas de 100 mm de diâmetro a uma densidade de 1,5 x 10 6 células.
- No dia da transfecção, transfectar células 293 com 16 ug de tipo selvagem ou mutante de HIV (pNLNgoMIVR - ΔLUC) e 4 ug de VSV (pHCMV-g), usando o método de fosfato de cálcio 35.
- Aproximadamente seis horas depois de o precipitado de fosfato de cálcio é adicionado, lavar 293 células duas vezes com tampão fosfato salino (PBS) e incuba-se com o meio fresco durante 48 horas. [DMEM suplementado com 5% (v / v) de soro fetal bovino, 5% de soro de bezerro recém-nascido, e penicilina (50 unidades / ml) mais estreptomicina (50 ug / ml)].
- Recolher o vírus contendo sobrenadantes removendo a mídia do 100 mm de diâmetropratos, esclarecer-se os sobrenadantes por centrifugação a baixa velocidade a 3000 rpm, durante 10 minutos, filtrar o sobrenadante através de um filtro de 45 um de tamanho de poro de seringa, tratam-se os sobrenadantes com Turbo DNase por 30 min à temperatura ambiente e dilui-se os sobrenadantes em suportes para a preparação em ensaios de infecção . Armazenar os sobrenadantes virais congelado, em ali quotas, a -80 ° C.
Nota: a quantidade de p24 no sobrenadante é determinada por meio de um kit de ensaio imunossorvente de p24 de HIV-1 ligado a enzima. A concentração de p24 é utilizado para controlar a quantidade de vírus na amostra. Aproximadamente 500 ng de vírus é adicionado a células HOS semeadas em pratos de 60 milímetros de diâmetro, a uma densidade de 1,5 x 10 5 células / placa no dia anterior à infecção. Depois de 48 horas de incubação, as células são colhidas, recolhidas por centrifugação, lavadas e ressuspensas em 100 ul de PBS. Adicionar uma quantidade igual de reagente de ensaio de luminescência repórter gene e medir a atividade luciferase conforme descrito nas seções 5.4.1 e5.4.2. A partir daí, uma diluição apropriada do vírus pode ser feito, como discutido no passo 4.6.
4. Composto de Triagem em placas de 96 poços
Tela cada composto em triplicado e média dos resultados.
Nota: o efeito de cada composto na replicação viral é corrigida através da normalização do nível de replicação obtida na ausência de qualquer composto.
- Determinar o intervalo de concentração empírica para ser exibido.
Nota: normalmente, com telas de 11 diluições seriadas são feitas através da adição do composto com a placa coluna por coluna e com telas de 7 diluições em série são feitas através da adição do composto de linha. Uma triplicado conjunto de poços deve ser reservado para o controle nenhum composto. Além disso, uma coluna ou uma linha deve permanecer vazio para actuar como controlo negativo / fundo. Por último, se se trata de uma citotoxicidade celular ou ensaio de infecciosidade vai ditar se é adicionado vírus. - Preparardiluições em série a partir da solução de reserva 20 mM. As concentrações são escolhidos em função da gama de concentrações determinada empiricamente a ser testados (como mostrado na Tabela 1). Preparar as diluições em mídia em 10x a concentração final desejada, ou seja, se a concentração final vai ser 100 M, faça um estoque de trabalho 1 mM.
Nota: compostos com IC 50 s acima 5-10 mM geralmente não são bons candidatos para o desenvolvimento de drogas. Nos ensaios iniciais, testar os compostos apenas contra o vetor WT. Compostos promissores que inibem eficazmente o vector WT são então testados contra um painel de mutantes resistentes aos medicamentos. - Retirar as placas de 96 poços a partir da incubadora e adicionar as diluições em série dos compostos a ser ensaiados para os poços, em triplicado, (como mostrado na Figura 1, etapa 2).
Nota: o volume adicionado ao poço deverá ser de 1/10 do volume da concentração final. Assim, adicionar 22 ul / poço (volume final de pAlém vírus ost é de 220 mL) para ensaios de infecciosidade. Para os ensaios de citotoxicidade, adicionar 11 ul / poço (volume final é de 110 uL / poço). - Devolver as placas de 96 poços para a incubadora. Para uma tela de citotoxicidade celular, incubar as placas de 96 poços de 48 horas a 37 ° C e não mais manipulações são necessários no Protocolo 4: proceder ao protocolo 5 Para Ensaios de infectividade, continue seguindo as instruções no Protocolo no 4..
- Ensaios de infectividade só. Retirar as placas do incubador, após um mínimo de 3 horas de incubação a 37 ° C com os compostos a serem analisados.
Nota: isto permite que o composto seja absorvido pelas células antes da infecção com o vector de HIV. - Prepara-se uma diluição de estoque de vírus 33, 34 (geralmente cerca de 1:3) de modo a produzir um sinal de luciferase entre 0,2-1,5 unidades de luciferase relativas (RLUs) em células não tratadas. Uma placa inteira demora cerca de 10 ml de diluiçãovírus ted. Adicionar 100 ul de vírus a cada um dos poços, utilizando um 8 ou 12 pipetador multicanal. Não adicionar o vírus para os poços de controlo negativo / fundo. Retorne os pratos para a 37 ° C incubadora por 48 horas.
Nota: uma diluição 1:03 de estoque de vírus é a diluição típico que vai produzir um sinal da luciferase, entre 0,2 -1,5 RLUs baseado num ensaio de p24 que mostra que a concentração de vírus no sobrenadante é de cerca de 500 ng em 1,0 ml.
5. Preparação e medição de citotoxicidade e infectividade em placas de 96 poços
- Aspirar a mídia dos poços (vermelho de fenol na mídia pode interferir com o sinal luciferase). Usar uma pipeta de vidro com uma ponta de pipeta de 200 ul ligado à extremidade. Comece no topo da mídia e trabalhar lentamente em direção ao canto inferior do poço. Não gastar demasiado tempo na parte inferior do poço, ou as células podem ser removidas a partir do poço.
- Adicionar 100 l de PBS suplementado com 0,5 mM MgCl 2 a cada poço. Isso precisa ser feito imediatamente após a mídia é removido para que as células não sequem.
- Apenas para testes de citotoxicidade, adicionam-se 5 ml de tampão de substrato a partir do ensaio de detecção de luminescência de ATP a cada frasco de reagente liofilizado fornecido. Um frasco é suficiente para uma placa de 96 poços.
- Adicionar 50 ul de tampão de lise de células a partir do ensaio de detecção de luminescência de ATP a cada poço. Agitar a placa de 96 poços a 700 rpm a temperatura ambiente durante 5 min, utilizando um termomisturador compacto.
- Adicionar 50 mL de reagente reconstituído teste de detecção de luminescência ATP em todos os poços, exceto para os negativos poços controle / fundo. Agitar a 700 rpm à temperatura ambiente durante 5 min, utilizando um termomisturador compacto. Incubar as placas à temperatura ambiente durante 20 minutos para dar tempo para o desenvolvimento de sinal.
- Ler a placa de 96 poços, utilizando o luminómetro de microplacas.
Nota: abrir o programa de microplacas luminometer SoftMax Pro. Verifique se o luminometer está definido para medir luminescence com uma sensibilidade de 5 leituras / poço.
- Apenas para ensaios de infecciosidade, adicionar 10 ml de tampão de substrato de ensaio do gene repórter de luminescência de cada frasco de reagente liofilizado fornecido. Um frasco é suficiente para cada placa de 96 poços.
- Adicionar 100 ul de reagente de ensaio de repórter reconstituído gene de luminescência em cada poço. Incubar à temperatura ambiente durante 20 minutos para dar tempo para o desenvolvimento de sinal.
- Ler a placa de 96 poços, utilizando um luminómetro de microplacas como é realizada na secção 5.3.3.
6. Determinação de CC50 e os valores de IC50 para os Compostos
- Transfira os dados de luciferase do luminometer microplaca em uma planilha excel.
- Média de ambos os dados de luciferase, em triplicado, e os dados de sinal de fundo / controlo. Subtrair o sinal média de fundo / controle do sinal de média triplicado para toda a faixa de concentração.
- Normalizar o fundo corrigido sinal médio para a gama de concentrações contra a actividade, quer seja a citotoxicidade ou a infectividade, na ausência de qualquer composto para determinar a percentagem de inibição.
Nota: a percentagem de inibição é definida como a actividade da luciferase na presença de droga dividida pela actividade da luciferase na ausência de droga multiplicada por 100.
- Usar o software Kaleidagraph para obter CC 50 e os valores de IC50
- Transferir tanto a gama de concentrações determinada empiricamente e a percentagem de inibição da actividade da luciferase em Kaleidagraph.
- Graficamente os dados com o intervalo de concentração no eixo do X e a percentagem de inibição da actividade da luciferase sobre o eixo y.
Resultados
Se o ensaio (Figura 1, os passos 1 e 2) foi realizada com sucesso, em seguida, os valores de luciferase deve assemelhar-se os dados apresentados na Tabela 2 varredura em toda a gama de concentração.; um composto potencialmente potente irá revelar o aumento da atividade da luciferase da esquerda para a direita, eo controle deve ter a maior atividade luciferase. Se a actividade da luciferase não exceda 0,1 Unidades de luciferase relativas (RLUs) em toda a gama de concentração, isto normalmente indica que o composto matou as células. Se os dados de luciferase é maior do que ou igual a 2,0 em todas as RLUs as diluições em série, em seguida, os compostos não foram capazes de inibir a infecção pelo HIV-1 nas concentrações testadas.
Determinação da concentração dos compostos em relação a inibição percentual da actividade da luciferase em Kaleidagraph (Tabela 3, parte A), após a realização de análises de regressão linear, irá produzir resultados semelhantes para t mangueira mostrado na Tabela 3, a parte B.

Figura 1. Preparação de VIH-1 Os estoques virais e de configuração de Citotoxicidade celular e uma única ronda infectividade ensaios. No passo 1, as células 293T são transfectadas com pNL4.3ΔEnv.LUC e VSV-G e incubadas durante 48 horas para produzir o vírus 34 . O vírus é colhido e armazenado (congelado a -80 ° C em alíquotas) até ser utilizado nos ensaios de infecciosidade. Para a etapa 2, células HOS são semeadas numa placa de 96 poços e incubadas durante 24 hr. As células são então pré-incubados com diluições em série dos compostos a serem testados durante 3 horas e, em seguida, infectadas com o vírus (ou WT ou resistente à droga). Após uma incubação de 48 horas, a actividade da luciferase é medida.
"width =" 300 le1.jpg "/>
Tabela 1. Drogas Triagem de série Prototype diluição. Uma triagem mais rigorosa envolve 11 diluições em série que normalmente começam em 10 mM e terminam em 0,0005 mM. As diluições são preparadas de 10x; há 100 ul de células e 100 ul de vírus em cada poço). Neste volume e seguindo estes cálculos, as diluições em série será suficiente para três fileiras de toda uma placa de 96 poços. Os ensaios de citotoxicidade são preparados de modo semelhante; porém as diluições 11 começam em 250 um e terminam em 0,05 mM. Apenas 11 mL das diluições são adicionados aos poços da placa que contém 100 ml de células. Clique aqui para ver uma versão maior desta figura.
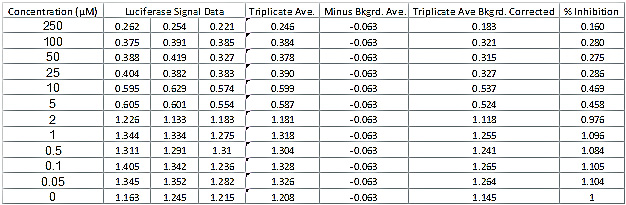
Tabela 2. Luciferase Leitura do sinal de dados e Determinação da Percentagem de Inibição da Actividade de Luciferase. A tabela mostra dados de um conjunto típico de dados de luciferase de um composto bem sucedido. A tabela também mostra os cálculos adicionais necessários para determinar a percentagem de inibição da atividade da luciferase eo CC 50 e IC 50 valores. Clique aqui para ver uma versão maior desta figura.
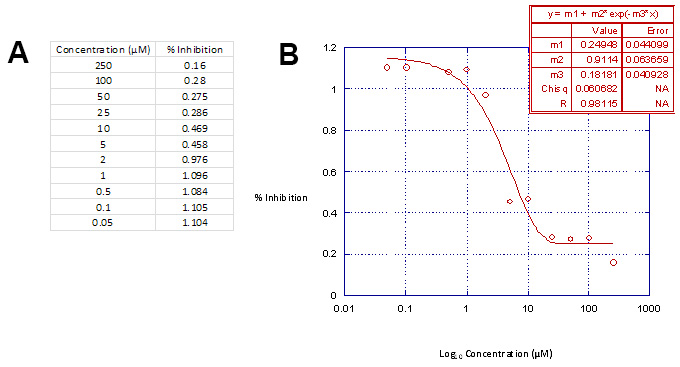
Tabela 3. Análise de Regressão Linear Tabela de Dados. Parte A. Representação gráfica do intervalo de concentração usado versus a percentagem de inibição da actividade da luciferase em Kaleidagraph produzirá as curvas de inibição adequadas. Parte B As curvas de inibição são definidos pela paramétrico 3função sigmoidal e ajuste aos dados de análises de regressão linear 18. Esta tabela de dados é então usado em conjunto com o Microsoft Excel para calcular as concentrações da droga necessária para inibir a integração vírus e de citotoxicidade celular em 50%, por exemplo, IC 50 e CC 50. Clique aqui para ver uma versão maior desta figura.
Discussão
Descreve-se um ensaio rápido, eficiente e reprodutível, que pode ser utilizado para rastrear compostos quanto à citotoxicidade e à sua capacidade para inibir a replicação de ambos WT e resistentes de HIV-1 da droga. A capacidade de identificar rapidamente os compostos e testar a sua eficácia e a citotoxicidade é crucial para o desenvolvimento de drogas novas e melhoradas contra o HIV-1. Uma vez que os compostos de chumbo são identificados, os análogos do composto de chumbo podem ser produzidos e testados usando o mesmo teste. O ensaio é relativamente simples. Há dois controles positivos e negativos que permitem ao usuário diagnosticar os problemas mais comuns (compostos tóxicos, problemas com o estoque do vetor). O uso de um conjunto de poços em triplicado sem composto adicionado mostra que a infecção viral ocorreu. O facto de a citotoxicidade é medida num ensaio independente misinterpreting evita uma redução da luciferase causada pelo citotoxicidade como um efeito específico sobre a replicação viral.
As etapas críticasno protocolo estão a preparar as placas de modo que as células são distribuídos uniformemente em poços, os poços que têm as concentrações apropriadas dos compostos a serem testados, a adição da mesma quantidade de vírus a cada um dos poços, e medindo a actividade da luciferase para determinar o CC50 e os valores de IC50.
O ensaio é segura, quantitativa, e reprodutível. O ensaio é seguro porque o vetor é a replicação defeituosa. O ensaio é quantitativo e reprodutível, pois baseia-se em um vector que expressa a única ronda de luciferase, que pode ser doseada com precisão e convenientemente. Em um ensaio de replicação do vírus de multi rodada, o IC 50 medido depende do número de ciclos de vida virais; este é um problema especial quando os ensaios envolve tanto WT e vírus resistentes a drogas que podem ter significativamente diferentes capacidades de replicação.
Houve vários ensaios enzimáticos relatado anteriormente que podeser utilizados para o rastreio de inibidores de NOS. Os ensaios que envolvem a tecnologia de PCR em tempo real para medir o ADN integrado requerem proteínas recombinantes purificadas (s), e são, em geral, tanto mais trabalho intensivo e caro, 36, 37. Embora seja possível utilizar ensaios enzimáticos para medir o impacto de compostos nas outras enzimas virais (transcriptase reversa e protease), cada enzima requer o seu próprio sistema de ensaio. O vector de um ensaio de Fase, como descrito, pode ser utilizado, sem modificação, para o rastreio de inibidores de RT. Um ensaio semelhante pode ser utilizado para o rastreio de inibidores de protease; No entanto, num ensaio de inibidores da protease, os compostos devem ser adicionados para as células utilizadas para produzir os vectores. Um ensaio relacionado, usando diferentes células e vectores, pode também ser usado para o rastreio de envelope (env), e inibidores de fusão de entrada do HIV. Finalmente, o ensaio pode ser utilizado, em maior escala, com dispensadores robóticas automáticas. Assim, o ensaio pode ser utilizado para rastrear grandes bibliotecas de compostos contra WT e mutant HIV. No entanto, o facto de o ensaio pode detectar um inibidor da replicação do HIV, que actua em diferentes fases do ciclo de vida viral aponta para uma limitação na interpretação dos dados. Por si só, o ensaio não define qual o passo do ciclo de vida é bloqueado por um composto. Se esta questão que surge é, ele pode ser resolvido mediante a utilização de ensaios de tempo de adição 38, e por meio de testes do composto contra as proteínas virais recombinantes purificadas.
Infelizmente, apesar do sucesso de drogas anti-VIH, ainda há problemas com ambos resistência e toxicidade. Na ausência de uma vacina eficaz contra o HIV anti, existe uma necessidade não só no desenvolvimento de novos fármacos terapêuticos que será eficaz contra os mutantes resistentes aos medicamentos existentes, mas também para o desenvolvimento de agentes profiláticos que podem reduzir a propagação do vírus. Se o uso profilático de medicamentos anti HIV incudes o tratamento de pessoas não infectadas, esta abordagem irá colocar uma carga especial no desenvolvimento de drogas que são têm little ou nenhuma toxicidade a longo prazo.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Esta pesquisa foi apoiada pelo Programa do NCI Research intramuros.
Materiais
| Name | Company | Catalog Number | Comments |
| DMSO | Sigma | D2650 | |
| DMEM | Corning Cellgro | 10-017 | |
| ATPlite Luminescence ATP Detection Assay System | Perkin Elmer | 6016941 | |
| Steady Lite Plus High Sensitivity Luminescence Reporter Gene Assay System | Perkin Elmer | 6016751 | |
| Dulbecco's PBS | Gibco-Life Technologies-Invitrogen | 14190-136 | |
| SpectraMax Gemini EM | Molecular Devices | ||
| KaleidaGraph | Synergy Software | ||
| Nunc F96 Microwell White Polystyrene Plate | Thomas Scientific | 12-566-26 | |
| Eppendorf Thermomixer Compact | Sigma Aldrich | T1442-1EA | |
| Turbo DNase | Ambion-Life Technologies-Invitrogen | AM2238 | |
| Millex HA Filter Unit, 0.45 µM | Millipore | SLAHA033SS | |
| Alliance HIV-1 p24 Elisa Kit | Perkin Elmer | NEK050B001KT | |
| HOS cells | ATCC | CRL-1543 | |
| TZM-bl cells | NIH AIDS Reagent Program | 8129 | |
| pNL4.3ΔEnv.LUC | NIH-NCI HIV Drug Resistance Program- Hughes Lab | ||
| VSV-G | NIH-NCI HIV Drug Resistance Program- Hughes Lab | ||
| SoftMax Pro | Molecular Devices | 0200-310 |
Referências
- Mouton, Y., et al. Impact of protease inhibitors on AIDS-defining events and hospitalizations in 10 French AIDS reference centres. Federation National des Centres de Lutte contre le SIDA. AIDS. , 101-105 (1997).
- Hammer, S. M., et al. A controlled trial of two nucleoside analogues plus indinavir in persons with human immunodeficiency virus infection and CD4 cell counts of 200 per cubic millimeter or less AIDS Clinical Trials Group 320 Study Team. New Eng. J. Med. 337, 725-733 (1997).
- Hogg, R. S., et al. Improved survival among HIV-infected patients after initiation of triple-drug antiretroviral regimens. Can. Med. Assoc. 160, 659-665 (1999).
- Egger, M., et al. Impact of new antiretroviral combination therapies in HIV infected patients in Switzerland: prospective multicentre study. Swiss HIV Cohort Study. BMJ. 315, 1194-1199 (1997).
- Gulick, R. M., et al. Treatment with indinavir, zidovudine, and lamivudine in adults with human immunodeficiency virus infection and prior antiretroviral therapy. New Eng. J. Med. 337, 734-739 (1997).
- Perelson, A. S., Neumann, A. U., Markowitz, M., Leonard, J. M., Ho, D. D. HIV-1 dynamics in vivo: virion clearance rate, infected cell life-span, and viral generation time. Science. 271, 1582-1586 (1996).
- Simoni, J. M., Amico, K. R., Pearson, C. R., Malow, R. Strategies for promoting adherence to antiretroviral therapy: a review of the literature. Curr. Infect. Dis. Rep. 10, 515-521 (2008).
- Simoni, J. M., Amico, K. R., Smith, L., Nelson, K. Antiretroviral adherence interventions: translating research findings to the real world clinic. Curr. HIV/AIDS Rep. 7, 44-51 (2010).
- Volberding, P. A., Deeks, S. G. Antiretroviral therapy and management of HIV infection. Lancet. 376, 49-62 (2010).
- Acosta, E. P., et al. Novel method to assess antiretroviral target trough concentrations using in vitro susceptibility data. Antimicr. 56, 5938-5945 (2012).
- Rockstroh, J. K., et al. Long-term treatment with raltegravir or efavirenz combined with tenofovir/emtricitabine for treatment-naive human immunodeficiency virus-1-infected patients: 156-week results from STARTMRK. Clin. Infect. Dis. 53, 807-816 (2011).
- Fernandez-Montero, J. V., Eugenia, E., Barreiro, P., Labarga, P., Soriano, V. Antiretroviral drug-related toxicities - clinical spectrum, prevention, and management. Exp. Opin. Drug Safety. , (2013).
- Lunzen, J., et al. Once daily dolutegravir (S/GSK1349572) in combination therapy in antiretroviral-naive adults with HIV: planned interim 48 week results from SPRING-1, a dose-ranging, randomised, phase 2b trial. Lancet Infect Dis. 12, 111-118 (2012).
- Sax, P. E., et al. Co-formulated elvitegravir, cobicistat, emtricitabine, and tenofovir versus co-formulated efavirenz, emtricitabine, and tenofovir for initial treatment of HIV-1 infection: a randomised, double-blind, phase 3 trial, analysis of results after 48 weeks. Lancet. 379, 2439-2448 (2012).
- Sax, P. E., et al. Abacavir/lamivudine versus tenofovir DF/emtricitabine as part of combination regimens for initial treatment of HIV: final results. Infect. Dis. 204, 1191-1201 (2011).
- Kellam, P., Larder, B. A. Recombinant virus assay: a rapid, phenotypic assay for assessment of drug susceptibility of human immunodeficiency virus type 1 isolates. Antimicr. Agents Chemother. 38, 23-30 (1994).
- Hertogs, K., et al. A rapid method for simultaneous detection of phenotypic resistance to inhibitors of protease and reverse transcriptase in recombinant human immunodeficiency virus type 1 isolates from patients treated with antiretroviral drugs. Antimicr. Agents Chemother. 42, 269-276 (1998).
- Petropoulos, C. J., et al. A novel phenotypic drug susceptibility assay for human immunodeficiency virus type 1. Antimicr. Agents Chemother. 44, 920-928 (2000).
- Engelman, A., Mizuuchi, K., Craigie, R. HIV-1 DNA integration: mechanism of viral DNA cleavage and DNA strand transfer. Cell. 67, 1211-1221 (1991).
- Hazuda, D. J., et al. Inhibitors of strand transfer that prevent integration and inhibit HIV-1 replication in cells. Science. 287, 646-650 (2000).
- Nguyen, B. Y., et al. Raltegravir: the first HIV-1 integrase strand transfer inhibitor in the HIV armamentarium. Ann. N.Y. Acad. Sci. 1222, 83-89 (2011).
- Wills, T., Vega, V. Elvitegravir: a once-daily inhibitor of HIV-1 integrase. Exp. Opin. Invest. Drugs. 21, 395-401 (2012).
- Kobayashi, M., et al. In Vitro antiretroviral properties of S/GSK1349572, a next-generation HIV integrase inhibitor. Antimicr. Agents Chemother. 55, 813-821 (2011).
- Cooper, D. A., et al. Subgroup and resistance analyses of raltegravir for resistant HIV-1 infection. Eng. J. Med. 359, 355-365 (2008).
- Briz, V., et al. Raltegravir and etravirine are active against HIV type 1 group O. AIDS Res.Human Retroviruses. 25, 225-227 (2009).
- Fransen, S., et al. Loss of raltegravir susceptibility by human immunodeficiency virus type 1 is conferred via multiple nonoverlapping genetic pathways. J. Virol. 83, 11440-11446 (2009).
- Goethals, O., et al. Primary mutations selected in vitro with raltegravir confer large fold changes in susceptibility to first-generation integrase inhibitors, but minor fold changes to inhibitors with second-generation resistance profiles. Virology. 402, 338-346 (2010).
- Goethals, O., et al. Resistance mutations in human immunodeficiency virus type 1 integrase selected with elvitegravir confer reduced susceptibility to a wide range of integrase inhibitors. J. Virol. 82, 10366-10374 (2008).
- Canducci, F., et al. Dynamic patterns of human immunodeficiency virus type 1 integrase gene evolution in patients failing raltegravir-based salvage therapies. AIDS. 23, 455-460 (2009).
- Ceccherini-Silberstein, F., et al. Characterization and structural analysis of HIV-1 integrase conservation. AIDS Rev. 11, 17-29 (2009).
- Charpentier, C., et al. Drug resistance profiles for the HIV integrase gene in patients failing raltegravir salvage therapy. HIV Med. 9, 765-770 (2008).
- Julias, J. G., et al. Effects of mutations in the G tract of the human immunodeficiency virus type 1 polypurine tract on virus replication and RNase H cleavage. J. Virol. 78, 13315-13324 (2004).
- Hare, S., et al. Structural and functional analyses of the second-generation integrase strand transfer inhibitor dolutegravir (S/GSK1349572). Mol. Pharmacol. 80, 565-572 (2011).
- Adachi, A., et al. Production of acquired immunodeficiency syndrome-associated retrovirus in human and nonhuman cells transfected with an infectious molecular clone. J. Virol. 59, 284-291 (1986).
- Kemp, S. D., et al. A novel polymorphism at codon 333 of human immunodeficiency virus type 1 reverse transcriptase can facilitate dual resistance to zidovudine and L-2',3'-dideoxy-3'-thiacytidine. J. Virol. 72, 5093-5098 (1998).
- Butler, S. L., Hansen, M. S., Bushman, F. D. A quantitative assay for HIV DNA integration in vivo. Nat. Med. 7, 631-634 (2001).
- Brussel, A., et al. Longitudinal monitoring of 2-long terminal repeat circles in peripheral blood mononuclear cells from patients with chronic HIV-1 infection. AIDS. 17, 645-652 (2003).
- Daelemans, D., Pauwels, R., De Clercq, E., Pannecouque, C. A time-of-drug addition approach to target identification of antiviral compounds. Nat. Protoc. 6, 925-933 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados