Method Article
Preparação fácil e eficiente de glicopolímeros fluorescentes Tri-componente via polimerização controlada pelo JANGADA
Neste Artigo
Resumo
An efficient, three-step synthesis of RAFT-based fluorescent glycopolymers, consisting of glycomonomer preparation, copolymerization, and post-modification, is demonstrated. This protocol can be used to prepare RAFT-based statistical glycopolymers with desired structures.
Resumo
Glicopolímeros sintéticos são ferramentas instrumentais e versáteis utilizados em vários campos de pesquisa bioquímicos e biomédicos. Um exemplo de uma síntese fácil e eficiente de glicopolímeros estatísticos fluorescentes bem controlados usando reversível adição-fragmentação de transferência de cadeia (RAFT) polimerização baseados é demonstrada. A síntese inicia-se com a preparação de 2-metacrilamida glycomonomer lactobionamidoethyl contendo β-galactose obtido por reacção de lactobionolactone e N - (2-aminoetil) metacrilamida (AEMA). 2-Gluconamidoethyl metacrilamida (GAEMA) é usado como um análogo estrutural falta um β-galactósido terminal. A seguinte reacção de copolimerização mediada por RAFT envolve três monómeros diferentes: N - (2-hidroxietil) acrilamida como espaçador, AEMA como alvo para posterior marcação por fluorescência, e os glycomonomers. Tolerante de sistemas aquosos, o agente RAFT usado na reacção é (ácido 4-cianopentanóico) -4-dithiobenzoate.Low dispersities (≤1.32), composições de copolímeros previsíveis e alta reprodutibilidade das polimerizações foram observadas entre os produtos. Polímeros fluorescentes são obtidas através da modificação das glicopolímeros carboxifluoresceína com éster de succinimidilo alvejando os grupos funcionais de amina primária em AEMA. Especificidades de ligação de lectina das glicopolímeros resultantes são verificados por meio de testes com esferas de agarose correspondentes revestidos com glycoepitope reconhecendo lectinas específicas. Devido à facilidade de síntese, o apertado controlo das composições e produtos da boa reprodutibilidade da reacção, este protocolo pode ser traduzido no sentido preparação de outros glicopolímeros à base de balsa com estruturas e composições específicos, se o desejar.
Introdução
Nas últimas duas décadas, as investigações com glicopolímeros sintéticos tenham sido submetidos a um desenvolvimento lento, mas contínuo, demonstrando potencial significativo no exame infecciosas mecanismos que incluam actividades de investigação que incide sobre lectina reconhecimento processa 1-3. Desde glicopolímeros sintéticos possuindo porções de açúcar multivalentes exibem eficácias de ligação a lectina muito mais elevadas, em comparação com os hidratos de carbono monovalentes, eles são de grande procura no campo Glycobiology 3. De particular interesse na investigação clínica é a utilização de glicopolímeros fluorescentes para caracterizar a ligação com hidratos de carbono disponíveis na superfície das células do aparelho respiratório humano e glicoproteína mucosa bacteriana mediada por lectinas. No início de estudos in vitro empregues glicopolímeros baseados em poliacrilamida disponíveis comercialmente em testes de ligação bacterianas. Várias dessas sondas mostraram resultados promissores, mas levantou preocupações a respeito, variâncias obtainability, e de lote para lote, tanto polpeso molecular Ymer e conteúdo glycoepitope. Um protocolo econômico em laboratório foi desenvolvido o que proporcionaria para um controle satisfatório de conteúdo estrutura, tamanho e pureza de glicopolímeros sintéticos visando lectinas bacterianas.
Em busca de uma abordagem sintética adequada para glicopolímeros, uma técnica relativamente nova de polimerização foi testada usando um tipo de polimerização radical controlada que empregue reversível adição-fragmentação da cadeia de transferência (RAFT) agentes 4. Tais reagentes RAFT foram recentemente utilizados em algumas preparações glicopoliméricos 5-7. Em comparação com outros protocolos de preparação glicopoliméricos, polimerizações mediada por RAFT demonstrar várias vantagens, incluindo a tolerância a uma variedade de estruturas de monómeros e as condições de reacção, a compatibilidade potencial com soluções aquosas, e baixa dispersividade de tamanhos dos produtos poliméricos desejados 8,9. De notável interesse são protocolos para a preparação de JANGADA-baglicopolímeros tri-componente sed, permitindo o controlo de composições de monómeros diferentes, cada um dos quais podem ter funções distintas 10-13. No entanto, a maioria dos esforços de pesquisas anteriores ou faltava anom�icos carboidratos pingente 10, ou empregada entrou polimerização, resultando em copolímeros tri-bloco, que consistem em homopolimeros covalente, que muitas vezes servem a propósitos diferentes do que os polímeros estatísticos que são copolímeros em que a sequência de monômero resíduos de seguir uma regra estatística 9-13.
Recentemente, empregando o composto RAFT thiocarbonylthio (ácido 4-cianopentanóico) -4-dithiobenzoate num ambiente aquoso, a preparação de um grupo de TRAF baseado no glicopolímeros estatísticos tri-componente lineares contendo pendentes açúcares específicos e a sua aplicação em ligação bacteriana mediada por lectina testes foi relatado 14. O objetivo geral deste método, apresentadas de forma visual, é preparar tri-componenteglicopolímeros fluorescentes estatísticos por copolimerização controlado-jangada. Devido à facilidade de o protocolo de polimerização de uma etapa, o controlo fino sobre o comprimento de polímeros e composições, e a elevada reprodutibilidade da reacção, este protocolo pode ser facilmente aplicado para outras sínteses à base de conjunto de glicopolímeros com estruturas desejadas.
Protocolo
1. Síntese de 2-Glycomonomer Lactobionamidoethyl metacrilamida
- Dissolver 2 g de ácido lactobiónico em 3,0 ml de metanol anidro e lentamente adicionar etanol absoluto em uma gota forma prudente até que a solução apenas se transforma nublado, em seguida, remover os solventes via rotoevaporação.
- Dissolve-se o resíduo, a partir do passo 1.1, em 3,0 ml de metanol anidro e, uma vez mais, adiciona-se lentamente etanol absoluto até pouco turvo, em seguida, evapora-se os solventes por meio de evaporação rotativa. Repetir esta etapa três vezes para se obter lactobiono-1,5-lactona (1,94 g, 98% de rendimento). Este produto tem pureza suficiente para ser utilizado nas reacções seguintes.
- Adicionar 1,0 g de lactobionolactone em 3,0 ml de metanol a N - (2-aminoetil) metacrilamida (AEMA, 0,58 g) e éter monometílico de hidroquinona (MEHQ, 1,0 mg), um inibidor de auto-polimerização, em 2,0 ml de metanol, seguido em 1,0 ml de trietilamina. Agita-se à TA durante 48 h.
- Adicionar 20 ml de H2O desionizada (2 dH O) ao balão de reacção, em seguida, remover o metanol e trietilamina livre por evaporação até à secura por meio de evaporação rotativa.
- Para remover qualquer ácido lactobiónico remanescente, adicionar 20 ml de dH 2 O, em seguida, passar a solução aquosa através de uma coluna de troca aniónica (forma OH -, em 10 mm x 20 mm) para uma proveta de recepção contendo 1,0 mg de MEHQ.
- Remover trietilamina, produzido no Passo 1.5, por evaporação até à secura por meio de evaporação rotativa.
- Adicionar 20 ml de dH2O e remover AEMA que não reagiu por adição lenta de 1 mg alíquotas de resina de permuta de catiões (forma H +) até que não ninidrina materiais reactivos são detectáveis. Monitorizar a eliminação, tomando aliquotas de 1 mL da solução após cada adição de resina, aplicando-a a uma placa de cromatografia em camada fina, em seguida, pulverizando a placa com um teste da ninidrina de 2% em solução de etanol. Quando nenhuma cor azul profundo é observado o desenvolvimento quando a chapa é aquecida a 90 ° C durante 1 min, o ponto final tenha sido atingido.
- Filtrar a solução através de um funil de vidro de frita, transferir o filtrado para um tubo de ensaio, congelar a amostra a -80 ° C, e, em seguida, liofilizar.
- Remover MEHQ a partir da amostra através da dissolução do material seco por congelação em uma quantidade mínima de metanol (~ 0,5 ml), em seguida, adicionar acetona anidra fria (-20 ° C, 15 ml) para precipitar o produto. Recolhe-se o precipitado por filtração, utilizando um funil de frita de vidro, em seguida, secar-se o precipitado em um exsicador sob vácuo para se obter 2-metacrilamida lactobionamidoethyl (LAEMA) como um pó esbranquiçado (0,94 g, 68% de rendimento). Este produto tem pureza suficiente para ser utilizado nas reacções seguintes.
2. Síntese de monómero de 2-Gluconamidoethyl metacrilamida
Nota: A preparação de 2-gluconamidoethyl metacrilamida (GAEMA), que não possui um açúcar pendente, foi adaptado a partir de um método publicado em 15.
- Adicionar 2,0 g de AEMA dissolvido em 10 ml de metanol a uma solução dede D-gliconolactona (1,6 g) em 30 ml de metanol e, sob agitação, adiciona-se lentamente 1,6 ml de trietilamina.
- Agita-se a reacção à temperatura ambiente durante 24 h.
- Filtra-se o produto precipitado através de um funil de frita de vidro e lavar o precipitado três vezes com 10 ml de cada vez de isopropanol, em seguida, lava-se com 10 ml de acetona seca. Seca-se o produto precipitado em um exsicador sob vácuo.
3. JANGADA glicopoliméricos Síntese
- Para remover o MEHQ inibidor presente em N comercial - (2-hidroxietil) acrilamida (HEAA), adicionar 1 ml de HEAA para um tubo de microcentrifugação de 2 ml, seguido pela adição de 0,5 g de nanopartículas de óxido de alumínio. Centrifuga-se o tubo a 300 xg durante 30 seg, e usar a camada de topo HEAA na reacção seguinte.
- Adiciona-se cuidadosamente 32,8 mg de LAEMA (70,0 umol), 1,7 mg de AEMA (10,5 umol) e 27,5 uL de HEAA (270 umol), todos dissolvidos em 0,4 ml de dH 2 O, para um tubo de 1 ml de Schlenk bem limpo, assim tendo um Monomer razão molar de 20: 3: 77.
- Numa reacção paralela, a fim de produzir polímeros de controlo que não possuem qualquer açúcar pendente, em vez de utilizar LAEMA na etapa 3.2, 21,4 mg de substituir GAEMA (70,0 umol) na reacção.
- Para o respectivo tubo de Schlenk (isto é, 3,2 ou 3,3), adiciona-se sequencialmente 50 ul de DMF contendo 0,53 mg de (ácido 4-cianopentanóico) -4-dithiobenzoate (1,9 umol, agente RAFT), e 50 ul de DMF contendo 250 mg de 4,4'-azobis- (ácido 4-cianovalérico) (0,9 umol, iniciador). Misture delicadamente com o dedo tocando.
- Congelar os conteúdos contidos no tubo de Schlenk empregando um banho de gelo seco: banho de etanol (75 g de gelo seco em 100 ml de etanol), para aplicar um vácuo dentro de 10-50 mTorr, em seguida, fechar a válvula de Schlenk e permitir que a solução a descongelar lentamente à temperatura ambiente . Repita este ciclo de congelamento-descongelamento evacuar mais duas vezes. Certifique-se de que todos os reagentes são dissolvidos após o último degelo.
- Coloque o tubo de Schlenk em um ba plástico lacradog, evacuar o ar do saco, e, em seguida, feche-o. Transferir o saco que contém o tubo de Schlenk a um banho de água pré-aquecido a 70 ° C e incubar durante 24 horas.
- Transferir cuidadosamente a solução no tubo de Schlenk a um saco de diálise preparada (MWCO = 3,500), e dializar contra dH2O (10 x 2 L) durante 24 horas, mudando o dH2O a cada hora durante as primeiras 8 horas. Após a diálise, a transferência da amostra do tubo de diálise para um tubo de ensaio, congelar a amostra a -80 ° C, e, em seguida, liofilizar-lo.
Nota: A estatística resultante poli-metacrilamida / acrilamida (PMA) copolímeros que contêm 4-O pingente -β-D-galactopiranosil-D-gluconamide (lactobionamide) (a partir do Passo 3,2) ou D-gluconamide (do Passo 3.3), respectivamente, são obtida. Por conveniência de discussão, estas duas glicopolímeros são abreviados como PMA-LAEMA e PMA-GAEMA, respectivamente.
4. Pós-modificação de glicopolímeros com fluoróforos
- Dissolve-se 5,0 mg de glicopoliméricos-LAEMA PMA ou PMA-GAEMA contendo ~ 0,9 mole de grupos funcionais de amina primária em 0,9 ml de solução salina de fosfato tamponada (PBS, fosfato de sódio 0,1 M, NaCl 0,15 M, pH 7,5), respectivamente.
- Adiciona-se lentamente 0,6 mg de éster de succinimidilo de carboxifluoresceína em 100 ul de DMF para as soluções com agitação rápida. Agitar suavemente as reacções durante 16 horas no escuro à temperatura ambiente.
- Enquanto protegido da luz, carregar a amostra para um tubo de diálise preparada (MWCO = 3,500) e dializar contra dH2O (2 L) durante 16 horas, trocando a solução de diálise a cada hora durante as primeiras 8 horas. Após a diálise, a transferência da amostra do tubo de diálise para um tubo de ensaio, congelar a amostra a -80 ° C, e, em seguida, liofilizar-lo.
Nota: Após a liofilização, glicopolímeros fluorescentes PMA-LAEMA-fluoresceína e PMA-GAEMA-fluoresceína, respectivamente, são obtidos.
5. Caracterização do Glicopolímeros
- Determinar o número médio de peso molecular (Mn), o peso médio de peso molecular (M w) e a dispersibilidade (M w / M n) dos glicopolímeros num sistema de HPLC comercial equipado com software de cromatografia de permeação em gel (GPC), um GPC coluna adequada para o peso molecular de interesse, e um detector de índice de refracção, utilizando Tris a 0,1 M / tampão de cloreto de sódio 0,1 M (pH 7) como eluente a um caudal de 0,6 ml / min 14. Use padrões de polietileno glicol como padrões de peso molecular (MW: 200-1,200,000 g / mol).
- Quantificar as concentrações reais de grupos funcionais de aminas primárias dentro dos glicopolímeros 16. Analisar o teor total de hidratos de carbono das glicopolímeros sintetizados de acordo com um método publicado em 17.
- Realizar testes de composição estrutural e pureza do LAEMA glycomonomers, GAEMA e glicopolímeros PMA-LAEMA, PMA-GAEMA em D 2 O por espectroscopia de RMN de 14.
6. Os ensaios de ligação da glicopolímeros sintéticas com Lectin revestido contas de agarose
- Adicionar 1,5 ml de PBS a 50 ul de suspensão de corticeira lectina (ECL) esferas de agarose -Revestido, centrifugar a 300 xg por 1 min, e remova cuidadosamente e elimine o sobrenadante. Repetir este passo duas vezes, e, em seguida, voltar a suspender as pérolas em 0,5 ml de PBS.
- Adiciona-se 3 ng de PMA-LAEMA-fluoresceína ou PMA-GAEMA-fluoresceína (controlo negativo) em 6 mL de PBS para a suspensão de pérolas, e incuba-se as misturas, no escuro, à temperatura ambiente durante 1 h.
- Lavam-se as misturas com 1,5 ml de PBS três vezes, e os grânulos ressuspender em 0,2 mL de PBS. Coloque uma alíquota (4 ul) em um poço em um slide de microscópio de imunofluorescência (teflon), cubra com uma tampa de deslizamento, e observar por microscopia de fluorescência usando um filtro FITC (comprimento de onda de excitação: 467-498 nm, comprimento de onda de emissão: 513- 566 nm) e uma objectiva de 10X a examinar a ligação de tele fluorescentes glicopolímeros com as esferas 14.
Resultados
Síntese de glycomonomer
Ácido lactobiónico foi aqui utilizado como um exemplo para a preparação de glycomonomers. Usando métodos no relatório inicial sobre a síntese de LAEMA 11, foram observadas produções variadas na preparação com pureza insatisfatórias. O método de purificação modificadas utilizando resinas catiónica e de permuta aniónica para remover o material de partida que não reagiu, o rendimento do produto oferecido estável e de elevada pureza, que é confirmada por 1 H e 13 C espectroscopia de RMN (Figura 1).
JANGADA síntese glicopoliméricos e pós-modificação de glicopolímeros com fluoróforos
Em contraste com o bloco-glicopolímeros preparados através de polimerizações RAFT escalonados, este protocolo de copolimerização de um passo proporciona uma distribuição glycomonomer uniforme ao longo da estrutura do polímero. Os glicopolímeros mostrados aqui conter 20% em mol de glycomonomer, 77 mol% de HEAA como um espaçador, e 3% molar de AEMA como alvo para modificações pós-(ver Figura 2). 1 H- e 13 C-rmn confirmou as estruturas de PMA-LAEMA e PMA-GAEMA (Figuras 3 e 4). Como mostrado na Figura 5, quando representada graficamente contra os perfis de eluição de GPC do glicopoliméricos sintetizado sem RAFT, tanto PMA-LAEMA e PMA-GAEMA têm baixos dispersities, provando a eficácia da abordagem jangada. Como esperado, PMA-GAEMA tem um Mn menor do que a de PMA-LAEMA devido à falta de um açúcar pingente de PMA-GAEMA. Análise de hidratos de carbono e os grupos funcionais de amina primária conteúdo das glicopolímeros RAFT revelou que a proporção de monómeros na glicopolímeros produto é consistente com a relação estequiométrica dos monómeros de arranque utilizados na reacção de polimerização mediada por TRAF (Tabela 1). Isso significa um controlo apertado do compositio monômerons nos glicopolímeros sintetizados, como projetado.
A reacção de grupos funcionais de amina primária com fluoróforos activadas é uma técnica amplamente utilizada na marcação de proteínas. Esta técnica foi empregada aqui para rotular glicopolímeros purificados com carboxifluoresce�a. Na sequência de pós-modificação, polímeros fluorescentes foram obtidos (Figura 6). Nenhuma degradação dos polímeros marcados com fluoresceína da reacção foi detectado por análise de GPC (dados não mostrados).
Encadernação testes dos glicopolímeros sintéticos com pérolas de agarose revestidas com lectina
Para avaliar a especificidade de ligação a lectina das glicopolímeros sintetizados, foi utilizada pérolas de agarose revestidas com lectina-hidrato de carbono conhecida especificidade de ligação crista-galli lectina. Erythrina (ECL), empregadas nas experiências, tem uma especificidade de ligação para com β-D-galactósido. A Figura 7A mostra claramente que PMA-LAEMA-Fluorescein, que contém β-D-galactósido como um hidrato de carbono pendente, exibiram forte ligação com a lectina de ECL. Em contraste, a ligação para a ECL do glicopoliméricos PMA-GAEMA-fluoresceina, que não possuem um açúcar pingente negativo, é mostrado na Figura 7B. Este resultado exemplifica a eficácia de ligação e afinidade do glicopoliméricos fluorescente sintetizada.
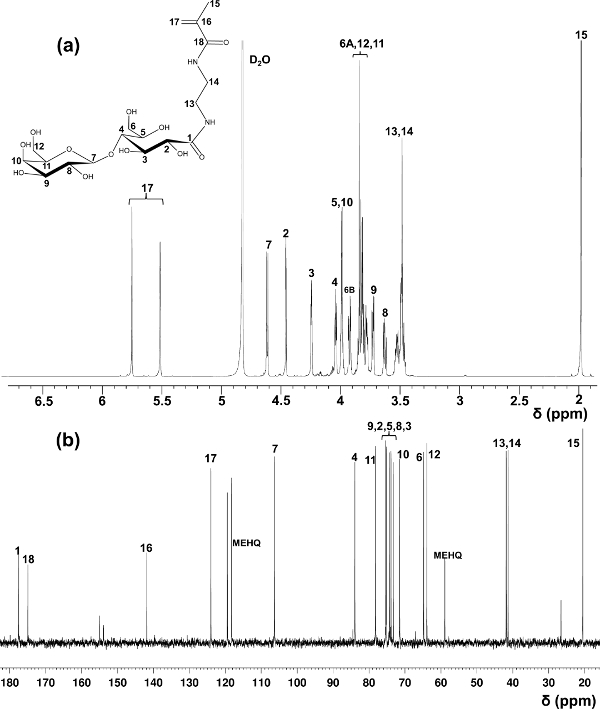
Figura 1. Atribuído 1 H- (a) e 13 C-NMR (b) os espectros (D 2 O) para LAEMA. (Esta figura foi modificado de Wang et al 14.) Por favor, clique aqui para ver uma versão maior desta figura.
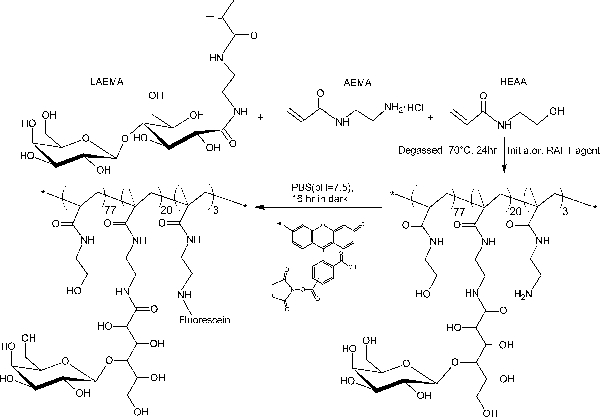
Figura 2. Ilustração esquemática da síntese de glicopoliméricos fluorescente PMA-LAEMA contendo β-galactoside como o açúcar pingente. Por favor clique aqui para ver uma versão maior desta figura.
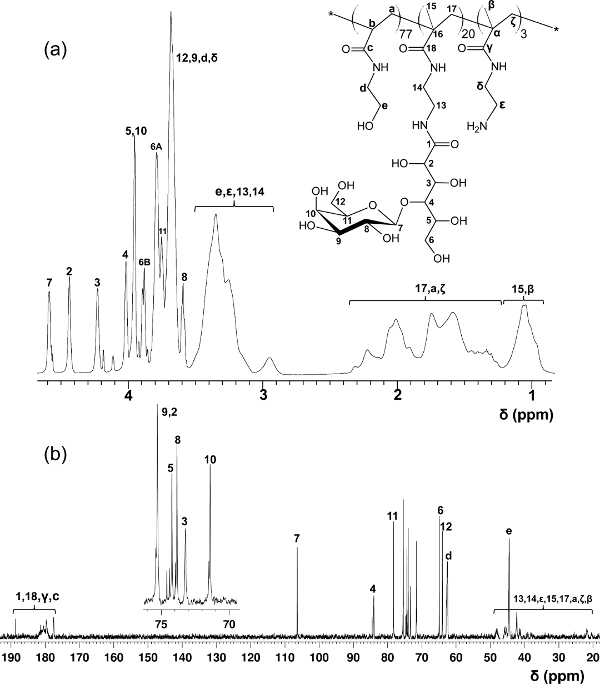
Figura 3. afectadas 1 H- (A) e 13 C-RMN (B) os espectros (D 2 O) para PMA-LAEMA glicopoliméricos. (Esta figura foi modificado a partir de 14 de Wang et al.) Fundamentose, clique aqui para ver uma versão maior desta figura.
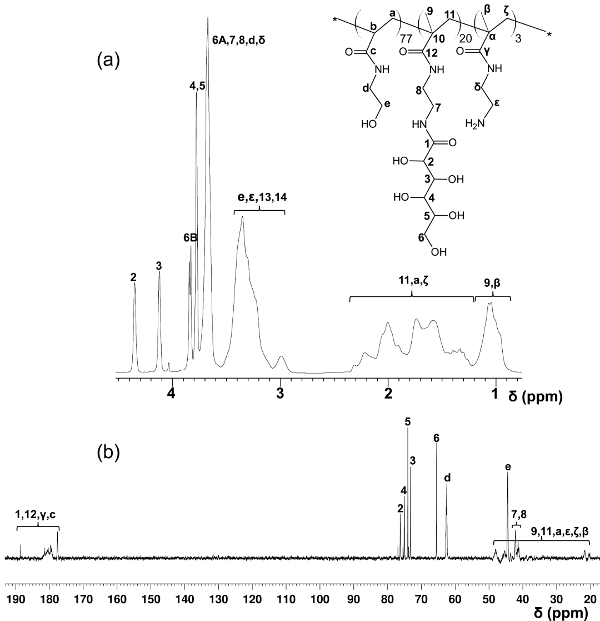
Figura 4. Assigned 1 H- (A) e 13 C-NMR (B) espectros (D 2 O) para PMA-GAEMA. (Esta figura foi modificado de Wang et al 14.) Por favor, clique aqui para ver uma versão maior desta figura.
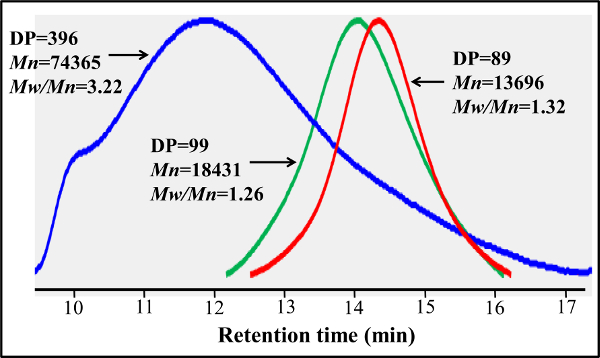
Figura 5. Gel vestígios de cromatografia de permeação de base-RAFT PMA-GAEMA e PMA-LAEMA preparados com e sem a utilização de agente de TRAF. Em contraste com o PMA-LAEMA preparada sem agente RAFT (azul), RAFT- baseada PMA-LAEMA (verde) tem uma dispersividade muito inferior (M w / M n). Baseado no JANGADA PMA-GAEMA (vermelho) e PMA-LAEMA têm perfis semelhantes GPC, mas o primeiro tem um menor M n, devido à ausência de quaisquer açúcares pingente. Por favor clique aqui para ver uma versão maior desta figura.

Figura 6. PMA-LAEMA antes e depois pós-modificação com fluoróforo. (A) Em comparação com glicopoliméricos não marcado branco (tubo de esquerda), marcado com fluoresceína PMA-LAEMA mostra uma cor amarela forte (tubo direita). (B) De acordo com UV, não marcado PMA-LAEMA (tubo esquerda, 1 mg / ml em PBS) é escuro e apresenta-se com ausência de fluorescência, enquanto que a fluoresceína marcado com PMA-LAEMA (tubo direito, a 1 mg / ml em PBS) mostra forte fluorescência verde.: "Target =" _ blank //www.jove.com/files/ftp_upload/52922/52922fig4large.jpg "> Clique aqui para ver uma versão maior desta figura.
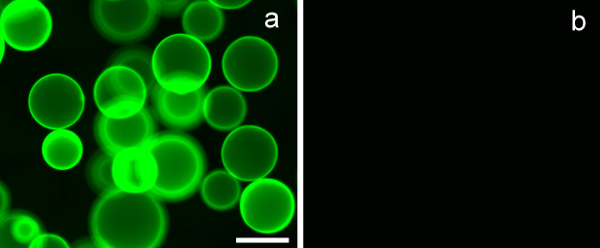
Figura 7. corticeira lectina (ECL) esferas de agarose -Revestido ligar β-D-galactósido contendo glicopolímeros, e não os que não possuem um açúcar pendente. (A) PMA-LAEMA-fluoresceína (3 ug) demonstraram forte ligação com ECL , enquanto que em (B) PMA-GAEMA-fluoresceina, que possui nenhum resíduo pendentes β-D-galactósido, não mostraram nenhuma ligação com as esferas revestidas com lectina. Barra de escala = 100 pm.
Tabela 1. Valores alvo um dos parâmetros sintéticos e composições reais dos glicopolímeros. A) Segmentação valores, valores quesão desejadas dos produtos; b) DP, grau de polimerização; c) NA, não disponível. Por favor clique aqui para ver uma versão maior desta figura.
| DP b | Dispersity | Conteúdo real do glycomonomers mol% | Conteúdo real da amina primária mol% | |
| Segmentação valores | 100 | <1,3 | 20 | 3 |
| PMA-LAEMA | 99 | 1.26 | 19 | 3.2 |
| PMA-GAEMA | 89 | 1.32 | NA c | 2.7 |
Discussão
Um protocolo fácil e eficiente para glicopolímeros fluorescentes baseados em RAFT tri-componente, com e sem um hidrato de carbono pendente, e a sua utilização num teste de ligação a lectina, é demonstrado no presente relatório. O protocolo começa com a preparação de glycomonomers LAEMA e GAEMA. Através de um controlo-RAFT copolimerização de um só passo, com rendimento glicopolímeros reprodutível, composição de monómero previsível e baixa dispersividade, são obtidos. Seguindo pós-modificação de glicopolímeros com éster de succinimidilo de carboxifluoresceína, a ligação do respectivo glicopoliméricos marcado com fluorescência resultante é facilmente verificável para a sua especificidade de ligação a lectina.
Nos passos preparativos iniciais dos glycomonomers que são para ser empregues nas sínteses glicopoliméricos subsequentes, foram utilizados ácido lactobiónico prontamente disponível e a gluconolactona. Em teoria, quaisquer hidratos de carbono de interesse a partir de monossacáridos, oligossacáridos complexos para, pode ser Converted para glycomonomers por conjugação do açúcar alvo para o grupo hidroxilo primário em C6 de glucose. Após a oxidação do resíduo de glucose redutores, e a sua desidratação subsequente a uma lactona, o produto pode então ser facilmente feito reagir com a amina primária em AEMA para formar o correspondente glycomonomer. Outros exemplos desta via pode ser visto em um relatório recente 14. Deve notar-se que antes de iniciar qualquer passo de polimerização, de MEHQ, um potente inibidor de polimerização, deve ser removido a partir de todas as preparações de monómeros e glycomonomer imediatamente antes da utilização. Isto é facilmente conseguido através da utilização da quantidade mínima de metanol para dissolver o glycomonomer que possui MEHQ seguida tratá-la imediatamente com acetona à temperatura de -20 ° C para precipitar o produto isento de inibidor, com elevado rendimento.
Essencial em qualquer esquema de polimerização radical, atenção aos detalhes e de monômero purezas são enfatizados. Como é típico de um sistema de polimerização RAFT, que consiste deuma fonte de radicais, um reagente RAFT, um monómero e solvente. Nesta apresentação visualizada, um sistema de polimerização TRAF de um só passo é descrito que incide sobre a produção de copolímeros estatísticos gerados a partir de uma mistura de reacção que possua três monómeros diferentes em uma solução aquosa. Duas reacções mediadas por RAFT separadas são apresentados no qual se utiliza um glycomonomer que possui um pendente, não redutor do hidrato de carbono terminal (isto é, β-D-galactose), e o outro, possuindo um poliol, sem resíduo de hidrato de carbono ligado. Comum a ambas as reacções mediadas por RAFT foram monómeros que possuem um grupo hidroxilo singular que serve como uma molécula separadora, e uma outra que possua uma amina livre de pós-modificação com um fluoróforo amino-reactivo.
Uma vez que a presença de oxigénio na mistura de reacção e do ambiente é prejudicial para a polimerização TRAF-mediada, a sua remoção para níveis vestigiais é prontamente conseguida através de vários congelamento-evaciclos cuate-descongelação, mantendo o recipiente de reacção de tubo de Schlenk sob alto vácuo.
Deve notar-se que a razão molar de diferentes monómeros na reacção pode ser ajustada conforme necessário. Além disso, fazendo variar a quantidade de agente RAFT usado, o comprimento dos polímeros resultantes pode ser controlada 18. No entanto, a proporção molar do agente de TRAF para iniciador deve ser sempre superior a dois para assegurar a baixa dispersibilidade do produto. Sob estas condições, a evolução da copolimerização é constante, e a reprodutibilidade da reacção é muito alta. Dito isto, é pouco provável que se obtém uma distribuição totalmente uniforme de todos os monómeros participantes dentro de um copolímero estatístico, devido às suas velocidades de polimerização diferentes. Caracterizar a distribuição de diferentes monómeros dentro do polímero ainda é muito difícil.
O método de pós-modificação, aqui apresentado, é ao mesmo tempo mais simples e mais amenable para a utilização de uma vasta selecção de marcadores fluorescentes, em comparação com outros protocolos aplicados para glicopolímeros etiqueta 2,11. Estes incluem muitos dos fluoróforos reactivos com aminas solúveis em água, quantum dots, biotinas, e outros. As especificidades de ligação dos sintetizados, glicopolímeros marcadas são prontamente verificáveis utilizando lectinas com afinidades de ligação conhecidas. PMA-GAEMA possuir nenhum açúcar pingente é um controle negativo apropriado. Glicopolímeros com diferentes etiquetas fluorescentes preparados por esta via tem sido utilizada com sucesso em investigações de lectina bacteriana mediada por ligação 14. Como apresentado, esta preparação fácil e eficiente de glicopolímeros fluorescentes estatísticos deve fornecer um grande potencial para uma ampla variedade de pesquisa glycobiological.
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was supported by the Experiment Station Chemical Laboratories of the University of Missouri, and by the Cystic Fibrosis Association of Missouri.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Lactobionic acid | Sigma-Aldrich | 153516 | |
| D-Gluconolactone | Sigma-Aldrich | G2164 | |
| N-(2-hydroxyethyl) acrylamide (HEAA) | Sigma-Aldrich | 697931 | |
| Orange II sodium salt | Sigma-Aldrich | O8126 | |
| Hydroquinone monomethyl ether (MEHQ) | Sigma-Aldrich | 54050 | Polymerization inhibitor |
| N-(2-aminoethyl) methacrylamide hydrochloride (AEMA) | Polysciences, Inc | 24833-5 | |
| Triethylamine | Fisher Scientific | BP-616 | |
| Anion-exchange resin IRN-78 hydroxide-form, 80 mesh | Sigma-Aldrich | 10343-U | |
| Cation-exchange resin 50Wx8, 200 mesh | Sigma-Aldrich | 217514 | |
| Aluminum oxide, ~150 mesh | Sigma-Aldrich | A1522 | Type WN-6, Neutral, Activity Grade Super I |
| Ninhydrin | Sigma-Aldrich | N4876 | An ethanol solution of 0.2% ninhydrin was used in the test |
| 4-Cyano-4-(phenylcarbonothioylthio)pentanoic acid | Sigma-Aldrich | 722995 | RAFT agent |
| 4,4′-Azobis(4-cyanovaleric acid) | Sigma-Aldrich | 11588 | Polymerization initiator |
| Carboxyfluorescein succinimidyl ester | Life Technologies | C1157 | |
| Erythrina Cristagalli lectin coated agarose bead | Vector Laboratories | AL-1143 | |
| Solvent | |||
| dH2O | Produced by Barnstead water purification system, 18 megOhm-cm | ||
| Isopropanol | Fisher Scientific | A461-4 | ACS grade or better |
| Methanol | Fisher Scientific | A454-4 | ACS grade or better |
| Absolute ethanol | Fisher Scientific | BP2818-100 | ACS grade or better |
| Dimethylformamide | Sigma-Aldrich | 22705 | ACS grade or better |
| Acetone | Fisher Scientific | A929-4 | ACS grade or better |
| Equipment | |||
| Dialysis membrane (MWCO: 3,500) | Spectrum Labs | 132720 | |
| Polyethylene glycol analytical standard standard | Sigma-Aldrich | O2393 | |
| Schlenk tube, 1 ml | Quark Glass | Customized | |
| TSK-GEL G4000 PWxl | Tosoh Bioscience | 8022 | Used for GPC analysis of the glycopolymers |
| Empower 3 with GPC/SEC package | Waters Corporation | ||
| Waters Alliance HPLC system | Waters Corporation | Equipped with refractive index detector (Waters 2414) and fluorescence detector (Waters 2475) | |
| Avance III 800 MHz NMR Spectrometer | Bruker Corporation | ||
| BX43 fluorescence microscope | Olympus Corporation | Used with FITC filter in the glycopolymer binding test | |
| Rotavap / Rotoevaporator | Heidolph | ||
| Fritted disc funnel | Fisher Scientific | 10-310-109 | |
| Lyophilizer | Labconco | ||
| Immunofluorescence microscope slide | Polysciences | 18357-1 | |
| Revco Ultima Plus -80 °C Freezer | Thermo Scientific | ||
| Plastic Vacuum Bag and Hand Pump | Ziploc | ||
| Vacuum Pump, Direct Drive, Maxima C Plus | Fisher Scientific | ||
| Vacuum Gauge | Sargent-Welch | ||
Referências
- Scharfman, A., et al. Pseudomonas aeruginosa binds to neoglycoconjugates bearing mucin carbohydrate determinants and predominantly to sialyl-Lewis x conjugates. Glycobiology. 9 (8), 757-764 (1999).
- Song, E. H., et al. In vivo targeting of alveolar macrophages via RAFT-based glycopolymers. Biomaterials. 33 (28), 6889-6897 (2012).
- Wolfenden, M. L., Cloninger, M. J., Wang, B., Boons, G. .. -. J. Chapter 14. Multivalency in carbohydrate binding. Carbohydrate Recognition: Biological Problems, Methods, and Applications. , 349-370 (2011).
- Moad, G., Rizzardo, E., Thang, S. H. Radical addition-fragmentation chemistry in polymer synthesis. Polymer. 49 (5), 1079-1131 (2007).
- Spain, S. G., Gibson, M. I., Cameron, N. R. Recent advances in the synthesis of well-defined glycopolymers. J. Polym. Sci., Part A: Polym. Chem. 45 (11), 2059-2072 (2007).
- Bernard, J., Hao, X., Davis, T. P., Barner-Kowollik, C., Stenzel, M. H. Synthesis of various glycopolymer architectures via RAFT polymerization: From block copolymers to stars. Biomacromolecules. 7 (1), 232-238 (2006).
- Bulmus, V. RAFT polymerization mediated bioconjugation strategies. Polym. Chem. 2, 1463-1472 (2011).
- Ting, S. R. S., Chen, G., Stenzel, M. H. Synthesis of glycopolymers and their multivalent recognitions with lectins. Polymer Chemistry. 1, 1392-1412 (2010).
- Vazquez-Dorbatt, V., Lee, J., Lin, E. W., Maynard, H. D. Synthesis of glycopolymers by controlled radical polymerization techniques and their applications. Chembiochem. 13, 2478-2487 (2012).
- Jiang, X., Ahmed, M., Deng, Z., Narain, R. Biotinylated glyco-functionalized quantum dots: Synthesis, characterization, and cytotoxicity studies. Bioconjugate Chem. 20 (5), 994-1001 (2009).
- Deng, Z., Li, S., Jiang, X., Narain, R. Well-defined galactose-containing multi-functional copolymers and glyconanoparticles for biomolecular recognition processes. Macromolecules. 42 (17), 6393-6405 (2009).
- Qin, Z., et al. Galactosylated N-2-hydroxypropyl methacrylamide-b-N-3-guanidinopropyl methacrylamide block copolymers as hepatocyte-targeting gene carriers. Bioconjugate Chem. 22 (8), 1503-1512 (2011).
- Albertin, L., Wolnik, A., Ghadban, A., Dubreuil, F. Aqueous RAFT polymerization of N-acryloylmorpholine, synthesis of an ABA triblock glycopolymer and study of its self-association behavior. Macromol. Chem. Phys. 213 (17), 1768-1782 (2012).
- Wang, W., Chance, D. L., Mossine, V. V., Mawhinney, T. P. RAFT-based tri-component fluorescent glycopolymers: synthesis, characterization and application in lectin-mediated bacterial binding study. Glycoconj. J. 31 (2), 133-143 (2014).
- Deng, Z., Ahmed, M., Narain, R. Novel well-defined glycopolymers synthesized via the reversible addition fragmentation chain transfer process in aqueous media. J. Polymer Sci. Part A: Polym. Chem. 47 (2), 614-627 (2009).
- Noel, S., Liberelle, B., Robitaille, L., De Crescenzo, G. Quantification of primary amine groups available for subsequent biofunctionalization of polymer surfaces. Bioconjugate Chem. 22 (8), 1690-1699 (2011).
- Fox, A., Morgan, S. L., Gilbart, J., Biermann, C. J., McGinnis, G. D. Preparation of alditol acetates and their analysis by gas chromatography (GC) and mass spectrometry (MS). Analysis of Carbohydrates by GLC and MS. , 87-170 (1989).
- Thomas, D. B., et al. Kinetics and molecular weight control of the polymerization of acrylamide via RAFT. Macromolecules. 37 (24), 8941-8950 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados