Method Article
Легким и эффективным Подготовка Tri-компонентов флуоресцентных гликополимеров помощью плот контролируется полимеризации
В этой статье
Резюме
An efficient, three-step synthesis of RAFT-based fluorescent glycopolymers, consisting of glycomonomer preparation, copolymerization, and post-modification, is demonstrated. This protocol can be used to prepare RAFT-based statistical glycopolymers with desired structures.
Аннотация
Синтетические гликополимеров инструментальные и универсальные инструменты, используемые в различных биохимических и биомедицинских исследований полей. Пример легким и эффективным синтеза хорошо контролируемых флуоресцентные статистических гликополимеров с использованием обратимого присоединения-фрагментации переноса цепи (RAFT) основе полимеризации продемонстрирована. Синтез начинается с подготовки β-галактозы содержащие glycomonomer 2-lactobionamidoethyl метакриламида полученной реакцией lactobionolactone и N - (2-аминоэтил) метакриламида (AEMA). 2-Gluconamidoethyl метакриламид (GAEMA) используется в качестве структурного аналога хватает терминала β-галактозид. Ниже РАФТ-опосредованной реакции сополимеризации включает три различных мономеров: N - (2-гидроксиэтил) акриламид в качестве спейсера, AEMA в качестве мишени дл дальнейшего маркировки флуоресценции, а glycomonomers. Устойчивость к воздействию водных системах, плота агент, используемый в реакции (4-cyanopentanoic кислота) -4-dithiobenzoate.Низкие дисперсности (≤1.32), предсказуемые композиции сополимера, и высокая воспроизводимость полимеризации наблюдается среди продукции. Люминесцентные полимеры получают путем модификации гликополимеров с карбоксифлуоресцеин сукцинимидиловым эфира таргетирования первичный амин функциональные группы на AEMA. Лектин-связывающий особенности получаемых гликополимеров проверяются путем тестирования с соответствующими бисером агарозы, покрытых конкретных glycoepitope признания лектинов. Из-за легкости синтеза, жесткий контроль составы продуктов и хорошую воспроизводимость реакции, этот протокол может быть переведен в направлении получения других плота на основе гликополимеров с конкретным структурам и композициям, как хотелось бы.
Введение
В последние два десятилетия, исследования с синтетическими гликополимеров прошли медленный, но постоянное развитие, демонстрируя значительный потенциал в изучении инфекционных механизмы, которые включают исследования, которая фокусируется на лектин признание процессов 1-3. Так синтетические гликополимеров обладающие мультивалентные сахара фрагменты демонстрируют гораздо более высокие лектин-связывающий эффективностями, по сравнению с одновалентных углеводов, они пользуются большим спросом в области Glycobiology 3. Особый интерес в области клинических исследований является использование флуоресцентных гликополимеров охарактеризовать лектин-опосредованного связывания бактериальных с углеводами, доступных на поверхностях человека дыхательных клеток и слизистой гликопротеина. В начале пробирке исследования использованы коммерчески доступные на основе полиакриламида гликополимеров в бактериальных обязательных тестов. Некоторые из этих зондов показали многообещающие результаты, но выразили обеспокоенность относительно, obtainability и много-много-к дисперсий в обоих PolYmer молекулярная масса и содержание glycoepitope. Экономичный протокол в лаборатории-был разработан, который будет обеспечивать для удовлетворительного контроля содержания структуры, размера и чистоты синтетических гликополимеров ориентированных бактериальных лектинов.
В поисках подходящего синтетического подхода к гликополимеров, относительно новый метод полимеризации был протестирован с использованием типа контролируемой радикальной полимеризации, что используемый обратимым дополнение фрагментации цепи передачи (плот) агентов 4. Такие реагенты RAFT недавно были использованы в нескольких glycopolymer препаратов 5-7. По сравнению с другими протоколами подготовки glycopolymer, плот опосредованной полимеризации демонстрируют несколько преимуществ, в том числе устойчивостью к различным мономерных структур и условий реакции, потенциальной совместимости с водными растворами, и маленький размер дисперсности желаемых полимерных продуктов 8,9. Из заметных интересных протоколы для подготовки плот баSED Tri-компонент гликополимеров, что позволяет контролировать композиций различных мономеров, каждый из которых может иметь различные функции 10-13. Тем не менее, большинство из предыдущих исследовательских усилий либо не было аномерные боковые углеводы 10, или применяться вышел полимеризации в результате три-блок-сополимеров, которые состоят из ковалентно связанных гомополимеров, которые часто служат для разных целей, чем статистических полимеров, которые представляют собой сополимеры, в которых последовательность мономера остатки следовать статистической правило 9-13.
Недавно, применяя thiocarbonylthio RAFT соединение (4-cyanopentanoic кислота) -4-dithiobenzoate в водной среде, подготовка группы плота на основе линейных три--компонент статистические гликополимеров содержащие специфические боковые сахаров и их применение в лектин-опосредованного связывания бактериальной Тесты сообщалось 14. Общая цель этого способа, представленного в визуальной форме, чтобы подготовить три-компонентстатистические люминесцентные гликополимеров через плот контролируемой сополимеризации. Из-за простоты протокола полимеризации одностадийного, в порядке контроля по длине полимерной композиции и, и высокой воспроизводимости реакции, этот протокол может быть легко применены к другим плот на основе синтеза гликополимеров с заданными структурами.
протокол
1. Синтез Glycomonomer 2-Lactobionamidoethyl метакриламида
- Растворите 2 г лактобионовой кислоты в 3,0 мл безводного метанола и медленно добавить абсолютного этанола в каплям моды, пока раствор не станет просто облачно, затем удалить растворители с помощью роторном испарителе.
- Остаток растворяют с шагом 1.1, 3.0 мл в безводном метаноле и снова, медленно добавить абсолютного этанола, пока только Облачно, то испаряются растворители помощью роторном испарителе. Повторите этот шаг 3 раза, чтобы получить lactobiono-1,5-лактон (1,94 г, выход 98%). Этот продукт имеет достаточную чистоту, чтобы быть использованы в следующих реакций.
- Добавить 1,0 г lactobionolactone в 3,0 мл метанола с N - (2-аминоэтил) метакриламид (AEMA, 0,58 г) и монометиловый эфир гидрохинона (MEHQ, 1,0 мг), ингибитор полимеризации себя, в 2,0 мл метанола, с последующим по 1,0 мл триэтиламина. Перемешивают при комнатной температуре в течение 48 ч.
- Добавьте 20 мл деионизированной H 2 O (DH 2 О) в реакционную колбу, а затем удалить метанол и бесплатный триэтиламин путем выпаривания досуха с помощью роторном испарителе.
- Для удаления остатков кислоты лактобионовую, добавить 20 мл дН 2 O, а затем пройти через водный раствор анионообменной колонке (ОН - форма, 10 мм х 20 мм) в приемной стакан, содержащий 1,0 мг МеГХ.
- Удалить триэтиламин, полученный на этапе 1.5, путем выпаривания досуха с помощью роторном испарителе.
- Добавьте 20 мл дН 2 O и удаления непрореагировавшего AEMA медленно добавляя 1 мг аликвоты катионообменной смолы (Н + форма) до тех пор, не нингидрином реактивные материалы обнаружить. Монитор удаление путем принятия 1 мкл аликвоты раствора после каждого смолы того, применяя его к тонкослойной хроматографии пластине, а затем распыления пластины с 2% нингидрина в растворе этанола. При отсутствии синий цвет не наблюдается для разработки, когда пластина нагревается до 90 ° С в течение 1 мин, конечная точка была достигнута.
- Фильтр решение через воронку из спеченного стекла, перевести фильтрата в пробирку, замораживание образца при -80 ° С, а затем лиофильной сушке.
- Удалить MEHQ из образца путем растворения лиофилизированного материала в минимальном количестве метанола (~ 0,5 мл), затем добавить холодной безводного ацетона (-20 ° C, 15 мл), чтобы осадить продукт. Собирают осадок фильтрованием с использованием стекл нный фильтр, а затем сухой осадок в эксикаторе под вакуумом с получением 2-метакриламид (lactobionamidoethyl LAEMA) в виде не совсем белого порошка (0,94 г, выход 68%). Этот продукт имеет достаточную чистоту, чтобы быть использованы в следующих реакций.
2. Синтез мономера 2-Gluconamidoethyl метакриламида
Примечание: подготовка 2-gluconamidoethyl метакриламида (GAEMA), которые не обладают кулон сахар, была взята из опубликованной методом 15.
- Добавить 2,0 г AEMA растворенного в 10 мл метанола к растворуД-глюконолактон (1,6 г) в 30 мл метанола и при перемешивании медленно добавляют 1,6 мл триэтиламина.
- Реакционную смесь перемешивают при комнатной температуре в течение 24 ч.
- Фильтр осажденного продукта с использованием стекл нный фильтр и промыть осадок три раза с 10 мл каждого из изопропанола, затем промыть 10 мл сухого ацетона. Сушат осажденный продукт в эксикаторе под вакуумом.
3. РАФТ Glycopolymer Синтез
- Для удаления ингибитора MEHQ присутствующие в коммерческом N - (2-гидроксиэтил) акриламид (HEAA), добавляют 1 мл HEAA к 2 мл микроцентрифужных трубки с последующим добавлением 0,5 г наночастиц оксида алюминия. Центрифуга трубки при 300 х г в течение 30 сек, и использовать верхний слой HEAA в следующей реакции.
- Осторожно добавить 32,8 мг LAEMA (70,0 мкмоль), 1,7 мг (10,5 AEMA мкмоль) и 27,5 мкл (270 HEAA мкмоль), все растворяется в 0,4 мл дН 2 O, чтобы хорошо очищенную 1 мл трубку Шленка, таким образом, имеющие monomэ молярное соотношение 20: 3: 77.
- В параллельной реакции, с целью получения контроля полимеры, которые не обладают какой-либо кулон сахар, вместо использования LAEMA на шаге 3.2, заменить 21,4 мг GAEMA (70,0 мкмоль) в реакции.
- К соответствующему Шленка (т.е. 3,2 или 3,3), последовательно добавляют 50 мкл ДМФА, содержащего 0,53 мг (4-cyanopentanoic кислоты) -4-dithiobenzoate (1,9 мкмоль, РАФТ агента) и 50 мкл ДМФА, содержащего 250 мкг 4,4'-azobis- (4-cyanovaleric кислота) (0,9 мкмоль, инициатор). Аккуратно перемешать палец нажатие.
- Замораживание содержимое, содержащиеся в Шленка занято сухой лед: этанол ванну (75 г сухого льда в 100 мл этанола), применять вакуум в пределах 10-50 мторр, затем закройте клапан Schlenk и разрешить решение медленно разморозить до комнатной температуры , Повторите эту замораживания-размораживания эвакуировать цикл в два раза больше. Убедитесь, что все реагенты растворяются после последнего оттепели.
- Поместите трубку Шленка в закрывающийся пластиковый баг, эвакуировать воздух мешок, а затем запечатать его. Передача пакет, содержащий трубку Шленка на водяной бане, предварительно нагретой при 70 ° С и выдержать в течение 24 часов.
- Тщательно передачи решения в Шленка на подготовленную для диализа (MWCO = 3500), и диализ против дН 2 O (10 х 2 л) в течение 24 ч, меняя ЦТ 2 O каждый час в течение первых 8 ч. После диализа переноса образца из диализной трубки в пробирку, замораживание образца при -80 ° С, а затем лиофилизации его.
Примечание: Полученный статистический сополимер-метакриламид / акриламида (РМА) сополимеры, содержащие боковые 4- O -β-D-галактопиранозил-D-gluconamide (lactobionamide) (со стадии 3.2) или D-gluconamide (со стадии 3.3), соответственно, получены. Для удобства обсуждения, эти два гликополимеров сокращенно PMA-LAEMA и PMA-GAEMA, соответственно.
4. После модификации гликополимеров флуорофорами
- Растворить 5,0 мг glycopolymer PMA-LAEMA или PMA-GAEMA содержащей ~ 0,9 мкмоль первичный амин функциональные группы в 0,9 мл забуференного фосфатом физиологического раствора (PBS, 0,1 М фосфата натрия, 0,15 М NaCl, рН 7,5), соответственно.
- Медленно добавляют 0,6 мг карбоксифлуоресцеин сукцинимидил эфира в 100 мкл ДМФ в растворах с быстрым перемешиванием. Осторожно перемешать реакции в течение 16 ч в темноте при комнатной температуре.
- В то время как в защищенном от света, загрузить образец в подготовленную диализной трубки (MWCO = 3500) и диализ против дН 2 O (2 л) в течение 16 ч, меняя раствор для диализа каждый час в течение первых 8 ч. После диализа переноса образца из диализной трубки в пробирку, замораживание образца при -80 ° С, а затем лиофилизации его.
Примечание: После лиофилизации, флуоресцентные гликополимеров РМА-LAEMA-флуоресцеин и РМА-GAEMA-флуоресцеин, соответственно, получаются.
5. Характеристика Glyсополимеры
- Определить количество средняя молекулярная масса (Мn), средневесовая молекулярная масса (M w) и дисперсность (M W / M п) гликополимеров на коммерческой системы ВЭЖХ, снабженной гель-проникающей хроматографии (ГПХ программного обеспечения), GPC Колонка подходит для молекулярного веса интерес, и детектором показателя преломления, с использованием 0,1 М Трис / 0,1 М хлорид натрия буфера (рН 7) в качестве элюента при скорости потока 0,6 мл / мин 14. Используйте стандарты полиэтиленгликоля как стандарты молекулярной массы (MW: 200-1,200,000 г / моль).
- Количественно фактических концентраций первичных аминов функциональных групп в гликополимеров 16. Анализ Общее содержание углеводов синтезированных гликополимеров в соответствии с опубликованным методом 17.
- Выполните тесты структурного состава и чистоты LAEMA glycomonomers, GAEMA и гликополимеров PMA-LAEMA, PMA-GAEMA в D 2 O ЯМР-спектроскопии 14,
6. Связывание тесты синтетической гликополимеров с лектина покрытием агарозном бисером
- Добавить 1,5 мл PBS 50 мкл суспензии эритрина петушиный гребень лектин (ECL) -покрытие агарозном бисером, центрифуги при 300 мкг в течение 1 мин, и тщательно удалить и утилизировать супернатанта. Повторите этот шаг дважды, а затем ресуспендируют бусины в 0,5 мл PBS.
- Добавить 3 мкг PMA-LAEMA-флуоресцеина или PMA-GAEMA-флуоресцеина (отрицательный контроль) в 6 мкл PBS к суспензии бисером и инкубировать смеси, в темноте, при комнатной температуре в течение 1 часа.
- Промыть смеси с 1,5 мл PBS три раза, и ресуспендируют бусины в 0,2 мл PBS. Загрузите аликвоту (4 мкл) в хорошо на иммунофлюоресценции микроскопа, (с тефлоновым покрытием), накрыть покровным, и наблюдать с помощью флуоресцентной микроскопии с использованием FITC фильтр (длина волны возбуждения: 467-498 нм, длина волны излучения: 513- 566 нм) и цель 10X изучить связывание тон люминесцентные гликополимеров с бисером 14.
Результаты
Синтез glycomonomer
Лактобионовая кислоты используется здесь в качестве примера для получения glycomonomers. Используя методы в первоначальном отчете о синтезе LAEMA 11, наблюдались разнообразные выходы в подготовке с неудовлетворительной чистоты. Модифицированный метод очистки с помощью катионов и анионов смол обмена для удаления непрореагировавшего исходного материала предложил стабильный урожай продукта и высокой чистоты, что подтверждается 1 H и 13 C-ЯМР-спектроскопии (рис 1).
РАФТ синтез glycopolymer и пост-модификация гликополимеров флуорофорами
В отличие от блок-гликополимеров приготовленных путем ступенчатых плота полимеризации, этот протокол один шаг сополимеризации обеспечивает равномерное распределение по всей glycomonomer основной полимерной цепи. В гликополимеров, показанные здесь, содержат 20% мол глycomonomer, 77% мол HEAA в качестве прокладки, и 3% мол AEMA в качестве мишени для почтовых модификаций (см рисунок 2). 1 H- и 13 С-ЯМР-спектроскопии подтвердили структуры PMA-LAEMA и PMA-GAEMA (3 и 4). Как показано на рисунке 5, когда заговор против ГПХ элюирования профилей glycopolymer синтезированного без плот, и ПМА-LAEMA и РМА-GAEMA имеют низкие дисперсности, доказывая эффективность подхода плот. Как и ожидалось, PMA-GAEMA имеет М Н меньше, чем PMA-LAEMA из-за отсутствия PMA-GAEMA в кулон сахара. Анализ углеводов и первичный амин функциональные группы содержание плота гликополимеров показал, что соотношение мономеров в гликополимеров продукта соответствует стехиометрическому соотношению исходных мономеров, используемых в реакции полимеризации, плот опосредованной (Таблица 1). Это означает жесткий контроль мономера Compositioнс в синтезированных гликополимеров, как задумано.
Реакция первичного амина функциональных групп с активированными флуорофоров является широко используемым методом в мечения белков. Этот метод был использован здесь для обозначения очищенные гликополимеров с карбоксифлуоресцеина. После пост-модификацию, были получены флуоресцентные полимеры (Рисунок 6). Нет деградация меченных флуоресцеином полимеров в реакции не было обнаружено с помощью анализа ГПХ (данные не показаны).
Связывание испытания синтетических гликополимеров с лектин-покрытием агарозном бисером
Для оценки лектина специфичность связывания синтезированных гликополимеров, был использован лектин покрытием агарозные гранулы с известными углеводами специфичности связывания. Эритрина петушиный гребень лектина (ECL), использовали в экспериментах, имеет связывающую специфичность в отношении β-D-галактозида. 7А ясно показывает, что PMA-LAEMA-ФЗuorescein, который содержит β-D-галактозид как кулон углеводов, выставлены сильной связи с лектина ECL. В противоположность этому, отрицательное связывание с ECL на glycopolymer PMA-GAEMA-флуоресцеин, которое не обладает кулон сахар, показано на фиг.7В. Этот результат иллюстрирует эффективность связывания и аффинность синтезированного флуоресцентного glycopolymer.
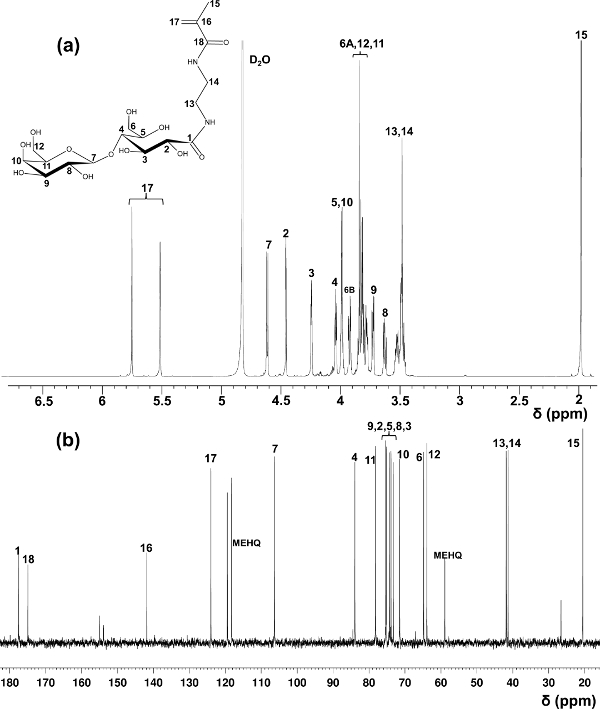
Рисунок 1. Назначается 1 Н- () и 13 С-ЯМР (б) спектры (D 2 O) для LAEMA. (Эта цифра была изменена с Ван и др. 14) Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этого фигура.
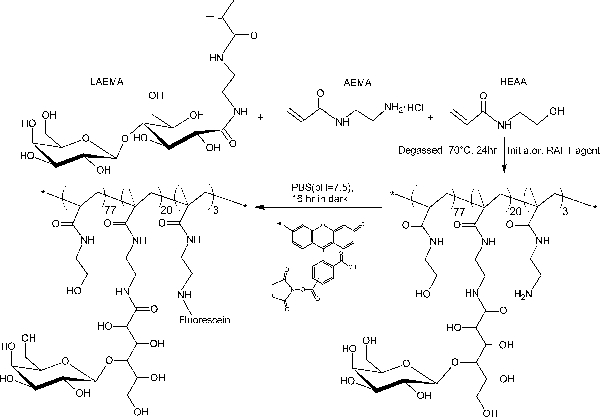
Рисунок 2. Схематическое изображение синтезе люминесцентные glycopolymer PMA-LAEMA, содержащей β-галактозид как кулон сахара. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
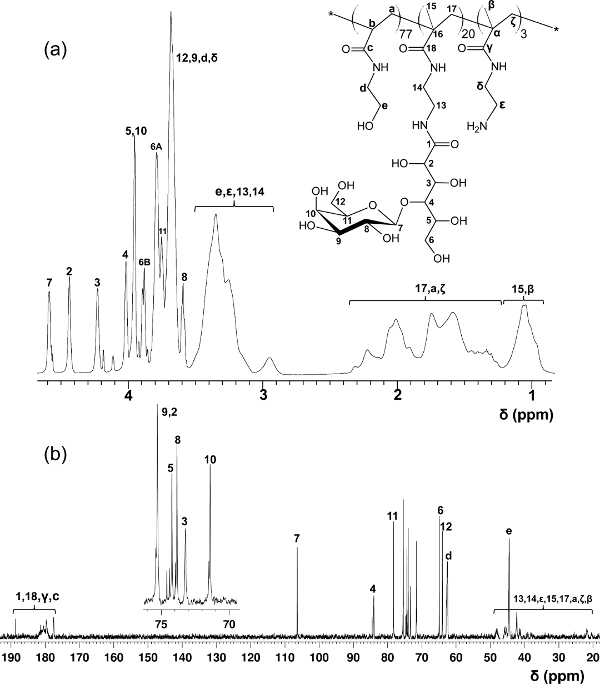
Рисунок 3. Назначенный 1Н (а) и 13 С-ЯМР (B) спектры (D 2 O) в течение РМА-LAEMA glycopolymer. (Эта цифра была изменена с Wang и др. 14) PleaSE нажмите здесь, чтобы посмотреть большую версию этой фигуры.
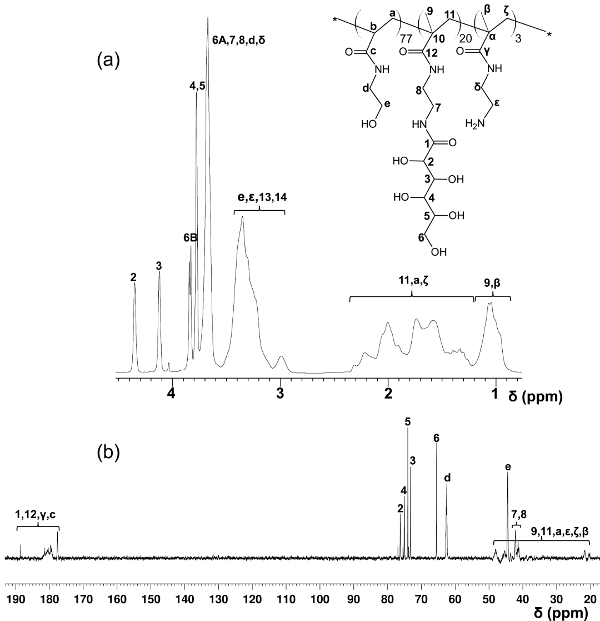
Рисунок 4. Назначенный 1 Н- () и 13 С-ЯМР (Б) спектры (D 2 O) для PMA-GAEMA. (Эта цифра была изменена с Ван и др. 14) Пожалуйста, нажмите здесь, чтобы посмотреть большую версию из этой фигуры.
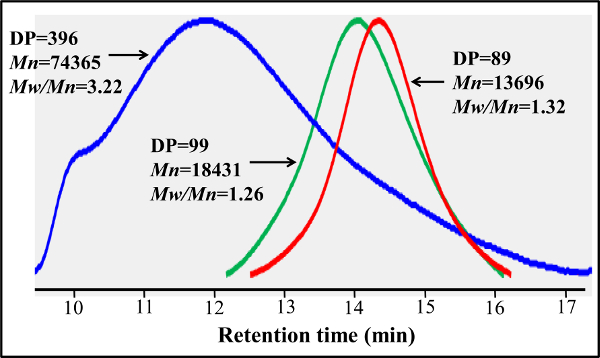
Рисунок 5. гель-проникающей хроматографии следы плот основе PMA-GAEMA и PMA-LAEMA приготовлены с использованием и без RAFT агента. В отличие от PMA-LAEMA, полученным без RAFT агента (синий), RAFT- на основе ПМА-LAEMA (зеленый) имеет гораздо более низкую дисперсность (М ж / М п). РАФТ основе ПМА-GAEMA (красный) и РМА-LAEMA имеют схожие профили GPC, но первый имеет меньшую М Н из-за отсутствия каких-либо подвесные сахара. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 6. РМА-LAEMA до и после пост-модификации с флуорофором. (А) по сравнению с белым немеченого glycopolymer (слева) трубки, меченных флуоресцеином РМА-LAEMA показывает сильный желтый оттенок (справа) трубки. (В) под действием УФ, не помечены РМА-LAEMA (слева трубки, 1 мг / мл в PBS) является темным и представляет без каких-либо флуоресценции, тогда как флуоресцентную метку PMA-LAEMA (справа трубки, 1 мг / мл в PBS) показывает сильный зеленая флуоресценция.: //www.jove.com/files/ftp_upload/52922/52922fig4large.jpg "Цель =" _ пустое "> Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
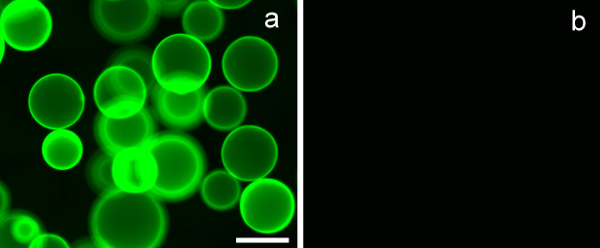
Рисунок 7. эритрина петушиный гребень лектин (ECL) -покрытие агарозные гранулы связывают β-D-галактозид содержащий гликополимеров, а не тех, кто не обладая кулон сахар. () PMA-LAEMA-флуоресцеина (3 мкг) показали сильное связывание с ECL , тогда как в (B) PMA-GAEMA-флуоресцеина, который не обладает подвесные β-D-галактозид остатка, не показали связывания с лектина покрытием бисера. Масштаб бар = 100 мкм.
Таблица 1. Значения таргетинга синтетических параметров и фактических составов гликополимеров.) Ориентация значения, ценности, которыежелательно из продуктов; б) ДП, степень полимеризации; в) Н.А., не имеется. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| ДП б | Дисперсность | Фактическое содержание glycomonomers мол% | Фактическое содержание первичного амина мол% | |
| Ориентация значения | 100 | <1.3 | 20 | 3 |
| PMA-LAEMA | 99 | 1.26 | 19 | 3.2 |
| PMA-GAEMA | 89 | 1.32 | Н. С | 2.7 |
Обсуждение
Легкий и эффективный протокол для плот основе три- компонент люминесцентных гликополимеров, с и без подвесного углеводов, и их использование в тесте лектин-связывания, будет показано в этом докладе. Протокол начинается с подготовки glycomonomers LAEMA и GAEMA. Через одностадийном плот контролируется сополимеризации, гликополимеров с воспроизводимым выходом, предсказуемой состава мономера и низкой дисперсности, получаются. После пост-модификации гликополимеров карбоксифлуоресцеин сукцинимидил эфира, связывание полученной соответствующего флуоресцентного меченных glycopolymer легко проверяемым своей лектина специфичность связывания.
На начальных препаративных ступеньках glycomonomers, которые должны быть использованы в последующих синтезах glycopolymer, легко доступны лактобионовая кислота и глюконолактон были использованы. В теории, любые углеводы, представляющие интерес, из моносахаридов до сложных олигосахаридов, может быть Converted чтобы glycomonomers путем конъюгирования целевой сахара на первичной гидроксильной группы на С6 глюкозы. После окисления восстановительного остатка глюкозы, и ее последующей дегидратацией до лактона, продукт может затем быть легко взаимодействует с первичным амином в AEMA с образованием соответствующего glycomonomer. Дальнейшие примеры этому маршруту можно увидеть в недавнем докладе 14. Следует отметить, что до начала любой стадии полимеризации, МеГХ, мощным ингибитором полимеризации, должен быть удален из всех мономерных и glycomonomer препаратов непосредственно перед использованием. Это легко достигается с помощью минимального количества метанола, чтобы растворить glycomonomer который обладает МеГХ затем сразу обработать его с ацетоном при температуре -20 ° С для осаждения ингибитора свободных продукт с высоким выходом.
Эфирное в какой-либо радикальной полимеризации схеме, внимание к деталям и чистоты мономера подчеркнул. Как это типично системы РАФТ полимеризации, состоит израдикальная источник, РАФТ реагент, мономер и растворитель. В этом визуализируется представления, система РАФТ полимеризации одного шага описано, что основное внимание на производство статистических сополимеров, полученных из реакционной смеси, обладающей три различных мономеров в водном растворе. Два отдельных плот опосредованной реакции представлены в которой один использует glycomonomer, обладающий кулон, невосстанавливающих углеводов конце (т.е. β-D-галактозы), а другой, обладающий полиола не связанного углеводного остатка. Общим для обоих плота-опосредованной реакции мономеры, имеющие особую гидроксильную группу, которая служит в качестве спейсера молекулу, а другой, обладающий свободного амина для пост-модификации с флуорофором амино-реактивного.
Так присутствии кислорода в реакционной смеси и наносит ущерб окружающей среде сплавляться-опосредованной полимеризации, его удаление проследить уровни легко осуществляется с помощью нескольких сублимационной Evaциклов cuate-оттаивания при сохранении реакционную трубку Шленка сосуд под высоким вакуумом.
Следует отметить, что молярное соотношение различных мономеров в реакции можно регулировать, как это необходимо. Кроме того, путем изменения количества плота агента, длина получаемых полимеров можно контролировать 18. Тем не менее, молярное отношение плота агента инициатора всегда должно быть больше, чем два, чтобы обеспечить низкую дисперсность продукта. В этих условиях, эволюция сополимеризации устойчива и воспроизводимость реакции очень высока. Это, как говорится, маловероятно, что один получает совершенно равномерное распределение всех участвующих мономеров в пределах статистической сополимера, из-за их разной скоростью полимеризации. Характеризующие распределение различных мономеров в полимерной еще очень сложным.
Метод пост-модификация, представленная здесь, и проще, и amenablе с использованием более широкого выбора флуоресцентных меток, по сравнению с другими протоколами, применяемых к этикетке гликополимеров 2,11. Они будут включать в себя многие из водорастворимых аминов-реактивного флуорофорами, квантовые точки, биотинами и другие. Связывания особенности синтезированных меченых, гликополимеров легко проверяемые с помощью лектинов с известными аффинности связывания. PMA-GAEMA, владевших не кулон сахар является подходящим отрицательный контроль. Гликополимеров с различными флуоресцентными метками, подготовленных по этому маршруту были успешно использованы в исследованиях лектин-опосредованного связывания бактериального 14. Как представлено, это легким и эффективным подготовка статистических флуоресцентных гликополимеров должен обеспечивать большой потенциал для широкого круга исследований glycobiological.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work was supported by the Experiment Station Chemical Laboratories of the University of Missouri, and by the Cystic Fibrosis Association of Missouri.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Lactobionic acid | Sigma-Aldrich | 153516 | |
| D-Gluconolactone | Sigma-Aldrich | G2164 | |
| N-(2-hydroxyethyl) acrylamide (HEAA) | Sigma-Aldrich | 697931 | |
| Orange II sodium salt | Sigma-Aldrich | O8126 | |
| Hydroquinone monomethyl ether (MEHQ) | Sigma-Aldrich | 54050 | Polymerization inhibitor |
| N-(2-aminoethyl) methacrylamide hydrochloride (AEMA) | Polysciences, Inc | 24833-5 | |
| Triethylamine | Fisher Scientific | BP-616 | |
| Anion-exchange resin IRN-78 hydroxide-form, 80 mesh | Sigma-Aldrich | 10343-U | |
| Cation-exchange resin 50Wx8, 200 mesh | Sigma-Aldrich | 217514 | |
| Aluminum oxide, ~150 mesh | Sigma-Aldrich | A1522 | Type WN-6, Neutral, Activity Grade Super I |
| Ninhydrin | Sigma-Aldrich | N4876 | An ethanol solution of 0.2% ninhydrin was used in the test |
| 4-Cyano-4-(phenylcarbonothioylthio)pentanoic acid | Sigma-Aldrich | 722995 | RAFT agent |
| 4,4′-Azobis(4-cyanovaleric acid) | Sigma-Aldrich | 11588 | Polymerization initiator |
| Carboxyfluorescein succinimidyl ester | Life Technologies | C1157 | |
| Erythrina Cristagalli lectin coated agarose bead | Vector Laboratories | AL-1143 | |
| Solvent | |||
| dH2O | Produced by Barnstead water purification system, 18 megOhm-cm | ||
| Isopropanol | Fisher Scientific | A461-4 | ACS grade or better |
| Methanol | Fisher Scientific | A454-4 | ACS grade or better |
| Absolute ethanol | Fisher Scientific | BP2818-100 | ACS grade or better |
| Dimethylformamide | Sigma-Aldrich | 22705 | ACS grade or better |
| Acetone | Fisher Scientific | A929-4 | ACS grade or better |
| Equipment | |||
| Dialysis membrane (MWCO: 3,500) | Spectrum Labs | 132720 | |
| Polyethylene glycol analytical standard standard | Sigma-Aldrich | O2393 | |
| Schlenk tube, 1 ml | Quark Glass | Customized | |
| TSK-GEL G4000 PWxl | Tosoh Bioscience | 8022 | Used for GPC analysis of the glycopolymers |
| Empower 3 with GPC/SEC package | Waters Corporation | ||
| Waters Alliance HPLC system | Waters Corporation | Equipped with refractive index detector (Waters 2414) and fluorescence detector (Waters 2475) | |
| Avance III 800 MHz NMR Spectrometer | Bruker Corporation | ||
| BX43 fluorescence microscope | Olympus Corporation | Used with FITC filter in the glycopolymer binding test | |
| Rotavap / Rotoevaporator | Heidolph | ||
| Fritted disc funnel | Fisher Scientific | 10-310-109 | |
| Lyophilizer | Labconco | ||
| Immunofluorescence microscope slide | Polysciences | 18357-1 | |
| Revco Ultima Plus -80 °C Freezer | Thermo Scientific | ||
| Plastic Vacuum Bag and Hand Pump | Ziploc | ||
| Vacuum Pump, Direct Drive, Maxima C Plus | Fisher Scientific | ||
| Vacuum Gauge | Sargent-Welch | ||
Ссылки
- Scharfman, A., et al. Pseudomonas aeruginosa binds to neoglycoconjugates bearing mucin carbohydrate determinants and predominantly to sialyl-Lewis x conjugates. Glycobiology. 9 (8), 757-764 (1999).
- Song, E. H., et al. In vivo targeting of alveolar macrophages via RAFT-based glycopolymers. Biomaterials. 33 (28), 6889-6897 (2012).
- Wolfenden, M. L., Cloninger, M. J., Wang, B., Boons, G. .. -. J. Chapter 14. Multivalency in carbohydrate binding. Carbohydrate Recognition: Biological Problems, Methods, and Applications. , 349-370 (2011).
- Moad, G., Rizzardo, E., Thang, S. H. Radical addition-fragmentation chemistry in polymer synthesis. Polymer. 49 (5), 1079-1131 (2007).
- Spain, S. G., Gibson, M. I., Cameron, N. R. Recent advances in the synthesis of well-defined glycopolymers. J. Polym. Sci., Part A: Polym. Chem. 45 (11), 2059-2072 (2007).
- Bernard, J., Hao, X., Davis, T. P., Barner-Kowollik, C., Stenzel, M. H. Synthesis of various glycopolymer architectures via RAFT polymerization: From block copolymers to stars. Biomacromolecules. 7 (1), 232-238 (2006).
- Bulmus, V. RAFT polymerization mediated bioconjugation strategies. Polym. Chem. 2, 1463-1472 (2011).
- Ting, S. R. S., Chen, G., Stenzel, M. H. Synthesis of glycopolymers and their multivalent recognitions with lectins. Polymer Chemistry. 1, 1392-1412 (2010).
- Vazquez-Dorbatt, V., Lee, J., Lin, E. W., Maynard, H. D. Synthesis of glycopolymers by controlled radical polymerization techniques and their applications. Chembiochem. 13, 2478-2487 (2012).
- Jiang, X., Ahmed, M., Deng, Z., Narain, R. Biotinylated glyco-functionalized quantum dots: Synthesis, characterization, and cytotoxicity studies. Bioconjugate Chem. 20 (5), 994-1001 (2009).
- Deng, Z., Li, S., Jiang, X., Narain, R. Well-defined galactose-containing multi-functional copolymers and glyconanoparticles for biomolecular recognition processes. Macromolecules. 42 (17), 6393-6405 (2009).
- Qin, Z., et al. Galactosylated N-2-hydroxypropyl methacrylamide-b-N-3-guanidinopropyl methacrylamide block copolymers as hepatocyte-targeting gene carriers. Bioconjugate Chem. 22 (8), 1503-1512 (2011).
- Albertin, L., Wolnik, A., Ghadban, A., Dubreuil, F. Aqueous RAFT polymerization of N-acryloylmorpholine, synthesis of an ABA triblock glycopolymer and study of its self-association behavior. Macromol. Chem. Phys. 213 (17), 1768-1782 (2012).
- Wang, W., Chance, D. L., Mossine, V. V., Mawhinney, T. P. RAFT-based tri-component fluorescent glycopolymers: synthesis, characterization and application in lectin-mediated bacterial binding study. Glycoconj. J. 31 (2), 133-143 (2014).
- Deng, Z., Ahmed, M., Narain, R. Novel well-defined glycopolymers synthesized via the reversible addition fragmentation chain transfer process in aqueous media. J. Polymer Sci. Part A: Polym. Chem. 47 (2), 614-627 (2009).
- Noel, S., Liberelle, B., Robitaille, L., De Crescenzo, G. Quantification of primary amine groups available for subsequent biofunctionalization of polymer surfaces. Bioconjugate Chem. 22 (8), 1690-1699 (2011).
- Fox, A., Morgan, S. L., Gilbart, J., Biermann, C. J., McGinnis, G. D. Preparation of alditol acetates and their analysis by gas chromatography (GC) and mass spectrometry (MS). Analysis of Carbohydrates by GLC and MS. , 87-170 (1989).
- Thomas, D. B., et al. Kinetics and molecular weight control of the polymerization of acrylamide via RAFT. Macromolecules. 37 (24), 8941-8950 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены