Method Article
Estabelecimento de um Defeito Modelo segmentar Femoral Critical-size em Ratos estabilizada por osteossíntese Placa
Neste Artigo
Resumo
Although mouse models are invaluable tools for bone tissue engineering, models of long bone defects are sparse. This need motivated development of the present protocol which uses a locking plate with four screws and a dedicated jig to perform and stabilize a reproducible, femoral, critical-size defect with low morbidity.
Resumo
The use of tissue-engineered bone constructs is an appealing strategy to overcome drawbacks of autografts for the treatment of massive bone defects. As a model organism, the mouse has already been widely used in bone-related research. Large diaphyseal bone defect models in mice, however, are sparse and often use bone fixation which fills the bone marrow cavity and does not provide optimal mechanical stability. The objectives of the current study were to develop a critical-size, segmental, femoral defect in nude mice. A 3.5-mm mid-diaphyseal femoral ostectomy (approximately 25% of the femur length) was performed using a dedicated jig, and was stabilized with an anterior located locking plate and 4 locking screws. The bone defect was subsequently either left empty or filled with a bone substitute (syngenic bone graft or coralline scaffold). Bone healing was monitored noninvasively using radiography and in vivo micro-computed-tomography and was subsequently assessed by ex vivo micro-computed-tomography and undecalcified histology after animal sacrifice, 10 weeks postoperatively. The recovery of all mice was excellent, a full-weight-bearing was observed within one day following the surgical procedure. Furthermore, stable bone fixation and consistent fixation of the implanted materials were achieved in all animals tested throughout the study. When the bone defects were left empty, non-union was consistently obtained. In contrast, when the bone defects were filled with syngenic bone grafts, bone union was always observed. When the bone defects were filled with coralline scaffolds, newly-formed bone was observed in the interface between bone resection edges and the scaffold, as well as within a short distance within the scaffold.
The present model describes a reproducible critical-size femoral defect stabilized by plate osteosynthesis with low morbidity in mice. The new load-bearing segmental bone defect model could be useful for studying the underlying mechanisms in bone regeneration pertinent to orthopaedic applications.
Introdução
defeitos ósseos da diáfise maciças são um grande desafio para o cirurgião ortopédico. substituição óssea com enxerto ósseo autólogo, actualmente considerado como o tratamento padrão-ouro, é em quantidade limitada e está associada com morbidade relacionada à colheita. Por estas razões, as construções de engenharia de tecidos ósseos combinando medula óssea as células estaminais mesenquimais com andaimes osteocondutoras têm sido explorados como uma alternativa para os auto-enxertos em cirurgia ortopédica.
Até à data, a maioria dos estudos foram realizados em modelos animais clinicamente relevantes, tais como cães, porcos e ovelhas 1-3, mas a avaliação preliminar destas construções em segmentadas, defeitos ortotópicos ósseos de tamanho crítico em modelos de pequenos animais (como ratinhos) pode ter diversas vantagens: (i) as despesas baixas, (ii) um grande número de animais pode ser operado; (III), em contraste com modelos animais de grande porte, a homogeneidade das estirpes de ratinho limita variações individuais na reabsorção um andaimend formação óssea e; (Iv) o mais importante, a disponibilidade de anticorpos específicos e animais de gene alvo possibilitar a avaliação do processo biológico envolvido na cicatrização óssea. Por último, mas não menos importante, o uso de estirpes de ratos imunodeficientes de também permite estudos utilizando quer enxertos ou células de origem humana, sem respostas imunes adversas em ratinhos.
Apesar das vantagens acima mencionadas, enormes modelos defeito ósseo da diáfise em camundongos são escassos. A maioria de tais modelos utilizam fixação do osso com uma cavilha intramedular que preenche a cavidade da medula óssea (que limita o volume de material a ser testado) e também impede reprodutibilidade, não fornecendo estabilidade rotacional e axial 2,4-7.
Os objectivos do estudo são (i) imitando uma situação óssea clínica não-união, para descrever uma, de tamanho crítico reprodutível, segmentar, modelo de defeito femoral em ratos, que é estabilizado por osteosynth bloqueio de placa preciso e reprodutívelESIS que fornece um ambiente biomecânico altamente estável 8-10; (Ii) para ilustrar o presente modelo com dois potenciais substitutos de osso e para descrever analisa a formação do osso que podem ser utilizados.
Protocolo
Declaração de Ética: Os ratos utilizados neste estudo foram tratados em conformidade com as orientações publicadas pela Comissão Europeia para "Cuidado e Uso de Animais de Laboratório" (Directiva 2010/63 / UE e da Convenção Europeia ETS 123). O protocolo experimental foi aprovado pelo Comitê de Ética da Faculdade de Medicina Lariboisière Saint-Louis (CEEA LV / 2010-01-04).
1. Os animais
- Use ratinhos atímicos (10 semanas de idade). Usar um número mínimo de 6 ratinhos com defeito deixados vazios como grupo de controlo negativo.
2. Preparação Scaffolds
- Singênicos Graft Preparação
- Use isoenxerto osso para encher o defeito para fornecer grupo de controlo com um número mínimo de 6 animais.
- Obter isoenxertos osso por colheita retirado do osso femoral de rato, pertencente à "defeitos deixados em branco ou" defeitos preenchidos com coral de andaime "grupos (thé evita o uso de animais extra para recolher isoenxerto osso) 11.
- Lave o osso ressecado com tampão fosfato (PBS) e mantê-lo estéril usando compressa de gaze úmida.
- Coral andaime Preparação
- Use andaime que são feitos de coral natural: Acropora sp. cubos exoesqueleto de coral, 3 x 3 x 3 mm, como potencial substituto de osso com um mínimo de 6 animais.
- Esculpir à mão cada cubo de coral com a forma do cilindro (3.5 altura; 2 mm de diâmetro).
- Esterilizar cada andaime em autoclave (121 ° C durante 20 min), lavá-lo com PBS estéril, e imerso que em meio de cultura completo (α-MEM) durante 24 horas antes da implantação em ratos.
3. procedimentos anestésicos e Analgesia
- Proporcionar analgesia preventiva, 15 minutos antes da anestesia, por injecção subcutânea de buprenorfina (0,1 mg / kg de peso corporal do animal).
- Aplicar pomada no animalolhos para evitar a secura a cada 30 min, enquanto os animais estão sob anestesia.
- Coloque os ratos em uma almofada de aquecimento para evitar a hipotermia.
- Anestesia e Analgesia durante o procedimento cirúrgico
- Injectar por via intraperitoneal uma solução contendo xilazina (8 mg / kg) e cetamina (100 mg / kg).
- Fornecer oxigénio através de fluxo por (50 ml / min).
- Confirmar profundidade de anestesia adequada pela presença de bom relaxamento muscular e da falta de resposta dos animais a um estímulo nocivo (por ex., Pitada toe firme).
- Injectar por via subcutânea uma dose única de enrofloxacina (0,05 mg / kg) como profilaxia microbianas.
- Analgesia pós-operatória
- Proporcionar analgesia pós-operatória, por injecção subcutânea de buprenorfina (0,1 mg / kg) a cada 12 horas, durante 3 dias consecutivos.
- Anestesia durante procedimentos de diagnóstico de imagem
- Colocar os ratinhos num anesthetizing-quadro, e, em seguida, induzir e manter a anestesia utilizando cerca de 4% e 2% de isoflurano em oxigénio, respectivamente.
- Confirmar profundidade adequada da anestesia pelo bom relaxamento muscular animal e à falta de movimento.
- Condições de recuperação
- Mantenha os ratos na almofada de aquecimento até a recuperação completa
- Não deixe um animal sem supervisão até que tenha recuperado a consciência suficiente para manter decúbito esternal após a cirurgia.
- Não devolva um animal que foi submetido a uma cirurgia para a companhia de outros animais até que esteja totalmente recuperado.
- Condições pós-operatórias
- Hospedar os ratos separadamente durante os primeiros 3 dias sediar os ratos por quatro em gaiolas após dia 3.
- Fornecer água e adaptado ad libitum alimentos. Permitir que os ratos de peso-urso, sem qualquer restrição de atividades durante todo o período pós-operatório.
4. Procedimento cirúrgico:Femoral segmentar Defeito Modelo 11,12
- Após a anestesia, coloque cada rato em decúbito ventral com o membro posterior esquerdo em extensão.
- Esfregar o membro para cirurgia asséptica utilizando 10% de iodo de povidona, durante 5 min e, em seguida, colocar uma cortina estéril sob o membro para criar uma superfície estéril (uma cortina transparente estéril é utilizado, a fim de ser capaz de controlar o movimento respiratório durante o processo). É tomado cuidado para manter a esterilidade do campo cirúrgico, durante o procedimento.
- Faça a 15 - 17-mm incisão cutânea longitudinal sobre o aspecto ântero-lateral do fêmur, que se estende desde a articulação do quadril com a articulação do joelho.
- Faça uma incisão na fáscia lata, dividir o músculo vasto lateral e o músculo bíceps femoral para expor toda a extensão da diáfise femoral. O cuidado deve ser tomado para preservar o nervo ciático caudal e da cápsula articular no sentido distal (Figura 1).
- Para melhorar a expo diáfise femoralcerteza, transecto do músculo glúteo e bíceps femoral da 3ª trocânter.
- Executar uma dissecção circular do fémur no meio da diáfise.
- Aplicar uma placa de titânio micro-bloqueamento 6-furo (10 mm de comprimento; 1,5 mm de largura, em peso: 30 mg) no lado femoral anterior.
NOTA: Os orifícios da placa, que são conicamente rebaixadas com uma porção cilíndrica, acomodar titânio auto-roscantes de bloqueio (2 mm de comprimento, diâmetro externo 0,47 milímetros, peso: 5 mg, com superfície inferior do parafuso de cabeça roscada para permitir bloqueio dentro o orifício da placa) que está ligado a uma haste, a qual torce fora quando bloqueado. - Faça o furo mais proximal da placa usando uma broca de 0,3 mm e quer a potência do motor dedicado ou potência do motor não dedicado operado a 2500 rpm a aproximadamente 500 mW 12).
- Insira o primeiro parafuso usando uma chave de fenda dedicado e, em seguida, bloqueá-lo (Figura 2).
NOTA: Uma vez que o alinhamento de tele placa é determinado pela aplicação deste primeiro parafuso, que é importante para posicionar a placa paralela ao fémur durante a inserção do parafuso. - Perfurar o furo mais distal da placa de uma forma semelhante, inserir e bloquear o parafuso (Figura 3).
- Inserir, mas não fazer nenhum bloqueio, os outros dois parafusos exteriores.
- Coloque o fio do 0,22 milímetros Gigli viu de perto ao redor do osso em uma orientação medio-lateral e, em seguida, inseri-lo nas ranhuras do gabarito (Figura 4).
- Inserir o gabarito dedicado na haste dos dois últimos parafusos e aplicá-la por cima da placa (Figura 5).
- Realizar uma osteotomia femoral de 3,5 mm de comprimento mid-diáfise usando o Gigli viu sob irrigação (usando solução isotónica salina estéril) para evitar a necrose térmica. Já o assistente do cirurgião tomar o gabarito. Têm o cirurgião aplica uma tensão constante constante. Tenha cuidado para não enroscar o fio de serra e usar as médias de dois terços do fio. Evite excesso movimento, a fim de obter um corte do osso linear (Figura 6).
- Após a ostectomy, remova o Gigli viu. Para evitar o dano do tecido mole, cortar o fio de serra perto do osso de um lado.
- Remover o gabarito e bloquear os dois últimos parafusos (Figura 7).
- Ou deixar o defeito segmentar vazio ou cirurgicamente preenchê-lo, colocando materiais a serem testados no interior do defeito.
- Copiosamente lavar o campo cirúrgico com solução salina isotônica estéril.
- Coloque o músculo vasto lateral vagamente sobre a placa. Feche a fáscia e planos subcutâneos usando um padrão de sutura contínua simples e 5.0 glycomer 631 de sutura; fechar a pele com um padrão de sutura simples interrompido usando 4.0 glycomer 631 de sutura. Alternativamente, é também possível fechar a pele usando cola de pele.
5. In Vivo Avaliação da regeneração óssea
- Com os ratos sob anestesia, execute radiográficaavaliações de uma maneira longitudinal usando ambos os raios-X convencionais (26 kV, 10 seg; 2X ampliação; 20 linhas / mm resolução espacial) e alta resolução tomografia computadorizada-micro (μCT).
- Para a análise μCT, aquisição de imagens com uma resolução de 36 uM (50 kV e 478 mA, a 40 o tempo de exposição ms, utilizando um filtro de 0,5 milímetros de alumínio, o passo de rotação de 0,7 °, e a rotação tomográfico de 180 °). Analisar as imagens usando o software residente.
6. ex vivo Avaliação da regeneração óssea
- Dez semanas após a cirurgia, utilizando induzir a anestesia de isoflurano em oxigénio, e depois sacrificar os ratinhos por injecção intraperitoneal de uma sobredose de barbitúrico (1 ml de pentobarbital).
- Extirpar os ossos do fêmur, remova sobrepondo tecido muscular, e fixar as peças ósseas em paraformaldeído a 4% (pH 7,4) durante quatro dias.
- Retirar a placa e parafusos de cada excisadas peça óssea após FIXA paraformaldeídoção.
- Ex Vivo u Análise CT
- Coloque cada osso excisadas e fixadas em tubos de polietileno preenchidos com álcool 75% e analisá-lo usando ex vivo μCT.
- Adquirir imagens a 80 kV e 100 mA (tempo de exposição de 1.000 ms, alumínio 0,5 filtro e 4 mm de tamanho do pixel da câmera (2.400 x 4.000 com um tamanho voxel de 7 mm), média de quatro quadros para cada incremento de rotação de 0,9 º.
- Reconstruir imagens em 3 dimensões (tamanho médio voxel de 13 mm) utilizando uma retro-projeção filtrada-Hamming com o software residente.
- Para a análise quantitativa da formação óssea, use software residente obter o volume de tecido mineralizado (limite inferior cinzenta de 45 índices em tons de cinza e limite superior cinzenta de 240 índices de tons de cinza) em uma região determinada e consistente de juros correspondentes ao defeito.
- Realizar análises da mesma maneira para cada rato com a mesma region de interesse.
- Use o teste one-way análise (intervalo de confiança - a 95% e nível de significância de p <0,05) para comparar a taxa de consolidação óssea e do volume de tecido mineralizado na região de interesse entre os grupos.
- Análise histológica
- Incorporar cada excisadas e fixadas osso femoral em resina de metacrilato de metila e processá-lo para histologia descalcificada.
- Corte cada espécime osso longitudinalmente em seção de espessura (200 mm) usando uma serra de diamante arrefecido a água circular.
- Moer cada seção amostra de osso até uma espessura de 100 um, ele polonês e manchá-la usando Stevenel manchas azuis e van Gieson picrofuchsin.
NOTA: Após a coloração, as células aparecem em azul, óssea em rosa e coral no marrom sob microscopia de luz.
Resultados
Os procedimentos cirúrgicos acima mencionados durou 45 a 60 min. Ostectomia e osteossíntese eram fáceis de realizar com a ajuda de um assistente de cirurgião, mas sem o uso de qualquer sistema de aumento. Não houve complicações intra-operatórias ocorreram. Em um estudo preliminar em 18 ratos 11, radiografias pós-operatórias forneceram evidências de que o comprimento do defeito ósseo (3,43 ± 0,12 mm) e o posicionamento da placa (distância entre a cavidade articular sufocar e a parte distal da placa = 2,65 ± 0,56 mm) foram reprodutíveis.
A taxa de mortalidade relacionada à anestesia foi de cerca de 5%.
A recuperação funcional do membro operado foi excelente em todos os animais e o suporte de peso total foi observada dentro de um dia após a cirurgia (animadas Figura 1). O peso do osteossíntese (placa e parafusos) utilizado no pestudo reenviado foi cerca de 0,1% do peso do corpo do rato. Não houve complicações pós-operatórias (por exemplo, infecção da ferida, falha do implante, migração enxerto ósseo, etc.) ocorridos. Sem auto-lesão ou lesões causadas por cagemates ocorreu.
Quando os defeitos ósseos induzidos cirurgicamente foram deixados vazios, sem formação óssea significativa foi observada com não-união óssea consistente. Em contraste, quando os defeitos foram preenchidos com um isoenxerto ou um andaime de coral, osso recentemente formado que se prolonga a partir do arestas proximal e distai do osso foi observada. Além disso, ao passo que a formação de osso permitido restabelecimento da continuidade do osso na maioria dos defeitos tratados com isoenxertos (Figura 8), foi observado apenas no interior do andaime de coral em defeitos cheios com este material. Na verdade, nenhum osso foi observada a uma distância maior do que 1 mm a partir das extremidades ósseas. Ausência de cartilagem em todos análises histológicas resultados comprovam oestabilidade da osteossíntese alcançado (Figura 9, Figura 10).
Radiografias e microCT análises forneceram evidências de que a consolidação óssea não ocorreu em nenhum dos animais do grupo defeito esquerdo vazio, 10 semanas após a implantação. O volume de tecido mineralizado avaliada por análises microCT foi de 0,8 ± 0,3 mm3 e foi representante do osso formado recentemente. Nos grupos de andaime isoenxerto e coral, união óssea foi obtida em 4 e 4 animais, respectivamente. O volume de tecido mineralizado avaliada por análises microCT foi de 4,4 ± 0,9 mm3 e 8,9 ± 0,7 mm3. Nesses grupos, no entanto, porque tanto o isoenxerto eo cadafalso coral continha minerais, formação de novo osso não poderia ser verdadeiramente distingue do material implantado restante (isoenxerto ou andaime coral). Tanto a taxa de união bon e o volume de tecido mineralizado obtido a partir do grupo e isoenxertoa partir do grupo andaime coral foram significativamente (p <0,001) mais elevada do que os obtidos a partir do grupo defeito esquerdo vazio.
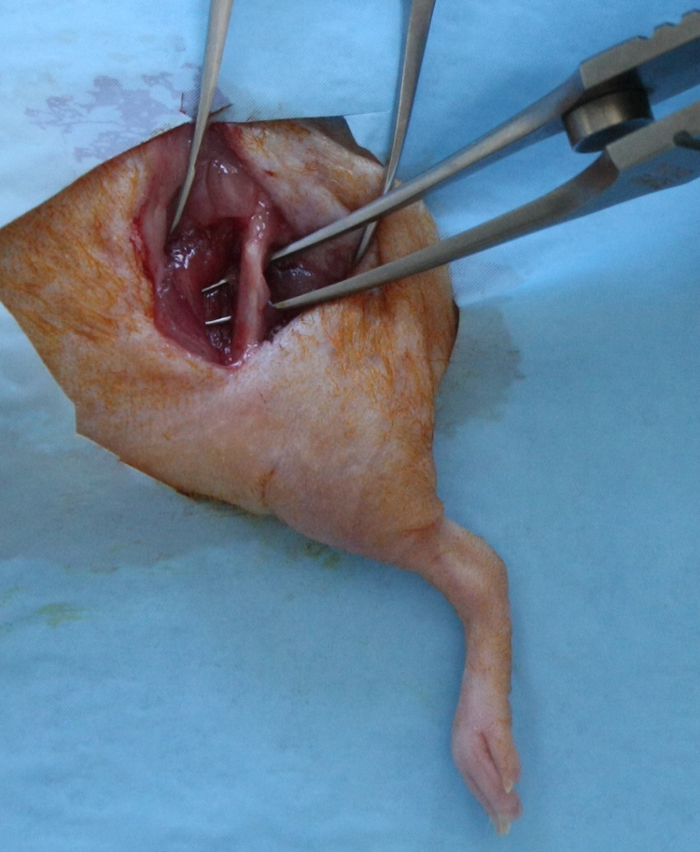
Figura 1:. A exposição cirúrgica para a Criação do Femoral segmentar Defeito A 15 - 17-mm incisão cutânea longitudinal, que se estende desde a articulação do quadril com a articulação do joelho, foi feita sobre o aspecto ântero-lateral do fêmur. A fáscia lata foi incisão; do músculo vasto lateral e o músculo bíceps femoral foram divididos para expor toda a extensão da diáfise femoral. Por favor clique aqui para ver uma versão maior desta figura.
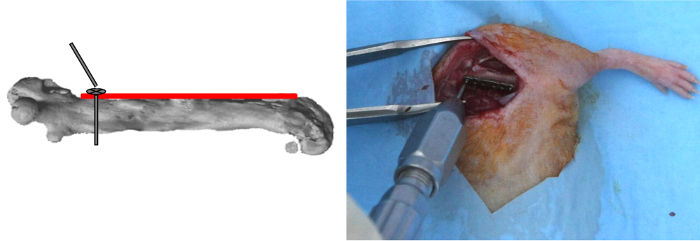
Figura 2: PlacaPosicionamento e proximal do parafuso de posicionamento. A placa foi aplicada no lado femoral anterior. O furo mais proximal da placa foi perfurado; o primeiro parafuso foi inserido e, em seguida, fechado. Por favor clique aqui para ver uma versão maior desta figura.
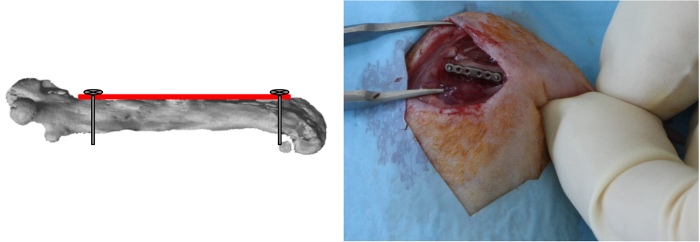
Figura 3:. Distal do parafuso de posicionamento O furo mais distal da placa foi perfurado e o parafuso foi inserido e bloqueado. (Reproduzido com permissão de Tissue Eng Parte C, 2013, 19 (4), 271-280) Por favor clique aqui para ver uma versão maior desta figura.
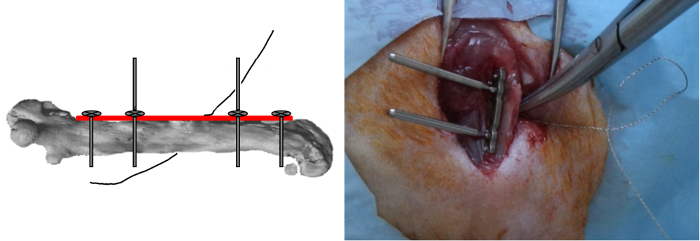
Figura 4: Gigli Saw Posicionamento. Foram inseridos os outros dois parafusos exteriores mas não trancadas e o fio das serras 0,22 mm Gigli foi intimamente ligada ao redor do osso em uma orientação medio-lateral. Por favor clique aqui para ver uma versão maior desta figura.
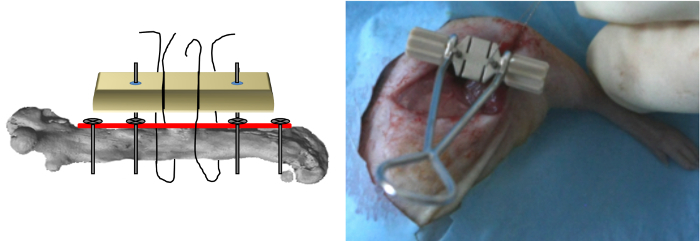
Figura 5: O gabarito de posicionamento O gabarito foi inserido na haste dos dois últimos parafusos e aplicado por cima da placa e o fio da serra foi então inserido nas ranhuras do gabarito.. (Reproduzido com permissão de Tissue Eng Parte C, 2013, 19 (4), 271-280) Por favor clique aqui para ver uma versão maior desta figura.

Figura 6:. Ostectomy ostectomia foi realizada ea serra Gigli foi retirada. (Reproduzido com permissão de Tissue Eng Parte C, 2013, 19 (4), 271-280) Por favor clique aqui para ver uma versão maior desta figura.
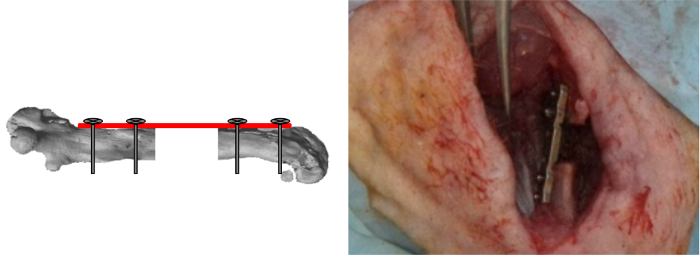
Figura 7:. Parafusos interiores Bloquear o gabarito foi removido e os últimos dois parafusos de bloqueio. Os defeitos segmentais foram então ou esquerdo vazio ou preenchido com os materiais testados. (Reproduzido com permissão de Tissue Eng Parte C, 2013, 19 (4), 271-280) Por favor clique aqui para ver uma versão maior desta figura.
t = "Figura 8" src = "/ files / ftp_upload / 52940 / 52940fig8.jpg" />
Figura 8: Representante pós-operatória radiografias e sagital μCT Reconstrução do osso femoral de ratos osso femoral com o respectivo defeito deixado vazio (AE), ou preenchido com enorme enxerto ósseo singénicos (FJ), ou preenchido com enormes andaimes de coral Acropora (KO. ); imediatamente após a cirurgia (A, F, K), 4 semanas após a cirurgia (B, G, L), 6 semanas após a cirurgia (C, H, M), e 10 semanas após a cirurgia (D, E, I, J, N , O) (placa de comprimento = 10 mm). (Reproduzido com permissão de Tissue Eng Parte C, 2013, 19 (4), 271-280) Por favor clique aqui para ver uma versão maior desta figura.
files / ftp_upload / 52940 / 52940fig9.jpg "/>
. Figura 9: Representante Radiografia, μCT Reconstrução e Histologia de um defeito preenchido com o andaime Coral Testado no estudo apresenta uma grande quantidade de osso neoformado foi observado em entre as extremidades ósseas circundantes e do andaime coral; em contraste, pequeno osso estava presente no interior do andaime. Manchas: Stevenel azul e von Gieson picrofuchsin. Sob estas condições, osso, células e coral manchado de vermelho, azul e marrom, respectivamente. Barra de escala = 500 pm. ACS = Acropora andaime coral; BN = osso. (Reproduzido com permissão de Tissue Eng Parte C, 2013, 19 (4), 271-280) Por favor clique aqui para ver uma versão maior desta figura.
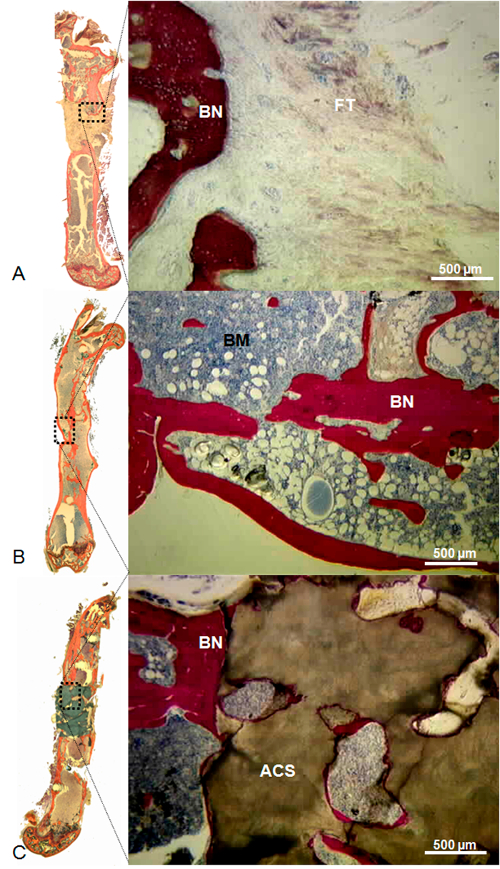
Figura 10: Repre sentante Histologia de Esquerda Defeito vazio (A), cheio de maciça singênicos de enxerto ósseo (B), e cheio de Coral andaime (C). No defeito deixado vazio, o arredondamento do ósseo bordas com preenchimento do canal medular e tecido fibroso abundante profunda dentro do defeito foram observadas. No defeito foi preenchido com massa de enxerto ósseo singénico, foi observado osso continuidade entre o enxerto e as extremidades ósseas circundantes; medula óssea estava presente em toda a cavidade originais. No defeito preenchido com o andaime coral, foi observado osso recém formado entre as extremidades ósseas circundantes e do andaime coral, mas pouco óssea estava presente no interior do andaime. Manchas: Stevenel azul e von Gieson picrofuchsin. Sob estas condições, osso, células e coral manchado de vermelho, azul e marrom, respectivamente. Barra de escala = 500 mm. ACS, andaime coral; BN, osso; BM, medula óssea; FT, tecido fibroso. (Reproduzido com permissão de Tissue Eng Parte C, 2013, 19 (4), 271-280)oad / 52940 / 52940fig10large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.

Animated / vídeo Figura 1: vídeo Representante da marcha de um mouse de um dia pós-operatório. Peso foi observado rolamento. Por favor clique aqui para ver este vídeo.
Discussão
Implante ectópico de materiais e do dispositivo em ratinhos ortopédicos-relacionada é normalmente realizada para avaliar a formação de osso capacidades de diversos suportes 13,14. no entanto existem diferenças importantes entre os modelos ectópica e ortotópicos, incluindo fatores de sinalização osteogênico nativas e interações parácrinos com células formadoras de osso hospedeiro.
O presente estudo estabelece uma grande segmentar murino reprodutível, de tamanho crítico defeito femoral (3,5 mm, aproximadamente 20-25% do comprimento do fémur). Considerando o tamanho de tal defeito e da estabilidade proporcionada pela osteossíntese placa resultante, este modelo imita a não união óssea atrófica clinicamente encontrado.
O período de tempo pós-operatório escolhido no presente estudo, está em linha com ratos modelos não-sindicalizados descritos anteriormente, mostrando uma falta de cicatrização adequada após 8 a 12 semanas 4,9,15,16.
Mais importante ainda, reproduCIBLE e estável osteossíntese, bem como a estabilidade dos substitutos de osso implantados foram obtidos sem a morbidade e mortalidade significativas 1,2 com o uso de ambas as placas de bloqueio e um gabarito para executar a osteotomia. Este resultado contrasta também os resultados relatados quando qualquer um fixador externo ou uma haste intramedular foram utilizados 4,5,17-24. Para os fixadores externos potenciais desvantagens incluem: variabilidade na rigidez, infecções dos tratos pinos, afrouxamento dos pinos, os potenciais lesões devido aos pinos e o peso dos materiais (4 a 20% do peso corporal do rato). Para o prego intramedular potenciais desvantagens incluem: enchimento da cavidade medular com a unha e iatrogénica danos das superfícies articulares.
Outros segmentares murino, crítico-size defeitos femorais estabilizados por placa de osteossíntese têm sido descritos com defeito ósseo criado por uma rebarba e que varia de 1,5 a comprimento de 2 mm 16,25. em the presente modelo, a utilização de um gabarito e um fio de serra permitiu uma osteotomia de 3,5 mm de tempo preciso, sem músculos significativas trauma.
No entanto, para ter sucesso na realização do procedimento deve-se levar em consideração vários pontos-chave: Não use pequena ratos (camundongos Nude com qualquer um peso inferior a 25 g ou idade inferior a 8 semanas) caso contrário, a placa deve ser muito longo. Ao aproximar-se do osso femoral, ter o cuidado de preservar tanto o nervo ciático caudal e da cápsula articular no sentido distal. Aplicar a placa na face anterior do osso femoral e uma vez que o alinhamento da placa é determinado pela aplicação deste primeiro parafuso, ter o cuidado de posicionar a placa paralela ao fémur ao inserir este primeiro parafuso.
Antes de fazer a ostectomy, ter o cuidado de realizar uma dissecção circular do fêmur no meio da diáfise para evitar trauma muscular. Ao realizar a osteotomia, o assistente do cirurgião deve segurar com firmeza o guia eo surGeon deve ter cuidado (i) não emaranhado do fio de serra, (ii) utilizar as médias de dois terços de fio durante a aplicação de uma tensão constante e regular, e (iii) para evitar o excesso de movimento para obter um corte do osso linear.
a cura do osso é possível, no presente modelo proporcionado um enxerto ósseo é usado. Além disso, este modelo permite estudos posteriores dos mecanismos envolvidos nas estratégias de substituição óssea quando tanto enxertos ou células de origem humana são utilizados num grande, segmentar, defeito bem padronizado, osso.
Além disso, de acordo com as tendências atuais que exigem refinamento e redução do uso de animais em pesquisas relacionadas à ortopedia, este modelo pode ser usado em conjunto com in vivo técnicas de imagem como bioluminescência. Tais técnicas não invasivas permitem o monitoramento tanto a sobrevivência das células implantadas e cicatrização do tecido sem exigir o sacrifício de animais 26.
As principais limitações do presente modelo são tanto ocondições de suporte de carga e o volume do defeito ósseo criada porque não imitar completamente aquelas encontradas clinicamente em humanos. Outras limitações do modelo são (i) a rádio-opacidade da placa que podem exigir a remoção da placa antes da análise ex vivo μCT e pode complicar a interpretação dos resultados do exame radiográfico longitudinais e, (ii) a incapacidade de modular a placa de rigidez que pode ser um parâmetro mecânico chave na formação do osso 27-30.
É preciso ter em mente, também, ao usar isoenxerto osso ou outros suportes que contêm um componente mineral (especificamente carbonato de cálcio), que algum viés são introduzidas no processo de segmentação da análise micro-CT, porque a densidade óssea recém-formado, em parte, sobreposto com quer a densidade isoenxerto ou densidade andaime. Por esta razão, o volume ósseo obter por meio da análise de micro-CT reflectem principalmente o volume de tecido mineralizado (osso recém-formado maissubstituto ósseo) 11,26,31.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Os autores agradecem a Rena Bizios por seus valiosos comentários sobre o manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| α-MEM , Minimum Essential Medium Eagle | Sigma-Aldrich, France | M4526 | 500 ml |
| Acropora sp. coral exoskeleton cubes, Biocoral® | Biocoral®, Inoteb, France | 3 x 3 x 3 mm cubes, autoclaving (121 °C for 20 min) sterilization | |
| Buprenorphine, Buprecare® | Axience, Pantin, France | 0.3 mg/ml | |
| Xylazine, Rompun® 2% | Bayer HealthCare, Puteaux, France | 20 mg/ml | |
| Ketamine, Ketamine 500® | Virbac, Carros, France | 50 mg/ml | |
| Isoflurane, Forène® | Abbott, Arcueil, France | ||
| Enrofloxacine, Baytril® 5% | Bayer HealthCare, Puteaux, France | 50 mg/ml | |
| Pentobarbital, Dolethal® | Vétoquinol, Lure, France | 182.2 mg/ml | |
| Anesthetizing box | Ugo Basile, Gemonio, Italy | 7900/10 | |
| Plastic transparent sterile drape, BusterOpCover 30 x 45 cm | Buster, Coveto, Montagu, France | 613867 | |
| 10% povidone iodine, Vétédine® Solution | Vétoquinol, Lure, France | 100 mg/ml | |
| Titanium micro- locking plate, MouseFix Plate XL | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.401.120 | 6 holes, 10 mm long and 1.5 mm wide, autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| 0.3 mm drill bit, Drill Bit 0.30 mm | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.592.200 | autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| Engine power | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | AccuPen | Cold sterilzation (ethylene oxide) |
| Screw driver, Handrill | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.390.130 | autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| Self-tapping locking screws, MouseFix Screw 2 mm | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.401.100 | 2 mm long, 0.47 mm outer diameter and 0.34 mm core diameter, autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| Jig, MouseFix XL Drill and Saw Guide | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.301.103 | 3.5 mm between the slots, autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| 0.22-mm Gigli saws (0.22 mm Saws) | RISystem AG, Davos, Switzerland | ||
| 5.0 glycomer 631, Biosyn | Covidien, Vétoquinol, Lure, France | Tapper-cut needle | |
| 4.0 glycomer 631, Biosyn | Covidien, Vétoquinol, Lure, France | Tapper-cut needle | |
| X-ray, MX20 | Faxitron X-ray Corp, Edimex, Le Plessis Grammorie | ||
| In vivo high-resolution microcomputed tomography, Skyscan 1176 | Skyscan, Aartselaar, Belgium | ||
| Ex vivo high-resolution microcomputed tomography, Skyscan 1172 | Skyscan, Aartselaar, Belgium | ||
| Resident software: Nrecon (v1.6.9) / Ctan (v.1.14.4) | Skyscan, Aartselaar, Belgium |
Referências
- Auer, J. A., et al. Refining animal models in fracture research: seeking consensus in optimising both animal welfare and scientific validity for appropriate biomedical use. BMC Musculoskelet Disord. 8 (72), (2007).
- Histing, T., et al. Small animal bone healing models: standards, tips, and pitfalls results of a consensus meeting. Bone. 49 (4), 591-599 (2011).
- Horner, E. A., et al. Long bone defect models for tissue engineering applications: criteria for choice. Tissue Eng. Part B Rev. 16 (2), 263-271 (2010).
- Srouji, S., et al. A model for tissue engineering applications: femoral critical size defect in immunodeficient mice. Tissue Eng. Part C Methods. 17 (5), 597-606 (2011).
- Thompson, Z., Miclau, T., Hu, D., Helms, J. A. A model for intramembranous ossification during fracture healing. J Orthop Res. 20 (5), 1091-1098 (2002).
- Harris, J. S., Bemenderfer, T. B., Wessel, A. R., Kacena, M. A. A review of mouse critical size defect models in weight bearing bones. Bone. 55 (1), 241-247 (2013).
- Garcia, P., et al. The LockingMouseNail--a new implant for standardized stable osteosynthesis in mice. J. Surg. Res. 169 (2), 220-226 (2011).
- Garcia, P., Histing, T., Holstein, J. H., Pohlemann, T., Menger, M. D. Femoral non-union models in the mouse. Injury. 41 (10), 1093-1094 (2010).
- Garcia, P., et al. Development of a reliable non-union model in mice. J. Surg. Res. 147 (1), 84-91 (2008).
- Viateau, V., Logeart-Avramoglou, D., Guillemin, G., Petite, H., Conn, P. M. Animal Models for bone tisue enginering purposes. Sourcebook of models for biomedical research. , 725-738 (2008).
- Manassero, M., et al. A novel murine femoral segmental critical-sized defect model stabilized by plate osteosynthesis for bone tissue engineering purposes. Tissue Eng. Part C Methods. 19 (4), 271-280 (2013).
- Matthys, R., Perren, S. M. Internal fixator for use in the mouse. Injury. 40 Suppl 4, S103-S109 (2009).
- Becquart, P., et al. Ischemia is the prime but not the only cause of human multipotent stromal cell death in tissue-engineered constructs in vivo. Tissue Eng. Part A. 18 (19-20), 2084-2094 (2012).
- Deschepper, M., et al. Proangiogenic and prosurvival functions of glucose in human mesenchymal stem cells upon transplantation. Stem Cells. 31 (3), 526-535 (2013).
- Oetgen, M. E., Merrell, G. A., Troiano, N. W., Horowitz, M. C., Kacena, M. A. Development of a femoral non-union model in the mouse. Injury. 39 (10), 1119-1126 (2008).
- Liu, K., et al. A murine femoral segmental defect model for bone tissue engineering using a novel rigid internal fixation system. J Surg Res. 183 (2), 493-502 (2013).
- Zwingenberger, S., et al. Establishment of a femoral critical-size bone defect model in immunodeficient mice. J Surg Res. 181 (1), e7-e14 (2013).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J. Orthop Res. 21 (4), 685-690 (2003).
- Claes, L., et al. Hyperhomocysteinemia is associated with impaired fracture healing in mice. Calcif. Tissue Int. 85 (1), 17-21 (2009).
- Drosse, I., et al. Validation of a femoral critical size defect model for orthotopic evaluation of bone healing: a biomechanical, veterinary and trauma surgical perspective. Tissue Eng. Part C Methods. 14 (1), 79-88 (2008).
- Holstein, J. H., et al. Advances in the establishment of defined mouse models for the study of fracture healing and bone regeneration. J. Orthop. Trauma. 23 (5 Suppl), S31-S38 (2009).
- Johnson, K. D., August, A., Sciadini, M. F., Smith, C. Evaluation of ground cortical autograft as a bone graft material in a new canine bilateral segmental long bone defect model. J. Orthop. Trauma. 10 (1), 28-36 (1996).
- Meinig, R. P., Buesing, C. M., Helm, J., Gogolewski, S. Regeneration of diaphyseal bone defects using resorbable poly(L/DL-lactide) and poly(D-lactide) membranes in the Yucatan pig model. J. Orthop. Trauma. 11 (8), 551-558 (1997).
- Wu, J. J., Shyr, H. S., Chao, E. Y., Kelly, P. J. Comparison of osteotomy healing under external fixation devices with different stiffness characteristics. J. Bone Joint Surg. Am. 66 (8), 1258-1264 (1984).
- Xing, J., et al. Establishment of a bilateral femoral large segmental bone defect mouse model potentially applicable to basic research in bone tissue engineering. J. Surg. Res. 192 (2), 454-463 (2014).
- Manassero, M., et al. Comparison of Survival and Osteogenic Ability of Human Mesenchymal Stem Cells in Orthotopic and Ectopic Sites in Mice. Tissue Eng. Part A. 22 (5-6), 534-544 (2016).
- Bos, R. R., et al. Degradation of and tissue reaction to biodegradable poly(L-lactide) for use as internal fixation of fractures: a study in rats. Biomaterials. 12 (1), 32-36 (1991).
- Oest, M. E., Dupont, K. M., Kong, H. J., Mooney, D. J., Guldberg, R. E. Quantitative assessment of scaffold and growth factor-mediated repair of critically sized bone defects. J.Orthop. Res. 25 (7), 941-950 (2007).
- Pihlajamaki, H., Bostman, O., Tynninen, O., Laitinen, O. Long-term tissue response to bioabsorbable poly-L-lactide and metallic screws: an experimental study. Bone. 39 (4), 932-937 (2006).
- Rai, B., et al. Combination of platelet-rich plasma with polycaprolactone-tricalcium phosphate scaffolds for segmental bone defect repair. J. Biomed. Mater Res. A. 81 (4), 888-899 (2007).
- Komlev, V. S., et al. Kinetics of in vivo bone deposition by bone marrow stromal cells into porous calcium phosphate scaffolds: an X-ray computed microtomography study. Tissue Eng. 12 (12), 3449-3458 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados