Method Article
Caracterização metabólica de Polarizada M1 e M2 macrófagos da medula óssea derivadas usando análises em tempo real do fluxo extracelular
Neste Artigo
Resumo
Metabolic reprogramming is a characteristic and prerequisite for M1 and M2 macrophage polarization. This manuscript describes an assay for the measurement of fundamental parameters of glycolysis and mitochondrial function in mouse bone marrow-derived macrophages. This tool can be applied to investigate how particular factors affect the macrophage’s metabolism and phenotype.
Resumo
Specific metabolic pathways are increasingly being recognized as critical hallmarks of macrophage subsets. While LPS-induced classically activated M1 or M(LPS) macrophages are pro-inflammatory, IL-4 induces alternative macrophage activation and these so-called M2 or M(IL-4) support resolution of inflammation and wound healing. Recent evidence shows the crucial role of metabolic reprogramming in the regulation of M1 and M2 macrophage polarization.
In this manuscript, an extracellular flux analyzer is applied to assess the metabolic characteristics of naive, M1 and M2 polarized mouse bone marrow-derived macrophages. This instrument uses pH and oxygen sensors to measure the extracellular acidification rate (ECAR) and oxygen consumption rate (OCR), which can be related to glycolytic and mitochondrial oxidative metabolism. As such, both glycolysis and mitochondrial oxidative metabolism can be measured in real-time in one single assay.
Using this technique, we demonstrate here that inflammatory M1 macrophages display enhanced glycolytic metabolism and reduced mitochondrial activity. Conversely, anti-inflammatory M2 macrophages show high mitochondrial oxidative phosphorylation (OXPHOS) and are characterized by an enhanced spare respiratory capacity (SRC).
The presented functional assay serves as a framework to investigate how particular cytokines, pharmacological compounds, gene knock outs or other interventions affect the macrophage’s metabolic phenotype and inflammatory status.
Introdução
Enquanto os macrófagos desempenham um papel central em praticamente todas as doenças, os mecanismos moleculares que regulam o seu fenótipo ainda não são completamente desvendados. Macrófagos apresentam elevada heterogeneidade e em resposta ao microambiente adoptar diferentes fenótipos 1. LPS (+ IFN-y) induzida classicamente activado M1 ou M (LPS) macrófagos promovem a inflamação e proteger o hospedeiro contra diferentes tipos de ameaças microbianos 2. Outros usam IFNy por si só ou em combinação com TNF como estímulos para provocar M1 polarização. IL-4 e / ou IL-13 induz a activação de macrófagos alternativa e estes M2 ou células M (IL-4) são supressores potentes e controladores de respostas imunitárias em curso 3. Macrófagos polarizadas exibir um regulamento distinto do metabolismo celular com macrófagos M1 LPS-ativados passando por um interruptor metabólica para o reforço da glicólise 4-6. Oxidação de ácido gordo Por outro lado, o reforço (FAO) e oxidativ mitocondriale fosforilação (OXPHOS) fornece energia sustentada no induzidas por IL-4 macrófagos M2 7-9. Assim, a alteração do metabolismo não é apenas uma característica de subconjuntos de macrófagos polarizadas, é também um pré-requisito para a polarização adequada e regulação inflamatória. Importante, a inibição da glicólise ou OXPHOS / FAO tem sido demonstrado para prejudicar M1 ou M2 activação, respectivamente, 8,10. Como tal, a identificação de mudanças metabólicas em macrófagos pode ser aplicado como uma ferramenta para avaliar o seu estado de polarização e potencial inflamatório.
Um ensaio que mede o metabolismo consistente macrófagos podia, portanto, ser usadas para prever se uma droga, gene derrubar ou outro tratamento afecta a polarização e função dos macrófagos. Neste vídeo, um analisador de fluxo extracelular é usado para caracterizar os perfis de bioenergética naïve, M1 e M2 macrófagos.
Este manuscrito apresenta detalhes de um protocolo optimizado que permite a mediçãode todos os parâmetros relevantes glicólise (glicólise, glicólise máxima e reserva glycolytic) e características da função mitocondrial (respiração total, a respiração basal mitocondrial, produção de ATP, vazamento de prótons, respiração máxima e capacidade respiratória de reposição) em um único ensaio. Usando esta configuração experimental, bioenergética pode ser comparado entre o controle e 'alterado' (eg gene knock down, a superexpressão transgênica ou tratamento farmacológico) células.
Protocolo
1. Os macrófagos A cultura e polarização de Medula Óssea derivados
- Dia 0: Isolar fêmur e tíbia ossos de 6-10 semana ratos velhos de interesse (C57BL / 6 neste ensaio).
- Remover o tecido do músculo dos ossos e colocar os ossos numa placa de petri com 9 cm cheia de PBS gelado.
- Transfira os ossos de um prato de 9 centímetros de Petri cheia com etanol 70% e agitar suavemente a placa durante 30 segundos.
- Transfira os ossos para uma nova 9 centímetros placa de Petri cheia de gelo-frio PBS estéril.
- Cortar o fêmur ea tíbia em ambas as extremidades com tesoura estéril.
- Lave os ossos com 10 ml de gelo-frio PBS estéril usando uma seringa de 10 ml e uma agulha de 25 G. Recolha da medula óssea em um tubo de 50 ml.
- Transferir as células da medula óssea para um novo tubo de 50 ml usando uma agulha 23 G.
- Repita este passo com uma agulha de 25 G. Nota: Estes passos são necessários para remover aglomerados de células e resíduos ósseos.
- Centrifuga-se a 300 xg durante 5 min a 4 ° C.
- Descarte o supernatant e ressuspender as células em meio de 40 ml de células de cultura (RPMI-1640 mais 2 mM de L-glutamina, 10% FCS, penicilina (100 U / ml), estreptomicina (100 ug / ml) e 15% filtrou-se L-929 de células ( ATCC, CCL-1) meio contendo climatizados, M-CSF (ou, alternativamente, 10 ng mL-M-CSF / recombinante em vez de L-929 de meio condicionado de células).
Nota: A geração de meio condicionado de células L-929 foi detalhado anteriormente neste jornal em 2013. 11 - Cultura das células a partir de um murganho em duas placas de Petri de 15 cm (não utilizar placas tratadas de cultura de células uma vez que macrófagos não irá separar a partir desta plástico) em 20 ml de meio de cultura por placa em uma temperatura de 37 ° C, 5% de CO2.
- Adicionar 10 ml de meio de cultura de células fresco no dia 3, sem remover os mais velhos 20 ml meio de cultura celular.
- Substitua a forma de cada placa com 20 ml de meio de cultura fresco no dia 6. Fazendo isto, as células não aderentes também serão removidos.
- Dia 8:
- Separe as células, incubando-as a 5 mno a 37 ° C em 10 ml de solução salina de citrato (135 mM de cloreto de potássio mais citrato de sódio 15 mM em H2O, autoclavado) e lava-se com 10 ml de PBS. Contagem macrófagos osso maduro derivadas da medula (BMDM) no dia 8, utilizando um contador de células.
- Verifique a formação de maduro (CD11b + F4 / 80 +) BMDM por inspeção visual ou por citometria de fluxo. Bloco 10 5 células com anti-CD16 1/100 / CD32 em PBS durante 20 minutos em 100 ul de PBS, incubar com 1/200 anti-CD11b-FITC mais 1/200 anti-F4 / 80-APC-Cy7 à RT, lavagem e analisar por citometria de fluxo.
Nota: os macrófagos derivados da medula óssea de rato A cultura foi publicada em detalhes anteriormente neste jornal por Ying et al 11..
- Semente 50.000 células (contagem de células óptimas devem ser optimizados) por cavidade em uma microplaca de cultura de células em 100 ul de meio de cultura. Não semear células em poços de correção de fundo (A1, A12, H1, H12) e colocar apenas meio (sem células) nesses poços. Sugestão: Segure a pipeta em um ângulo umluta a meio do lado dos poços para camada de células mais homogênea.
- Permitir que as células de resolver à temperatura ambiente numa capa de cultura de células durante 1 h. Isto irá promover uma distribuição uniforme de células e reduzir efeitos de borda. Monitorar a aderência usando um microscópio e cultura num banho a 37 ° C, 5% de CO2.
- Três horas após o plaqueamento, estimular as células durante 24 horas com 10 ng / ml de LPS, ou 20 ng / ml de rato recombinante da IL-4 para gerar M1 ou M2 macrófagos, respectivamente. Incluir naïve (M0) macrófagos não tratados como um controle. Avaliar adequada M1 e M2 macrófagos polarização medindo induzida por LPS a secreção de IL-6, IL-12, TNF (ELISA) e IL-4 induzida pela arginase-1 atividade e / ou MMR (CD206) e MGL (CD301) a expressão de superfície (citometria de fluxo) conforme descrito anteriormente 3,11.
Nota: Neste ponto, as células podem ser (pré) tenha sido tratada com com compostos farmacológicos de interesse ou os macrófagos podem ser estimuladas com outros factores. Uma vez que, a variação entre os poços separados pode ser substantial, é aconselhável a utilização de, pelo menos, 4 e, idealmente 6 poços por condição.
2. Preparação do Ensaio de Fluxo Extracelular
- Hidratar o cartucho do sensor, um dia antes de realizar o teste:
- Coloque o cartucho do sensor de cabeça para baixo ao lado da placa de utilidade.
- Encher cada poço da placa de utilidade com 200 ul de solução de calibração e diminuir o cartucho do sensor sobre a placa de utilidade submergindo os sensores na solução de calibração.
- Verificar o nível da solução de calibração é alta o suficiente para manter os sensores e submersos num lugar não-CO 2 37 ° C incubadora S / N.
- Prepare meio de ensaio no dia do ensaio como se segue:
- 50 ml de meio de base XF Aquece-se até 37 ° C.
- Adicionar 500 ul de 200 mM de L-glutamina para obter uma concentração final de 2 mM.
- Ajustar o pH para 7,4 utilizando NaOH 1 N e esterilizar com um filtro de 0,2 uM e manter o meio de ensaio a 37 ° C.
- Suavemente remover o meio de cultura de células de macrófagos polarizadas e armazená-lo a -20 ° C para uso futuro (por exemplo, ELISA para examinar a polarização adequada de macrófagos). Lavam-se as células com meio de ensaio de 100 ul, adicionar meio de ensaio de 180 ul por poço e verificar ao microscópio as células que não foram lavados. Colocar a placa de cultura de células em um temperatura de 37 ° C sem incubadora de CO2 durante 1 hora antes do procedimento de ensaio.
- Preparar 10 x compostos para injecção misturas A até D, tal como descrito na Tabela 1, aquecer até 37 ° C, ajustar o pH para 7,4 e esterilizar filtro.
- Fazer todos os compostos nessas misturas em 10x a concentração final em poços de cultura de células e optimizar estas concentrações para cada tipo de célula.
- Coloque o cartucho do sensor usando as guias de carregamento fornecidos com volumes indicados (Tabela 1) das misturas de compostos 10x injeção preparados nos portos A, B, C e D, respectively.
| Mistura / Injecção | Compostos | Volume adicionado para obter 10x mistura (ul) | Ensaio Volume Médio (ml) | Volume injetado durante a execução (ul) | A concentração final no ensaio |
| UMA | 2,5 M (45%) de glucose | 300 | 2.7 | 20 | 25 mM |
| B | 5 mM de oligomicina A (OM) | 9 | 3.0 | 22 | 1,5 uM |
| C | MM FCCP 5 | 9 | 2.7 | 25 | 1,5 uM |
| Solução 100 mM de piruvato de sódio | 300 | 1 mM | |||
| D | 5 mM antimicina A (AA) | 15 | 3.0 | 28 | 2,5 uM |
| 5 mM rotenone (Rot) | 7,5 | 1,25 mM |
Tabela 1. misturas de injecção.
3. Caracterização bioenergética da Polarizada M1 e M2 BMDM usando um Extracelular Flux Analyzer
- Criar um modelo de ensaio com o assistente de ensaio com MIX 2 minutos e 3 vezes minuto medir e (pelo menos) 3 mix e de taxa de medições laços antes de cada um dos 4 injecções (Tabela 1) e após a última injecção.
Nota: Estas concentrações são válidas para os macrófagos derivados da medula óssea e RAW264.7 linhas celulares de macrófagos, mas deve ser optimizada para cada tipo de célula. Adição de piruvato na mistura FCCP é necessário para abastecer respiração máxima. - Comece a correr, empurrando o fundo de início e siga as instruções do aparelho. Primeira carga do carroplaca cartucho com as sondas hidratados para permitir calibração por aparelhos e próxima carga da placa de células.
- Após o ensaio, descartar cuidadosamente todos meio de ensaio e armazenar a microplacas de cultura celular analisada a -20 ° C para futuro normalização celular utilizando o kit de ensaio de proliferação celular, como descrito em detalhe pelo fornecedor.
- Resumidamente, preparar um tampão de lise de células-1x diluindo o componente B de 20 vezes em água destilada e dilui-se o composto A de 400 vezes no tampão de lise de células-1x. Adicionar 200 ul por poço, incubar 5 minutos à temperatura ambiente e medir a fluorescência com excitação a 180 nm ~ e ~ 520 nm de emissão máximos.
Nota: Quando se trabalha com células não-aderentes ou se baixa adesão é uma preocupação, o kit de proliferação de células directo pode ser usado como uma alternativa uma vez que este protocolo não necessita descartando todos meio de ensaio. No entanto, este protocolo direto é um pouco menos sensível em comparação com o protocolo utilizado neste laboratório.
- Resumidamente, preparar um tampão de lise de células-1x diluindo o componente B de 20 vezes em água destilada e dilui-se o composto A de 400 vezes no tampão de lise de células-1x. Adicionar 200 ul por poço, incubar 5 minutos à temperatura ambiente e medir a fluorescência com excitação a 180 nm ~ e ~ 520 nm de emissão máximos.
- Após a medição de fluorescência, normalizara contagem de células em cada poço como uma razão em que a contagem média de células de todas as cavidades sem tratamento prévio de macrófagos é fixada em 1.
Nota: a quantificação de proteínas (por exemplo, utilizando um ensaio BCA) poderia ser utilizado como uma forma alternativa para normalizar as contagens de células. No entanto, nas nossas mãos este ensaio foi menos sensível em comparação com o kit de ensaio de proliferação celular.
Resultados
Depois de terminar o ensaio celular e a quantificação de fluxo extracelular, os dados podem ser normalizada para contagem de células e analisado. Isto irá tipicamente produzir ECAR e OCR lotes como se mostra na Figura 1A e Figura 1B.
Após a injecção de glucose (A), o aumento em ECAR representa a taxa de glicólise. O aumento adicional na ECAR após a inibição ATP sintase com oligomicina (B) fornece informações sobre a reserva glycolytic ea capacidade (Figura 1A). Ao analisar os valores de OCR, oligomicina injecção (B) permite o cálculo do consumo de oxigénio utilizado para a síntese de ATP mitocondrial. FCCP (C) desacopla respiração mitocondrial e as medidas correspondentes de OCR produzir dados sobre a capacidade respiratória máxima e de reposição. Finalmente, a injeção de rotenona (Rot) e antimicina A (AA) bloquear mitocondrial complexo I e III eo OCR residual representa os contras de oxigênio não-mitocondriaisumption (Figura 1B).
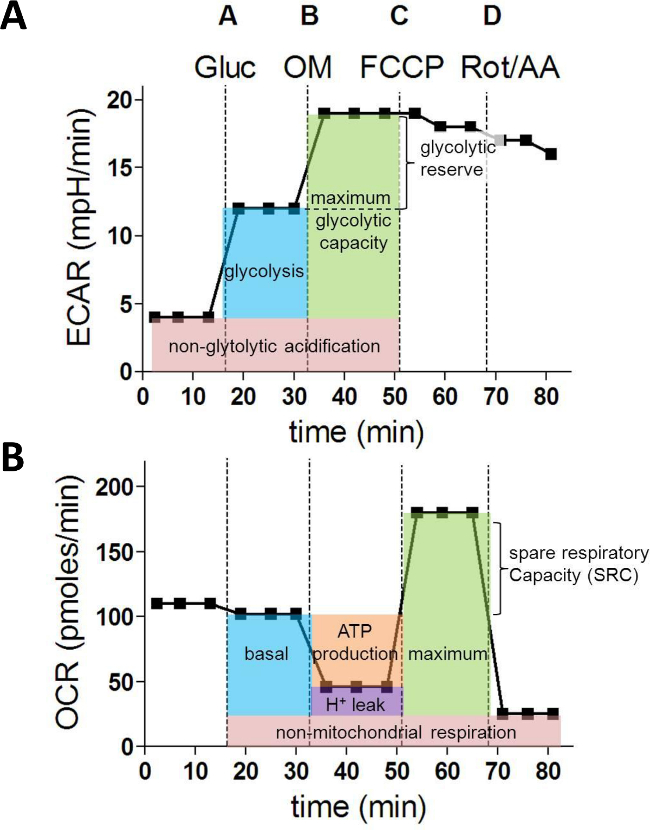
Figura 1: parâmetros metabólicos derivados a partir de um ensaio de fluxo de XF extracelular. (A) Os seguintes parâmetros da glicólise celular são calculados a partir dos valores ECAR (em mph / min): glicólise, capacidade máxima glicolítica e reserva glicolítica. Medições (B) OCR (em pMoles / min) são utilizados para calcular os parâmetros fundamentais próximos da função mitocondrial: respiração basal, a produção de ATP, vazamento de prótons, respiração máxima e capacidade respiratória de reposição. Gluc = glucose; OM = oligomicina A; FCCP = cianeto de carbonilo 4- (trifluorometoxi) fenil-hidrazona; AA = antimicina A; Rot = Rotenone Por favor clique aqui para ver uma versão maior desta figura.
Após a corrida, eCar e OCR medições 1 til15 l para cada cavidade podem ser exportados para Excel e os seguintes parâmetros glicolíticas podem ser calculados a partir das medições ECAR como se segue:
Acidificação não glycolytic = avg. ECAR (1,2,3)
Glicólise = avg. ECAR (4,5,6) - avg. ECAR (1,2,3)
Capacidade glicolítica máximo = avg. ECAR (7,8,9) - avg. ECAR (1,2,3)
Reserva Glicosidases = avg. ECAR (7,8,9) - avg. ECAR (4,5,6)
A partir das taxas de OCR, os próximos características metabólicas podem ser determinados:
Respiração não-mitocondrial = avg. OCR (13,14,15)
Respiração basal = avg. OCR (4,5,6) - avg. OCR (13,14,15)
Produção de ATP = avg. OCR (4,5,6) - avg. OCR (7,8,9)
Proton vazamento =avg. OCR (7,8,9) - avg. OCR (13,14,15)
Respiração = avg máxima. OCR (10,11,12) - avg. OCR (13,14,15)
Capacidade respiratória Spare (SRC) = avg. OCR (10,11,12) - avg. OCR (4.5.6)
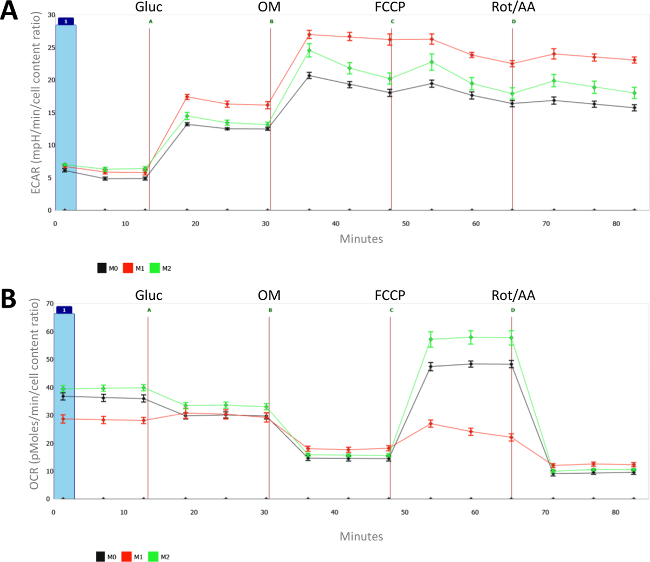
Figura 2:. Metabólicas características de ingénuos (M0), LPS (M1) e IL-4 (M2) macrófagos polarizadas Para cada medição, a média e o erro padrão da média (SEM) de 8 poços individuais é apresentada. (A) taxas de acidificação extracelular (ECAR, em mph / min) e (B) taxas de consumo de oxigênio (OCR, em pMoles / min) são medidos para diferencialmente polarizado (M1 e M2) e macrófagos naïve (M0). Todas as medições foram normalizadas para a contagem de células (tal como medido com CyQUANT) e a contagem média de células de macrófagos sem tratamento prévio foi fixado em 1. EmUm jecção = glucose; B = oligomicina; C = FCCP; D = antimicina A + Rotenone. Por favor clique aqui para ver uma versão maior desta figura.
Como mostrado na Figura 2A, a activação de macrófagos com LPS induz aumento do metabolismo glicolítico. As diferenças entre as LPS e macrófagos tratados com IL-4 são ainda mais evidentes quando se olha para as taxas de consumo de oxigênio (OCR) na Figura 2B. Com efeito, enquanto o metabolismo oxidativo máxima é altamente suprimida em M (LPS), a IL-4 induz a respiração basal e especialmente máxima em macrófagos M2. Deve-se notar que o aumento glycolytic é bastante singular para M (LPS) macrófagos e não é necessariamente uma característica de macrófagos M1 desde M (IFN-y) macrófagos não exibem melhorar a glicólise.
No geral, esta análise demonstra fluxo extracelular thaT com IL-4 induzida por macrófagos M2 são caracterizadas por metabolismo oxidativo aumentado e especialmente uma elevada capacidade respiratória de reposição (SRC), ao passo que os macrófagos activados por LPS visualização melhorada metabolismo glicolítico e não possuir qualquer capacidade respiratória de reposição.
Discussão
O objetivo do nosso laboratório é entender como polarização e função dos macrófagos pode ser influenciada com o objetivo final de melhorar o resultado da aterosclerose e outras condições inflamatórias 12. Para avaliar macrófagos polarização, um mede tipicamente o LPS (+ IFN-y) e induzidas por IL-4 induzida a expressão do gene de M1 e M2 genes marcadores (qPCR), determina a IL-6, IL-12, TNF e nenhuma secreção (por ELISA e reacção de Griess) e examina induzida por IL-4 CD71, CD206, CD273 e CD301 expressão de superfície (por citometria de fluxo) e actividade da arginase 3,13. Além disso, ensaios de apoptose (por Anexina-V / coloração PI), ensaios de fagocitose (com esferas fluorescentes de látex e / ou pHrodo de E. coli) e ensaios de formação de células espumosas (por absorção Dil-oxLDL, LipidTOX coloração lípido neutro) podem ser realizados para avaliar a funcionalidade de macrófagos 14. Além disso, a análise de fluxo extracelular pode ser realizado para medir a bioenergética perfis de Mac polarizadarophages como uma leitura funcional novo e alternativo.
Este manuscrito polarização mostra que macrófagos induz reprogramação metabólica com macrófagos induzida por LPS de comutação para o aumento da glicólise como fonte de energia. Inversamente, M2 macrófagos induzida por IL-4 utilizar a fosforilação oxidativa mitocondrial, como a principal fonte de ATP. É importante ressaltar que a reprogramação metabólica não só fornece energia para os requisitos particulares do M1 e M2 macrófagos polarizadas. Com efeito, as alterações metabólicas afetam as concentrações do metabolito que são reguladores diretos do fenótipo de macrófagos 10,15,16. Assim, o metabolismo de macrófagos não é apenas uma característica (como mostrado aqui na Figura 2), mas também um controlador de estados de polarização de macrófagos e esse novo conhecimento apoiado o rápido crescimento da área de pesquisa do immunometabolism durante o último par de anos.
No entanto, as medidas robustas de perfis metabólicos em macrofagos permaneceu difícil e tinha suas limitações. Neste estudo, um analisador de fluxo extracelular é aplicado para medir de forma robusta glicólise, reserva glicolítica, capacidade glicolítica máxima, acidificação não glicolítica, respiração basal e máxima, a produção de ATP, a capacidade respiratória de reposição, vazamento de protões e respiração não-mitocondrial em tempo real em uma quantidade mínima de macrófagos.
Portanto, modificada e melhorada protocolos do fabricante, conforme se segue. O Teste de Estresse Mito padrão (# 103015-100) sugere o uso de meio com glicose e piruvato e um protocolo com 3 injecções (OM, FCCP, AA / rot). Nós optar para iniciar o ensaio com meio de glucose /-piruvato livre, adicionar glucose como uma primeira injecção no canal A (como no teste de stress glicólise # 103020-100) e adicionar piruvato em conjunto com o desacoplador FCCP no porto C. Desta maneira , todos os parâmetros relevantes glicólise são derivados a partir das medições eCar 1-9 e todas as informações relevantes sobre mitochondrial função a partir de medições de OCR 4-15.
Note-se que é fundamental para injetar piruvato juntamente com FCCP para abastecer respiração máxima em cima do desacoplamento. Antes de utilizar este protocolo combinado, deve-se verificar que a 2-desoxi-D-glicose (2-DG) reduz os níveis de eCar após o ensaio com os valores basais (1-3) e que as taxas eCar gravadas 4-6 são, de facto, devido a glicólise. Além disso, deve-se compreender que as concentrações do composto e o número de células utilizadas neste manuscrito são válidas para os macrófagos derivados da medula óssea e RAW264.7 linhas celulares de macrófagos e devem ser optimizados para outros tipos de células. Além disso, deve-se notar que o FEC-M, que é usado para gerar os macrófagos derivados da medula óssea promove um fenótipo anti-inflamatória M2-like. Os resultados apresentados a partir de macrófagos derivados de medula óssea, por conseguinte, pode não ser totalmente comparáveis às medições com macrófagos residentes de tecido primário ou macrófagos linhas de células que não necessitem de M-CSF durante culturi célulang.
Em comparação com os métodos existentes, este protocolo requer quantidades mínimas de macrófagos e fornece rapidamente praticamente todos os celulares características metabólicas fundamentais. Isto resulta em células excedentes suficientes para realizar outros ensaios imunológicos e até mesmo as células utilizadas para a bioenergética perfilamento pode ainda ser utilizado para outros propôs após o ensaio. Além disso, em particular o formato de placa de 96 bem permite avaliar múltiplos condições em tempo real, ao mesmo tempo. No entanto, a variação entre os poços individuais pode ser considerável e, por conseguinte, a utilização de pelo menos 4 poços por condição é muitas vezes desejado. Tomados em consideração esta limitação, a análise de fluxo extracelular descrito ainda permite executar mais de 10 condições experimentais (n = 6) de uma só vez, o que é muito mais do que as técnicas tradicionais.
No geral, este artigo fornece um ensaio funcional fácil e reprodutível, que permite medir tudo glicólise relevante e param mitocondrialtros em subconjuntos de macrófagos polarizada. Esta técnica pode servir como uma aplicação futura para avaliar a função de macrófagos e para avaliar o efeito de manipulações distintas (por exemplo, gene batida para baixo, novos fármacos, etc.) no (metabólica) do fenótipo de macrófagos. Como tal, os dados de fluxo extracelular pode ser usado em conjunto com outros ensaios para permitir a caracterização detalhada do estado da activação do macrófago.
Divulgações
Acesso gratuito a este artigo é patrocinado pela Seahorse Bioscience.
Agradecimentos
Jan Van den Bossche received a Junior Postdoc grant from the Netherlands Heart Foundation (2013T003) and a VENI grant from ZonMW (91615052). Menno de Winther is an Established Investigator of the Netherlands Heart Foundation (2007T067), is supported by a Netherlands Heart Foundation grant (2010B022) and holds an AMC-fellowship. We also acknowledge the support from the Netherlands Cardiovascular Research Initiative, Dutch Federation of University Medical Centers, the Netherlands Organization for Health Research and Development and the Royal Netherlands Academy of Sciences for the GENIUS project “Generating the best evidence-based pharmaceutical targets for atherosclerosis” (CVON2011-19). We acknowledge Seahorse Bioscience for making open access publication possible. The authors thank Riekelt Houtkooper and Vincent de Boer (Laboratory Genetic Metabolic Diseases, Academic Medical Center, Amsterdam, The Netherlands) for all previous assistance with the Seahorse analyzer.
Materiais
| Name | Company | Catalog Number | Comments |
| 23G and 25G needles | Becton Dickinson | #300800 and #300600 | To flushed bone marrow |
| 10 ml syringes | Becton Dickinson | #307736 | To flushed bone marrow |
| Petri dishes | Greiner | #639161 | To culture bone marrow cells |
| CyQUANT Cell Proliferation Assay kit | Molecular Probes | #C7026 | For cell quantification at a later time point (works only for adherent cells) |
| CyQUANT Direct Cell Proliferation Assay kit | Molecular Probes | #35011 | For cell quantification immediately after assay (non-adherent cells) |
| XFe96 cell culture microplate | Seahorse Bioscience | #101085-004 | 96 well plate in which cells are cultured and in which assay is done |
| recombinant mouse interleukin-4 (IL-4) | Peprotech | #214-14-B | Used to induced alternative macrophage activation |
| lipopolysaccharide (LPS) | Sigma | #L2637 | Pro-inflammatory stimulus |
| Seahorse Sensor Cartridge | Seahorse Bioscience | #102416-100 | Contains the probes for pH and O2 measurement |
| Seahorse XF Calibrant | Seahorse Bioscience | #100840-000 | Needed to hydrate the probes overnight |
| XF base medium | Seahorse Bioscience | #102353-100 | Buffer-free medium that allows efficient measurement of pH changes |
| L-glutamine | Life Technologies | #25030-081 | |
| D-(+)-Glucose | Sigma | #G8769 | Fuels glycolysis once added to the cells |
| oligomycin A | Sigma | #75351 | Inhibits mitochondrial ATP synthase |
| FCCP( Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone) | Sigma | #C2920 | Uncouples mitochondrial respiration |
| 100 mM Sodium Pyruvate solution | Lonza | #BE13-115E | Allows maximal mitochondrial respiration without the need for glycolysis |
| Antimycin A | Sigma | #BE13-115EA8674 | Inhibits complex III of the mitochondria |
| Rotenone | Sigma | #BE13-115EA8674R8875 | Inhibits complex I of the mitochondria |
| Casy Cell Counter | Roche Diagnostics | #05 651 697 001 | Instrument to count cells |
| anti-CD16/CD32 | eBioscience | #14-0161 | Fc receptor block flow cytometry |
| anti-F4/80-APC-eFluor780 | eBioscience | #47-4801 | Antibody to stain macrophages |
| anti-CD11b-FITC | eBioscience | #11-0112 | Antibody to stain macrophages |
Referências
- Murray, P. J., et al. Macrophage activation and polarization: nomenclature and experimental guidelines. Immunity. 41, 14-20 (2014).
- Hoeksema, M. A., et al. IFN gamma Priming of Macrophages Represses a Part of the Inflammatory Program and Attenuates Neutrophil Recruitment. J Immunol. , (2015).
- Vanden Bossche, J., et al. Pivotal Advance Arginase 1 independent polyamine production stimulates the expression of IL 4 induced alternatively activated macrophage markers while inhibiting LPS-induced expression of inflammatory genes. Journal of leukocyte biology. 91, 685-699 (2012).
- Pearce, E. L., Pearce, E. J. Metabolic pathways in immune cell activation and quiescence. Immunity. 38, 633-643 (2013).
- Yang, L., et al. PKM2 regulates the Warburg effect and promotes HMGB1 release in sepsis. Nature communications. 5, 4436 (2014).
- Freemerman, A. J., et al. Metabolic reprogramming of macrophages glucose transporter 1 (GLUT1) mediated glucose metabolism drives a proinflammatory phenotype. The Journal of biological chemistry. 289, 7884-7896 (2014).
- Tavakoli, S., Zamora, D., Ullevig, S., Asmis, R. Bioenergetic profiles diverge during macrophage polarization implications for the interpretation of 18F FDG PET imaging of atherosclerosis. J Nucl Med. 54, 1661-1667 (2013).
- Vats, D., et al. Oxidative metabolism and PGC 1beta attenuate macrophage mediated inflammation. Cell metabolism. 4, 13-24 (2006).
- Huang, S. C., et al. Cell intrinsic lysosomal lipolysis is essential for alternative activation of macrophages. Nature immunology. 15, 846-855 (2014).
- Tannahill, G. M., et al. Succinate is an inflammatory signal that induces IL 1beta through HIF 1alpha. Nature. 496, 238-242 (2013).
- Ying, W., Cheruku, P. S., Bazer, F. W., Safe, S. H., Zhou, B. Investigation of macrophage polarization using bone marrow derived macrophages. J Vis Exp. (76), (2013).
- Hoeksema, M. A., et al. Targeting macrophage Histone deacetylase 3 stabilizes atherosclerotic lesions. EMBO Mol Med. 6, 1124-1132 (2014).
- Vanden Bossche, J., et al. Alternatively activated macrophages engage in homotypic and heterotypic interactions through IL 4 and polyamine induced E cadherin catenin complexes. Blood. 114, 4664-4674 (2009).
- Van den Bossche, J., et al. Inhibiting epigenetic enzymes to improve atherogenic macrophage functions. Biochem Biophys Res Commun. 455, 396-402 (2014).
- Galvan Pena, S., O Neill, L. A. Metabolic reprograming in macrophage polarization. Frontiers in immunology. 5, 420 (2014).
- Zhu, L., Zhao, Q., Yang, T., Ding, W., Zhao, Y. Cellular metabolism and macrophage functional polarization. International reviews of immunology. 34, 82-100 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados