Method Article
실시간 세포 외 유출 분석을 사용하여 편광 M1과 M2 골수 유래 대 식세포의 대사 특성
요약
Metabolic reprogramming is a characteristic and prerequisite for M1 and M2 macrophage polarization. This manuscript describes an assay for the measurement of fundamental parameters of glycolysis and mitochondrial function in mouse bone marrow-derived macrophages. This tool can be applied to investigate how particular factors affect the macrophage’s metabolism and phenotype.
초록
Specific metabolic pathways are increasingly being recognized as critical hallmarks of macrophage subsets. While LPS-induced classically activated M1 or M(LPS) macrophages are pro-inflammatory, IL-4 induces alternative macrophage activation and these so-called M2 or M(IL-4) support resolution of inflammation and wound healing. Recent evidence shows the crucial role of metabolic reprogramming in the regulation of M1 and M2 macrophage polarization.
In this manuscript, an extracellular flux analyzer is applied to assess the metabolic characteristics of naive, M1 and M2 polarized mouse bone marrow-derived macrophages. This instrument uses pH and oxygen sensors to measure the extracellular acidification rate (ECAR) and oxygen consumption rate (OCR), which can be related to glycolytic and mitochondrial oxidative metabolism. As such, both glycolysis and mitochondrial oxidative metabolism can be measured in real-time in one single assay.
Using this technique, we demonstrate here that inflammatory M1 macrophages display enhanced glycolytic metabolism and reduced mitochondrial activity. Conversely, anti-inflammatory M2 macrophages show high mitochondrial oxidative phosphorylation (OXPHOS) and are characterized by an enhanced spare respiratory capacity (SRC).
The presented functional assay serves as a framework to investigate how particular cytokines, pharmacological compounds, gene knock outs or other interventions affect the macrophage’s metabolic phenotype and inflammatory status.
서문
대식 세포는 거의 모든 질환에서 핵심적인 역할을하지만, 그 표현형을 조절하는 분자 메커니즘은 아직 완전히 풀리지 아니다. 대 식세포는 높은 이질성을 표시하고 미세에 응답 한 다른 표현형을 채택한다. LPS (+ IFNγ)의 고전 (M1) 또는 M (LPS) 대 식세포는 염증을 촉진하고 미생물 위협이 다른 유형에 대한 호스트를 보호 활성화 유도 된. 기타 (M1)의 편광을 유도하는 자극으로 TNF와 단독으로 또는 조합 IFNγ을 사용합니다. IL-4 및 / 또는 IL-13은 대안 식세포 활성화를 유도하고 이러한 M2 또는 M (IL-4) 세포는 강력한 억제제 3 지속적인 면역 반응의 컨트롤러이다. 편광 대 식세포는 LPS 활성화 (M1)의 대 식세포가 강화 된 당분 4-6로 대사 스위치를 겪고과 세포 대사의 뚜렷한 규제를 표시합니다. 반대로, 향상된 지방산 산화 (FAO) 및 미토콘드리아 oxidativ전자 인산화 (OXPHOS)는 IL-4에 의한 M2의 대 식세포 7-9에서 지속적인 에너지를 제공합니다. 따라서, 변경 대사는 적절한 편광 및 염증 조절을위한 전제 조건뿐만 아니라, 편광 식세포 부분 집합의 특성도이다. 중요한 것은, 당분 또는 OXPHOS의 억제 / FAO는 각각 8, 10, M1 또는 M2 활성화를 저해하는 것으로 입증되었습니다. 이와 같이, 대 식세포의 식별 대사 변화는 편광 상태 및 염증 가능성을 평가하기위한 수단으로 적용될 수있다.
대식 세포 대사를 측정 일관된 분석 따라서 약물, 유전자 노크 여부를 예측하는데 사용될 수있는 다른 처리는 대 식세포 및 편광 기능에 영향을 미친다. 이 비디오에서는, 세포 외 플럭스 분석기는 순진, M1과 M2 대 식세포의 생체 에너지 프로파일을 특성화하는 데 사용됩니다.
이 원고는 측정 할 수 최적화 프로토콜 세부모든 관련 해당 작용 매개 변수 (해당 작용, 최대 당분과 당분 준비 제도 이사회)와 하나의 분석에서 미토콘드리아의 기능 특성 (총 호흡, 기초 미토콘드리아 호흡, ATP 생산, 양성자 누출, 최대 호흡 및 예비 호흡기 용량)의. 이 실험 장치를 사용하여 생체 에너지가 세포 (유전자 과발현 또는 약물 치료를 허물고 예를 들어 유전자) 제어 및 '변경'사이에 비교 될 수있다.
프로토콜
1. 배양 및 편광 골수 유래 대 식세포
- 날 0 : 관심의 6 ~ 10 주 된 쥐에서 격리 대퇴골과 경골 뼈 (이 분석에서 C57BL / 6).
- 뼈에서 근육 조직을 제거하고 얼음처럼 차가운 PBS로 가득 9cm의 페트리 접시에 뼈를 배치합니다.
- 70 % 에탄올로 가득 9cm 페트리 접시에 뼈를 전송하고 부드럽게 30 초 동안 판을 흔들.
- 얼음처럼 차가운 멸균 PBS로 가득 신선한 9cm 페트리 접시에 뼈를 전송합니다.
- 멸균 가위로 양쪽 끝에서 대퇴골과 경골을 잘라.
- 10 ML의 주사기와 25 G 바늘을 사용하여 10 ml의 얼음처럼 차가운 멸균 PBS와 뼈를 플래시합니다. 50 ㎖ 튜브에서 골수를 수집한다.
- 23 G 바늘을 이용하여 새 50 ㎖ 튜브에 골수 세포를 옮긴다.
- 25 G 바늘이 단계를 반복합니다. 참고 :이 단계는 세포 덩어리와 뼈 잔류 물을 제거하기 위해 필요하다.
- 4 ℃에서 5 분 300 XG에 원심 분리기.
- SUP 폐기ernatant 40 ml의 세포 배양 배지 (RPMI-1640 플러스 2 mM L- 글루타민, 10 % FCS, 페니실린 (100 U / ㎖), 스트렙토 마이신 (100 μg의 / ml) 및 15 % 여과 L-929 세포에서 세포를 재현 탁 ( ATCC, CCL-1) L-929 세포 조정 배지 대신에 M-CSF (또는 대안 10 NG / ㎖ 재조합 M-CSF를 포함 -conditioned 중).
참고 : L-929 세포 조절 매체의 생성을 2013 년 11 초 저널에 설명 된 - 문화 37 ° C, 5 % CO 2 배양기에서 접시 당 20 ml의 배지에서 두 15cm 페트리 접시 (대 식세포이 플라스틱으로 분리되지 않으므로 세포 배양 처리 플레이트를 사용하지 않는) 한 마우스에서 세포.
- 20 ㎖에게 이전 세포 배양 배지를 제거하지 않고, 제 3 일에 10 ㎖에게 신선한 세포 배양 배지를 추가한다.
- 이렇게 하루 6. 20 ml의 신선한 배양액 각 판의 기존 매체를 대체, 비 부착 세포도 제거됩니다.
- 8 일 :
- 그들에게 5m를 배양하여 세포를 분리(멸균 H 2 O 135 mM의 염화칼륨 플러스 15 MM의 구연산 나트륨,) 37 ° C에서 10 ml의 구연산 식염수와 10 ml의 PBS로 씻는다. 세포 계수기를 사용하여 8 일째에 성숙한 골수 유래 대 식세포 (BMDM)를 계산.
- 육안 검사 또는 유동 세포 계측법에 의해 성숙의 형성 (CD11b를 + F4 / 80 +) BMDM를 확인합니다. 100 μL PBS에서 20 분 동안 PBS에서 1/100 항 CD16 / CD32와 블록 10 5 세포, 실온에서 항 -CD11b-FITC 1/200 플러스 1/200 방지 F4 / 80-APC-Cy7으로 품어, 세척 및 유동 세포 계측법에 의해 분석한다.
참고 :. 배양 마우스 골수 유래 대 식세포는 잉 등 (11)에 의해 이전이 저널에 자세히 게시되었습니다.
- 시드 50,000 세포를 100 μl의 배지에서 세포 배양 용 마이크로 플레이트에 웰 당 (최적의 세포 수는 최적화 될 필요가있다). 배경 보정 우물 (A1, A12, H1, H12)에서 세포를 씨와이 우물 만 매체 (어떤 세포)를 넣어하지 마십시오 팁 :. 각도에서 피펫을 잡고중간에 가장 균일 한 세포 층의 우물의 측면 아래로 한판 승부.
- 세포를 1 시간 동안 세포 배양 후드에서 실온에서 정착 할 수있다. 이것은 세포의 분포를도 홍보하고 가장자리 효과를 줄일 수 있습니다. 37 ° C, 5 % CO 2 인큐베이터에서 현미경과 문화를 사용하여 준수를 모니터링합니다.
- 세 HR 도금 후, 10 NG / ㎖ LPS 또는 NG 20 / 24 시간 동안 세포를 자극 ml의 IL-4는 각각 M1 또는 M2 식세포를 생성하는 재조합 마우스. 제어와 같은 치료 순진한 (M0) 대 식세포를 포함합니다. IL-6, IL-12의 LPS 유도 된 분비를 측정하여 적절한 M1 및 M2 식세포 편광을 평가 TNF (ELISA) 및 IL-4 유도 된 아르 기나-1 활성 및 / 또는 MMR (CD206) 및 MGL (CD301) 표면 발현 이전 3,11 설명 된대로 (유동 세포 계측법).
참고 :이 시점에서, 세포 (사전)이 될 수있는 다른 요소로 자극 할 수 있습니다 관심 또는 대 식세포의 약리 화합물로 처리 한. 때문에에게 별도의 우물 사이의 변화는 서브 수 있습니다tantial, 그것은 조건 당 최소 4 이상적으로 6 우물을 사용하는 것이 좋습니다.
세포 외 플럭스 분석 2. 준비
- 일일 분석을 실행하기 전에 센서 카트리지를 수화물 :
- 다음 유틸리티 판에 거꾸로 센서 카트리지를 놓습니다.
- calibrant 용액 200 μL와 유틸리티 플레이트의 각 웰을 채우고 calibrant 용액에 센서를 침지 유틸리티 판에 센서 카트리지를 하향 조정한다.
- calibrant 솔루션 수준이 아닌 CO 2 37 ° C 배양기 O / N에서 침수 센서와 위치를 유지하기에 충분히 높은 확인합니다.
- 다음 분석의 일에 분석 배지를 제조 :
- 37 ° C에서 따뜻한 50 ㎖ XF 기본 매체.
- 2 mM의 최종 농도를 얻기 위해 500 μL 200 밀리미터 L- 글루타민을 추가합니다.
- 1 N의 NaOH를 사용하여 7.4으로 산도를 조정하고 0.2 μm의 필터를 소독하고 37 ℃에서 분석 매체를 유지합니다.
- 부드럽게 편광 식세포에서 세포 배양 배지를 제거하고, 나중에 사용하기 위해 -20 ℃에서 보관 (예를 들어 ELISA 적절한 식세포 편광을 조사하기 위해). 100 μL 분석 매체와 세포를 씻으 잘 당 180 μL 분석 매체를 추가하고 세포가 씻겨되지 않은 현미경으로 확인합니다. 분석을 실행하기 전에 1 시간 동안 이산화탄소없이 37 ° C를 인큐베이터에있는 세포 배양 접시를 놓습니다.
- 37 ° C에, 표 1에 따뜻한 바와 같이 D까지 10 × 주입 화합물의 혼합물을 준비, 7.4 및 필터 소독하여 pH를 조정합니다.
- 10 배에서 세포 배양 웰에 최종 농도가 이들의 혼합물의 모든 화합물을 확인하고 각각의 세포 유형에 대해 이러한 농도를 최적화한다.
- 포트 A, B, C 및 D, respe에서 제조 된 10 배 주입 화합물의 혼합물을 표시된 양 (표 1)과 함께 제공되는 가이드로드를 사용하여 센서 카트리지를 장착ctively.
| 혼합 / 사출 | 화합물 | 볼륨은 10 배 혼합물 (μL)를 얻기 위해 추가 | 볼륨 분석 중간 (㎖) | 실행 중에 주입 볼륨 (μL) | 분석에서 최종 농도 |
| 에이 | 2.5 M (45 %) 포도당 | (300) | 2.7 | (20) | 25 mM의 |
| 비 | oligomycin 5 밀리미터 (OM) | 9 | 3.0 | (22) | 1.5 μM |
| 기음 | 5 mM의 FCCP | 9 | 2.7 | (25) | 1.5 μM |
| 100 mM의 나트륨 피루브산 솔루션 | (300) | 1 밀리미터 | |||
| 디 | 5mM의 antimycin (AA) | (15) | 3.0 | (28) | 2.5 μm의 |
| 5 MM의 로테 논 (ROT) | 7.5 | 1.25 μM |
표 1. 사출의 혼합물을 포함한다.
세포 외 유출 분석기를 사용하여 편광 M1과 M2 BMDM 3. 바이오 에너지 특성화
- 2 분 MIX 3 분 법안 시간과 (적어도) 3 혼합 및 속도 측정과 분석 마법사를 사용하여 분석 템플릿을 작성하면 4 주사의 각 전 (표 1)과 마지막 주사 후 반복합니다.
주의 : 이러한 농도는 골수 유래 대 식세포 및 RAW264.7 대 식세포 세포주에 적용되어, 각각의 세포 유형에 대해 최적화되어야한다. FCCP 혼합물에 첨가 피루브산은 호흡의 최대 연료 필요하다. - 시작 바닥을 눌러 실행을 시작하고 장치의 지침을 따르십시오. 차 우선로드수화 프로브 리지 판은 장치 및 다음로드 셀 플레이트에 의해 보정을 허용합니다.
- 분석 후에,주의 깊게 분석 배지를 버리고 공급자 상세히 기술 된 바와 같이 세포 증식 분석 키트를 이용하여 미래의 휴대 정상화 -20 ° C에서 분석 된 세포 배양 용 마이크로 플레이트를 저장한다.
- 간단히, 증류수 성분 B 20 배 희석 1 배 세포 용해 완충액을 제조하고 화합물 1X 세포 용해 완충액에 400 배 희석. 물론 당 200 μl를 추가 실온에서 5 분 품어와 ~ 180 nm의 여기와 ~ 520 nm의 방출 최대와 형광을 측정한다.
주 : 비 부착 세포 작업시 또는 불량한 부착이 우려,이 프로토콜은 모든 분석 배지를 폐기 요구하지 않기 때문에 직접적인 세포 증식 키트가 대안으로 이용 될 수있는 경우이다. 그러나,이 직접 프로토콜은이 실험실에서 사용되는 프로토콜에 비해 약간 덜 민감하다.
- 간단히, 증류수 성분 B 20 배 희석 1 배 세포 용해 완충액을 제조하고 화합물 1X 세포 용해 완충액에 400 배 희석. 물론 당 200 μl를 추가 실온에서 5 분 품어와 ~ 180 nm의 여기와 ~ 520 nm의 방출 최대와 형광을 측정한다.
- 형광 측정 한 후, 정상화각각의 세포 수 및 모든 나이브 식세포 웰의 평균 세포 수는 1로 설정되어있는 비율.
(예 BCA 분석을 사용하여) 단백질 정량 세포 카운트를 정규화하는 다른 방법으로 사용될 수있다 : 참고. 그러나, 우리의 손이 분석은 세포 증식 분석 키트에 비해 덜 민감했다.
결과
세포 외 플럭스 분석 및 세포 정량화 끝나면 데이터 세포 수에 대한 정규화 및 분석 될 수있다. 도 1a 및도 1b에 도시 된 바와 같이, 이것은 일반적 ECAR 및 OCR 플롯을 산출 할 것이다.
혈당 (A)의 주사 후, ECAR의 증가는 해당 작용 속도를 나타낸다. oligomycin (B)와 ATP 합성 효소 억제 후 ECAR의 추가 증가는 당분 예약 및 용량 (그림 1A)에 대한 정보를 제공합니다. OCR 값을 분석 할 때, 주사 (B) oligomycin 미토콘드리아 ATP 합성에 사용되는 산소 소비량의 계산을 허용한다. FCCP (C)는 미토콘드리아 호흡으로 분리하고 해당 OCR 측정은 최대 및 예비 호흡 능력에 대한 데이터를 얻을 수 있습니다. 마지막으로, 로테의 주입 (ROT) 및 antimycin의 (AA)는 미토콘드리아 복잡한 I를 차단하고 III 잔류 OCR은 비 미토콘드리아의 산소 단점을 나타냅니다umption (그림 1B).
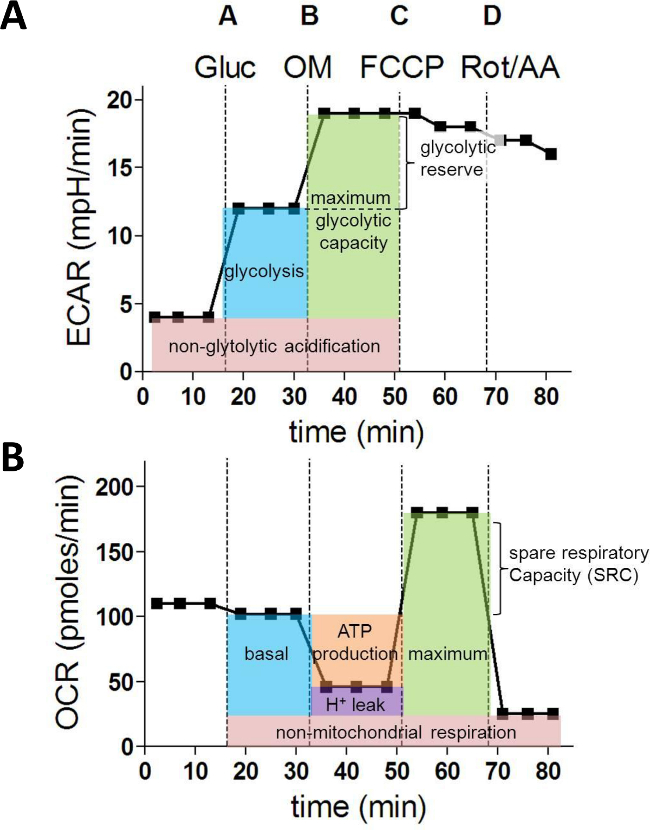
그림 1 : XF 세포 외 플럭스 분석에서 파생 된 대사 매개 변수를 설정합니다. (A)는 세포의 당분의 다음 매개 변수 (MPH / 분에서) ECAR 값으로부터 계산 : 해당 작용, 최대 당분 해 능력과 당분 예약. 기초 호흡, ATP 생산, 양자 누출, 최대 예비 호흡 및 호흡 용량 (pmole의 / 분)에서 (B) OCR 측정은 미토콘드리아 기능의 다음의 기본 파라미터를 계산하는 데 사용된다. Gluc = 포도당; OM = oligomycin; FCCP = 카르 보닐 시안화 4- (트리 플루오 로메 톡시) 페닐; AA = antimycin의; 부패 = 로테 논은 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
실행 한 후, ECAR 및 OCR 측정 1 틸다음 ECAR 측정으로부터 각각의 웰에 대한 L (15)은 엑셀에 수출 할 수 있고, 다음 파라미터는 당분 해 계산 될 수있다 :
비 당분 산성화 = 평균. ECAR (1,2,3)
당분 = 평균. ECAR (4,5,6) - 평균. ECAR (1,2,3)
최대 당분 용량 = 평균. ECAR (7,8,9) - 평균. ECAR (1,2,3)
당분 예약은 평균을 =. ECAR (7,8,9) - 평균. ECAR (4,5,6)
OCR 레이트에서 다음 대사 특성이 결정될 수있다 :
비 미토콘드리아 호흡 = 평균. OCR (13,14,15)
기저 호흡 = 평균. OCR (4,5,6) - 평균. OCR (13,14,15)
ATP 생산 = 평균. OCR (4,5,6) - 평균. OCR (7, 8, 9)
양성자 누출 =평균. OCR (7,8,9) - 평균. OCR (13,14,15)
최대 호흡 = 평균. OCR (10,11,12) - 평균. OCR (13,14,15)
예비 호흡기 용량 (SRC) = 평균. OCR (10,11,12) - 평균. OCR (4,5,6)
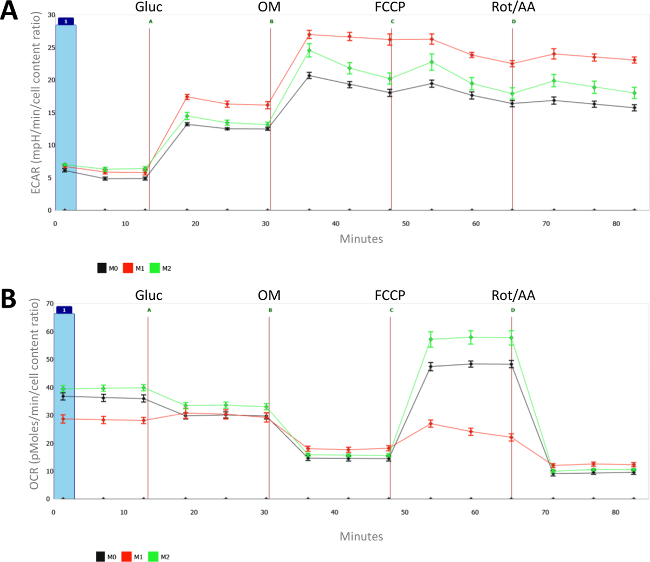
그림 2 :. 순진한의 대사 특성 (M0), LPS- (M1) 및 IL-4- (M2) 편광 식세포 8 개인 우물의 평균 (SEM)의 각각의 측정, 평균과 표준 오류가 표시됩니다. (A) 세포 외 산성화 속도 (시속 / 분에서 ECAR)와 (B) 산소 소비 속도 (OCR, pmole의 / 분)에 차등 편광 (M1 및 M2) 및 순진한 대 식세포 (M0)를 측정한다. (CyQUANT로 측정) 및 나이브 식세포 평균 셀 카운트에서 1로 설정 한 모든 측정은 세포 수에 대한 정규화 된이 켜졌 = 포도당; B = oligomycin; C = FCCP; D는 antimycin의 A + 로테 논을 =. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
도 2a에 도시 된 바와 같이, LPS와 대 식세포의 활성화는 당분 해 대사를 증가 유도한다. 도 2b에서 산소 소비율 (OCR)을 볼 때 LPS와 IL-4 처리 된 대 식세포의 차이는 더욱 명백하다. 최대 산화 대사가 높은 M (LPS)로 억제하면서 실제로, IL-4는 M2 식세포에 기초 특히 최대 호흡을 유도한다. 하나는 증가 당분이 M (LPS) 대 식세포에 오히려 고유하며 M (IFNγ) 대 식세포가 해당 작용을 강화 표시되지 않기 때문에 반드시 M1의 대 식세포의 특성 않음을 유의해야한다.
전반적으로,이 세포 외 플럭스 분석은 그쪽을 보여줍니다LPS 활성화 된 대 식세포 디스플레이 당분 해 대사를 개선하고 예비 호흡 능력을 가지고 있지 않는 반면, t, M2 식세포 향상된 산화 대사를 특징으로하고, 특히 높은 예비 호흡 용량 (SRC)되는 IL-4 유도.
토론
우리 실험실의 목적은 대 식세포 편광 기능이 죽상 동맥 경화증 및 기타 염증성 조건 (12)의 결과를 향상시킬 수있는 궁극적 인 목표에 영향을받을 수있는 방법을 이해하는 것입니다. 대식 편광을 평가하기 위해, 하나의 전형적 LPS (+ IFNγ) - 유도 및 M1과 M2의 마커 유전자 (qPCR에)의 유전자 발현 IL-4 유도 된 측정은 ELISA에 의해 IL-6, IL-12, TNF 및 NO 분비 (결정 과은 Griess 반응) 및 IL-4에 의한 CD71, CD206, CD273 및 CD301 표면 유동 세포 계측법에 의해 식 ()와 아르 기나 활동 3,13을 검사합니다. 또한, (DII-oxLDL 흡수, LipidTOX 중성 지질 염색) 및 거품 세포 형성 분석 (형광 라텍스 비드 및 / 또는 pHrodo 대장균)와 식세포 작용 분석 (어 넥신 V / PI 염색법으로) 세포 자멸사 분석법에 수행 될 수있다 대 식세포의 기능 (14)을 평가한다. 또한, 세포 외 플럭스 분석 생체 에너지를 편광 MAC의 프로파일을 측정하기 위해 수행 될 수있다새로운 대체 기능 판독으로 rophages.
이 원고 식세포 편광 그들의 에너지 원으로 증가 당분 전환 LPS 유도 된 대 식세포와 대사 리 프로그래밍을 유도하는 것을 나타낸다. 반대로, IL-4에 의한 M2의 대 식세포는 ATP의 주요 소스로 미토콘드리아의 산화 적 인산화를 사용합니다. 중요한 것은, 대사 재 프로그래밍뿐만 아니라 M1과 M2 편광 대 식세포의 특정 요구 사항에 에너지를 제공합니다. 실제로, 대사 변화는 대 식세포 표현형 10,15,16의 직접 규제이다 대사 산물 농도에 영향을 미친다. 또한 별개의 식세포 편광 상태의 드라이버 (도 2에 여기에 도시 된 바와 같이)이 새로운 기술은 지난 몇 년 동안 immunometabolism 조사 영역의 급속한 성장을 지원 따라서, 식세포 대사뿐만 아니라 특성이다.
그러나, 매크로 대사 프로파일의 강력한 측정파지는 어려운 남아 있고 자신의 한계를 가지고 있었다. 본 연구에서는 세포 외 플럭스 분석기는 견고하게 실시간으로 당분, 당분 보유, 최대 당분 용량, 비 당분 산성화, 기초 및 최대 호흡, ATP 생산, 예비 호흡기 용량, 양자 누출 및 비 미토콘드리아 호흡을 측정하기 위해 적용 대 식세포의 최소량.
따라서, 우리는 다음과 같이 수정 제조자의 프로토콜을 개선 하였다. 표준 미토 스트레스 테스트 (# 103015-100)은 포도당과 피루브산과 3 주사 (OM, FCCP, AA / ROT)와 프로토콜과 매체를 이용하여 제안합니다. 우리는, 글루코스 / 피루 베이트 배지와 분석을 시작 (해당 작용 스트레스 시험 # 103,020에서 100 사이에서 등) 포트의 제 주입 포도당을 추가하고 이러한 방식으로 포트 C.에서 FCCP의 uncoupler 함께 피루브산을 추가하도록 선택할 모든 관련 해당 작용 파라미터 ECAR 측정 1-9 mitochondri 대한 모든 관련 정보로부터 유도된다OCR 측정 4-15에서 알 기능.
이 언 커플 링에 최대 호흡을 연료로 FCCP와 함께 피루브산을 주입하는 것이 중요합니다. 이 조합 된 프로토콜을 사용하기 전에, 하나는 2- 데 옥시 -D- 글루코스 (2-DG)는 기저 값 (1-3)을 분석 한 후 ECAR 수준을 낮추는 것을 확인해야하며, 기록 ECAR 레이트 4-6 실제로 기인 것을 해당 작용한다. 또한, 사람은이 원고에 사용되는 화합물의 농도와 세포 수는 골수 유래 대 식세포 및 RAW264.7 대 식세포 세포주에 유효하며, 다른 세포 유형에 대해 최적화되어야한다는 것을 이해한다. 또한, 하나는 골수 유래 대 식세포를 생성하는 데 사용되는 M-CSF는 (M2)과 같은 항 염증 표현형을 촉진 있음을 알아 두셔야합니다. 골수 유래 대 식세포에서 제시된 결과는 따라서 세포 culturi 동안 M-CSF를 필요로하지 않는 차 조직 상주 식세포 또는 대식 세포주와 측정에 완벽하게 비교할 수 없습니다 수 있습니다NG.
기존의 방법에 비해,이 프로토콜은 대 식세포의 최소량을 요구하고 신속 거의 모든 대사 기본적인 전지 특성을 제공한다. 이것은 다른 면역 분석법 및 생체 에너지 프로파일 링에 사용되는 셀에도 여전히 다른 목적의 분석 후에 사용될 수를 수행하기에 충분한 잉여 셀을 초래한다. 또한, 특히 96 웰 플레이트 형식으로 동시에 실시간으로 여러 조건을 평가할 수있다. 그러나, 개별 웰 사이의 변화는 상당한 따라서 조건 당 적어도 4 웰의 사용은 종종 바람직하다 할 수있다. 계정에 이러한 제한을 촬영, 설명 세포 외 플럭스 분석은 여전히 10 개 이상의 실험 조건을 실행할 수 있습니다 (N = 6) 기존의 기술보다 훨씬 더 인, 한 번에.
전반적으로,이 문서는 모든 관련 해당 작용과 미토콘드리아 PARAM을 측정 할 수있는 쉽고 재현성 기능 분석을 제공합니다편광 식세포의 부분 집합에 eters. 이 기술은 대 식세포의 기능을 평가하고 대 식세포의 (대사) 표현형에 서로 다른 조작의 효과 (예를 들어 유전자 허물고, 새로운 의약품 등)을 평가하기 위해 미래의 응용 프로그램 역할을 할 수 있습니다. 이와 같이, 플럭스 외 데이터는 대 식세포 활성화 상태의 심층 특성화를 허용하도록, 다른 분석과 함께 사용될 수있다.
공개
이 기사에 대한 무료 액세스는 해마 바이오 사이언스가 후원한다.
감사의 말
Jan Van den Bossche received a Junior Postdoc grant from the Netherlands Heart Foundation (2013T003) and a VENI grant from ZonMW (91615052). Menno de Winther is an Established Investigator of the Netherlands Heart Foundation (2007T067), is supported by a Netherlands Heart Foundation grant (2010B022) and holds an AMC-fellowship. We also acknowledge the support from the Netherlands Cardiovascular Research Initiative, Dutch Federation of University Medical Centers, the Netherlands Organization for Health Research and Development and the Royal Netherlands Academy of Sciences for the GENIUS project “Generating the best evidence-based pharmaceutical targets for atherosclerosis” (CVON2011-19). We acknowledge Seahorse Bioscience for making open access publication possible. The authors thank Riekelt Houtkooper and Vincent de Boer (Laboratory Genetic Metabolic Diseases, Academic Medical Center, Amsterdam, The Netherlands) for all previous assistance with the Seahorse analyzer.
자료
| Name | Company | Catalog Number | Comments |
| 23G and 25G needles | Becton Dickinson | #300800 and #300600 | To flushed bone marrow |
| 10 ml syringes | Becton Dickinson | #307736 | To flushed bone marrow |
| Petri dishes | Greiner | #639161 | To culture bone marrow cells |
| CyQUANT Cell Proliferation Assay kit | Molecular Probes | #C7026 | For cell quantification at a later time point (works only for adherent cells) |
| CyQUANT Direct Cell Proliferation Assay kit | Molecular Probes | #35011 | For cell quantification immediately after assay (non-adherent cells) |
| XFe96 cell culture microplate | Seahorse Bioscience | #101085-004 | 96 well plate in which cells are cultured and in which assay is done |
| recombinant mouse interleukin-4 (IL-4) | Peprotech | #214-14-B | Used to induced alternative macrophage activation |
| lipopolysaccharide (LPS) | Sigma | #L2637 | Pro-inflammatory stimulus |
| Seahorse Sensor Cartridge | Seahorse Bioscience | #102416-100 | Contains the probes for pH and O2 measurement |
| Seahorse XF Calibrant | Seahorse Bioscience | #100840-000 | Needed to hydrate the probes overnight |
| XF base medium | Seahorse Bioscience | #102353-100 | Buffer-free medium that allows efficient measurement of pH changes |
| L-glutamine | Life Technologies | #25030-081 | |
| D-(+)-Glucose | Sigma | #G8769 | Fuels glycolysis once added to the cells |
| oligomycin A | Sigma | #75351 | Inhibits mitochondrial ATP synthase |
| FCCP( Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone) | Sigma | #C2920 | Uncouples mitochondrial respiration |
| 100 mM Sodium Pyruvate solution | Lonza | #BE13-115E | Allows maximal mitochondrial respiration without the need for glycolysis |
| Antimycin A | Sigma | #BE13-115EA8674 | Inhibits complex III of the mitochondria |
| Rotenone | Sigma | #BE13-115EA8674R8875 | Inhibits complex I of the mitochondria |
| Casy Cell Counter | Roche Diagnostics | #05 651 697 001 | Instrument to count cells |
| anti-CD16/CD32 | eBioscience | #14-0161 | Fc receptor block flow cytometry |
| anti-F4/80-APC-eFluor780 | eBioscience | #47-4801 | Antibody to stain macrophages |
| anti-CD11b-FITC | eBioscience | #11-0112 | Antibody to stain macrophages |
참고문헌
- Murray, P. J., et al. Macrophage activation and polarization: nomenclature and experimental guidelines. Immunity. 41, 14-20 (2014).
- Hoeksema, M. A., et al. IFN gamma Priming of Macrophages Represses a Part of the Inflammatory Program and Attenuates Neutrophil Recruitment. J Immunol. , (2015).
- Vanden Bossche, J., et al. Pivotal Advance Arginase 1 independent polyamine production stimulates the expression of IL 4 induced alternatively activated macrophage markers while inhibiting LPS-induced expression of inflammatory genes. Journal of leukocyte biology. 91, 685-699 (2012).
- Pearce, E. L., Pearce, E. J. Metabolic pathways in immune cell activation and quiescence. Immunity. 38, 633-643 (2013).
- Yang, L., et al. PKM2 regulates the Warburg effect and promotes HMGB1 release in sepsis. Nature communications. 5, 4436 (2014).
- Freemerman, A. J., et al. Metabolic reprogramming of macrophages glucose transporter 1 (GLUT1) mediated glucose metabolism drives a proinflammatory phenotype. The Journal of biological chemistry. 289, 7884-7896 (2014).
- Tavakoli, S., Zamora, D., Ullevig, S., Asmis, R. Bioenergetic profiles diverge during macrophage polarization implications for the interpretation of 18F FDG PET imaging of atherosclerosis. J Nucl Med. 54, 1661-1667 (2013).
- Vats, D., et al. Oxidative metabolism and PGC 1beta attenuate macrophage mediated inflammation. Cell metabolism. 4, 13-24 (2006).
- Huang, S. C., et al. Cell intrinsic lysosomal lipolysis is essential for alternative activation of macrophages. Nature immunology. 15, 846-855 (2014).
- Tannahill, G. M., et al. Succinate is an inflammatory signal that induces IL 1beta through HIF 1alpha. Nature. 496, 238-242 (2013).
- Ying, W., Cheruku, P. S., Bazer, F. W., Safe, S. H., Zhou, B. Investigation of macrophage polarization using bone marrow derived macrophages. J Vis Exp. (76), (2013).
- Hoeksema, M. A., et al. Targeting macrophage Histone deacetylase 3 stabilizes atherosclerotic lesions. EMBO Mol Med. 6, 1124-1132 (2014).
- Vanden Bossche, J., et al. Alternatively activated macrophages engage in homotypic and heterotypic interactions through IL 4 and polyamine induced E cadherin catenin complexes. Blood. 114, 4664-4674 (2009).
- Van den Bossche, J., et al. Inhibiting epigenetic enzymes to improve atherogenic macrophage functions. Biochem Biophys Res Commun. 455, 396-402 (2014).
- Galvan Pena, S., O Neill, L. A. Metabolic reprograming in macrophage polarization. Frontiers in immunology. 5, 420 (2014).
- Zhu, L., Zhao, Q., Yang, T., Ding, W., Zhao, Y. Cellular metabolism and macrophage functional polarization. International reviews of immunology. 34, 82-100 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유