Method Article
Claro conduzido enzimática descarboxilação
Neste Artigo
Resumo
Nós descrevemos um protocolo para a geração de luz catalisada de peróxido de hidrogênio - um co-fator para transformações oxidativas.
Resumo
Oxirredutases pertencem às enzimas industriais mais-aplicadas. No entanto, eles precisam de elétrons externos cujo fornecimento é muitas vezes caro e desafiador. Reciclagem do NADH ou NADPH doadores de electrões requer a utilização de outros enzimas e substratos sacrificiais. Curiosamente, vários Oxirredutases aceitar peróxido de hidrogénio como doador de elétrons. Apesar de ser pouco dispendioso, este reagente, muitas vezes reduz a estabilidade das enzimas. Uma solução para este problema é a geração in situ do cofactor. O fornecimento contínuo da co-factor, a baixa concentração conduz a reacção sem prejudicar a estabilidade da enzima. Este trabalho demonstra um método para a luz catalisada por geração in situ de peróxido de hidrogénio com o exemplo da descarboxilase de ácido gordo dependente do heme OLET JE. O descarboxilase do ácido graxo OLET JE foi descoberto devido à sua capacidade única de produzir de cadeia longa 1-alcenos de ácidos graxos, uma enzimática até então desconhecidoreação. 1-alcenos são aditivos amplamente utilizado para plastificantes e lubrificantes. OLET JE foi mostrado para aceitar electrões a partir de peróxido de hidrogénio para a descarboxilação oxidativa. Embora a adição de peróxido de hidrogênio danos a enzima e resulta em rendimentos baixos, a geração in situ do cofator contorna este problema. O sistema photobiocatalytic mostra vantagens claras sobre a actividade da enzima e o rendimento, o que resulta em um sistema simples e eficiente para a descarboxilação de ácido gordo.
Introdução
A mudança climática eo esgotamento previsível dos recursos renováveis constitui uma ameaça grave para a nossa sociedade. Neste contexto, catálise enzimática representa um potencial ainda não plenamente exploradas para o desenvolvimento de sustentável e mais "verde" química 1. Oxidorredutases tem a capacidade de catalisar a introdução e a modificação de grupos funcionais sob condições de reacção suaves e pertencem às mais importantes biocatalisadores 2. A maioria das transformações redox requer o fornecimento de externa de co-factores, tais como o NAD (P) H. Métodos para a regeneração do cofactor foram aplicadas em escala industrial. No entanto, eles ainda resultar em elevados custos de processo, o que limita a sua aplicação principalmente para produtos de alto valor. Curiosamente, várias peroxidases 3,4 e P450 monooxigenases 5 aceitar electrões a partir de peróxido de hidrogénio por meio do assim chamado peróxido de derivação. Enquanto H 2 O 2 é um co-reagente mais barato, que é declaradamente inseUL para muitas enzimas. A constante formação in situ de baixas concentrações de peróxido de hidrogénio é uma abordagem viável para conduzir a reacção, sem prejudicar a estabilidade operacional da enzima.
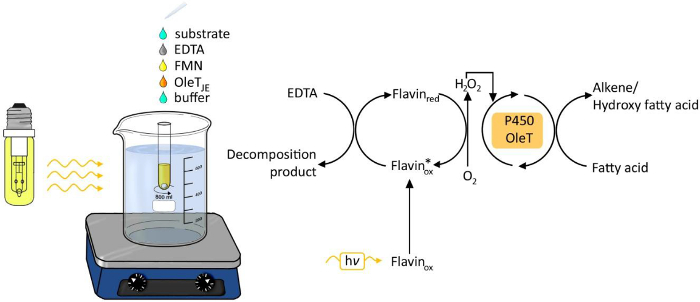
Figura 1. Experimental set-up do decarboxylation photobiocatalytic de ácidos graxos por OLET JE. Por favor clique aqui para ver uma versão maior desta figura.
O uso da luz como fonte de energia para processos químicos e biológicos tem vindo a receber cada vez mais atenção nos últimos anos 6. Geração de luz dirigido de peróxido de hidrogénio tem surgido como um método fácil e robusto para fornecer peróxido de hidrogénio para transformações redox (Figura 1). Um fotocatalisador tais como flavina adenina seg.onucleotide (FMN) permite a redução de oxigénio molecular em peróxido de hidrogénio, o qual é então utilizado como co-factor para a reacção enzimática oxyfunctionalization. Os doadores de electrões possíveis são o ácido etilenodiaminotetracético (EDTA), ácido ascórbico ou o formiato de baixo custo. O método é geralmente aplicável para a H 2 O 2 enzimas dependentes, incluindo as peroxidases 3,4 e P450 monooxigenases 5.
Nós temos investigado recentemente a aplicação de um novo descarboxilase bacteriana 7 para a transformação de gorduras naturais em olefinas 8. Esta seria uma rota sustentável para a síntese de produtos químicos de plataformas amplamente utilizado a partir de uma fonte de base biológica. O descarboxilase OLET JE a partir da bactéria Jeotgalicoccus sp gram-positiva. catalisa a descarboxilação oxidativa de ácidos gordos e forma 1-alcenos como produtos. OLET JE está intimamente relacionado com monooxigenases P450 bacterianas e precisa de elétrons fperóxido de hidrogénio ROM para a reacção.
Infelizmente, a adição de H 2 O 2 a uma solução de substrato e enzima resultou em conversões baixas e uma fraca reprodutibilidade dos resultados, presumivelmente devido a um efeito prejudicial de peróxido de hidrogénio sobre a estabilidade do OLET JE. Geração de uma proteína de fusão com a NADPH-reductase RhFred fez uma descarboxilação dependente de NADPH possível. 9 No entanto, o alto preço do NADPH e as actuais possibilidades limitadas de uma regeneração econômica nos levou a investigar doadores de elétrons mais baratos. Inspirado pela semelhança de OLET JE com monooxigenases P450, utilizou-se a geração de luz catalisada de H 2 O 2. Tivemos o prazer de obter altas conversões (até> 95%), utilizando extratos de células livres ou soluções enzimáticas purificadas.
Com o exemplo de descarboxilação de ácidos graxos, apresentamos um protocolo geral para enzym-driven luztransformações redox atic usando FMN como fotocatalisador e peróxido de hidrogênio como co-fator. Os métodos apresentados incluem a produção da enzima recombinante em células de E. coli, a purificação da enzima, a aplicação para a síntese de 1-alcenos e a análise dos produtos de reacção.
Protocolo
Cuidado: Por favor, consulte todas as folhas de dados de segurança pertinentes (MSDS) antes do uso. Muitos dos produtos químicos usados nestas sínteses são altamente tóxicos e cancerígenos. Todas as etapas que envolvem solventes orgânicos prejudiciais à saúde, especialmente a extração dos produtos da reacção e da derivação de ácidos graxos deve ser realizado sob um exaustor utilizando equipamentos de proteção individual (óculos de segurança, luvas, jaleco, calças compridas, sapatos fechados ). Todas as operações que envolvam organismos geneticamente modificados neste trabalho necessitam de instalações que são aprovados para a manipulação de organismos geneticamente modificados do S1 nível de segurança.
1. A expressão da descarboxilase recombinante em E. OLET JE coli
- Preparação da estirpe de produção
- Preparar um gene sintético de JE a partir OLET Jeotgalicoccus e clonado no vector de expressão de pASK-IBA37plus como descrito. 8
NOTA: Para evitar a degradação de ácidos graxos por enzimas do metabolismo bacteriano, E. foi usada coli estirpe JW5020 da coleção Keio com um caminho disfuncional para a degradação de ácidos graxos.
- Preparar um gene sintético de JE a partir OLET Jeotgalicoccus e clonado no vector de expressão de pASK-IBA37plus como descrito. 8
- O cultivo e a indução da expressão da enzima
- Prepara-se uma pré-cultura por inoculação a E. coli JW5020 OLET mutante a partir de uma placa de LB-(contendo 100? g ml-1 de ampicilina) em dois 3 ml de LB médio em tubos de ensaio. Pipeta ampicilina (100 ug mL-1) a partir de uma solução de estoque para o meio de selecção e incubar a 37 ° C durante 15 h num incubador com agitação a 180 rpm.
- Adicionar 2 ml das pré-culturas para dois 200 ml de LB médio, contendo ampicilina (100 ug mL-1), em frascos de 1 L de agitação. A incubação decorre a 37 ° C e 180 rpm.
- Monitorar a mudança de 600nm OD após a inoculação. Quando a DO600 atinge um valor entre 0,6 umd 0,8 induzir a expressão por adição de tetraciclina (0,2 mg ml-1). Incubam-se as culturas durante 15 horas a 20 ° C e 180 rpm.
Observação: Uma vez que OLET JE contém um cofactor do heme, é necessária a adição de ácido levulínico δ-amino (0,5 mM) antes da indução para proporcionar a cultura com um precursor para a síntese do co-factor.
- A lise celular
- Realizar os seguintes passos no gelo. Transferir as culturas por decantação ou pipetagem para tubos de centrífuga e usar uma escala para assegurar a igualdade de distribuição. Centrifugar as culturas durante 20 min a 12000 xg, a 4 ° C.
- Cuidadosamente descartar o sobrenadante e ressuspender as pelotas em 50 ml de tampão (Tris 50 mM, NaCl 200 mM, pH 7,5) por pipetagem e transferir a suspensão em um tubo de centrífuga cónico.
- Após centrifugação durante 15 min a 4000 xg, a 4 ° C descartar o sobrenadante, ressuspender cada sedimento em 3 ml de tampão por pipetagem.
- Realizar a lise celular por assimnicar as soluções em gelo (três ciclos x 30 s), deixando uma pausa de 1 min entre os ciclos. Centrifugar as soluções durante 20 minutos a 15000 xg, a 4 ° C para remover os restos de células e transferir o sobrenadante para um tubo de centrifugação cónico, sem perturbar o sedimento por pipetagem. Descartar o sedimento.
NOTA: Uma fracção de solvente será utilizado directamente para a biocatálise depois de moléculas pequenas são removidos. A segunda fracção irá ser utilizada para a purificação do OLET JE marcada com His.
- A remoção de pequenas moléculas de adesão célula-extractos
- Antes de utilizar o extracto em bruto na biocatálise remover pequenas moléculas que possam interferir com a formação de peróxido de hidrogénio ou a transferência de electrões por pipetagem 3 ml de extracto isento de células numa unidade de filtro de centrifugação, utilizando uma membrana de 10 kDa e centrifugar a 4000 xg, a 4 ° C. Ressuspender a proteína restante em 3 ml de Tris-HCl-tampão.
- A purificação do OLET
- Aplicar 3 ml de extracto celular a segunda aos Seus colunas de giro Pur Ni-NTA, que tenham sido equilibrada antes com tampão de equilíbrio (Tris 20 mM, NaCl 300 mM, imidazol 10 mM).
- Selar as colunas com os plugues de fundo e parafuso-tampões superiores e agitá-los levemente até que a resina é distribuído igualmente com o extrato livre de células. Incubar as colunas carregadas durante 30 min num agitador vertical, a 4 ° C.
- Lavam-se as colunas com 1 ml de tampão de lavagem (Tris 20 mM, NaCl 300 mM, imidazol 20 mM, pH 7,4) por centrifugação a 700 xg durante 2 min. Repita esta etapa duas vezes.
- Colocar as colunas para um tubo de centrifugação cónico fresca e adicionar 1 ml de tampão de eluição (Tris a 20 mM, NaCl 300 mM, imidazol 250 mM, pH 7,4) OLET JE. Centrifugar a 700 xg durante 2 minutos e repita esta etapa duas vezes.
NOTA: Imidazole se ligará ao níquel e, assim, remover OLET JE a partir da coluna. - Transfira a eluição de uma unidade de filtro de centrífuga (10 mem kDabrana) e centrifugar a 4000 xg, a 4 ° C para remover o imidazole.
- Verifique a pureza da enzima por um SDS-PAGE (15%). 9 3 ul da mistura da eluição com um tampão de SDS-(1x concentração final) e incubar a solução a 95 ° C durante 5 min para a desnaturação. Subsequentemente aplicam-se a quantidade total de uma SDS-PAGE. Submeter o gel a 35 mA utilizando um padrão de proteína comerciais. Detectar a proteína de 50 kDa.
- Para determinar a concentração de proteína disponível usar um BSA-kit comercial. Pipetar 50 ul de amostras de proteína (diluído 1: 100, 1: 200, 1: 500) e o padrão de BSA (0, 20, 30, 40,50, 60, 80, 100 mg mL -1) em uma placa de 96 poços . Adicionar 200 ul de reagente de Bradford, medir a absorvância a 595 nm após 15 min com um fluorímetro e calcular as concentrações utilizando a curva padrão.
2. Biotransformação de luz catalisada
- Reacções biocatalíticas sem adição de peróxido de hidrogénio
- Prepara-se uma solução de 10 ml de estoque de 10 mM de ácido esteárico (M r 284,5 g mol-1) por adição de 10% (v / v) de Tergitol e 0,0284 g de ácido esteárico a água destilada. Aquece-se a solução em uma câmara de aquecimento a 60 ° C até que o ácido gordo é completamente dissolvido.
- Biocatálise e amostragem
- Preparar dois 2 ml misturas reaccionais contendo 50 mM de EDTA, 0,01 mM de FMN, ácido esteárico 0,5 mM em Tris-HCl-tampão. Adicionar uma barra de agitação magnética para fornecimento de oxigénio suficiente e colocar os tubos de vidro num banho de água, aquecida a 25 ° C.
- Adicionar 200? G ml -1 de enzima purificada ou 10% (v / v) extracto isento de células de cada uma das misturas de reacção e iluminar-los com uma ampola de vidro clara (120 W) em 15 cm de distância dos tubos de reacção.
- Aqui amostras de 200 ul em pontos de tempo específicos (0, 10, 30, 60 e 120 min) e durante a noite a paragem da reacção com HCl a 20 ul de 37%. Adicionar 5 mL de ácido mirístico (10 mM de modolução) como padrão interno.
- Análise dos produtos de reacção
- Para a extracção adicionar 500 mL de acetato de etilo às amostras duas vezes, inverter os tubos e centrifugar durante 1 min a 13.000 x g.
- Tire 400 ul do sobrenadante e deixar o solvente evaporar completamente.
- Derivatizar os ácidos carboxílicos em ácido trimethylsilylcarboxylic por adição de 200 uL de N-metil-N - (trimetilsilil) trifluoro- acetamida (MSTFA). Incubar a solução a 60 ° C durante 30 minutos, a fim de converter os grupos hidroxilo para trimetilsilil éteres.
- Determinação de conversão por GC / FID
NOTA: Determinar a formação de 1-heptadeceno (RT: 8,34 min), ácido esteárico e α- β-hidroxi (RT: 12,05 e 12,1 min) e diminuição do substrato (RT: 11,15 min) utilizando GC / FID.- Defina o perfil de temperatura descrito abaixo Defina a temperatura de injecção de 340 ° C. Aguardea temperatura do forno inicial é a 90 ° C durante 3,5 min e, subsequentemente, aumentar a 45 ° C min-1. A 220 ° C, mantida a temperatura durante 2 min. Depois de um aumento repetido de 45 ° C min @ 1, manter a temperatura a 280 ° C durante 2 min e, em seguida, aumentam com a 60 ° C min-1.
NOTA: A temperatura máxima de 330 ° C é mantida por 1,44 min. - Injectar 4 ul da amostra, com uma razão de divisão de 5 a obter a volatilização rápida e a mistura homogénea com o hélio gás portador.
NOTA: Em dependência do aumento da temperatura do substrato e dos produtos vai entrar na fase gasosa. As substâncias são detectados pelo detector / FID GC após a passagem da coluna a tempos de retenção específicos e são apresentados como picos no ecrã. Observar a formação de pico no monitor. - Calcula-se a concentração do produto formado pela seguinte fórmula:
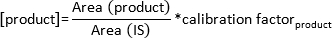
NOTA: O factor de calibração foi determinada especificamente para esta coluna para cada substrato e do produto através do cálculo da curva padrão a partir de quantidades conhecidas de substâncias derivadas e sua área de pico correspondente.
- Defina o perfil de temperatura descrito abaixo Defina a temperatura de injecção de 340 ° C. Aguardea temperatura do forno inicial é a 90 ° C durante 3,5 min e, subsequentemente, aumentar a 45 ° C min-1. A 220 ° C, mantida a temperatura durante 2 min. Depois de um aumento repetido de 45 ° C min @ 1, manter a temperatura a 280 ° C durante 2 min e, em seguida, aumentam com a 60 ° C min-1.
- Identificar picos de ácidos olefínicos e beta-hidroxi por GC / MS.
- Identificar picos de ácidos olefínicos e beta-hidroxi por GC / MS. Defina o perfil de temperatura. Ajustar a temperatura de injecção de 250 ° C. Mantenha a temperatura do forno a 100 ° C durante 5 min e, subsequentemente, aumentar a 20 ° C min-1.
NOTA: Máximo temperatura é mantida por 7,5 min. - Ajustar a temperatura do detector espectrómetro de massa a 250 ° C e digitalizar a de 50 a 500 m / z no modo de impacto de electrões.
NOTA: A ionização por impacto remove um único electrão resultando na formação de um catião radical que irá ser passada para a frente para análise de massa. Devido às altas ligações covalentes energia intramolar dentro domolécula quebra criando fragmentos de menor m / z. Estes fragmentos formar uma impressão digital específica para uma substância. - Injectar 1 ul da amostra. Detectar 1-heptadeceno após o tempo de retenção de 11,4 minutos por a impressão digital correspondente (Figura 2).
- Identificar picos de ácidos olefínicos e beta-hidroxi por GC / MS. Defina o perfil de temperatura. Ajustar a temperatura de injecção de 250 ° C. Mantenha a temperatura do forno a 100 ° C durante 5 min e, subsequentemente, aumentar a 20 ° C min-1.
Resultados
Enquanto a adição de peróxido de hidrogénio à mistura de reacção resultou em conversões baixas (<10%) a moderada, a geração in situ de peróxido de hidrogénio aumentou a conversão a uma conversão de 80%. Análise por CG / EM mostra a formação de olefinas a partir de ácidos gordos (Figura 2).
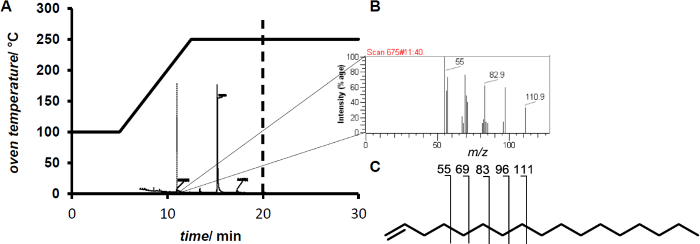
Figura 2. (A) perfil de temperatura para GC medições / MS. (B) de impressão digital do eluição 1-heptadeceno após 11,4 min. (C) Característica íons C n H 2n-1 fragmento secundárias de olefinas terminais exemplar mostrado por 1-heptadeceno. Por favor clique aqui para ver uma versão maior desta figura.
A reação de luz catalisada alcançado altas conversões com extratos livres de células de E. coli. Uma solução de enzima purificada mostrou uma clara correlação entre a concentração de enzima e de conversão. O aumento da concentração do decolheita chumbo molécula FMN de conversões mais elevadas. No entanto, aumentar a concentração acima de 10 mM não acelerar ainda mais as reacções, o que indica que a quantidade de peróxido de hidrogénio é suficientemente disponível e já não o factor limitante.
Além da descarboxilação de ácidos gordos, OLET JE também catalisa uma hidroxilação na posição-β. Na conversão do ácido esteárico, a descarboxilação é cerca de três vezes mais rápido do que a hidroxilação. Numa experiência típica usando uma solução de ácido esteárico 0,5 mM e 10 pM FMN, 99% do substrato foram convertidos a uma mistura de 1-heptadeceno e ácido 2-hidroxiesteárico, com um rácio de3,3: 1 (Figura 3) 8. Uma investigação do espectro do substrato da luz biocatálise-driven mostraram que para os ácidos gordos com cadeias acilo mais longas, OLET JE preferencialmente catalisa a descarboxilação, embora a quantidade relativa de ácidos gordos hidroxilo na mistura do produto aumentou com o comprimento de cadeia mais curta. Os ácidos graxos mais curtos do que o ácido mirístico (C14) não foram submetidos a descarboxilação.
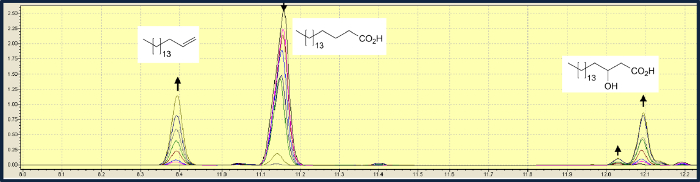
Figura 3. análise cromatográfica de gás de OLET JE mediada por descarboxilação de ácido esteárico (11,15 min) em 1-heptadeceno (8,4 min), ácido esteárico (12,04 min) ácido esteárico β-hidroxi α-hidroxi (12,1 min). A mudança das áreas dos picos de amostras colhidas ao longo de um tempo de curso de 2 horas é mostrado. Por favor clique aqui para viewa versão maior desta figura.
Surpreendentemente, os ácidos insaturados de ácido oleico (C18: cis 1d9) e ácido linoleico (C18: 2d9d12) não foram aceites como substratos, o que indica que a configuração de entrançado de duplas ligações cis não podem ser acomodados num modo de ligação produtiva na enzima. A adição de ácido oleico (10%) também preveniu a conversão do ácido esteárico. Curiosamente, o ácido esteárico (C18: 1d9 trans) foi convertido por OLET JE, ainda com uma actividade ligeiramente inferior, em seguida, o ácido esteárico.
Discussão
A geração de luz-driven de peróxido de hidrogênio pode ser aplicado para uma gama redox transformações, incluindo peroxygenases 3, chloroperoxidases 10 e P450 monooxigenases 5. É uma abordagem fácil e praticável. No longo prazo, o uso de luz visível abre a perspectiva de se utilizar a luz solar para as transformações químicas, que é uma alternativa sustentável para reacções ricos em energia.
O método é aplicável com enzima purificada ou com extracto isento de células. Enquanto o último requer menos trabalho e de custos, deve notar-se que pequenas moléculas no extracto em bruto pode interferir com a conversão de luz catalisada. Uma abordagem possível é para remover estes componentes pequenos com um microfiltrantes (isto é, por centrifugação numa unidade de filtração centrífuga ou por diálise). A concentração da molécula decolheita FMN determina a concentração do peróxido de hidrogénio. Dependendo da AffiniTy da oxidorredutase, esta concentração é decisiva para a actividade enzimática. Outro factor importante é a concentração do doador de electrões EDTA sacrificial. O parâmetro mais importante, no entanto, é a estabilidade operacional e a actividade da enzima.
O olefinization de ácidos gordos é uma reacção elegante para a conversão dos ácidos gordos bio-baseados em olefinas que pertencem aos principais produtos para a indústria química. A descarboxilação biocatalítica-driven luz pode ser levada a cabo a temperatura ambiente e a um pH neutro, o que oferece vantagens evidentes em termos de sustentabilidade.
Os nossos resultados mostram que a geração in situ de peróxido de hidrogénio é uma estratégia para fornecer o cofactor sem prejudicar a estabilidade da enzima, conduzindo a uma conversão elevada. Os métodos atuais para a regeneração cofator usar produtos agrícolas ou produtos químicos à base de gasolina. reações luz-driven estão surgindo como alternativa renovável. Futuroinvestigação será dedicada a métodos para a substituição do reagente EDTA sacrificial por moléculas mais baratos e para reduzir a quantidade de luz-colheita molécula FMN.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
R.K. and F.H. are grateful for the EU-commision for financial support within the Marie-Sklodowska ITN Biocascades (Nr. 634200).
Materiais
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Ampicillin | Sigma Aldrich | 69-52-3 | |
| Bradford reagent | Roth | K015.1 | |
| BSA | Sigma Aldrich | 90604-29-8 | |
| DMSO | Sigma Aldrich | 67-68-5 | |
| Ethyl acetate | Fisher Chemical | 141-78-6 | |
| Ethylenediaminetetraacetic acid (EDTA) | Roth | 8043.1 | |
| Riboflavin 5-monophosphate sodium salt hydrate | Sigma Aldrich | 130-40-5 | |
| Hydrochlorid acid 37% | Sigma Aldrich | 7647-01-0 | |
| Hydrogen peroxide 30% | Sigma Aldrich | 7722-84-1 | |
| δ-Amino levulinic acid | Sigma Aldrich | 5451-09-2 | |
| N-Methyl-N-(Trimethylsilyl)trifluoro acetamide (MSTFA) | Sigma Aldrich | 24589-78-4 | |
| Myristic acid >99% | Sigma Aldrich | 208-875-2 | |
| Imidazole | Sigma Aldrich | 288-32-4 | |
| Sodium chloride | Fisher Chemical | 7647-14-5 | |
| Stearic acid >99% | Sigma Aldrich | 57-11-4 | |
| Tetracycline | Sigma Aldrich | 60-54-8 | |
| Tergitol | Sigma Aldrich | MFCD01779855 | |
| Tris(hydroxymethyl)-aminomethan | Sigma Aldrich | 77-86-1 | |
| Device | |||
| Incubator shaker | G-25CK | New Brunswick Scientific | |
| Ecotron | Infors HT | ||
| Centrifugation | Labofuge 400R | Heraeus | |
| RC 5B Plus | Sorvall | ||
| Fresco 17 | Thermo Scientific | ||
| Centrifugation rotors | SS34 | Sorvall | |
| SLA | Sorvall | ||
| Clean bench | Envirco | Ceag Schirp Reinraum technik | |
| Column GC-FID | CP-Sil 5CB (30 m x 0.25 mm x 0.25 µm) | Agilent Technologies | |
| Column GC-MS | FactorFour Capillary Coloumn (VF-5 ms + 5 m EZ Guard) | Varian | |
| GC-FID | GC-2010 plus | Shimadzu | |
| GC-MS | IST-40 | Varian | |
| Magnetic stirrer | RCT classic | IKA | |
| pH meter | SevenEasy | Mettler toledo | |
| Sonicator | Branson Sonifier 250 | Branson | |
| Spectral photometer | FLUOstar Omega | BMG Labtech | |
| Equipment | |||
| Affinity chromatography column | His Pur Ni-NTA spin column | Thermo Scientific | |
| Centricon | Vivaspin turbo 15 | VWR International | |
| Microtiter plates | 96 Well Multiply®PCR Plates | Sarstedt |
Referências
- Kourist, R., Domìnguez de Marìa, P., Miyamoto, K. Biocatalytic strategies for the asymmetric synthesis of profens - recent trends and developments. Green Chem. , 2607-2618 (2011).
- Holtmann, D., Fraaije, M. W., Arends, I. W., Opperman, D. J., Hollmann, F. The taming of oxygen: biocatalytic oxyfunctionalisations. Chemical Comm. 50, 13180-13200 (2014).
- Churakova, E., et al. Specific photobiocatalytic oxyfunctionalization reactions. Ang. Chem. In. Ed. 123, 10904-10907 (2011).
- Hollmann, F., Arends, I., Buehler, K. Biocatalytic Redox Reactions for Organic Synthesis: Nonconventional Regeneration Methods. ChemCatChem. 2, 762-782 (2010).
- Girhard, M., Kunigk, E., Tihovsky, S., Shumyantseva, V. V., Urlacher, V. B. Light-driven biocatalysis with cytochrome P450 peroxygenases. Biotechnol. Appl. Biochem. 60, 111-118 (2013).
- Bartsch, M., et al. Photosynthetic production of enantioselective biocatalysts. Microb. Cell. Fact. 14, 53 (2015).
- Rude, M. A., et al. Terminal olefin (1-alkene) biosynthesis by a novel P450 fatty acid decarboxylase from Jeotgalicoccus species. Appl. Environ. Microbiol. 77, 1718-1727 (2011).
- Zachos, I., et al. Photobiocatalytic decarboxylation for olefin synthesis. Chem. Comm. 51, 1918-1921 (2015).
- Liu, Y., et al. Hydrogen peroxide-independent production of α-alkenes by OleTJE P450 fatty acid decarboxylase. Biotechnol. Biofuels. 7, 28 (2014).
- Perez, D. I., Grau, M. M., Arends, I. W., Hollmann, F. Visible light-driven and chloroperoxidase-catalyzed oxygenation reactions. Chem. Comm. 40 (44), 6848-6850 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados