Method Article
Avaliando Neurogênese Primária em
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este artigo apresenta um método conveniente e rápido para a visualização de diferentes populações de células neuronais no sistema nervoso central de embriões de Xenopus, utilizando coloração de imunofluorescência em secções.
Resumo
Primary neurogenesis is a dynamic and complex process during embryonic development that sets up the initial layout of the central nervous system. During this process, a portion of neural stem cells undergo differentiation and give rise to the first populations of differentiated primary neurons within the nascent central nervous system. Several vertebrate model organisms have been used to explore the mechanisms of neural cell fate specification, patterning, and differentiation. Among these is the African clawed frog, Xenopus, which provides a powerful system for investigating the molecular and cellular mechanisms responsible for primary neurogenesis due to its rapid and accessible development and ease of embryological and molecular manipulations. Here, we present a convenient and rapid method to observe the different populations of neuronal cells within Xenopus central nervous system. Using antibody staining and immunofluorescence on sections of Xenopus embryos, we are able to observe the locations of neural stem cells and differentiated primary neurons during primary neurogenesis.
Introdução
Em vertebrados, o desenvolvimento do sistema nervoso central compreende várias fases distintas ainda consecutivos. O primeiro passo é a indução neural, quando as células ectodérmicas naive são especificados para um destino neuronal, em vez de um destino epidérmica. Vários mecanismos reguladores interligados estão envolvidos nesta fase em outros sistemas modelo 1,2 Xenopus e. Este processo é coordenado principalmente por factores segregados produzidos pela mesoderme subjacente, tais como chordin, noggin, e folistatina 3-7. Após a indução neural, um subconjunto de células progenitoras neurais sair do ciclo celular e começam a diferenciar num processo referido como neurogénese primária. Nem todos os precursores neuronais diferenciar neste momento. As células precursoras neurais restantes continuam a proliferar, mantendo assim o conjunto de células estaminais necessária para o crescimento continuado do sistema nervoso central durante o desenvolvimento e na vida adulta.
estes proliferating células precursoras neurais são caracterizados pela sua expressão do gene 8-11 SRY (sex região determinante Y) -box 3 (SOX3). A outra população de células, que a saída do ciclo celular e comprometer-se a um destino diferenciado, são identificados pela expressão do genes marcadores de diferenciação, tubulina, beta 2B classe IIb (tubb2b, N-banheira) e fator de transcrição mielina 1 (myt1) 12-14. Tais células neuronais diferenciadas, eventualmente, dar origem a diferentes tipos de neurónios, incluindo, mas não limitado a, o motor, inter, e neurónios sensoriais posicionado em zonas distintas no interior do tubo neural 15-17.
Enquanto esforços significativos foram dedicada a descobrir os mecanismos reguladores que regem a padronização eo destino determinação eventos na neuroectoderma anterior, menos atenção tem sido feito em investigar os eventos neurogênicas que ocorrem após afase de padronização inicial. Com efeito, a transdução de sinal, os regulamentos da transcrição, assim como as modificações pós-traducionais são todos envolvidos nesta fase posterior, controlando tanto a especificação de tempo e linhagem durante neurogénese 18-20. Outras investigações sobre estes mecanismos requerem um método fiável para visualizar e distinguir as diferentes populações de células neuronais facilmente. A N-banheira acima mencionados marcadores neurais, incluindo, SOX3, Myt1, e, pode proporcionar um meio para identificar estas populações de células diferentes, proporcionando assim as bases necessárias para revelar os mecanismos subjacentes da diferenciação neuronal 21-23.
Embora a rotulagem diferencial de populações de células neuronais tem sido demonstrado em outros organismos modelo, relativamente poucos estudos têm explorado o sistema Xenopus para o seu máximo a este respeito. Isto é principalmente devido a uma escassez de anticorpos compatíveis que confiantemente identificar os vários neuronal populações de células no tubo neural. Aqui, descrevemos um método para visualizar a diferenciação neuronal em embriões precoces de Xenopus via imunocoloração, que fornece uma abordagem robusta e conveniente para investigar a neurogênese primária em Xenopus. Este protocolo deve dar orientação suficiente para os pesquisadores interessados no desenvolvimento inicial do sistema nervoso central Xenopus entre etapa 26 e etapa 45.
Protocolo
Todos os experimentos com animais foram aprovados pela Universidade de Manchester Centro de Bem-Estar Animal e foram cobertos por uma licença UK Home Office Project.
1. Recolha e Fixação de Xenopus embriões
- Prepare Reagentes e materiais para experimentos.
- Prepare 10x de modificação de Ringer de Marc (MMR) por dissolução de 56,5 g de NaCl em aproximadamente 800 ml de água ultrapura e adição de soluções de 1 M de KCl, 1 M de MgSO4, 1 M de CaCl2, e 1 M de HEPES pH 7,4 para atingir uma concentração final de KCl 20 mM, 10 mM de MgSO 4, 20 mM de CaCl2, 50 mM de HEPES. Ajustar o pH para 7,4 com NaOH 10 M e, em seguida, ajustar o volume final de 1 L.
- Esterilizar a solução 10x MMR em autoclave a 121 ° C durante 20 minutos num ciclo de líquidos. Ao utilizar, dilui-se com ddH2O para 0,1 x concentração final e adiciona-se 20 mg / L de gentamicina para inibir o crescimento microbiano.
- Adicione 10x solução de TBS através da mistura de 24 g de Tris-HCl, 5,6 g de Tris-base, 88 g de NaCl e dissolver em cerca de 900 ml de água ultrapura. A solução final terá um valor de pH cerca de 7,6. Ajustar quer com NaOH a 10 M ou HCl concentrado para atingir um pH final de 7,6 e um volume final de 1 L.
- Ao utilizar, fazer TBS 1x diluindo 1 parte de 10x solução de TBS com 9 partes de água ultrapura.
- Adicione 10x MEM de sal por dissolução de 209.2 g de MOPS em aproximadamente 800 ml de água ultrapura e adição de soluções de reserva de 0,5 M de EGTA e 1M MgSO4 para atingir uma concentração final de EGTA a 20 mM, MgSO4 10 mM. Ajustar o pH para 7,4 com NaOH 10 M e, em seguida, ajustar o volume final de 1 L.
- Esterilizar a solução de sal de MEM em autoclave a 121 ° C durante 20 minutos num ciclo de líquidos (a solução pode ficar amarelo por alguns meses de armazenagem à temperatura ambiente ou depois de ter sido esterilizado, mas esta mudança de cor não afecta o seu uso ). No entanto, não use a solução após armazenagem prolongada (mais de 6 meses).
- Faça 1x MEMFA solução através da diluição de uma parte de MEM sais, 1 parte de 37% de formaldeído, com 8 partes de água ultrapura (v / v, estáveis a 4 ° C durante, pelo menos, 1-2 semanas).
- Prepare paraformaldeído a 4% em TBS (para posterior coloração envolvendo faloidina) por dissolução de 4 g de pó de paraformaldeído em 100 ml de solução de 1X TBS aquecer a solução a 60 ° C e adiciona-se algumas gotas de NaOH a 10 M para auxiliar a dissolução. Alíquota em 5-10 ml de volume e congelamento de -20 ° C. Não voltar a congelar uma vez descongelado.
CUIDADO: O paraformaldeído em pó é um irritante e é tóxico por inalação, assim o passo de pesagem deve ser realizada numa hotte. - Rotular como muitos frascos de vidro de 4 ml com tampas de rosca antes da coleta da amostra.
- Prepare a 15% de gelatina / sacarose a 15% vertendo 20 ml de 40% de gelatina de peixe (pré-aquecimento em um banho de água a 50 ° C) em um tubo de centrífuga de 50 ml. Adiciona-se 8 g de sacarose e encher o tubo para a linha de 50 ml com TBS 1x.
- Coloque o tubo de gelatina num misturador rotativo ou cama de rolamentoa misturar durante a noite à temperatura ambiente. Esta solução de gelatina é estável a 4 ° C durante 1 semana. Não use solução expirado e não de congelamento e descongelamento.
- Preparar e corrigir X. laevis ou X. tropicalis embriões cultivados a Escalonamento desejado.
- Cultura do X. fertilizado laevis ou X. tropicalis embriões em MMR 0,1x com gentamicina até as fases desejadas.
NOTA: Geralmente, recolher embriões entre os estágios 23 e 40. Mais tarde recolha de embriões após a etapa 40 é possível, especialmente quando se observa o crescimento axonal da medula espinhal, mas tenha em mente que o tempo de penetração de gelatina adicional pode ser necessária. Os embriões podem ser de tipo selvagem, transgénico, mutante, inibidor-tratada, morfolino (MO) -injected, ou a electroporação 23,24. - Recolha 20-50 embriões em cada frasco de vidro de 4 ml, remover o máximo médio possível e substituir com MEMFA.
NOTA: Se posterior coloração envolve phalloidin, use paraformaldeído a 4%em vez de MEMFA vez que as soluções de formaldeído fornecido comerciais normalmente contêm até 10% de metanol como um estabilizador que irão interferir com a coloração com faloidina. - Fixar durante a noite a 4 ° C ou, em caso de urgência, à temperatura ambiente durante 2 horas num misturador rotativo. Os embriões será estável na solução de fixação durante pelo menos 1 semana a 4 ° C.
- Após a fixação, lavar os embriões 3 vezes durante 20 min, utilizando 1x TBS com 0,05% de Triton X-100. Após a lavagem final, remover tanto TBS-Triton quanto possível e adicionar 3 ml de 15% de gelatina / sacarose a 15% em cada frasco.
- Colocar os tubos em um rolo cama durante a noite à temperatura ambiente. Para os embriões com mais de estágio 40, utilizar pelo menos 24 horas de tempo de penetração. Após a penetração, proceder imediatamente à seção 2.2 no dia seguinte.
- Cultura do X. fertilizado laevis ou X. tropicalis embriões em MMR 0,1x com gentamicina até as fases desejadas.
2. Montagem e cryosectioning de Xenopus embriões
- Prepare Reagentes e materiais para experimentos.
- Pegue uma caixa de charg positivamenteed desliza, de preferência sem abrir.
NOTA: Se aberta, manter as lâminas numa condição seca (tal como uma caixa de seco) e utilizar no prazo de um mês para assegurar a carga estática sobre as lâminas é mantida. Não use lâminas expirados desde amostras vão cair durante a imunocoloração. - Pré-refrigerar a câmara de criostato a -30 ° C. Defina os parâmetros do instrumento como -35 ° C para micrótomo e 12 de espessura mm seção. Instalar a placa de cobertura de vidro grosso para o palco e deixar o criostato equilibrar durante pelo menos 30 minutos antes da seção começa.
- Prepare escovas de pintura para mover tiras de seção, mantenha dentro da câmara de criostato.
- Prepare lápis para escrever sobre slides, colocá-los à temperatura ambiente.
- Usar luvas durante criocorte. Não use as mãos desprotegidas.
- Pegue uma caixa de charg positivamenteed desliza, de preferência sem abrir.
- Montagem Xenopus embriões
- Aspirar cuidadosamente 5-10 embriões para fora do frasco de vidro usando um plástico ou pipeta de vidro, sem a introdução de bolhas de ar. Transferir os embriões empara a câmara de montagem e observe sob um estereoscópio. Encher-se a câmara de montagem com uma solução de gelatina a garantir a rigidez do bloco de secção.
- Disponha os embriões conforme a Figura 1, usando um par de fórceps de ponta fina. Marque a orientação das cabeças desenhando uma seta na borda da câmara utilizando um marcador criogénico-compatível. Para vários grupos de embriões, anote a descrição de cada grupo na borda da câmara correspondente bem.
- Com cuidado, coloque a câmara na horizontal em uma caixa de espuma de meio-cheio com gelo seco e feche a tampa. Observe o congelamento câmara de montagem em 5-10 min. Processar cada uma das câmaras em série (ou seja, colocar a câmara anterior em gelo seco antes de prosseguir para a próxima), como isso vai deixar tempo suficiente para cada câmara para congelar e impedir que a caixa de gelo seco para tornar-se superlotadas.
NOTA: câmaras de montagem congelados não precisa ficar na horizontal e podem ser empilhadas até dentro da caixa. - Prosseguir com cryosectioning ou, se necessário, manter as amostras congeladas a -80 ° C durante pelo menos 1-2 semanas, sem perda de imunogenicidade.
- Criocorte de embriões de Xenopus montadas
- Remover um bloco de amostras congeladas a partir da câmara pressionando a parte inferior da câmara usando uma vara blunt (tal como um lápis).
- Adicionar algumas gotas de meio de congelamento de tecidos, um álcool (meio contendo polietileno-glicol e polivinil) para o disco de retenção de amostra e montar o bloco de amostras com a extremidade anterior dos embriões aponta para cima (Figura 2). Permitir que o bloco mounted- ficar dentro da câmara de criostato durante aproximadamente 1 min ou até que o meio de congelamento do tecido torna-se opaca.
- Imediatamente instalar o disco de retenção de amostra para o micrótomo com o lado de baixo do bloco de amostra virado para cima. Aparar uma porção do bloco de amostra utilizando uma lâmina quando o bloco de amostra é ainda relativamente "macio" para reduzir o comprimento de cada secção(se desejado). Deixar o disco de retenção da amostra do micrótomo para, pelo menos, 5 minutos para permitir que a sua temperatura atingisse o equilíbrio.
- Aos poucos, cortar o bloco de amostra para baixo até que as cabeças dos girinos são visíveis através da gelatina translúcida. Para aumentar o corte de velocidade, aplicar uma configuração mais alta (mais grosso) de espessura de corte (por exemplo, 20-25 M) neste estágio (como habilitar a opção "trim"), mas não muito grosso porque o bloco de amostra pode cair a partir do disco de retenção de amostra . Observar o desempenho de criostato, tais como a nitidez e o ângulo da lâmina, nesta fase, para assegurar a geração de uma longa tira de secções subsequentes.
- Uma vez que as cabeças de girinos se tornam visíveis, ajuste as configurações do criostato de volta ao normal (por exemplo, 10-12 M) e limpo tanto o micrótomo e palco usando um pincel. Delicadamente fazer 2-3 seções como um teste usando a configuração de roda de mão (não utilize a definição motorizado) para se certificar de que fatias acabados podem formar strips, não sobrepostas ou furar a lâmina.
- Continue o corte até que as cabeças de girinos são quase exposto (pode precisar de alguma experiência, mas possível). Escove todas as seções remanescentes no palco e na constituição de seções de amostra começará.
- Faça cerca de 10-15 secções e deixá-los formar uma longa faixa.
- Vire a placa de cobertura de vidro grosso para o lado e remova cuidadosamente a fita da lâmina utilizando um pincel de ponta fina e organizá-lo no palco com longo eixo paralelo à lâmina.
- Escolha um slide carregado positivamente à temperatura ambiente, rotulá-la com um lápis (que não vai ser lavado durante os tratamentos de coloração subsequentes), pressione-o rapidamente, mas com firmeza sobre a tira com a etiqueta virada para baixo e retirar a lâmina da câmara de criostato. Se feito corretamente, a tira deve ficar imediatamente para o slide carregado positivamente (Figura 3A).
- Repita este passo para ter 20-30 fatias em cada deslizouE e dispostos em paralelo (Figura 3B). Isto é suficiente para cobrir toda a região do cérebro de X. embriões tropicalis e a maioria de cérebro anterior e do mesencéfalo regiões do X. laevis embriões.
- Secar as lâminas durante 10 min, proceda de imediato, ou armazenar os slides em uma caixa de slides a -80 ° C durante pelo menos 3-6 meses sem perder a imunogenicidade.
3. A imunocoloração de Sectioned Xenopus embriões
- Prepare Reagentes e materiais para experimentos.
- Prepare a 0,05% de TBS-Triton X-100 por adição de Triton X-100 em 1x TBS para se conseguir uma concentração final de 0,05%. Esta solução é estável à temperatura ambiente durante 3-4 dias. Não use solução expirada.
- Prepare 5% de soro de cabra inactivado pelo calor ou 5% de BSA em TBST como tampão de bloqueio. Em primeiro lugar, o calor-inactivar o de soro de cabra / cordeiro, colocando cerca de 20-30 ml de soro em um banho de água a 65 ° C durante 30-60 min. Aliquota em 1,5 ml de centrífugatubos e congelamento de -20 ° C. Não re-inactivação é exigido no momento usando.
- Diluir o soro inactivado pelo calor ou de BSA em TBST para atingir uma concentração final de 5% antes da utilização.
- Preparar anticorpos primários apropriados de acordo com diluições em tampão de bloqueio (por exemplo, 1: 250 de anti-tubulina Myt1 26 / anti-acetilada: 500 de anti-SOX3 10,25 / 1). Use cerca de 100 ml de solução de anticorpo em cada slide.
- Preparar anticorpos fluorescentes adequados (de coelho fluorescentes vermelho anticorpos por exemplo, anti-ratinho / conjugado com corante) em tampão (habitualmente 1: 500) de bloqueio.
- (Opcional) Adicionar vermelho fluorescente conjugado com corante faloidina (1: 500) em combinação anticorpo secundário para revelar rede de actina.
- (Opcional) Adicionar DAPI (0,5 ug / ml de concentração final) em combinação anticorpo secundário para visualizar a localização nuclear.
- Leve o meio de montagem anti-fade fora do congelador e descongelar em banho de água à temperatura ambiente.
- imunocoloração
- Retirar as lâminas congeladas entre -80 ° C e colocá-los em um pedaço de papel toalha dentro de um exaustor por pelo menos 1 hora para eliminar quaisquer gotas de água condensadas, então cozer as lâminas secas em um bloco de aquecimento C 85-90 ° com o fatias que enfrentam-se durante 15 min para ativar o mecanismo de adesão. Por fim, permitir que as lâminas de arrefecer até à temperatura ambiente (pelo menos 10 min).
- Encha a tina de coloração com acetona pura e incubar as lâminas em acetona durante 10 min para remover gelatina de peixe. Se vários slides estão a ser tratados, organizá-los em um rack de coloração. Secar as lâminas-tratadas durante 15 min num exaustor de ventilação. Não re-utilizar a acetona.
- Cuidadosamente desenhar um anel em torno das amostras no slide usando uma caneta PAP sem tocar nas amostras. Certifique-se de que o anel é fechado em si mesmo, caso contrário solução de anticorpo fluirá durante a coloração. Totalmente secar o anel PAP caneta.
- Encha uma outra tina de coloração com TBS 1x sem Triton X-100. insert-as lâminas secas na tina de coloração e permitir re-hidratação durante pelo menos 1 h. No entanto, preparar o tampão de bloqueio por diluição de soro de cabra inactivado pelo calor ou de BSA até à concentração final de 5% utilizando 1x TBS com 0,05% de Triton X-100.
- Faça uma caixa molhada, colocando 1-2 placas de 6 poços dentro de uma caixa de alimentos click-lock e encher os poços até a metade com água ultrapura. Retirar as lâminas re-hidratados do frasco de coloração e colocá-los horizontalmente sobre as placas de 6 poços (sem a tampa da placa).
- Adicionar cuidadosamente 300-600 mL de tampão de bloqueio no interior do anel PAP. Selar a caixa molhada por bloqueio a tampa para a posição e incubar à temperatura ambiente durante pelo menos 1 h.
- Dilui-se os anticorpos primários apropriadas em tampão de bloqueio. Geralmente, use 100-150 solução de anticorpo ul diluído por slide. Se vários slides são processados, ampliar o volume proporcionalmente.
- Após o bloqueio, remova cuidadosamente o tampão de bloqueio de diapositivos por aspiração e adicionar rapidamente pA solução de anticorpo rimary para evitar seca-a, em seguida, selar a caixa húmida e incubar a 4 ° C durante a noite.
- No dia seguinte, remover a solução de anticorpo primário a partir das corrediças por aspiração. Lavar as lâminas através da inserção em frascos de coloração com 1x TBS com 0,05% de Triton X-100, 3 vezes, 15 min cada. Entretanto, dilui-se os anticorpos secundários fluorescentes apropriados com tampão de bloqueio (com ou sem DAPI ou faloidina).
- Adiciona-se cuidadosamente 100-150 ul de solução de anticorpo secundário sobre as lâminas. Colocar as lâminas dentro da caixa molhada e selar a tampa. Incubar as lâminas durante 1-2 horas à temperatura ambiente.
- Lavam-se as lâminas em frascos de coloração com 1x TBS com 0,05% de Triton X-100, 3 vezes, 15 min cada. Na lavagem final, descongelar o meio de montagem anti-desbotamento em um banho de água a 50 ° C durante 10 minutos, se for armazenado a -20 ° C. Arrefecer o meio de montagem à temperatura ambiente antes do uso.
- Adicionar cerca de 20 l (uma gota) de meio de montagem emo slide e aplicar uma grande lâmina de cobertura (pelo menos 22 mm x 64 mm) sobre as amostras. Observe usando fluorescente ou microscópio confocal dentro de 6 horas de montagem post.
- Se de imagem não pode ser feito no mesmo dia, selar lâminas usando unha polonês e colocá-los dentro da caixa molhada, a 4 ° C durante a noite.
NOTA: O meio de montagem anti-fade vai gradualmente se oxidado depois de alguns dias (e transformá-acastanhado) por isso é recomendado que tome as imagens o mais rápido possível.
- Se de imagem não pode ser feito no mesmo dia, selar lâminas usando unha polonês e colocá-los dentro da caixa molhada, a 4 ° C durante a noite.
Resultados
Os resultados representativos mostram secções transversais da fase 30 embriões de Xenopus em diferentes níveis, ou seja, o cérebro anterior, mesencéfalo, rombencéfalo, e da medula espinhal, corados com anticorpos diferentes (Figura 4). Como mencionado, SOX3-marcado da população de células progenitoras neuronais localiza na proximidade do lúmen do tubo neural, enquanto MyT1 marcado neurónios primárias diferenciadas migram para fora e localizar perto da camada marginal (lâmina basal) do tubo neural. Anti-acetil-tubulina etiquetas axónios em neurónios diferenciados, que podem ser observados dentro de todo o tubo neural.
-Lado específico silenciamento de genes ou a sobre-expressão é um método amplamente utilizado em neurobiologia para avaliar se modular a expressão do gene específico (s) interrompe o crescimento e diferenciação de células neuronais. Em tais casos, ambos os Morpholinos (OMs) ou a construção (ões) de ADN transportando pro gene (s) orientada para o moter são injectadas em uma das duas blastómeros no estádio de duas células 23. Alternativamente, eles podem ser injectado no ventrículo cerebral seguido por electroporação, o que irá resultar em knockdown ou sobre-expressão de gene (s) desejado 27. Em ambos os casos, os efeitos serão restritas a um lado do embrião, fazendo com que o lado oposto do embrião como controlo interno não tratada.
Após a fixação, o seccionamento, e imunocoloração, os impactos de silenciamento de genes / sobre-expressão são quantificadas por contagem e comparando os números de células de populações diferentes em ambos os lados do embrião. Acumulando esses dados a partir de vários embriões, a análise estatística pode ser realizada. Em nossos resultados representativos, nenhuma perturbação foi feito nos embriões. Exemplos de perturbações do gene e os seus efeitos em diferentes populações de células neuronais pode ser encontrada nas referências 20,23.
t "fo: manter-together.within-page =" 1 ">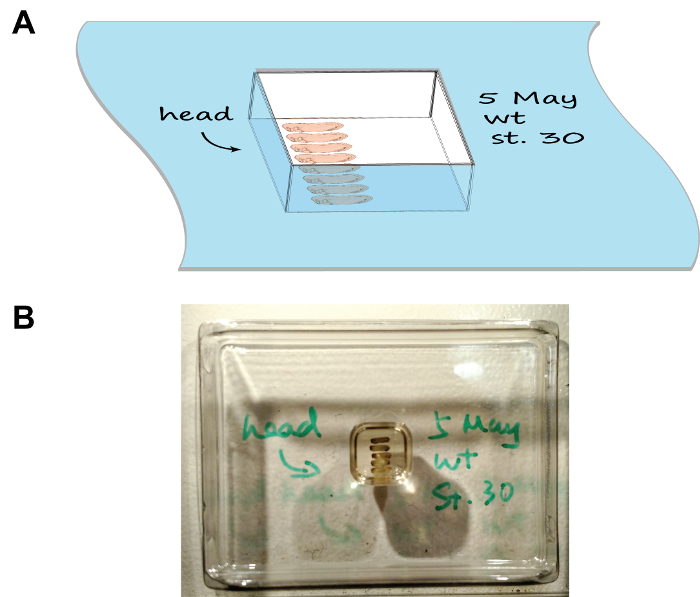
Figura 1:. Arranjo de embriões e orientação no molde seção (A) Uma descrição dos desenhos animados que mostra o conjunto de montagem, observe a bandeja foi marcada com a data, palco, e a orientação de embriões. (B) Uma imagem que mostra a aparência natural do conjunto de montagem. Por favor clique aqui para ver uma versão maior desta figura.
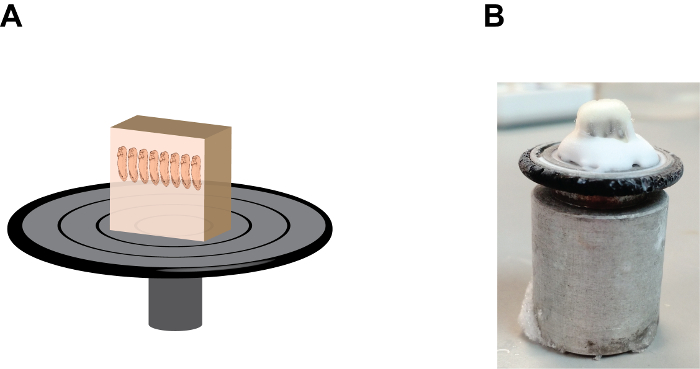
Figura 2:. A orientação ea posição do bloco de gelatina no disco realização da amostra (A) Uma descrição dos desenhos animados que mostra o conjunto do bloco seção, note que embriões estão em uma posição "heads-up" e do bloco de gelatina esteja firmemente o fixonpara o disco de retenção da amostra pelo meio de congelamento de tecidos na base (ver Figura 2B). (B) Uma imagem que mostra a aparência natural do conjunto do bloco de seção, observe o acúmulo do meio de congelamento do tecido entre o bloco de gelatina e o disco de retenção da amostra. Por favor clique aqui para ver uma versão maior desta figura.
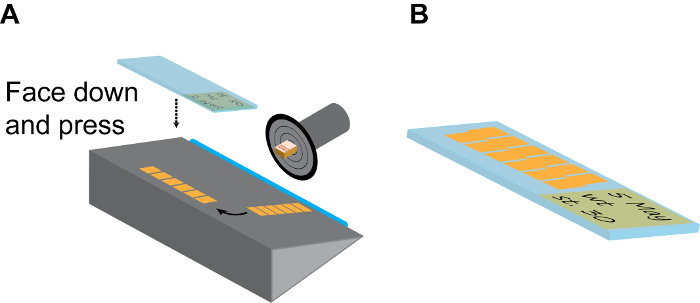
Figura 3:. Seccionamento Contínuo (A) Modelo de uma câmara de secção. O disco de retenção de amostra deve ser rodada e fixada para a posição de que o lado do embrião está virada para cima. Depois de alguns (6-10) seções, a longa faixa de azulejos secção contínua são cuidadosamente separados da lâmina (azul) usando um pincel fino, e depois virou 90 ° na chapa de fixação. Em seguida, uma sala de temperatura com carga positiva slide éfirmemente pressionado sobre a tira seção voltada para baixo e imediatamente levantado para tiras acabados recolhidos. (B) Normalmente, cada lâmina pode acomodar 2 linhas paralelas de tiras, como se mostra. Lembre-se de fazer registro detalhado no rótulo de slides usando lápis. Por favor clique aqui para ver uma versão maior desta figura.
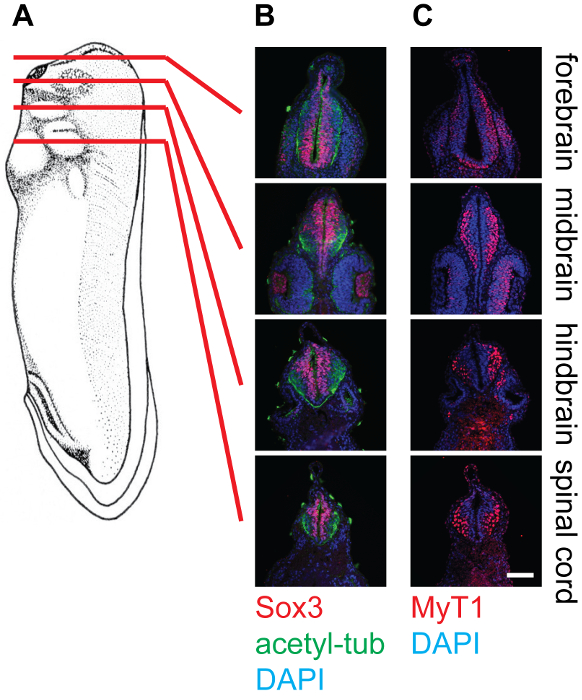
Figura 4: Secção transversal da fase de 30 X. laevis girinos e coloração no tecido neural, 20X. (A) Esquema indicando as posições relativas (prosencéfalo, mesencéfalo, rombencéfalo e espinal medula) de planos de corte em girinos de Xenopus. (B) secções transversais correspondentes coradas com anti-SOX3 (vermelho), anti-acetilado-tubulina (Green) e DAPI (azul), que mostra os locais relativos dos agrupamentos de células estaminais neuronais, bem como neurofilamentos dentro do tubo neural. (C) Correspondente cortes transversais corados com anti-MyT1 (vermelho) e DAPI (azul), mostrando as localizações relativas de neurônios primários diferenciadas dentro do tubo neural. Barra de escala = 20 mm. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Aqui demonstramos um método conveniente e eficiente para a visualização neurogénese primária em embriões de Xenopus. Este método permite a avaliação de diferentes tipos de células neurais, incluindo células estaminais neuronais e neurónios primárias diferenciadas utilizando marcadores específicos do tipo de célula.
O protocolo geral é robusto com muito elevado nível de reprodutibilidade. Para os embriões que estão em fases pré-incubação (ou seja, até à fase 28), recomendamos remover manualmente a membrana vitelina antes da fixação, pois isso permite que embriões para desenrolar completamente antes de fixação. Isto é especialmente importante quando a recolha de embriões em fases relativamente iniciais (antes da eclosão), uma vez que embriões dobrados são extremamente difíceis de arranjar na orientação desejada no interior da câmara de montagem. Nós ainda não experimentou uma perda de imunogenicidade após MEMFA ou PFA fixação passo recuperação antigênica, portanto, adicional não é necessário para este protocolo. Além disso, esteimunocoloração procedimento pode ser realizado em amostras de cromogénico / hibridação in situ fluorescente. Em tal situação, é recomendado para ignorar a protease K durante o passo de tratamento in situ protocolo de hibridização. Após a reacção do substrato cromogénico / fluorescente, as amostras podem ser lavadas com TBS e embebidos em solução de gelatina de peixe de uma maneira semelhante à amostras fixadas MEMFA / PFA. frascos de amostra pode ser protegida da luz enrolando os frascos em folha de alumínio se hibridação in situ fluorescente vai ser trabalhada em conjunto com a coloração imunofluorescente mais tarde.
Em alguns casos, os embriões podem diminuir excessivamente após a penetração de gelatina. Isto é provavelmente causado por uma fixação insuficiente ou insuficiente de extracção TBS-Triton. Certifique-se de que os embriões foram fixados em PFA / MEMFA para, pelo menos, 2-3 horas, ou de preferência durante a noite a 4 ° C. Se o problema persistir, aumentar o tempo de lavagem de Triton-TBS a 3 para 1 hr.
Durante crio-sectioNing, a rigidez do bloco de amostra pode variar como diferentes lotes de gelatina de peixe possuem propriedades diferentes. Este problema pode ser parcialmente compensada através do ajuste da temperatura do micrótomo. A temperatura mais baixa resultará em um bloco "mais difícil" amostra no entanto sob a temperatura excessiva baixo o bloco de amostra torna-se nítida e difícil de seção. Algum ajuste fino ou prática (usando blocos de amostras simuladas sem embriões) antes de cada corte pode ser benéfica antes do uso em amostras particularmente valiosos.
Um problema comum encontrado durante o corte é os cortes finos, por vezes, tendem a ficar sobre a placa de vidro grosso, em vez de ficar plana no palco de aço. Isto pode ser particularmente perturbadoras, uma vez que constantemente interromper o processo de corte contínuo. Tais casos são geralmente causadas por uma de duas razões: a câmara de secção e (especialmente) a placa de vidro grosso não sendo carga estática frio o suficiente, ou excessiva na máquina eo Sperator, especialmente em tempo seco. O primeiro pode ser resolvido, rodando abaixo da temperatura da câmara de secção e deixando a chapa de vidro para dentro de um tempo extra (possivelmente durante a noite); e este último por terra corretamente o criostato. Ligar a superfície metálica do criostato a uma torneira de metal ou de sistema de tubulação de água semelhante feita de metal pode ser uma maneira alternativa para liberar as cargas estáticas. Depois de cada utilização, a placa de vidro de espessura deve ser bem lavados com um detergente não-corrosivas (como o líquido de lavagem de loiça), lavado com água ultrapura, pulverizados com etanol puro, e embrulhada em papel toalha para proteger a superfície e os bordos da danificação.
Os anticorpos listados no protocolo são geralmente específica e nós raramente encontram adsorção não específica ou de alto sinal de fundo. Deve notar-se que, se utilizando soro de cabra / cordeiro inactivado pelo calor como agente bloqueador, de calor-inactivação excessiva (tal como visualizado pela formação de precipitante macio no soro) deveser evitada, pois esta precipitante é muito atractiva para os anticorpos secundários e pode contribuir para uma fonte de elevado ruído de fundo.
É possível, e por vezes necessário, para efectuar dupla coloração para visualizar diferentes populações de células neuronais em simultâneo. Essa dupla-coloração é possível e, geralmente, dá resultados satisfatórios com as seguintes combinações: SOX3 / N-banheira ou Myt1 / N-banheira. No entanto, a coloração de dupla-SOX3 e Myt1 é complicada pelo facto de que os dois anticorpos são tanto de origem de coelho. Testámos vários kits de marcação directa de anticorpos, no entanto, não há resultados satisfatórios foram observados (baixo nível de sinal-para-ruído), possivelmente devido à falta de amplificação de sinal a partir de anticorpos secundários. Uma abordagem possível para ultrapassar este problema seria o de aumentar linhas transgénicas em Xenopus, como discutido abaixo.
Uma das principais restrições deste protocolo é que, embora este protocolo poderá suficientemente distinguish dois conjuntos principais de células neuronais, ou seja, o conjunto de células estaminais neuronais que expressam SOX3 e os neurónios diferenciados Myt1-expressam, ele não tem a capacidade para revelar diferentes sub-populações de neurónios diferenciados. Tais sub-populações, que incluindo, mas não se limitam a, os neurónios motores principais, e interneurónios, neurónios sensoriais, são usualmente caracterizados pelos seus genes marcadores expressos diferencialmente-28-30. Como mencionado acima, os avanços recentes no desenvolvimento de multicolor hibridação in situ combinado com o método de detecção de imunofluorescência com anticorpos em embriões de Xenopus pode preencher a abertura para revelar estas sub-populações de neurónios diferenciados para a pesquisa do potencial 31. Alternativamente, como já foi demonstrado no modelo de ratos, seria também desejável para elevar um conjunto mais completo de anticorpos específicos do tipo de célula para distinguir tais populações de células diferentes em Xenopus.
Isto éTambém vale a pena mencionar que, como um complemento para este método, os recentes avanços na imagem óptica e análise de imagem, como a microscopia multiphoton, reconstrução 3D, e segmentação, pode também ser aplicado após as avaliações iniciais para alcançar observações mais abrangentes de oócitos de Xenopus, bem como embriões, em particular no âmbito de um ajuste 32,33 ao vivo. Portanto, para controlar a proliferação, diferenciação, e o movimento de células neuronais em animais vivos, que seria desejado por uma ou mais linhas transgénicas que abrigam proteínas fluorescentes conduzidos pelo promotor específico do tipo de célula para permitir a observação ao vivo de tais populações de células no início de Xenopus embriões. O estabelecimento de um X. linha laevis com o promotor β-tubulina neuro-específica condução tauGFP e suas aplicações têm proporcionado um bom exemplo 23,34. Com as sequências promotoras completas de ambos SOX3 e myt1 caracterizado por vertebrados 35-37, é SHould ser relativamente fácil estabelecer linhagens transgênicas adicionais em Xenopus que deverão contribuir extensivamente tanto para a comunidade Xenopus e um campo mais geral da pesquisa neurogênese primário.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos Prof. Michael Klymkowsky na Universidade do Colorado em Boulder e Prof. Nancy Papalopulu na Universidade de Manchester para gentileza de anticorpos anti-SOX3 e anti-Myt1, respectivamente. Agradecemos aos membros do laboratório Papalopulu por suas sugestões perspicazes no desenvolvimento deste protocolo. Este trabalho foi apoiado por dois fundação cura Studentships para SZ e JL, duas bolsas projecto da fundação cura para SZ / EA e JL / EA, respectivamente, a concessão de um programa a partir do Wellcome Trust para EA (WT082450MA), e um subsídio de Apoio Estratégico Institucional do Wellcome Trust [097820 / Z / 11 / Z].
Materiais
| Name | Company | Catalog Number | Comments |
| gentamicin | Sigma-Aldrich | G1397 | |
| Tris-HCl | Sigma-Aldrich | T3253 | |
| Tris-base | Sigma-Aldrich | T1503 | |
| NaCl | Sigma-Aldrich | S7653 | |
| KCl | Sigma-Aldrich | 746436 | |
| MgSO4 | Sigma-Aldrich | 746452 | |
| CaCl2 | Sigma-Aldrich | 793639 | |
| HEPES | Sigma-Aldrich | H3375 | |
| MOPS | Sigma-Aldrich | RDD003 | |
| EGTA | Sigma-Aldrich | E3889 | |
| 37% formaldehyde | Sigma-Aldrich | F8775 | |
| Gelatin from cold water fish skin | Sigma-Aldrich | G7765 | |
| Sucrose | Sigma-Aldrich | S7903 | |
| Base Mould Disposable 15 Mm x 15 Mm x 5 Mm Simport | VWR | EMB-200-015A | |
| Base Mould Disposable 7 Mm x 7 Mm x 5 Mm Simport | VWR | EMB-200-010K | |
| Superfrost Plus slides | ThermoFisher | 12-550-15 | |
| Tissue Freezing Medium (OCT) | Leica | 14020108926 | |
| Cryostat | Leica | CM3050 | |
| Gloves | |||
| Dry Ice | |||
| Triton X-100 | Sigma-Aldrich | X100 | |
| 85-90 °C Heat block | |||
| PAP pen | Sigma-Aldrich | Z377821 | |
| Acetone, analytical grade | |||
| Staining jar with slide racks | |||
| Click-lock food box of appropriate size (has the capacity to hold 1-2 6-well plate inside) | |||
| anti-acetylated tubulin | Sigma-Aldrich | T7451 | |
| Anti-mouse IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 488 Conjugate) | Cell Signaling | 4408 | |
| Anti-rabbit IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 555 Conjugate) | Cell Signaling | 4413 | |
| Alexa Fluor® 647 Phalloidin | Cell Signaling | 8940 | |
| DAPI | Cell Signaling | 4083 | |
| ProLong Gold Antifade Mountant | Life Technologies | P36930 |
Referências
- De Robertis, E. M., Kuroda, H. Dorsal-ventral patterning and neural induction in Xenopus embryos. Annual Rev Cell Dev Biol. 20, 285-308 (2004).
- Wilson, S. W., Houart, C. Early steps in the development of the forebrain. Dev Cell. 6, 167-181 (2004).
- Hemmati-Brivanlou, A., Melton, D. Vertebrate embryonic cells will become nerve cells unless told otherwise. Cell. 88, 13-17 (1997).
- Hemmati-Brivanlou, A., Melton, D. A. Inhibition of activin receptor signaling promotes neuralization in Xenopus. Cell. 77, 273-281 (1994).
- Fainsod, A., et al. The dorsalizing and neural inducing gene follistatin is an antagonist of BMP-4. Mech Dev. 63, 39-50 (1997).
- Piccolo, S., Sasai, Y., Lu, B., De Robertis, E. M. Dorsoventral patterning in Xenopus: inhibition of ventral signals by direct binding of chordin to BMP-4. Cell. 86, 589-598 (1996).
- Zimmerman, L. B., De Jesus-Escobar, J. M., Harland, R. M. The Spemann organizer signal noggin binds and inactivates bone morphogenetic protein 4. Cell. 86, 599-606 (1996).
- Koyano, S., Ito, M., Takamatsu, N., Takiguchi, S., Shiba, T. The Xenopus Sox3 gene expressed in oocytes of early stages. Gene. 188, 101-107 (1997).
- Rogers, C. D., Harafuji, N., Archer, T., Cunningham, D. D., Casey, E. S. Xenopus Sox3 activates sox2 and geminin and indirectly represses Xvent2 expression to induce neural progenitor formation at the expense of non-neural ectodermal derivatives. Mech Dev. 126, 42-55 (2009).
- Zhang, C., Basta, T., Jensen, E. D., Klymkowsky, M. W. The beta-catenin/VegT-regulated early zygotic gene Xnr5 is a direct target of SOX3 regulation. Development. 130, 5609-5624 (2003).
- Penzel, R., Oschwald, R., Chen, Y., Tacke, L., Grunz, H. Characterization and early embryonic expression of a neural specific transcription factor xSOX3 in Xenopus laevis. Int J Dev Biol. 41, 667-677 (1997).
- Bellefroid, E. J., et al. X-MyT1, a Xenopus C2HC-type zinc finger protein with a regulatory function in neuronal differentiation. Cell. 87, 1191-1202 (1996).
- Moody, S. A., Miller, V., Spanos, A., Frankfurter, A. Developmental expression of a neuron-specific beta-tubulin in frog (Xenopus laevis): a marker for growing axons during the embryonic period. J Comp Neurol. 364, 219-230 (1996).
- Oschwald, R., Richter, K., Grunz, H. Localization of a nervous system-specific class II beta-tubulin gene in Xenopus laevis embryos by whole-mount in situ hybridization. Int J Dev Biol. 35, 399-405 (1991).
- Chitnis, A., Henrique, D., Lewis, J., Ish-Horowicz, D., Kintner, C. Primary neurogenesis in Xenopus embryos regulated by a homologue of the Drosophila neurogenic gene Delta. Nature. 375, 761-766 (1995).
- Roberts, A. Early functional organization of spinal neurons in developing lower vertebrates. Brain Res Bull. 53, 585-593 (2000).
- Hartenstein, V. Early neurogenesis in Xenopus: the spatio-temporal pattern of proliferation and cell lineages in the embryonic spinal cord. Neuron. 3, 399-411 (1989).
- Hirabayashi, Y., et al. The Wnt/beta-catenin pathway directs neuronal differentiation of cortical neural precursor cells. Development. 131, 2791-2801 (2004).
- Munji, R. N., Choe, Y., Li, G., Siegenthaler, J. A., Pleasure, S. J. Wnt signaling regulates neuronal differentiation of cortical intermediate progenitors. J Neurosci. 31, 1676-1687 (2011).
- Bonev, B., Stanley, P., Papalopulu, N. MicroRNA-9 Modulates Hes1 ultradian oscillations by forming a double-negative feedback loop. Cell Rep. 2, 10-18 (2012).
- Bonev, B., Pisco, A., Papalopulu, N. MicroRNA-9 reveals regional diversity of neural progenitors along the anterior-posterior axis. Dev Cell. 20, 19-32 (2011).
- Munoz, R., et al. Regeneration of Xenopus laevis spinal cord requires Sox2/3 expressing cells. Dev Biol. , (2015).
- Zhang, S., Li, J., Lea, R., Vleminckx, K., Amaya, E. Fezf2 promotes neuronal differentiation through localised activation of Wnt/beta-catenin signalling during forebrain development. Development. 141, 4794-4805 (2014).
- Zhang, S., Li, J., Lea, R., Amaya, E., Dorey, K. A Functional Genome-Wide In Vivo Screen Identifies New Regulators of Signalling Pathways during Early Xenopus Embryogenesis. PloS one. 8, e79469(2013).
- Wang, T. W., et al. Sox3 expression identifies neural progenitors in persistent neonatal and adult mouse forebrain germinative zones. J Comp Neurol. 497, 88-100 (2006).
- Sabherwal, N., et al. The apicobasal polarity kinase aPKC functions as a nuclear determinant and regulates cell proliferation and fate during Xenopus primary neurogenesis. Development. 136, 2767-2777 (2009).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev Biol. 7, 107(2007).
- Moreno, N., Retaux, S., Gonzalez, A. Spatio-temporal expression of Pax6 in Xenopus forebrain. Brain Res. 1239, 92-99 (2008).
- Kay, B. K., Shah, A. J., Halstead, W. E. Expression of the Ca2+-binding protein, parvalbumin, during embryonic development of the frog, Xenopus laevis. J Cell Biol. 104, 841-847 (1987).
- Park, B. Y., Hong, C. S., Weaver, J. R., Rosocha, E. M., Saint-Jeannet, J. P. Xaml1/Runx1 is required for the specification of Rohon-Beard sensory neurons in Xenopus. Dev Biol. 362, 65-75 (2012).
- Lea, R., Bonev, B., Dubaissi, E., Vize, P. D., Papalopulu, N. Multicolor fluorescent in situ mRNA hybridization (FISH) on whole mounts and sections. Methods Mol Biol. 917, 431-444 (2012).
- Canaria, C. A., Lansford, R. Advanced optical imaging in living embryos. Cell Mol Life Sci. 67, 3489-3497 (2010).
- Prouty, A. M., Wu, J., Lin, D. T., Camacho, P., Lechleiter, J. D. Multiphoton laser scanning microscopy as a tool for Xenopus oocyte research. Methods Mol Biol. 322, 87-101 (2006).
- Love, N. R., et al. pTransgenesis: a cross-species, modular transgenesis resource. Development. 138, 5451-5458 (2011).
- Kovacevic Grujicic, N., Mojsin, M., Krstic, A., Stevanovic, M. Functional characterization of the human SOX3 promoter: identification of transcription factors implicated in basal promoter activity. Gene. 344, 287-297 (2005).
- Wang, S., et al. Myt1 and Ngn3 form a feed-forward expression loop to promote endocrine islet cell differentiation. Dev Biol. 317, 531-540 (2008).
- Rogers, C. D., Archer, T. C., Cunningham, D. D., Grammer, T. C., Casey, E. M. Sox3 expression is maintained by FGF signaling and restricted to the neural plate by Vent proteins in the Xenopus embryo. Dev Biol. , 307-319 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados