Method Article
Medição do Tamanho de Partículas Distribuição em turvas Solutions pela Dynamic dispersão de luz Microscopia
Neste Artigo
Resumo
Um protocolo para a medição directa da distribuição de tamanho de partículas em soluções concentradas usando microscopia de luz espalhamento dinâmico é apresentado.
Resumo
A protocol for measuring polydispersity of concentrated polymer solutions using dynamic light scattering is described. Dynamic light scattering is a technique used to measure the size distribution of polymer solutions or colloidal particles. Although this technique is widely used for the assessment of polymer solutions, it is difficult to measure the particle size in concentrated solutions due to the multiple scattering effect or strong light absorption. Therefore, the concentrated solutions should be diluted before measurement. Implementation of the confocal optical component in a dynamic light scattering microscope1 helps to overcome this barrier. Using such a microscopic system, both transparent and turbid systems can be analyzed under the same experimental setup without a dilution. As a representative example, a size distribution measurement of a temperature-responsive polymer solution was performed. The sizes of the polymer chains in an aqueous solution were several tens of nanometers at a temperature below the lower critical solution temperature (LCST). In contrast, the sizes increased to more than 1.0 µm when above the LCST. This result is consistent with the observation that the solution turned turbid above the LCST.
Introdução
Particle size is one of the most fundamental properties of colloidal and polymer solutions. Numerous techniques are used to measure the particle size. Particle sizes of 1.0 µm or larger can be measured directly using an optical microscope. For smaller particles, alternative techniques, such as laser diffraction, electron microscopy, or atomic force microscopy, are used2,3. Dynamic light scattering is a commonly-used technique for the measurement of particle size distributions in solutions4. The results obtained using this technique are not derived from images of the particles but from the characteristic time of the fluctuations in scattered light intensity. These fluctuations originate from Brownian motion, which is characterized by a diffusion constant. The size distribution is obtained from the distribution of diffusion constants using the Einstein-Stokes equation. Due to its simplicity, dynamic light scattering is widely used for the routine assessment of solutions, such as paints and food colloids.
Pretreatment is required for most of the techniques used for the particle size measurement of solution samples. In the case of electron microscopy and atomic force microscopy, the sample must be analyzed under vacuum conditions. Therefore, it is difficult to observe the samples in their native forms. Furthermore, for laser diffraction and dynamic light scattering, only diluted samples that are free from multiple scattering and light absorption can be measured. To overcome this difficulty, several new techniques have been proposed for the measurement of dynamic light scattering from undiluted, concentrated solutions, such as cross-correlation spectroscopy5,6, low-coherence dynamic light scattering7,8, diffusing-wave spectroscopy9,10, and differential dynamic microscopy11,12.
We have developed a new apparatus called a dynamic light scattering microscope1. This apparatus enables us to measure turbid samples without dilution by means of a confocal optical system in which multiple scattering is eliminated using a pinhole. However, the measurement procedure and data analysis are slightly more complicated than those of commercially-available instruments. This video explains the measurement procedure and data analysis in detail using the analysis of the temperature-responsive polymer, poly(N-isopropylacrylamide), as an example.
Protocolo
Preparação 1. Amostra
- Purificação de monómeros de temperatura-sensível
- Dissolve-se 20 g de N -isopropylacrylamide (INAP) em 100 ml de tolueno.
- Filtra-se a solução sob vácuo para eliminar o pó.
- Misturar-se o filtrado com 500 ml de éter de petróleo.
- Colocar o recipiente de reacção num banho de gelo-água.
- Agita-se a solução até que os monómeros são precipitados (tipicamente 30 minutos).
- Filtra-se a solução sob sucção para se obter os monómeros precipitados.
- Secam-se os monómeros sob pressão reduzida (100 Pa) durante a noite.
- Preparação da solução de polímero de temperatura-sensível
- Desgaseifica 20 mL de água desionizada durante 1,0 min utilizando uma bomba de diafragma.
- Dissolve-se 780,8 mg do INAP purificado em 9,5 ml de água desgaseif içada e desionizada.
- Colocar o recipiente de reacção num banho de gelo-água.
- Proteger a reação deluz, cobrindo o aparelho com folha de alumínio.
- Agita-se a solução suavemente durante 10 min enquanto se introduz uma corrente moderada de gás Ar suavemente através de uma ponta de pipeta ligada ao cilindro de gás com um tubo.
- Adicionar 11,9 mL de N, N, N ', N' tetrametiletilenodiamina à solução por meio de uma micropipeta.
- Agita-se a solução durante 1,0 min, enquanto a introdução de gás Ar, como mencionado no passo 1.2.5.
- Enquanto se agitava a amostra, dissolver-se 4,0 mg de persulfato de amónio em 0,5 ml de água desgaseif içada e desionizada.
- Misturar a solução de amostra (a partir do passo 1.2.7) e uma solução de persulfato de amónio (a partir do passo 1.2.8).
- Agita-se a solução durante 30 segundos enquanto se introduz gás Ar, como mencionado no passo 1.2.5.
- Cubra a solução com folha de alumínio e mantê-lo no frigorífico (4 ° C) durante a noite.
- Preparação de fixação do provete
- Colocar 60 mL de solução da amostra (a partir depasso 1.2.11) em um slide cavidade.
- Cubra a solução com uma tampa de vidro circular. Não ser o cuidado de bolhas de ar armadilha.
- Retire o excesso de solução usando uma micropipeta e laboratoriais toalhetes.
- Selar a amostra com cola. Deixe secar cola à temperatura ambiente (tipicamente 6 h).
- Prepare outro slide preenchido com látex de 0,1% em peso de poliestireno (100 nm de diâmetro das partículas) suspensão por seguir os passos 1.3.1-1.3.4. Esta corrediça é utilizada como um padrão.
2. Partícula medição do tamanho com um Dynamic Light Scattering Microscópio
- Optimização do instrumento
- Colocar a lâmina suspensão de látex de poliestireno (a partir do passo 1.3.5) sobre a fase de microscópio invertido. Pelo lado da tampa de vidro deve estar voltada para baixo.
- Coloque um amortecedor feixe em frente do detector (um fotodiodo de avalanche e um autocorrelador).
- Aplicar um feixe de laser (laser de estado sólido, λ = 488 nm, 30 mW, contínuaOnda) para a amostra através de uma lente objetiva (10 ×). Uma porção da luz reflectida passa por um espelho lançamento do microscópio e é observada por uma câmara CCD montada na porta do lado do microscópio (Figura 1).
- Ajuste a altura da lente objetiva para definir o ponto focal na suspensão da amostra, deslocando a altura da lente objetiva a partir da posição de baixa para alta. Durante este processo, a imagem reflectida é focada três vezes: na superfície do vidro de cobertura, na interface entre a cobertura de vidro e a amostra, e na interface entre a amostra e o vidro furo-corrediça. Defina o ponto focal entre o segundo e terceiro pontos.
- Atenuar a intensidade da luz dispersa, alterando a potência do laser.
- Introduzir a luz dispersa para o detector por remoção do amortecedor de feixe em frente do detector. Esta unidade mede a correlação temporal da intensidade de luz.
- Definir uma pinhole (φ = 50 mm) between o microscópio e o detector para alcançar o efeito confocal. Ajustar a posição do orifício para maximizar a intensidade da luz no detector.
- Medir o tempo de função de correlação de intensidade de luz dispersa durante 30 s por iniciar a operação do dispositivo de correlação através de um computador. A função de correlação medido é muitas vezes expressa como g de (2) (t) - 1, em que t é o tempo de correlação e quatro
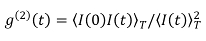 . Aqui, I (t) é a intensidade da luz dispersa no tempo t e (•••) T tem uma média de tempo. O tempo de decaimento será de aproximadamente 0,1 ms.
. Aqui, I (t) é a intensidade da luz dispersa no tempo t e (•••) T tem uma média de tempo. O tempo de decaimento será de aproximadamente 0,1 ms. - Ajustar o ponto focal para se obter uma vasta gama para a amplitude iniciais da função de correlação de tempo (g (2) (t = 0) - 1).
NOTA: A amplitude inicial é fortemente influenciada pela quantidade de luz refletida. Movendo a reboque ponto focalard a interface entre a cobertura de vidro e a amostra, aumenta a quantidade de luz refletida. Para dispersores de luz fortes, tais como látex de poliestireno, a amplitude inicial pode ser alterado a partir de 0 a 1. No entanto, é difícil definir a amplitude inicial perto de 1 de soluções de polímeros mais comuns porque a intensidade da luz reflectida é muito maior do que que parte da luz dispersa. - Aplicar a transformação inversa de Laplace (utilizando o programa CONTIN regularização constrangido 13,14) para a função de correlação obtida tempo para a aquisição da função de distribuição de tamanho. Nos casos em que a amplitude inicial é definida como inferior a 0,2, a função de distribuição do raio hidrodinâmico irá mostrar um pico acentuado a cerca de 100 nm, o que é o dobro do raio real (ver a discussão para detalhes).
- medição da amostra
- Ajustar a temperatura etapa até 25 ° C.
- Coloque uma lâmina preparada com poli-INAP (PNIPA) solutde iões (passo 1.3.4) sobre a fase de microscópio.
- Medir a função de correlação temporal da intensidade de luz dispersa através dos seguintes passos 2.1.4-2.1.8. Se a amplitude inicial é maior do que 0,2, ajustar o ponto focal para tornar a amplitude iniciais da função de correlação de tempo inferior a 0,2 seguindo o passo 2.1.9. Uma pequena amplitude inicial simplifica a análise.
- Regule a temperatura do estágio de 35 ° C e aguarde até que a solução se torna turva. A temperatura crítica inferior de solução (TCIS) da solução PNIPA é de 32 ° C 15.
- Medir a função de correlação de tempo seguindo os passos 2.1.4-2.1.8. Se possível, ajustar a posição do ponto focal para tornar a amplitude iniciais da função de correlação de tempo inferior a 0,2. Para soluções turvas, as suas amplitudes iniciais tendem a aumentar, desde que a intensidade da luz aumenta os dispersos, enquanto que a luz reflectida de permanece constante.
- Aplicar o inverso Laplace transformatiem que as funções de correlação de tempo obtidas para obter as funções de distribuição de tamanho. Note-se que o tamanho real é metade do valor obtido em casos onde a amplitude inicial é inferior a 0,2.
Resultados
Funções tempo de correlação de intensidade da luz dispersa para uma suspensão de látex de poliestireno (raio de partícula: 50 nm) foram medidos em diferentes pontos focais, como mostrado na Figura 2 (a). Estas funções de correlação foram convertidos para as funções de distribuição do raio hidrodinâmico pela transformação inversa de Laplace (consulte a Figura 2 (b) e (c)). Utilizando o mesmo procedimento, as funções de correlação de tempo e funções de distribuição do raio hidrodinâmico da solução PNIPA foram obtidos a 25 ° C e 35 ° C, respectivamente. As Figuras 3 (a) e (b) mostram as funções de correlação de tempo da intensidade da luz dispersa e as funções de distribuição de tamanho correspondente da solução abaixo PNIPA (25 ° C) e acima (35 ° C) a TCIS. As funções de distribuição de tamanhos foram obtidos pela transformação inversa de Laplace seguido pelacorreção do heterodyne parcial. O raio hidrodinâmico médio abaixo da TCIS é de várias dezenas de nanómetros, o que é típico para soluções de polímero. Em contraste, o raio hidrodinâmico acima da TCIS é de cerca de 1,0 um. Este resultado é consistente com o facto que a solução é turva acima da TCIS. As linhas vermelhas e azuis na Figura 3 representam a distribuição do tamanho de soluções PNIPA obtidos imediatamente após 20 min e após a solução se tornar turva, respectivamente. A Figura 3 (b) indica claramente o crescimento da agregação.
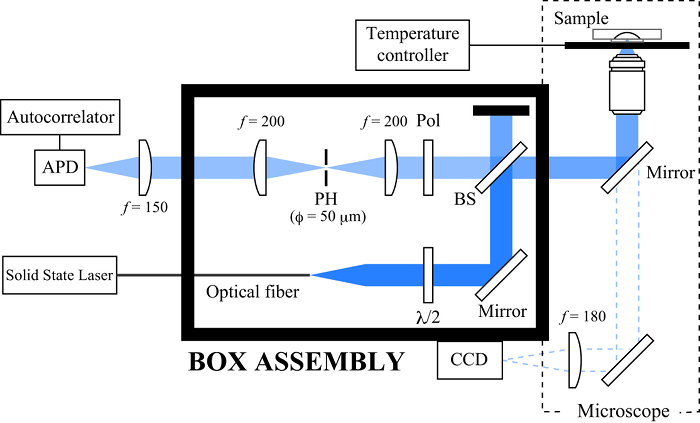
Figura 1. Esquema do microscópio de dispersão de luz dinâmica. Pinhole (PH), divisor de feixe (BS), polarizador (Pol) e fotodiodo avalanche (APD). Por favor clique aqui para veruma versão maior desta figura.
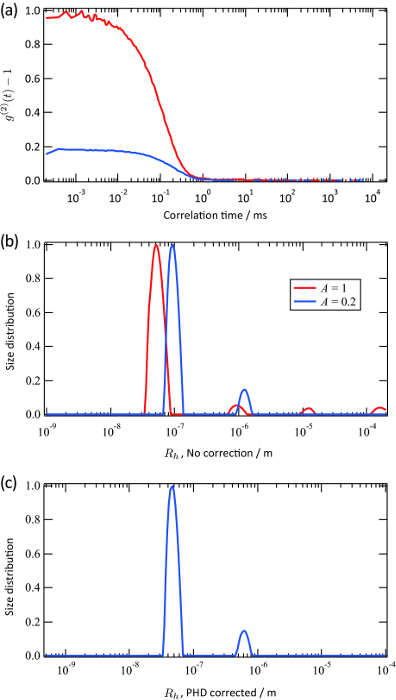
Figura 2. Os resultados representativos de uma suspensão de látex de poliestireno. (A) funções de correlação temporal da intensidade da luz dispersa para a suspensão de látex de poliestireno. O raio nominal é de 50 nm, e a concentração é de 0,1% em peso. Dois conjuntos de dados foram obtidos a partir de diferentes pontos de dispersão. (B), (c) funções de distribuição de tamanho correspondente para a suspensão de látex de poliestireno, obtidos por transformação inversa de Laplace de (a). A linha vermelha corresponde à função de correlação de tempo cuja amplitude inicial é de cerca de 1,0, e a linha azul corresponde ao que com uma amplitude inicial que é de aproximadamente 0,2. O eixo horizontal foi calculado sem (b) e com (c), considerando o efeito de heterodyning parcial (PHD), quando A << ; 1. Por favor, clique aqui para ver uma versão maior desta figura.
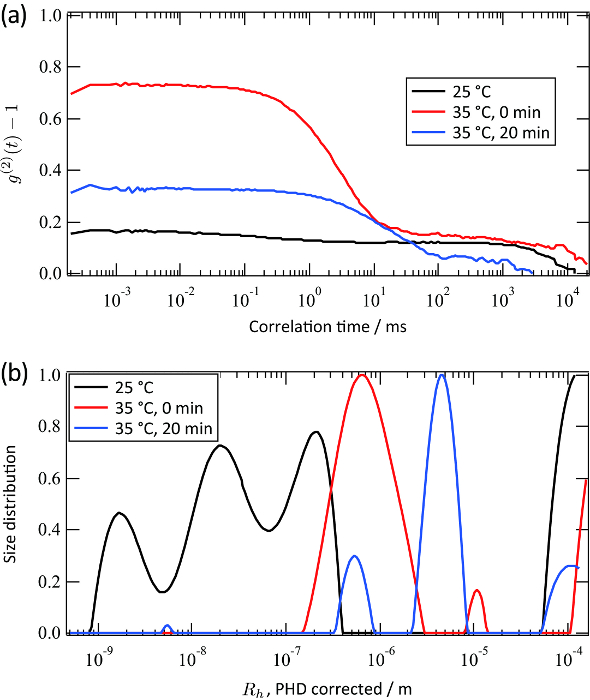
Figura 3. Os resultados representativos para uma solução PNIPA. (A) funções de correlação temporal de intensidade de luz dispersa para a solução PNIPA. (B) funções de distribuição de tamanho correspondente para a solução PNIPA obtido pela transformação inversa de Laplace de (a). O eixo horizontal foi calculado considerando o efeito de heterodyning parcial para cada conjunto de dados. A linha preta representa os dados obtidos a 25 ° C. A linha vermelha representa os dados obtidos imediatamente após a solução se tornar turva (35 ° C). A linha azul representa os dados obtidos após uma medição de 20 min da linha vermelha./54885/54885fig3large.jpg "Target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
Discussão
A amplitude inicial da função de correlação de tempo depende muito do ponto focal, como mostrado na Figura 2 (a). Isto aparentemente contraria o facto de que a solução é homogénea (excepto para a camada fina na interface) 8. Esta variação na amplitude inicial é atribuída a uma variação na quantidade de luz reflectida. Teoria heterodyne parcial 16 prevê que a amplitude inicial, A, a intensidade da luz dispersa, eu s, e a intensidade da luz refletida, I r, satisfazer a seguinte equação 1
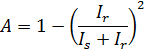
Esta equação mostra que a maior I r torna-se, o mais pequeno se torna um. Portanto, A é reduzida, definindo a posição focal próximo da interface. A aparente de difusão constante D Um can ser obtido ajustando a função de correlação de tempo no caso de soluções monodispersas:
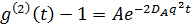
Onde 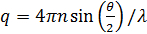 . Aqui, n é o índice de refracção do solvente (água, 1,33), θ é o ângulo dispersa (180 °), e λ é o comprimento de onda da luz (514,5 nm). Uma vez que aplicada geometria retroespalhamento, o valor de q é fixo. No entanto, este ponto é resolvido pelo uso de diferentes comprimentos de onda de luz. Por favor note que qualquer tipo de fonte de laser de onda contínua está disponível para construir o microscópio DLS. Graças ao pequeno volume irradiado, o factor de coerência 17 está estimada em mais de 0,99 e é insignificante. Para soluções polidispersos, a função de distribuição de D A é obtido pela transformação inversa de Laplace. th heterodyne parciaiseory também prevê que D A não é a mesma que a constante de difusão D efectiva. Estas duas constantes de difusão satisfazer a seguinte equação:
. Aqui, n é o índice de refracção do solvente (água, 1,33), θ é o ângulo dispersa (180 °), e λ é o comprimento de onda da luz (514,5 nm). Uma vez que aplicada geometria retroespalhamento, o valor de q é fixo. No entanto, este ponto é resolvido pelo uso de diferentes comprimentos de onda de luz. Por favor note que qualquer tipo de fonte de laser de onda contínua está disponível para construir o microscópio DLS. Graças ao pequeno volume irradiado, o factor de coerência 17 está estimada em mais de 0,99 e é insignificante. Para soluções polidispersos, a função de distribuição de D A é obtido pela transformação inversa de Laplace. th heterodyne parciaiseory também prevê que D A não é a mesma que a constante de difusão D efectiva. Estas duas constantes de difusão satisfazer a seguinte equação:
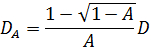
A constante de difusão D é convertido no raio Rh hidrodinâmico utilizando a equação de Stokes-Einstein 4. Quando A = 1, esta relação se torna D A = D. Neste caso, o processo de conversão de dados é o mesmo que o descrito para a dispersão dinâmica de luz comum. A linha vermelha mostrada na Figura 2 (b) corresponde a este caso. Em contraste, esta relação torna-se D A = 0,5 D ao limite de A → 0. Por conseguinte, o tamanho é estimada para ser duas vezes tão grande como o tamanho real quando A é pequeno (na prática, inferior a 0,2), como mostrado pela A linha azul da Figura 2 (b) . Se se sabe que A é significativamente pequena, o eixo horizontal pode ser deslocado, como mostrado na Figura 2 (c). Em princípio, podemos converter D A em D para qualquer valor de. Na prática, no entanto, é melhor para definir a amplitude inicial menor do que 0,2, uma vez que a aproximação simples D A ~ 0,5 D é válido.
As características proeminentes da técnica de dispersão de microscópio de luz dinâmica foram demonstrados usando uma solução PNIPA. A conformação do PNIPA abaixo e acima da TCIS tem sido extensivamente estudada usando pequeno ângulo de dispersão de neutrões 15,18. Em contraste, a dispersão dinâmica de luz não tem sido utilizada para a análise de PNIPA acima da TCIS devido à sua turbidez 19. Este problema é resolvido pelo microscópio de luz de dispersão dinâmica, como se mostra nas Figuras 3 (a) e (b). O tamanho destes agregados é várias &# 181; m, o que não pode ser obtida por qualquer pequeno ângulo de raios X de dispersão / neutrões ou técnicas de dispersão de luz convencionais. medições resolvida no tempo usando este sistema dar informações sobre o processo de agregação durante a mudança de temperatura.
A desvantagem do microscópio de dispersão de luz dinâmica é também ilustrada na Figura 3. Para o resultado abaixo da TCIS, a função de correlação de tempo é fortemente afetada pela pequena quantidade de poeira presente (as linhas pretas na Figura 3). Por exemplo, a função de correlação de tempo não se decompor completamente, mesmo com tempos de correlação da ordem de 1,0 s. Isto é porque o volume irradiado com este aparelho (aproximadamente 1.0 um) é significativamente menor do que irradiada com o aparelho de dispersão de luz dinâmica habitual (cerca de 100 um). Nos casos em que a intensidade de luz dispersa é fraco, o sinal está obscurecido pelo ruído, tal como a causada por Squantidades de shopping de poeira na solução. Portanto, os três picos mostrados na Figura 3 (b) pode não ter importância quantitativa embora a ordem geral do tamanho é significativa. Note-se que um espalhador tal fraco pode ser medida por um aparelho de dispersão de luz dinâmica convencional.
Nós demonstramos que a dinâmica microscópio de dispersão da luz permite-nos medir amostras tanto transparentes e turvos com a mesma configuração. Uma vez que o comprimento do percurso óptico nas amostras é curto, esta técnica pode ser aplicada a amostras de absorção de luz fortes, tais como suspensões de nanotubos de carbono 20. Além disso, devido à sua alta resolução espacial, esta técnica pode ser aplicada a células biológicas. Para a sua aplicação para a biologia, este método também pode ser combinada com outras técnicas de imagiologia, tais como imagiologia de fluorescência e Raman. Assim, acreditamos que a dinâmica microscópio de dispersão da luz é uma ferramenta poderosa para uma ampla gama de campos de pesquisa.
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work has been financially supported by Grants-in-Aid for Scientific Research from the Ministry of Education, Culture, Sports, Science, and Technology (No. 25248027 to M.S.).
Materiais
| Name | Company | Catalog Number | Comments |
| N-isopropylacrylamide, 98% | Tokyo Chemical Industry Co., Ltd. | I0401 | |
| toluene, 99% | Wako Pure Chemical Industries, Ltd. | 201-01876 | |
| petroleum ether, distillation temperature 30 ~ 60 °C | Wako Pure Chemical Industries, Ltd. | 169-22565 | |
| N,N,N',N'-tetramethylethylenediamine, 99% | Sigma | T9281 | |
| ammonium persulfate, 98% | Sigma | 248614 | |
| polystyrene latex suspension, 1 wt% | Duke Scientific Corporation | 3500A | |
| argon | Koike Sanso Kogyo Co., Ltd. | purity > 99.999 vol.% | |
| cavity slide | Matsunami Glass Ind.,Ltd. | 83-0336 | |
| inverted microscope | Nikon Instech Co., Ltd. | ECLIPSE Ti-U | |
| Thermo Plate | Tokai Hit CO.,Ltd | TP-108R-C | |
| Solid-state laser | Coherent | OBIS 488LX | |
| avalanche photodiode | ALV-GmbH | ALV-High Q.E. Avalanche Photo Diode | |
| correlator | ALV-GmbH | ALV-5000/EPP |
Referências
- Hiroi, T., Shibayama, M. Dynamic Light Scattering Microscope: Accessing Opaque Samples with High Spatial Resolution. Opt. Express. 21, 20260-20267 (2013).
- Barth, H. G., Flippen, R. B. Particle Size Analysis. Anal. Chem. 67, 257-272 (1995).
- Liu, Y., Wang, Z., Zhang, X. Characterization of supramolecular polymers. Chem. Soc. Rev. 41, 5922-5932 (2012).
- Berne, B. J., Pecora, R. Dynamic Light Scattering with Applications to Chemistry, Biology and Physics. , Dover Publications, Inc. (2000).
- Phillies, G. D. J. Experimental demonstration of ruultiple-scattering suppression in quasielastic-light-scattering spectroscopy by homodyne coincidence techniques. Phys. Rev. A. 24, 1939-1943 (1981).
- Phillies, G. D. J. Suppression of multiple scattering effects in quasielastic light scattering by homodyne crosscorrelation techniques. J. Chem. Phys. 74, 260-262 (1981).
- Ishii, K., Yoshida, R., Iwai, T. Single-scattering spectroscopy for extremely dense colloidal suspensions by use of a low-coherence interferometer. Opt. Lett. 30, 555-557 (2005).
- Xia, H., Ishi, K., Iwai, T. Hydrodynamic Radius Sizing of Nanoparticles in Dense Polydisperse Media by Low-Coherence Dynamic Light Scattering. Jpn. J. Appl. Phys. 44, 6261-6264 (2005).
- Maret, G., Wolf, P. E. Multiple light scattering from disordered media. The effect of brownian motion of scatterers. Z. Phys. B. 65, 409-413 (1987).
- Pine, D. J., Weitz, D. A., Chaikin, P. M., Herbolzheimer, E. Diffusing wave spectroscopy. Phys. Rev. Lett. 60, 1134-1137 (1988).
- Cerbino, R., Trappe, V. Differential Dynamic Microscopy: ProbingWave Vector Dependent Dynamics with a Microscope. Phys. Rev. Lett. 108, 188102(2012).
- Lu, P. J., et al. Characterizing Concentrated, Multiply Scattering, and Actively Driven Fluorescent Systems with Confocal Differential Dynamic Microscopy. Phys. Rev. Lett. 108, 218103(2012).
- Provencher, S. W. A constrained regularization method for investing data represented by linear algebraic or integral equations. Comp. Phys. Comm. 27, 213-227 (1982).
- Provencher, S. W., Stepanek, P. Global analysis of dynamic light scattering autocorrelation functions. Part. Part. Syst. Charact. 13, 291(1996).
- Takata, S., Norisuye, T., Shibayama, M. Small-angle Neutron Scattering Study on Preparation Temperature Dependence of Thermosensitive Gels. Macromolecules. 35, 4779-4784 (2002).
- Pusey, P. N., van Megen, W. Dynamic Light Scattering by Non-Ergodic Media. Physica A. 157, 705-741 (1989).
- Chu, B. Laser Light Scattering. 2nd Ed. , Academic Press. (1991).
- Shibayama, M., Tanaka, T., Han, C. C. Small-Angle Neutron-Scattering Study on Poly(N-Isopropyl Acrylamide) Gels near Their Volume-Phase Transition-Temperature. J. Chem. Phys. 97, 6829-6841 (1992).
- Tanaka, T., Sato, E., Hirokawa, Y., Hirotsu, S., Peetermans, J. Critical Kinetics of Volume Phase Transition of Gels. Phys. Rev. Lett. 55, 2455-2458 (1985).
- Hiroi, T., Ata, S., Shibayama, M. Transitions of Aggregation States for Concentrated Carbon Nanotube Dispersion. J. Phys. Chem. C. 120, 5776-5782 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados