Method Article
Imaging o neutrófilos fagossoma e citoplasma utilizando um indicador de pH Ratiometric
Neste Artigo
Resumo
Este manuscrito descreve um método simples para medir o pH e phagosomal área, bem como o pH citoplasmática de neutrófilos humanos e de rato utilizando o indicador de medida proporcional seminaphthorhodafluor (SNARF) -1, ou S-1. Isto é conseguido usando microscopia de fluorescência confocal ao vivo de células e análise de imagem.
Resumo
Os neutrófilos são cruciais para hospedar defesa inata e, consequentemente, constituem uma importante área de pesquisa médica. O fagossoma, o compartimento intracelular onde a matança e digestão de partículas engoliram ter lugar, é a principal arena para neutrófilos matar patógeno que exige uma regulamentação apertada. Phagosomal pH é um aspecto que é cuidadosamente controlada, por sua vez, regula a actividade de protease antimicrobiana. Muitos corantes sensíveis ao pH fluorescentes têm sido usados para visualizar o ambiente phagosomal. S-1 tem várias vantagens sobre outros corantes sensíveis ao pH, incluindo o seu espectro de emissão dual, a sua resistência à foto-branqueamento, e o seu pKa elevado. Usando este método, temos demonstrado que o fagossoma neutrófilos é invulgarmente alcalina em comparação com outros fagócitos. Ao utilizar diferentes conjugações bioquímicas do corante, a fagossoma podem ser delineados a partir do citoplasma de modo que as mudanças no tamanho e forma do fagossoma pode ser avaliada. Isso permite que fou ainda a monitorização do movimento iónico.
Introdução
O neutrófilo é a célula imune inata mais abundante no corpo. A sua função principal consiste em patrulha a corrente sanguínea e engolindo e digerindo as partículas estranhas que podem ocorrer em um processo conhecido como fagocitose 1, 2. As partículas são degradados num compartimento intracelular chamado o fagossoma. A activação de neutrófilos oxidase de NADPH, o NOX2 isoforma, inicia uma cascata de reaces bioquicas que culmina na morte do agente patogénico. Subunidades proteicas NOX2 prosseguir para formar um complexo de cadeia de transporte de electrões na membrana phagosomal 3. Uma vez activado, que transporta electrões de NADPH através da membrana para o oxigénio molecular no interior do fagossoma, produzindo aniões superóxido e das espécies reactivas de oxigénio adicional. Isto é conhecido como a explosão respiratória, e pensa-se ser essencial para matar microbiana eficiente e digestão 2 . No entanto, este movimento exclusivo de carga negativa através da membrana logo inativar NOX2 se não fosse compensada pela carga positiva entrando e / ou carga negativa saindo do fagossoma. Tem sido bem estabelecido que a maioria de compensação de carga no neutrófilo é levada a cabo pelo canal de protões HVCN1 4, 5. Esse canal permite o movimento passivo de protões para baixo do seu gradiente electroquimico do citosol para o fagossoma. concentração de protões é reflectida pelo pH, assim, para um dado nível de actividade de oxidase, medindo o pH no fagossoma pode fornecer informações sobre a contribuição relativa de vias protónicos e não protónicos em compensação de carga.
O fagossoma de neutrófilos humanos tem um pH alcalino de cerca de 8,5 durante 20-30 minutos após a fagocitose 5. Isto implica a existência de canais de iões não-protões adicionais em NOX2-induzida de compensação de carga, como a fusão e a libertação dos conteúdos dos grânulos acídicos e único compensação por HVCN1 iria manter um ambiente ácido, em contraste com o observado. O movimento de iões para compensar esta carga negativa podem também exercer mudanças no tamanho do fagossoma por osmose. Estes iões podem estar presentes na neutrófilos em altas concentrações fisiológicas: iões de potássio foram mostrados para mover no fagossoma 6, e o movimento iónico é cloreto de outro candidato importante para a função dos neutrófilos 7.
A regulação de pH no fagossoma é vital para a actividade de protease antimicrobiana 5. Mieloperoxidase (MPO) parece ter uma actividade tima a um pH de 6, enquanto que para a catepsina G e da elastase, os níveis óptimos são pH 7-9 e pH 8-10, respectivamente 5. Por conseguinte, a mudança transitória em pH phagosomal pode fornecer nichos de actividade para as diferentes enzimas a diversãocção. Entender como pH está envolvida na morte microbiana neutrófilos pode fornecer informações úteis para a criação de novos agentes microbianos de aumento de neutrófilos.
O fagossoma neutrófilos é um ambiente altamente reactivo. Isso torna difícil avaliar com precisão pH, porque corantes podem ser facilmente oxidado, levando a artefactos técnicos. Historicamente, o isotiocianato de fluoresceína (FITC) foi o corante de escolha para medir o pH intracelular 8, 9. No entanto, existem algumas desvantagens para a sua utilização na medição de pH de neutrófilos phagosomal. Ele tem um pKa de 6,4 10, o que significa que só pode precisamente ser usado para avaliar os níveis de pH 5-7,5 8, uma vez que satura a pH <8 11. Como o pH neutrófilos phagosomal pode tornar-se muito mais alcalino 5, FITC não pode capturar toda a gama de potenciais alterações de pH. Um outro signifiproblema não pode com FITC no contexto de neutrófilos é que ele é pensado para ser Foto-descoloração por MPO 12. O inibidor de MPO, azida de sódio, pode ser utilizado para limitar a fotodegradação 13, mas foi demonstrado que reduz a azida de sódio directamente o pH phagosomal de forma MPO-independente e é, portanto, inadequado para uso em tais ensaios 5.
Em comparação com outros corantes intracelulares, S-1 tem um nível relativamente elevado de pKa de 7,5 a 10. Em condições ácidas, a molécula é protonado e produz um sinal de emissão entre 560 e 600 nm quando excitado a 488 nm ou acima. Quando a molécula é desprotonado em condições mais alcalinas, o comprimento de onda de emissão é de mais de 600 nm. A razão entre as intensidades de fluorescência a estes dois comprimentos de onda indica a mudança de emissão, o que é mais fiável do que as medições de fluorescência únicas, uma vez que não é afectado pela concentração de fluoróforo e estrutura celular. S-1 podem ser conjugados com material antigénico, tal como o zimosano 14, embora seja preferido o calor-morto (HK) Cândida albicans, como a maior área de superfície dá uma leitura de fluorescência mais consistente.
Temos também utilizado uma modificação do método para estudar alterações temporais no pH (Figura 3) 5. Este método para a medição do pH citosólico pode ser facilmente aplicado a outros tipos de células, como descrito noutro local 15, 16, e as células com fagossomas mais alcalinas 14.
Protocolo
declaração de ética: Todo o trabalho animal foi realizado com a licença e aprovação do Home Office do Reino Unido. participação humana nesta pesquisa foi aprovado pelos comités mistos UCL / UCLH sobre a ética da pesquisa humana. Todos os participantes forneceram consentimento informado.
1. Preparação de C. albicans
- Crescer um disco Candida (ver Lista de Materiais) em uma placa de agar YPD, conforme as instruções do fabricante. Escolha uma colônia e adicioná-lo a 15 ml de caldo YPD. Incubar-lo em uma incubadora com agitação a 30 ° C e 200 rpm até que o caldo é turvo (geralmente cerca de 2 dias, ou a uma concentração de cerca de mais de 1 x 10 9 / mL).
- Girar a forma Candida e ressuspender-lo em 50 ml de solução salina tamponada com fosfato (PBS). Centrifugar a 3.000 xg durante 10 min. Repita este passo duas vezes.
- Colocar o tubo contendo 50 ml de meio PBS / Candida em um banho de água pré-aquecido a 60 ° C, de modo que todo o tubo é submerged durante 1 h.
- Para confirmar que a Cândida são mortas pelo calor, sequência de uma amostra numa placa de agar YPD e incubar durante a noite a 30 ° C. Ajustar a concentração morta pelo calor (HK) Candida a 5-9 x 10 8 / mL, dependendo do crescimento de Candida, e armazená-lo em aliquotas de 1 ml num congelador -20 ° C.
Nota: Todas as contagens de células em este protocolo foram realizadas utilizando um contador de células automatizado.
- Para confirmar que a Cândida são mortas pelo calor, sequência de uma amostra numa placa de agar YPD e incubar durante a noite a 30 ° C. Ajustar a concentração morta pelo calor (HK) Candida a 5-9 x 10 8 / mL, dependendo do crescimento de Candida, e armazená-lo em aliquotas de 1 ml num congelador -20 ° C.
2. S-1 de acoplamento para aquecer-morto (HK) Candida
- Prepara-se uma alíquota de carboxi-S-1 de éster de succinimidilo (50 g) diluindo-lo em 100 mL de sulfóxido de dimetilo de grau elevado (DMSO). Vortex bem para misturar.
- Preparar 1 mL de 1 x 10 8 HK Candida em bicarbonato de sódio 0,1 M (pH 8,3) num tubo de 15 mL.
- Adicionar 100 mL de carboxi-S-1 uma gota de cada vez para o HK Candida, enquanto se mistura num vórtice a aproximadamente 2000 rpm (velocidade média a alta). Enrole foi alumíniol em torno do tubo e colocá-lo num rolo à temperatura ambiente durante 1 h.
- Lava-se a HK Candida- S-1 (HKC-S-1), três vezes por centrifugação a 2250 xg durante 10 minutos cada. Para as duas primeiras lavagens, ressuspender o sedimento em 15 mL de bicarbonato de sódio 0,1 M (pH 8,3). Após a terceira lavagem, ressuspender-lo em 1 ml de tampão equilibrado solução salina (BSS) (ver Tabela 1).
- Transferir os HKC-S-1 da suspensão para dentro de tubos em aluotas de 100 e armazená-las a -20 ° C.
NOTA: Usar tubos com material de ligação de superfície baixa, se possível, como HKC-S-1 partículas pode furar a parede de tubos de centrifugação normais. - Opsonizar HKC-S-1
- Para os neutrófilos humanos, adiciona-se 100 uL de soro de IgG humano a 100 uL de descongeladas HKC-S-1.
- Para neutrófilos de rato, adicionar 50 ul de soro de ratinho normal e 50? L de rato Candida no soro imune (gerado a partir de ratos C57B6 injectados com Cândida HK) 5 a 100 uLde HKC-S-1.
- Misturá-lo em um calor agitador a 37 ° C e 1100 rpm durante 60-90 min, e, em seguida, sobre um rolo de 4 ° C durante 2 h.
- Lavar três vezes em tampão BSS por centrifugação a 17200 xg durante 1 min cada. Ressuspender em 100 uL de tampão BSS.
3. Isolamento de Neutrófilos
- Para neutrófilos de sangue periférico humano, tomar 15 ml de sangue por punção venosa a partir de um dador saudável e colocá-lo em uma seringa de 20 mL contendo 90 mL de solução de heparina sódica 1000 UI / mL (60 uL de heparina / 10 mL de sangue).
- Utilizando uma ponta de pipeta, injectar 1,5 ml de solução de dextrano a 10% para dentro da seringa. Invertê-lo suavemente 3 vezes e deixá-lo de pé no banco.
- Esperar 30-60 minutos, até que o sangue é dividida aproximadamente em metade, com uma camada buffy coat topo que é cor de palha, e uma camada inferior contendo eritrócitos.
- Cuidadosamente empurrar para fora a camada superior por meio de uma agulha ou removê-lo com uma ponta de pipeta. Coloque-ind tubo de 15 mL. Evite tirar a camada de vermelho. Usando uma pipeta de 5, adicionar 3-4 mL de meio de gradiente de densidade (ver Lista de Materiais) para o fundo do tubo por baixo da camada buffy coat para se obter duas camadas distintas. Centrifugar a 913 xg durante 10 min.
NOTA: Se usando neutrófilos de rato (ver referência 17 para o isolamento dos neutrófilos de rato), utilizar a suspensão de células que foi descarregado a partir da medula óssea, em vez. - Deitar fora o sobrenadante, deixando para trás uma bolinha vermelha. Suavemente vortex para perturbar o sedimento. Adicionar 7 ml de água destilada, H autoclavados 2 O para o sedimento e inverter durante 20 s para ressuspender o sedimento. Adicionar 7 ml de solução salina e 2x inverter algumas vezes para misturar, a lise das células vermelhas do sangue remanescentes.
- Centrifugar a 300 xg durante 5 min. Decantar o sobrenadante e ressuspender o sedimento em tampão BSS para cerca de 4 x 10 6 / mL.
NOTA: Para a microscopia óptimo das células, manter a concentração da suspensão de células entre 1,5-6 x 10 6 / mL.
4. Preparação de Lâminas
- Pré-tratar uma chapa de microscopia de 8 poços (ver Lista de Materiais) com 200 ul de poli-L-lisina (solução 0,01%) em cada poço durante 40-60 min à temperatura ambiente.
- Remover o poli-L-lisina (pode ser reutilizada) e lavar os poços duas vezes com 200 mL de H2O destilada
- Adicionar 200 uL de suspensão de células, preparado no passo 3.6 a cada poço. Incubar à temperatura ambiente durante 30-60 min.
- Prepara-se uma alíquota de 5- (e-6) -carboxi-1 S acetoximetilo (S-1-AM) éster (50? G) por adição de 100 uL de DMSO de grau elevado a um tubo. Vortex para misturar. Quando não estiver em utilização, armazenar a -20 ° C.
- Em um pequeno tubo, adicionar 1,7 ml de tampão BSS e 20 uL de S-1-AM. Vortex para misturar.
- Lavam-se os poços duas vezes com 200 mL de tampão BSS, e então substituir o tampão com a solução de S-1-AM. Tome cuidado para não perturbar a monocamada de células ligados ao fundo do poço com cuidado pipetandopara baixo nas paredes dos poços. Incubar à temperatura ambiente durante pelo menos 25 min.
- Lavam-se os poços duas vezes com 200 uL de tampão BSS. Para testar um inibidor, fazer-se uma "mistura principal" do fármaco apropriado em tampão BSS. Lavam-se os poços duas vezes na solução de inibidor.
NOTA: Certifique-se usar a mesma quantidade de veículo do fármaco (por exemplo, DMSO ou etanol) no controlo assim como foi utilizado para o inibidor. Se testar o efeito do cloreto de zinco, usar tampão BSS falta de KH 2 PO 4 (o HEPES pode tamponar a solução sozinho), como zinco precipitados com fosfato. - Sonicar a opsonizado HKC-S-1 (secção 6.2) durante cerca de 3 s a 5 m de amplitude. Adicionam-se 10 uL a cada poço. Incubar a placa a 37 ° C durante 15-20 minutos para permitir a fagocitose, tornando as células de pronto a ser trabalhada para instantâneos da fagocitose.
5. microscopia confocal
- Usando um microscópio confocal, ajustar o comprimento de onda do laser de modo them que as células são animado a 555 nm e o de emissão é detectada por dois canais, ou detectores: 560-600 nm e a 600 nm.
NOTA: Os parâmetros microscópio específicos serão diferentes para cada microscópio e precisam ser otimizados pelo pesquisador. - Ver as células usando uma lente de 63X com óleo. Usar uma imagem de telha-scan do ajuste contínuo para ver a peça central. Usando a intensidade de fluorescência e ganho de canais de detecção, ajustar o foco ea intensidade do laser e o ganho dos dois canais para otimizar a imagem.
- Dividir a imagem usando as configurações para ver ambos os canais; verifique que não há saturação da intensidade de fluorescência no citoplasma ou vacúolos. Saturação aparece como pontos vermelhos. Reduzir a intensidade do laser de modo que haja um número mínimo de pontos vermelhos, mas as células e phagosomes são brilhantes o suficiente para ver claramente.
- Quando estiver satisfeito, clique em "Iniciar a experiência." Uma imagem de digitalização 9-telha é gerado. Salve a imagem como um arquivo complexo recomendado peloo software que contém uma imagem compósita de dois canais (não TIFF ou JPEG).
6. Experiências de calibração
- Construir a curva padrão de pH com sozinho Candida.
- Prepare os tampões de pH 3,0-13,0, conforme indicado na Tabela 1.
- Tomar uma aliquota (100 uL) de HKC-S-1. Girá-lo para baixo durante 1 min a 17.200 x g. Ressuspender-lo em 500 uL do tampão atribuído.
- A partir do intervalo de pH mais baixo, adicionar a suspensão para um pré-tratamento bem (a partir do passo 4.2). Colocar a lâmina do microscópio confocal sobre uma fase aquecida ajustado para 37 ° C.
- Grave a fluorescência a cada min para 10 min. Repetir para cada tampão.
- Saponina curva padrão.
- Isolar 1 x 10 7 neutrófilos humanos 5 e suspendê-las em 1 mL do tampão de pH mais baixo.
- Seguir o processo descrito na secção 4 para medir a ppH hagosomal em neutrófilos.
- Após a incubação com a suspensão Candida durante 20 min, adicionar 0,3% de saponina (15 ul de estoque de 10% de um pré-tratamento bem (a partir do passo 4.2)) para o prato, e, em seguida, incuba-se durante 20 min a 37 ° C. Tome uma imagem a cada minuto, durante 10 min. Repetir para cada tampão.
- Curvas padrão pH citosólicas usando o elevado de K + / nigericina técnica de 5, 18, 19.
- Adicione-se os tampões descritos na Tabela 1, a partir de pH 4,0 a 13.0.
- Siga passos 4,1-4,7, deixando apenas os neutrófilos nos poços pré-tratada - cada cavidade para conter um tampão diferente. Adicionar a corrediça para a fase aquecida a 37 ° C e registar a fluorescência de cada min durante 10 min.
- Nota: Pode levar algum tempo para que o pH citosólico para estabilizar com a solução externa, mas após este ponto, o valor da relação de S-1 se tornaconstante. Medindo as extracelulares HKC-S-1 em cada experiência pode servir como um controlo para verificar se quaisquer inibidores adicionados não interferem com a fluorescência emitida S-1 ou afectar o pH do tampão.
Análise 7. Imagem
NOTA: Aqui, é fornecido instruções para análise de imagem (quantificação de fluorescência) usando o ImageJ software livre. Uso de ImageJ é recomendado.
- Faça o download e instale a versão ImageJ> 1.46r como por instruções do desenvolvedor (https://imagej.nih.gov/ij/). Instale o arquivo de código suplementar anexado com este protocolo chamado de “medição Phagosomal.”
- Abrir imagem J e carregar o arquivo de imagem escolhida para análise na barra de ferramentas. Para combinar os dois canais, use Imagem> Cor> Faça Composite.
- Botão direito do mouse para escolher um arquivo para armazenar resultados.
- Clique na ferramenta de linha na barra de ferramentas e clique duas vezes para aumentar a largura de & #34; 2 ".
- Desenhar uma linha em toda a largura de um fagossoma, e em seguida, clique com o botão direito a "medida pH". A intensidade média dos dois canais é adquirido, e seu índice é calculado automaticamente pelo arquivo de código em ImageJ.
- Depois de terminar as medições, botão direito do mouse para escolher "salvar o arquivo."
- Para medir a área do fagossoma, use o quarto ícone ao longo da barra de ferramentas para desenhar à mão livre ao redor da área. Botão direito do mouse para selecionar "medida área."
NOTA: Os resultados são salvas e um arquivo de log é gerado no diretório selecionado. Os resultados podem ser processados utilizando folha de cálculo, R, ou um software equivalente. A relação entre a razão de fluorescência para pH é aproximadamente sigmoidal, e os valores da relação gerados pela análise ImageJ pode ser convertido a pH utilizando uma função logística ou sigmóide generalizada ou por interpolao spline cúbica linear ou. - Para medir citoplasma, desenhar uma linha através do citoplasma e clique com o botão direito “medir pH”.
Resultados
A Figura 1 apresenta instantâneos dos neutrófilos a partir de diferentes origens para demonstrar ambientes phagosomal variados. Para facilitar a análise quantitativa, é importante para semear poços com um número adequado de células: demasiados fará com que as células de camada sobre a outra, o que torna difícil visualizar fagossomas fechados com precisão; muito poucos vontade, é claro, proporcionar menos resultados, particularmente porque nem todos os neutrófilos vai fagocitam. A Figura 2 é uma imagem que é sobre-saturado; este pode ser avaliado dividindo a imagem entre seus dois canais (usando o software microscópio recomendado na Lista de Materiais ou equivalente) - pontos vermelhos mostram onde foi detectado o máximo de fluorescência. Isto pode ser combatido através da redução da intensidade do laser. As curvas de calibrao utilizando os vários sistemas tampão são mostrados na Figura 3, adaptado de Levine et ai. 5 </ Sup>. As barras de erro mostram que há alguma variação na fluorescência entre as leituras. A figura 4 dá um exemplo de como os dados para pH phagosomal e área poderia ser apresentada. Esta abordagem permite que cada medição individual a ser visualizado com um boxplot-acabada. No entanto, os dados podem também ser exibidos em um gráfico de barras do histograma.
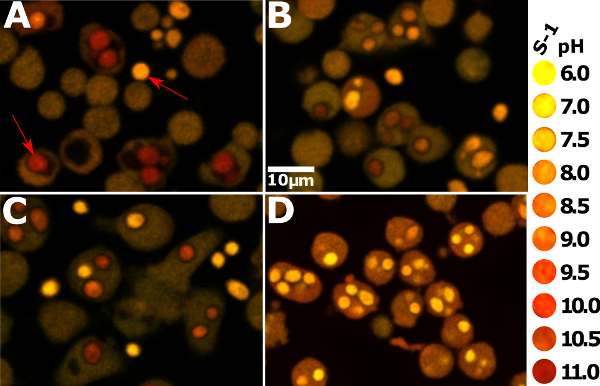
Figura 1: Imagens instantâneo apropriado de neutrófilos de seres humanos e ratinhos. Para o lado direito é uma chave visuais qualitativas da cor de aproximada os fagossomas S-1-coradas correspondentes ao pH. A cor amarela indica mais acidez, enquanto o vermelho indica mais alcalinidade. (A) mostra Hvcn1 - / - neutrófilos medula óssea de ratinho 20 min após a fagocitose. Os phagosomes aparecer muito vermelho, alcalina, e inchado. A seta vermelha na parte inferior direita daimagem aponta para um Cândida intracelular, enquanto que a seta no topo esquerda aponta para uma partícula extracelular. (B) mostra os neutrófilos de medula óssea de ratinho de tipo selvagem que ingeriram Candida; eles são muito menos alcalino do que Hvcn1 - / - células. (C) mostra neutrófilos de sangue periférico humano, ao mesmo ponto após a fagocitose. Eles aparecem ligeiramente mais alcalino do que as células de rato de tipo selvagem, mas os phagosomes ainda não são tão grande e vermelho como o Hcvn1 - / - células. (D) mostra neutrófilos humanos que têm fagocitados Cândida na presença de 5 uM de iodónio de difenileno (DPI). Todos os fagossomas são muito ácida, com um pH de 6 ou menos; o medicamento inibe a NADPH-oxidase, de modo que não existe movimento de iões de compensação. Os protões libertados a partir dos grânulos acídicos que se fundem com a fagossoma fazer com que o pH ácido 20, e aumento do recrutamento da V-ATPase ao thphagosomal membrana e, após tratamento com o DPI 9. O citoplasma também aparece mais alcalina em comparação com as células a partir das outras condições. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2: O excesso de saturação de Hvcn1 - / - de ratinho neutrófilos de medula óssea. É importante excluir a partir das imagens de análise em que os dados de fluorescência são sobre-saturada. Tal como descrito na secção 5.3, a imagem compósita é dividida em duas imagens (parte superior esquerda, seta vermelha) com ambos os canais apresentados individualmente. Neste software, indicador de gama é verificada em (na parte inferior esquerda, seta vermelha), então quaisquer pixels que são mais saturado são vermelho brilhante. Não é sobre-saturação presente em ambos os canais (1 e 2). A magnificação de algumas células e extracelular Candida é mostrado no canto inferior direito, com as setas que apontam para as áreas afectadas. Analisando estes pontos levaria a uma medida ratiometric falsa. Por favor clique aqui para ver uma versão maior desta figura.
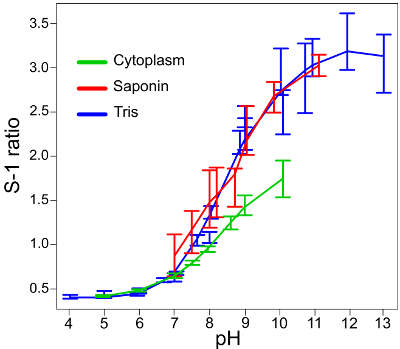
Figura 3: Curvas de calibração padrão para a conversão de S-1 proporções de fluorescência para medições de pH. As curvas padrão para Candida isoladamente em diferentes tampões (marcados como "Tris") e, quando as células são permeabilizadas com saponina ( "saponina") são muito semelhantes, mostrando que o S-1 de leitura dentro e fora da célula (fagossoma e extracelular médio) são comparáveis. As barras de erro representam a média ± SD. A curva em S-1 / relação de pH é reduzido quando testado in o citoplasma ( "citoplasma"), que devem ser levados em consideração na análise de imagem. Esta figura foi modificado a partir de Levine et ai. 5. Por favor clique aqui para ver uma versão maior desta figura.
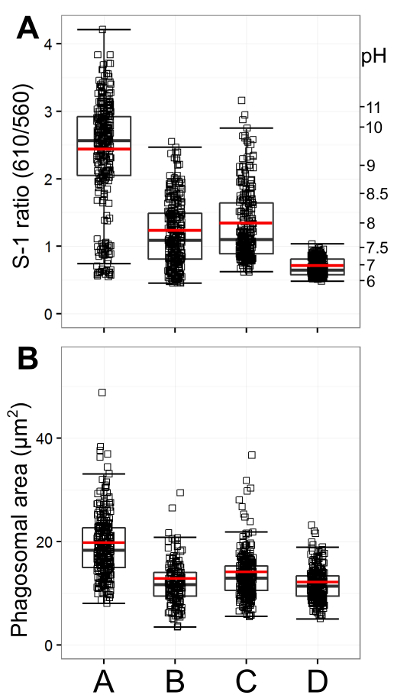
Figura 4: Quantificação do pH phagosomal e área. Esta figura apresenta um exemplo de apresentação de dados. Os gráficos foram gerados utilizando o software de programação R. A: mostra proporção phagosomal e correspondente pH para A (Hvcn1 - / - de ratinho neutrófilos de medula óssea), B: neutrófilos de medula óssea de ratinho de tipo selvagem, C: neutrófilos de sangue periférico humano, e D: humano neutrófilos com 5 uM DPI n = 3/300. medições individuais são mostrados como quadrados pequenos, com uma sobreposição de boxplot com medium e variação interquartil. Uma barra vermelha representa a média. Como se vê nas imagens na Figura 1, Hvcn1 - / - células têm fagossomas muito alcalinas, em comparação com rato de tipo selvagem e os neutrófilos humanos. Eles também têm uma área maior phagosomal (Figura 4B, n = 3/300). fagossomas neutrófilos humanos são ligeiramente mais alcalino e maior do que os neutrófilos de rato de tipo selvagem, enquanto que os neutrófilos humanos incubados com DPI têm fagossomas muito ácidas e pequenas. Por favor clique aqui para ver uma versão maior desta figura.
| Solução salina equilibrada (BSS) tampão | |||
| NaCl | 156 mM | ||
| KCl | 3 mM | ||
| MgSO4 | 2 mM | ||
| KH 2 PO 4 | 1,25 mM | ||
| CaCl2 | 2 mM | ||
| Glicose | 10 mM | ||
| Hepes | 10 mM | ||
| pH 7,4 com NaOH ou HCl | |||
| caldo YPD | |||
| caldo YPD | 50 g | ||
| Água destilada | 1? L | ||
| Autoclave a 121 ° C durante 15 min | |||
| Para agar YPD: antes da autoclavagem, adicionar 15 g / L de ágar | |||
| Solução de Dextrano 10% | |||
| grau clínico dextrano | 50 g | ||
| NaCl | 4,5 g | ||
| Água destilada | 500 ml | ||
| Adicionar ao frasco de vidro e autoclave a 121 ° C durante 15 min | |||
| 2x solução salina | |||
| NaCl | 18 g | ||
| Água destilada | 1? L | ||
| Adicionar ao frasco de vidro e autoclave a 121 ° C durante 15 min | |||
| Estoque Saponina 10% | |||
| tampão BSS | 50 ml | ||
| saponina | 5 g | ||
| tampão BSS calor a 37 ° C, adicionar saponina e misturar. | |||
| Adiciona-se 0,1% de azida de sódio como conservante, mistura armazenar a 4 ° C. | |||
| buffers de calibração | |||
| Candida curva padrão | |||
| Em primeiro lugar faz-se estoque de cada tampão de 0,15 M | |||
| Adicione-se uma solução 0,15 M de NaCl | |||
| 15 mL de volume final: 5 mL de 0,15 M de solução tampão desejado + 10 mL de soluo de NaCl 0,15 M | |||
| pH 3 | 100 mM de NaCl | glicina 50 mM | |
| pH 4 | 100 mM de NaCl | 50 mM de acetato | |
| pH 5 | 100 mM de NaCl | 50 mM de acetato | |
| pH 6 | 100 mM de NaCl | 50 mM de acetato | |
| pH 7 | 100 mM de NaCl | Tris 50 mM | |
| pH 8 | 100 mM de NaCl | Tris 50 mM | |
| pH 9 | 100 mM de NaCl | Tris 50 mM | |
| pH 10 | 100 mM de NaCl | glicina 50 mM | |
| pH 11 | 100 mM de NaCl | fosfato 50 mM | |
| pH 12 | 100 mM de NaCl | fosfato 50 mM | |
| pH 13 | 100 mM de NaCl | fosfato 50 mM | |
| Curva padrão citosólica | |||
| Use previamente feitos 0,15 M soluções tampão de estoque | |||
| Adicione-se uma solução 0,15 M de KCl | |||
| 15 mL de volume final: 5 mL de 0,15 M de solução de + 10 mL de 0,15 M de KCl tampão desejado | |||
| estoque 10 mM de nigericina em etanol, adicionar 15 ul de cada solução volume final | |||
| pH 3 | 100 mM de KCl | glicina 50 mM | nigericina 10 uM |
| pH 4 | 100 mM de KCl | 50 mM de acetato | nigericina 10 uM |
| pH 5 | 100 mM de KCl | 50 mM de acetato | nigericina 10 uM |
| pH 6 | 100 mM de KCl | 50 mM de acetato | nigericina 10 uM |
| pH 7 | 100 mM de KCl | Tris 50 mM | nigericina 10 uM |
| pH 8 | 100 mM de KCl | Tris 50 mM | nigericina 10 uM |
| pH 9 | 100 mM de KCl | Tris 50 mM | nigericina 10 uM |
| pH 10 | 100 mM de KCl | glicina 50 mM | nigericina 10 uM |
| pH 11 | 100 mM de KCl | fosfato 50 mM | nigericina 10 uM |
| pH 12 | 100 mM de KCl | fosfato 50 mM | nigericina 10 uM |
| pH 13 | 100 mM de KCl | fosfato 50 mM | nigericina 10 uM |
| pH de todas as soluções de calibração, quer com HCl ou NaOH | |||
Tabela 1: Composição de buffers. Esta tabela descreve as composições apropriadas dos diferentes tamps utilizados no protocolo.
Arquivo de código suplementar. Este arquivo contém um número de macros, escrito por AP Levine, que são necessários para análise de imagem. Os autores seriam felizes para tentar resolver quaisquer consultas associadas à utilização deste código. Por favor clique aqui para baixar esse arquivo.
Discussão
Uma vez que os reagentes adequados, configurações de microscópio, e experimentos de calibração são criadas, este método é relativamente simples de executar. Os passos críticos incluem: rotular a Candida com S-1 para garantir que não há nenhuma sobrecarga do corante, a calibragem, e a análise da imagem.
S-1 é um reagente adequado para ambientes de pH mais alcalino, o que é particularmente importante para os neutrófilos 21 mas limita o seu uso em determinados tipos de células. Para ambientes mais ácidos, tais como macrófagos, fagossomas SNARF-4, ou S-4, é mais apropriado por causa do seu mais baixo de pKa 22. Além disso, para leituras citoplasmáticos mais precisos, é melhor usar S-4, como a curva padrão para o S-1 mostra que os rácios de fluorescência começar a planalto abaixo de pH 6 (Figura 3). Outros corantes, tais como 2' , 7'-bis- (2-carboxietil) -5- (e-6) -Carboxyfluorescein (BCECF) ou pHrodo vermelhos pode também ser mais apropriada em um context que está prevista para ser ácida. No entanto, a coloração citoplasmática ainda é necessário para a identificação correcta dos fagossomas contendo Candida.
Uma característica importante de um indicador de pH phagosomal é que ele não é irreversivelmente alterada pelo ambiente phagosomal reactivo. S-1 parece ser resistente ao meio de neutrófilos. Isto é mostrado por Levine et ai. 5 (ver suplementar de vídeo 4 de referência 5) que demonstram a fagocitose e a libertação subsequente de uma partícula marcada Cândida S-1-por um Hvcn1 - / - de neutrófilos. Quando fagocitados, a partícula muda de amarelo / laranja para vermelho (pH neutro a alcalino), mas quando a partícula é libertada por neutrófilos, ele retorna à sua cor original.
É importante mencionar algumas das limitações associadas ao uso de S-1. O fato de que este corante tem dois espectros de emissão, permitindo meas raciométricaurement é uma vantagem, mas equipamento especializado é necessário para adquirir imagens; O microscópio utilizado para os experimentos devem ser capazes de gravar duas imagens simultaneamente ou com um atraso de tempo insignificante. Os autores assumem que o pesquisador tenta este protocolo tem experiência usando microscopia confocal, ou tem acesso a um profissional treinado. Não podemos listar todos os parâmetros microscópio específicos como eles serão diferentes para cada microscópio e precisam ser otimizados pelo pesquisador. O éster de acetoximetilo conjugado com S-1, que permite que o corante se difunda para dentro do citoplasma celular é degradada por esterases não-específicos no citoplasma da célula para formar a molécula fluorescente. Esterases, tal como fosfatase alcalina, estão presentes no soro humano e soro de bovino fetal, que são utilizadas para suplementar meios de cultura de células. Por conseguinte, o meio no qual as células são carregadas com S-1-AM (secção 4.5) não deve conter soro. Isso pode ser um desafio, se utilizando células que requerem uma mais nutrientes rich meio para sustentar a eles do que a solução salina balanceada utilizado ao longo deste protocolo. Da mesma forma, outros componentes do meio fluorescentes, tais como f enol vermelho, podem interferir com as medições de S-1.
As barras de erro na Figura 3 indicam que há alguma variação nas medidas de proporção em cada pH. Um número adequado de repetições de cada experiência (pelo menos, n = 3) e o maior número de medições individuais em cada única experiência são necessários para ultrapassar a variação inter-vacuolar. Assim, é aconselhável para medir o pH de pelo menos 100 fagossomas para cada condição e como muitas áreas phagosomal que parecem conter apenas um Cândida. Os fagossomas para ser medido por quantificação deveriam ser aqueles que têm engolida completamente uma partícula Cândida (isto é, aqueles completamente cercado por citoplasma). Para mitigar contra desvios não intencionais na selecção de células / fagossomas para quantificação, todas as análises deverão ser realizadas enquantocego para as condições experimentais.
Aqui, nós descrevemos o isolamento de neutrófilos por sedimentação com dextrano do sangue total por centrifugação seguido da camada de plasma através de um gradiente de densidade. Utilizamos esta técnica, uma vez que rapidamente e produz eficientemente uma população pura (> 95%) de neutrófilos, embora existam outros métodos disponíveis, tais como toda a centrifugação de sangue através de outras fórmulas de gradiente de densidade ou selecção negativa de neutrófilos utilizando kits especializadas com anticorpos ou magnético miçangas. No entanto, este último pode ser proibitivamente caros para a maioria dos grupos que isolam os neutrófilos de forma rotineira. Além disso, utilizar o anticoagulante heparina no tubo de recolha de sangue, enquanto que outros investigadores podem ser mais acostumados a usar o ácido etilenodiaminotetracético (EDTA) ou ácido citrato de sódio (ACD). Como existem muitos métodos diferentes para escolher, cabe à preferência pessoal do pesquisador.
Além disso,quando o isolamento e a manipulação de neutrófilos eles devem ser manuseados com algum cuidado para evitar a activação excessiva. medidas de precaução incluir: somente usando utensílios de plástico, não de vidro; filtrar-esterilizar todos os buffers para remover qualquer endotoxina contaminante; quando os neutrófilos fiação certificar-se a centrífuga é bem equilibrado para evitar vibrações excessivas; limitar, tanto quanto possível, os neutrófilos tempo permanecer num sedimento após centrifugação; não manter os neutrófilos de solução de mais do que 5 x 10 6 / mL; e realizar o experimento, logo que possível após o isolamento.
Este método pode ser adaptado para medir alterações na área de pH e phagosomal ao longo do tempo, usando um conjunto fase aquecida a 37 ° C no microscópio e tendo instantâneos uma vez a cada 30-60 s a partir da mesma posição, tal como descrito para as etapas de calibragem. Pode também ser, teoricamente, adaptado para experiências de maior taxa de transferência, tais como em placas de 96 poços, e para as experiências de citometria de fluxo, onde S-1 podeser utilizada como um indicador de pH 23. No entanto, nesses ambientes, a ênfase na atividade de células individuais é substituído por um efeito mais global sobre a população de células.
Este método tem como objetivo fornecer uma configuração experimental relativamente simples no qual pesquisadores individuais podem adaptar-se a adequar a sua área de interesse. Os investigadores podem deseja explorar neutrófilos pH phagosomal e área enquanto também medir movimento de outros iões, por exemplo, a concentração de cálcio intracelular. Existem várias fluorescentes indicadores de Ca2 + prontamente disponíveis por microscopia confocal, como indo-1, que também tem espectros de emissão dual a 400 e 475 nm 24. Estes comprimentos de onda de emissão não se sobrepõem com o S-1 espectros de emissão, mas o comprimento de onda de excitação é no final ultravioleta (UV) do espectro, o que pode ser prejudicial para as células, e um laser de UV não é comum em todos os microscópios. Uma revisão abrangente dos diferentes indicadores paramedir o fluxo de cálcio intracelular é coberto por Takahashi et al. 25 e Hillson et al. 26.
Em conclusão, existem outros métodos disponíveis para medir o pH phagosomal utilizando diferentes corantes fluorescentes como Nunes et al. demonstraram 13, bem como outros grupos 27, 28. Outros investigadores também foram utilizados S-1 para medir citosólica pH 29 ou pH phagosomal 14. No entanto, este protocolo é único para medir simultaneamente o pH de ambos citosol e fagossoma, o que proporciona a oportunidade de observar alterações em phagosomal área da secção transversal e para distinguir entre tipo selvagem e Hvcn1 - / - neutrófilos de rato, e neutrófilos humanos com e sem um trabalho de NADPH-oxidase.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi gentilmente financiado pelo Wellcome Trust, da Biotecnologia e Ciências Biológicas Conselho Investigação, eo Irwin Joffe Memorial Fellowship.
Materiais
| Name | Company | Catalog Number | Comments |
| Candida albicans ATCC 10231 Vitroids 80 CFU | Sigma-Aldrich | RQC14003-10EA | Place directly on a spread agar plate according to the manufacturer's instructions |
| YPD broth | Sigma-Aldrich | Y1375 | Follow manufacturer's instructions, various providers exist |
| Dextran Clinical grade MW = 200,000-300,000 | MP Biomedicals | 2101514 | Use gloves |
| Heparin Sodium solution for infusion (preservative free), 1,000IU/ml | Fannin, Wockhardt UK Ltd | FP1077 | We purchased from UCH inpatient pharmacy |
| SNARF-1 Carboxylic Acid, Acetate, Succinimidyl Ester - Special Packaging | Thermo Scientific/Invitrogen | SS22801 | Use gloves |
| 5-(and-6)-Carboxy SNARF-1, Acetoxymethyl Ester, Acetate | Thermo Scientific/Invitrogen | C1272 | Use gloves |
| Vivaglobin human IgG 160mg/ml solution | CSL Behring | received as a gift | Various providers exist |
| Normal mouse serum | Abcam | ab7486 | Various providers exist |
| Lymphoprep (density gradient medium) | Alere Ltd | 1114547 | Keep sterile and away from direct sunlight, can be substituted by Ficoll-Paque |
| Nigericin | Sigma-Aldrich | N7143 | Toxic, use gloves, various providers exist |
| Saponin | Sigma-Aldrich | 47036 | Toxic, use gloves, various providers exist |
| Dimethyl sulphoxide (DMSO) | Sigma-Aldrich | D8418 | Toxic, use gloves, various providers exist |
| 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375 | Various providers exist |
| Tris(hydroxymethyl)aminomethane (Tris) | Sigma-Aldrich | T1503 | Various providers exist |
| Potassium chloride (KCl) | Sigma-Aldrich | P9333 | Various providers exist |
| Sodium chloride (NaCl) | Sigma-Aldrich | S7653 | Various providers exist |
| Magnesium chloride (MgCl2) | Sigma-Aldrich | M8266 | Various providers exist |
| Magnesium sulphate (MgSO4) | Sigma-Aldrich | M7506 | Various providers exist |
| Potassium dihydrogen phosphate (KH2PO4) | Sigma-Aldrich | P9791 | Various providers exist |
| Calcium chloride (CaCl2) | Sigma-Aldrich | C1016 | Various providers exist |
| Glucose | Sigma-Aldrich | D9434 | Various providers exist |
| Absolute Ethanol | Sigma-Aldrich | 2860 | Various providers exist |
| Diphenylene iodonium (DPI) | Sigma-Aldrich | D2926 | Various providers exist |
| Zinc chloride | Sigma-Aldrich | 208086 | Various providers exist, do not dilute in phosphate based buffers as it will precipitate |
| Poly L lysine | Sigma | P4707 | Various providers exist |
| Laser scanning confocal microscope (Zeiss LSM 700) | Carl Zeiss | The microscope must be able to excite at 555nm and measure emission at two channels simultaneously (560-600nm, >610nm) | |
| Ibidi µ slide 8 well ibiTreat | Thistle Scientific | IB-80826 | Other appropriate imaging dishes can be substituted |
| Fluorodish Cell Culture Dish-35mm, 23mm well | World Precision Instruments | FD35-100 | Other appropriate imaging dishes can be substituted, different sizes are available |
| Soniprep 150 | MSE | Any appropriate sonicator will suffice | |
| TC20 Automated Cell Counter | BioRad | Various providers exist | |
| 1.5ml Protein LoBind Tubes | Sigma-Aldrich | Z666505-100EA | Specially used as Candida can stick to normal eppendorfs |
Referências
- Segal, A. W. NADPH oxidases as electrochemical generators to produce ion fluxes and turgor in fungi, plants and humans. Open Biol. 6 (5), 515-517 (2016).
- Segal, A. W. How neutrophils kill microbes. Annu Rev Immunol. 23, 197-223 (2005).
- Cross, A. R., Segal, A. W. The NADPH oxidase of professional phagocytes - Prototype of the NOX electron transport chain systems. BBA Bioenergetics. 1657 (1), 1-22 (2004).
- Demaurex, N., El Chemaly, A. Physiological roles of voltage-gated proton channels in leukocytes. J Physiol. 588 (23), 4659-4665 (2010).
- Levine, A. P., Duchen, M. R., de Villiers, S., Rich, P. R., Segal, A. W. Alkalinity of neutrophil phagocytic vacuoles is modulated by HVCN1 and has consequences for myeloperoxidase activity. PLoS One. 10 (4), 0125906 (2015).
- Reeves, E. P., Lu, H., et al. Killing activity of neutrophils is mediated through activation of proteases by K+ flux. Nature. 416 (6878), 291-297 (2002).
- Menegazzi, R., Busetto, S., Dri, P., Cramer, R., Patriarca, P. Chloride ion efflux regulates adherence, spreading, and respiratory burst of neutrophils stimulated by tumor necrosis factor-alpha (TNF) on biologic surfaces. J Cell Biol. 135 (2), 511-522 (1996).
- Ohkuma, S., Poole, B. Fluorescence probe measurement of the intralysosomal pH in living cells and the perturbation of pH by various agents. Cell Biol. 75 (7), 3327-3331 (1978).
- Jankowski, A., Scott, C. C., Grinstein, S. Determinants of the phagosomal pH in neutrophils. J Biol Chem. 277 (8), 6059-6066 (2002).
- Tsien, R. Y. Fluorescent Indicators of Ion Concentrations. Methods in Cell Biol. 30, 127-156 (1989).
- Lavis, L. D., Rutkoski, T. J., Raines, R. T. Tuning the pK a of Fluorescein to Optimize Binding Assays. Anal Chem. 79 (17), 6775-6782 (2007).
- Hurst, J. K., Albrich, J. M., Green, T. R., Rosen, H., Klebanoff, S. Myeloperoxidase-dependent fluorescein chlorination by stimulated neutrophils. J Biol Chem. 259 (8), 4812-4821 (1984).
- Nunes, P., Guido, D., Demaurex, N. Measuring Phagosome pH by Ratiometric Fluorescence Microscopy. J Vis Exp. (106), e53402 (2015).
- Canton, J., Khezri, R., Glogauer, M., Grinstein, S. Contrasting phagosome pH regulation and maturation in human M1 and M2 macrophages. Mol Biol Cell. 25 (21), 3330-3341 (2014).
- Schlafer, S., Dige, I. Ratiometric Imaging of Extracellular pH in Dental Biofilms. J Vis Exp. (109), e53622 (2016).
- Buckler, K. J., Vaughan-Jones, R. D. Application of a new pH-sensitive fluoroprobe (carboxy-SNARF-1) for intracellular pH measurement in small, isolated cells. Pfl ügers Archiv EJP. 417 (2), 234-239 (1990).
- El Chemaly, A., Nunes, P., Jimaja, W., Castelbou, C., Demaurex, N. Hv1 proton channels differentially regulate the pH of neutrophil and macrophage phagosomes by sustaining the production of phagosomal ROS that inhibit the delivery of vacuolar ATPases. J Leuko Biol. 95 (5), 827-839 (2014).
- Morgan, D., Capasso, M., et al. Voltage-gated proton channels maintain pH in human neutrophils during phagocytosis. Proc Natl Acad Sci USA. 106 (42), 18022-18027 (2009).
- Thomas, J. A., Buchsbaum, R. N., Zimniak, A., Racker, E. Intracellular pH measurements in Ehrlich ascites tumor cells utilizing spectroscopic probes generated in situ. Biochemistry. 18 (11), 2210-2218 (1979).
- Levine, A. P., Segal, A. W. The NADPH Oxidase and Microbial Killing by Neutrophils, With a Particular Emphasis on the Proposed Antimicrobial Role of Myeloperoxidase within the Phagocytic Vacuole. Microbiol Spectr. 4 (4), (2016).
- Segal, A. W., Geisow, M., Garcia, R., Harper, A., Miller, R. The respiratory burst of phagocytic cells is associated with a rise in vacuolar pH. Nature. 290 (5805), 406-409 (1981).
- Hunter, R. C., Beveridge, T. J. Application of a pH-sensitive fluoroprobe (C-SNARF-4) for pH microenvironment analysis in Pseudomonas aeruginosa biofilms. Appl Environ Microbiol. 71 (5), 2501-2510 (2005).
- Van Erp, P. E. J., Jansen, M. J. J. M., De Jongh, G. J., Boezeman, J. B. M., Schalkwijk, J. Ratiometric measurement of intracellular pH in cultured human keratinocytes using carboxy-SNARF-1 and flow cytometry. Cytometry. 12 (2), 127-132 (1991).
- Minamikawa, T., Takamatsu, T., Kashima, S., Fushiki, S., Fujita, S. Confocal calcium imaging with ultraviolet laser- scanning microscopy and indo-1. Micron. 24 (6), 551-556 (1993).
- Takahashi, A., Camacho, P., Lechleiter, J. D., Herman, B. Measurement of Intracellular Calcium. Physiol Rev. 79 (4), (1999).
- Hillson, E. J., Dewitt, S., Hallett, M. B. Optical methods for the measurement and manipulation of cytosolic free calcium in neutrophils. Methods Mol Biol. 412, 125-137 (2007).
- Bernardo, J., Long, H. J., Simons, E. R. Initial cytoplasmic and phagosomal consequences of human neutrophil exposure to Staphylococcus epidermidis. Cytometry Part A. 77 (3), 243-252 (2010).
- Riazanski, V., Gabdoulkhakova, A. G., et al. TRPC6 channel translocation into phagosomal membrane augments phagosomal function. Proc Natl Acad Sci USA. 112 (47), 6486-6495 (2015).
- Martínez-Zaguilán, R., Martínez, G. M., Lattanzio, F., Gillies, R. J. Simultaneous measurement of intracellular pH and Ca2+ using the fluorescence of SNARF-1 and fura-2. Am J Physiol Cell Physiol. 260 (2), (1991).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados