Method Article
Legionella pneumophila Outer Membrane vesículas: Isolamento e Análise do seu potencial pró-inflamatórios em macrófagos
Neste Artigo
Resumo
Aqui, nós descrevemos a purificação de Legionella pneumophila (L. pneumophila) vesículas de membrana externa (OMVs) a partir de culturas líquidas. Estas vesículas purificados são então usados para o tratamento de macrófagos para analisar o seu potencial pro-inflamatória.
Resumo
Bacteria are able to secrete a variety of molecules via various secretory systems. Besides the secretion of molecules into the extracellular space or directly into another cell, Gram-negative bacteria can also form outer membrane vesicles (OMVs). These membrane vesicles can deliver their cargo over long distances, and the cargo is protected from degradation by proteases and nucleases.
Legionella pneumophila (L. pneumophila) is an intracellular, Gram-negative pathogen that causes a severe form of pneumonia. In humans, it infects alveolar macrophages, where it blocks lysosomal degradation and forms a specialized replication vacuole. Moreover, L. pneumophila produces OMVs under various growth conditions. To understand the role of OMVs in the infection process of human macrophages, we set up a protocol to purify bacterial membrane vesicles from liquid culture. The method is based on differential ultracentrifugation. The enriched OMVs were subsequently analyzed with regard to their protein and lipopolysaccharide (LPS) amount and were then used for the treatment of a human monocytic cell line or murine bone marrow-derived macrophages. The pro-inflammatory responses of those cells were analyzed by enzyme-linked immunosorbent assay. Furthermore, alterations in a subsequent infection were analyzed. To this end, the bacterial replication of L. pneumophila in macrophages was studied by colony-forming unit assays.
Here, we describe a detailed protocol for the purification of L. pneumophila OMVs from liquid culture by ultracentrifugation and for the downstream analysis of their pro-inflammatory potential on macrophages.
Introdução
As bactérias podem secretar factores de virulência através de diferentes mecanismos 1. Além dos sistemas de secreção bem conhecidas, bactérias Gram-negativas podem trocar informações e fornecer factores de virulência por meio de vesículas da membrana externa (OMVs), que são pequenas, vesículas esferóides 10-300 nm de diâmetro e com uma estrutura de membrana de camada dupla. Eles são segregadas numa variedade de ambientes de crescimento (cultura líquida, sólida, cultura e biofilmes) e em todas as fases de crescimento 2, 3. As OMVs são um importante meio de transporte (por exemplo, para proteínas, toxinas, adesinas, e enzimas, bem como por LPS, que se encontram na superfície do OMV) 4. A carga intraluminal é protegido contra a degradação proteolítica, de modo que é capaz de actuar ao longo de grandes distâncias, e as vesículas podem ser encontrados nos fluidos corporais e órgãos distantes 5, 6,"xref"> 7, 8. Eles não só pode ser reconhecido e absorvidos pelas células eucarióticas 9, 10, mas, além disso, eles são capazes de facilitar a ligação de bactérias e a sua invasão em células hospedeiras 4. Legionella pneumophila (L. pneumophila) é uma bactéria Gram-negativa que pode libertar OMVs. No pulmão humano, que infecta primariamente os macrófagos alveolares, apesar de seu hospedeiro natural são de água doce amebas 11. Uma infecção L. pneumophila pode causar doença do legionário, uma forma grave de pneumonia 12. Ela bloqueia a fusão do fagossoma-lisossoma na célula hospedeira. Ele também recruta organelas de acolhimento, em que um nicho de replicação, a Legionella -Contendo vacúolo (LCV), é formado 13, 14. a degradação lisossómica é inibido não só por tra proteínas efetorasnslocation através do sistema de secreção de tipo IV, mas também pela libertação de OMVs 15.
A purificação de OMVs a partir de culturas bacterianas é necessário para analisar o seu efeito em células receptoras. Estudos anteriores voltadas para o teor de proteína L. pneumophila OMV e sobre a influência das vesículas em células epiteliais alveolares 16, mas estudos posteriores com transplantes de tecidos do pulmão humano demonstraram que L. pneumophila OMVs são ocupados por macrófagos alveolares 17.
Como apresentam padrões OMVs associado de agentes patogénicos moleculares (PAMPs) e outros antigénios bacterianos, que pode ter um impacto sobre a infecção de células eucarióticas e modular a resposta imune do hospedeiro 18. L. pneumophila OMVs fundir rapidamente com membranas de células hospedeiras e, por outro lado, eles activar o TLR2 19 membranoso. Como é sabido que o L. pneumophila OMVs estimular macrófagos e células epiteliais de uma forma pró-inflamatória 16, 17, analisou-se o impacto das OMVs no processo de infecção em macrófagos humanos e de murídeo.
Aqui, nós descrevemos um protocolo para a cultura de L. pneumophila em cultura líquida para isolar as OMVs secretadas por ultracentrifugação diferencial e para avaliar o impacto das vesículas em células hospedeiras eucarióticas, quer directamente ou depois de uma infecção.
Protocolo
1. Prepare médio e placas de ágar
- Prepare 1 L de meio de caldo (YEB). Dissolve-se 10 g de ases e 10 g de extracto de levedura em 900 ml de água destilada. Ajustar o pH para 6,9 com KOH (5 N). Adiciona-se 10 ml de L-cisteína (0,4 g em 10 ml de água destilada) e 10 mL de Fe (NO3) 3 x9H 2 O (0,25 g em 10 mL de água destilada). Encha até 1 L com água destilada e filtra-se esterilizar o (tamanho de poro: 0,22 pm) solução. Armazenar a 4 ° C.
- Prepare carvão tamponado extrato de levedura (BCYE) placas de ágar. Dissolve-se 10 g de ases e 10 g de extracto de levedura em 900 ml de água destilada. Ajustar o pH para 6,9 com KOH (5 N). Adiciona-se 15 g de ágar e 2,5 g de carvão activado. Encha até 1 L com água destilada e autoclave.
- Adiciona-se 10 ml de L-cisteína (0,4 g em 10 ml de água destilada) e 10 mL de Fe (NO3) 3 x9H 2 O (0,25 g em 10 ml de água destilada, ambos esterilizada por filtração através de 0,22 mícronsporos) para BCYE arrefecida (aproximadamente 50 ° C). Despeje placas e armazenar a 4 ° C.
2. Cultivar L. pneumophila
- Espalhe estirpe de L. pneumophila Corby (tipo selvagem, WT) em placas de agar e incubam BCYE-los a 37 ° C durante 3 dias. Inocular 10 ml de YEB a uma DO 600 de 0,3 com L. pneumophila da placa pré-cultura; incubar as bactérias a 37 ° C num agitador rotativo (150 rpm) durante 6 h.
- Verifique a pureza da cultura líquida por espalhando 100 jil de suspensão em uma placa de agar de sangue. Incubar durante a noite a 37 ° C.
- Adicionar a cultura líquido remanescente para 90 ml de meio fresco YEB e incubar num agitador rotativo (37 ° C e 150 rpm) para atingir uma DO 600 de 3,0-3,5, o que leva aproximadamente 16-20 horas.
3. Prepare-se e quantificar L. pneumophila OMVs
NOTA: Realizar todos os seguintes etapa de centrifugaçãos em condições estéreis e a 4 ° C.
- Centrifuga-se o líquido de cultura a 4.000 xg durante 20 minutos para sedimentar as bactérias. Transferir o sobrenadante para tubos de centrífuga, descarta o sedimento bacteriano, e repetir a centrifugação (4000 xg durante 20 min). Repita este passo uma vez.
- Esterilizada por filtro o restante sobrenadante duas vezes (tamanho de poro: 0,22 pm). Transferir o sobrenadante livre de bactérias para tubos de ultracentrífuga e ultracentrifugação a 100000 xg durante 3 h.
- Decantar o sobrenadante e descartá-lo. Ressuspender o pellet em solução salina estéril OMV tamponada com fosfato (PBS) e ultracentrifugação (100.000 x g, durante 3 h) para remover proteínas contaminantes e LPS.
- Descartar o sobrenadante e ressuspender o pellet em OMV 500 ul de PBS estéril. Streak 20 ul numa placa de agar de sangue e numa placa de agar BCYE para excluir contaminação bacteriana das vesículas preparadas. Incubar a placa de agar de sangue durante a noite e a placa de ágar BCYE durante 3 dias a 37 (ambas6; C).
- Quantificar a quantidade de proteína obtida a partir da preparação OMV utilizando um ensaio de ácido bicinconínico de acordo com as instruções do fabricante.
NOTA: A concentração de 100 mL de cultura de L. pneumophila é geralmente de 1 ug / uL. Armazenar os OMVs preparadas e quantificados a -20 ° C.
Os macrófagos 4. Pré-tratamento
- Preparar células THP-1.
NOTA: células THP-1 é uma linha celular monocítica derivado de um paciente com leucemia.- Adicionar 2x10 5 células THP-1 por 24 poços e diferenciá-los por adição de 20 nM de forbol 12-miristato 13-acetato (PMA) em células tipo macrófagos. Incubar durante 24 h a 37 ° C.
- Substituir o meio com 500 mL de meio fresco e incuba-se durante mais 24 h; a forma ideal para células THP-1 é composto por meio RPMI 1640 alto teor de glucose suplementado com 10% de soro fetal de vitelo.
- Isolar os macrófagos derivados da medula óssea de murinos (mBMDM), tal como descrito em referemrência 20.
- Tratar macrófagos THP-1 derivadas ou mBMDM com OMVs.
- Descongelar as OMVs preparada no Passo 3 e adicioná-los de acordo com a quantidade de proteína (a 0,1, 1, e 10 ug / mL) para a macrófagos de murídeo ou humano. Incubar os macrófagos com as OMVs a 37 ° C durante pelo menos 20 h. Use o sobrenadante para ELISA ou seguir em frente com a etapa 5.
5. infectam os macrófagos, Avaliar replicação bacteriana com um (CFU) Ensaio Unidade Formadora de Colônia
- Use L. pneumophila do passo 2.1, pré-trataram células THP-1 ou mBMDM do passo 4.3, e não tratada pré-macrófagos como controlos (2x10 5/24 poços). Não troque o meio.
- Infectar as células THP-1 com a L. pneumophila Corby WT e mBMDM com um mutante falta-flagelina de L. pneumophila Corby (ambos com uma multiplicidade de infecção (MOI) de 0,5; 1x10 5 L. pneumophila / 24 poços) e incubar por 24 e 48 h, respectivamente. Prepare both L. pneumophila Corby (WT ou mutante falta-flagelina) tal como descrito na etapa 2.1.
- Lisar as células no seu meio pela adição de saponina (concentração final: 0,1%) e incuba-se a 37 ° C durante 5 min.
- Ressuspender as bactérias por pipetagem e transferir a suspensão para um recipiente de reacção. Preparar diluições em série da L. pneumophila molecular contendo meios de comunicação em PBS estéril.
- Streak 50 uL das diluições necessárias em placas de agar BCYE e incubar durante 3 dias a 37 ° C.
- Visualmente contar as colónias formadas. Calcula-se a CFU
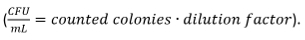 Normalizar o resultado da contagem CFU para não pré-tratados, mas os macrófagos, que são fixadas a 100% infectado.
Normalizar o resultado da contagem CFU para não pré-tratados, mas os macrófagos, que são fixadas a 100% infectado.
Resultados
A montagem experimental para preparar a L. pneumophila OMVs e para analisar a sua influência na resposta pró-inflamatória de macrófagos após infecção está representado na Figura 1. O potencial pro-inflamatória das OMVs preparados podem ser analisados em células THP-1 diferenciadas com PMA, que é mostrado na Figura 2. As células THP-1 respondem com um aumento de tempo e dependente da dose de IL-8 e IL-6 secreção. Além disso, a influência de diferentes TLRs no reconhecimento de L. pneumophila OMV podem ser analisados usando mBMDM de diferentes origens genéticas, tal como apresentado pelo ELISA CXCL1 na Figura 3. mBMDM de ratinhos WT CXCL1 segregadas, após estimulação OMV, enquanto mBMDM TLR2 / 4 - / - segregado significativamente menos. Para estudar o impacto de L. pneumophila OMVs na replicação bacteriana em THP-1 macrófagos, as células foram pré-incubadas com as OMVs e, em seguida, adicionalmente infectadoscom L. pneumophila (Figura 4 A). A pré-estimulação de macrófagos de THP-1 derivadas de primeira reduz a replicação bacteriana após 24 horas de infecção, mas leva a uma duplicação em CFU contar no ponto de tempo posterior (48 h pi). O impacto do receptor de tipo Toll (TLR) de sinalização sobre o reconhecimento OMV após a infecção dos macrófagos pode ser avaliada por mBMDM, como apresentado na Figura 4 B. Aumenta bacterianas de replicação por dez vezes em mBMDM de animais WT após a OMV pré-incubação, enquanto TLR2 - / - e TRIF / MyD88 - / - células não apresentam este aumento na replicação pneumophila L..
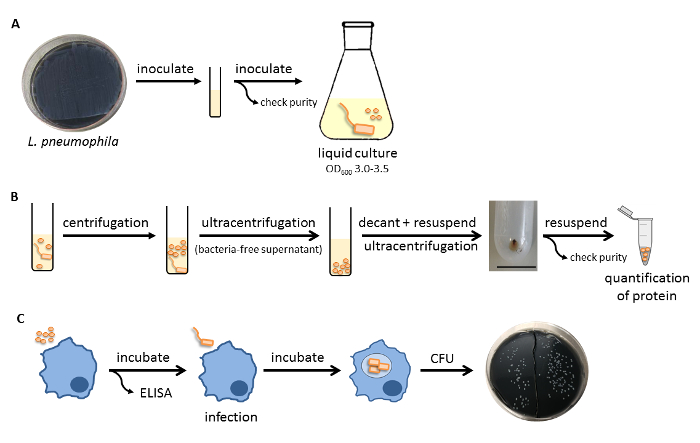
Figura 1: Procedimento experimental. (A) L. pneumophila Corby WT a partir de 10-cm BCYE placas de agar são utilizadas para inocular um pequeno cultura líquida (10 ml), que é transferido para 90 ml de YEB frescomeio após 6 h. Um pequeno volume também é revestida sobre uma placa de agar de sangue para verificar a pureza. As bactérias são incubadas a 37 ° C até que a fase estacionária precoce (DO 600 = 3,0-3,5). (B) O líquido de cultura é centrifugado e esterilizado por filtração para remover as bactérias. O sobrenadante livre de Legionella é em seguida ultracentrifugado a obter um sedimento OMV, que é ressuspenso em PBS e ultracentrifugado novamente. As vesículas isoladas são suspensas, verificada a pureza, e quantificadas para a quantidade de proteína. A barra de escala representa 2,5 cm. (C) macrófagos humanos ou murinos são estimuladas com as OMVs quantificados. O sobrenadante de cultura de células pode ser utilizado para o ELISA, ou macrófagos pode ser infectado com L. pneumophila para determinar a replicação bacteriana por ensaio de CFU em 10 cm BCYE placas de agar. Por favor clique aqui para ver uma versão maior desta figura.
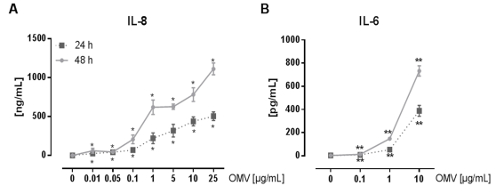
Figura 2: A activação pró-inflamatórias de células THP-1 de L. pneumophila OMVs. (A) Aqui, a linha de células monocíticas THP-1 é usado como um modelo para os macrófagos alveolares. Células diferenciadas com PMA-THP-1 foram tratadas com doses crescentes de L. pneumophila OMVs (0,01-25 ug / mL), durante 24 e 48 h, respectivamente. O sobrenadante isento de células foi utilizado para ELISA de IL-8. Os valores médios de três experiências independentes ± SEM são mostrados. As células THP-1 respondeu a tão pouco como 0,01 ng / mL L. pneumophila OMVs com significativa da secreção de IL-8, o que foi tempo e dose-dependente. (B) L. pneumophila OMVs (0,1-10 ug / mL) foram utilizadas para estimular as células THP-1 diferenciadas com PMA-. O sobrenadante foi recolhido depois de 24 e 48 h de incubação, e a IL-6 libertada foi medida no sobrenadante através de ELISA. Os valores médios de três experiências independentes ± SEM são mostrados. As células THP-1 segregadas quantidades significativas de IL-6, mesmo com a dose mais baixa de OMVs (0,1 ug / mL). A secreção de IL-6 aumentou com o aumento das doses de OMV e com tempos de incubação prolongados. Estatísticas: teste de Mann-Whitney; * P <0,05 e ** p <0,01 em comparação com o correspondente 0 ug / mL de OMV. Reproduzido com permissão de Referência 20. Por favor clique aqui para ver uma versão maior desta figura.
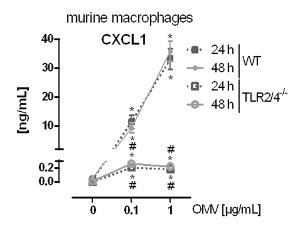
Figura 3: A activação de pró-inflamatória de macrófagos depende de TLR2 / 4. mBMDM de WT e TLR2 / 4 - / - ratos foram incubadas com L. pneumophila OMVs (0,1 ou 1 ug / mL). secreção CXCL1 foi analisada por ELISA após 24 e 48 h, respectivamente. ovalores médios ± SEM de três experiências independentes são apresentados. mBMDM de ratinhos WT respondeu com uma secreção CXCL1 dependente da dose após incubação a L. pneumophila OMV. TLR2 / 4 - / - mBMDM segregado significativamente menos CXCL1 em comparação com WT mBMDM, e esta secreção não aumentou dependentemente da dose. Estatísticas: teste de Mann-Whitney; * P <0,05 em comparação com o correspondente 0 ug / mL OMV; #p <0,05 em comparação com uma amostra de WT igualmente tratada. Reproduzido com permissão de Referência 20. Por favor clique aqui para ver uma versão maior desta figura.
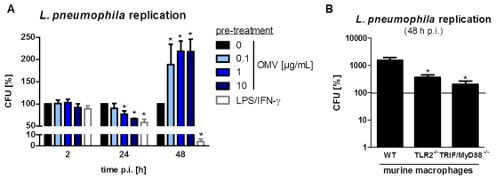
Figura 4: replicação L. pneumophila OMV pré-incubação aumenta bacteriana em macrófagos. (A) Diferenciadas As células THP-1 foram pré-incubadas com as OMVs (0,1, 1, ou 10 μ; G / ml) ou LPS / IFN-γ (200 ng / mL de cada vez) ou foram deixados sem tratamento para controlo. Após a pré-incubação (20 horas), as células THP-1 foram infectadas com L. pneumophila Corby WT (MOI de 0,5) durante 2, 24, e 48 h, respectivamente. As células THP-1 foram lisadas pela adição de saponina, e as bactérias foram semeadas em placas de agar BCYE. CFUs foram calculadas em relação a 0 ug / mL OMV após cada ponto de tempo. As barras representam os valores médios ± SEM de três experiências independentes, cada uma realizada em duplicado técnicas. Não houve diferença na captação bacteriana (2 h após a infecção (pi)) em comparação com células não pré-tratados. Alterações na replicação bacteriana foram determinadas após 24 e 48 h, respectivamente. LPS / células THP-1 pré-tratados IFN-γ mostraram uma redução na carga bacteriana 24 h pi Isto também foi observado dependente da dose, para células pré-tratadas L. pneumophila OMV. No ponto de tempo posterior (48 h pi), as células THP-1 pré-OMV tratados mostraram uma duplicação em L. pneumophila replicação, enquanto que o LPS / IFN-y macrófagos pré-tratados mostraram uma redução da carga bacteriana. Estatísticas: teste de Mann-Whitney; * P <0,05 e ** p <0,01 em comparação com o correspondente 0 ug / mL de OMV. (B) mBMDM a partir de ratinhos com diferentes antecedentes genéticos (WT, TLR2 - / -, e TRIF / MyD88 - / -) foram pré-incubadas com 0,1 ug / mL L. pneumophila OMVs durante 20 h e foram depois infectadas com um flagellin- mutante deficiente de L. pneumophila Corby (MOI de 0,5) durante 48 h. mBMDM foram lisadas pela adição de saponina, e a Legionella foram plaqueadas em placas de agar BCYE. O CFU foram calculadas em relação a 0 ug / mL de OMV, indicado pela linha a cheio. As barras representam os valores médios ±± SEM de três experiências independentes, cada uma realizada em duplicado. mBMDM de ratinhos WT mostrou um aumento na replicação da L. pneumophila OMV após pré-tratamento. TLR2 - / - mostraram significativamente reduzida macrófagos Replicação Legionella, que foi comparável ao TRIF / MyD88 - / - mBMDM. Estatísticas: teste de Mann-Whitney; P <0,05 em comparação com a amostra de WT. Reproduzido com permissão de Referência 20. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
As OMVs de patógenos bacterianos e o impacto destas vesículas de membrana de suas células-alvo estão sendo intensamente estudados. Por exemplo, Clostridium perfringens -derived OMVs induzir a secreção de citocinas em macrófagos, linfócitos B podem ser activados por as OMVs a partir de Borrelia burgdorferi, Helicobacter pylori e -released vesículas de membrana pode actuar em células epiteliais gástricas 21, 22, 23. L. pneumophila, um patogénio intracelular, que pode induzir uma forma grave de pneumonia atípica, também liberta OMVs que são capazes de activar as células epiteliais do pulmão e macrófagos 16, 19. Aqui, apresentamos um protocolo detalhado para o isolamento em pequena escala de L. pneumophila OMVs da cultura líquida para estudar o papel potencial da OMV em pneumonia. É crítico para trabalhar sob Condit estériliões e para impedir a contaminação de outras bactérias, a fim de obter um L. pneumophila puro -derived preparação OMV. O isolamento de OMVs inclui um passo de filtração através de poros de 0,22 mícrons, a fim de evitar a contaminação do sedimento obtido com OMV L. pneumophila, mesmo que isso reduz o rendimento de OMV, uma vez que as maiores OMVs são perdidas por este passo de filtração.
Além disso, testou-se a resposta de macrófagos humanos e de murino para aquelas vesículas isoladas e células infectadas com L. pneumophila para aproximar mais estreitamente a situação em Legionella pneumonia, onde são libertadas OMVs dentro da LCV por bactérias extracelulares 15. As doses empregadas OMV foram estimados de acordo com a quantidade OMV livre em uma infecção in vitro de macrófagos humanos após 24 h de incubação (descrito na referência 20). Para a estimulação de outros receptores ou células em experiências in vivo,outras doses de OMV pode ser necessária e deve ser estabelecida. A análise do efeito de L. pneumophila OMVs representa um avanço com o protocolo descrito por Jager e 24 de Steinert.
Aqui, diferenciadas com PMA células THP-1 servir como um modelo para os macrófagos alveolares, devido à disponibilidade limitada de material humano primário. A adição de PMA diferencia as células monocíticas THP-1 em células macrófagos do tipo 25. Além disso, eles são uma linha celular modelo bem conhecido por L. pneumophila estuda 26. Além desta linha celular monocítica humana, são utilizadas células mBMDM. mBMDM são amplamente aceite para o estudo dos efeitos de L. pneumophila 27, 28, 29. A possibilidade de utilização de orifícios genéticos para diferentes TLRs ou outras proteínas torná-los uma ferramenta valiosa para estudar os efeitos de OMV. em order para diminuir a quantidade de murganhos por experiência, mBMDM são usados em vez dos macrófagos alveolares, devido às limitações dos macrófagos. experimentos-chave pode exigir macrófagos alveolares para validação.
Além disso o protocolo aqui descrito da ultracentrifugação para purificar as OMVs, é possível efectuar uma centrifugação em gradiente de densidade, que está incluído no protocolo por Chutkan et ai. 30. Isto pode melhorar a pureza da preparação obtida OMV e reduzir a quantidade de agregados de proteína co-purificado, flagelina, e LPS. A pureza da preparação de OMV obtida pode ser analisada por microscopia electrónica de transmissão, ou por análise de rastreamento de nanopartículas como um passo suplementar no controle de qualidade. Isto pode proporcionar um meio adicional de quantificação, para além do processo de medição de proteína aqui apresentada. Opcionalmente, a concentração de LPS pode ser analisada por um teste de lisado de amebócitos de Limulus. Se o rendimento de OMV é baixo, umapasso de concentração adicional por meio de filtros centrífugos pode ser realizada, o que não foi feito aqui. Se o rendimento foi mais baixo do que o esperado, as OMVs foram descartados.
Como parte do esforço contínuo para elucidar os mecanismos biológicos e funções por trás OMV, a influência de diferentes condições de estresse sobre a produção OMV poderia ser testada. A perda de nutrientes, as mudanças na temperatura de incubação, ou exposição a agentes nocivos podem ter um impacto sobre a secreção de OMV 31. Condições de estresse possíveis são discutidos no protocolo por Klimentova e Stulik 32. Além disso, hiper ou hypovesiculating mutantes L. pneumophila poderia ser gerado. As preparações de OMV diferentes poderiam, então, ser analisados em experiências de infecção com macrófagos, explantes de tecido de pulmão humano (descritos na Referência 17), ou mesmo em modelos in vivo. Além do papel de OMV na sinalização imune inata, sua influência na comunicação bacterianapodem ser tratadas experimentalmente. Além disso, o impacto de várias cascatas de sinalização imune inata pode ser analisada através da utilização de células de murino ou knockout a geração de CRISPR / Cas9 knockouts em linhas celulares humanas. Esta pesquisa básica em OMVs irá contribuir para o desenvolvimento de novas estratégias de vacina, que já existem para a meningite B transmitida por Neisseria meningitidis 33.
A partir do protocolo sobre o isolamento e caracterização OMV, pode-se aplicar isso a outras bactérias Gram-negativas e outras células hospedeiras; ela só precisa de ser ajustada para o crescimento das bactérias em cultura líquida. O protocolo publicado por Chutkan et ai. fornece informações detalhadas sobre a geração de OMVs a partir de Escherichia coli e Pseudomonas aeruginosa 30. A cultura não deve atingir a fase estacionária tardia, a fim de evitar aumentos de bactérias lisadas e as proteínas contaminantes e MEMbranas. Além disso, a dose OMV usado para a estimulação das células hospedeiras deve ser determinado de acordo com a quantidade de OMVs presente durante as infecções in vivo, e ainda garantir uma baixa taxa de citotoxicidade. Desta forma, o papel patológico das OMVs, o seu impacto na comunicação inter-espécies, e interacções hospedeiro-patogénio poderia ser examinada.
Para estudar melhor o papel da L. pneumophila OMVs em pneumonia, são necessárias preparações OMV padronizados com rendimentos suficientes e experiências de infecção comparáveis. Este protocolo vai ajudar a padronizar os procedimentos de isolamento e estender estudos OMV a outras bactérias Gram-negativas e outras células hospedeiras. Além disso, a pesquisa irá beneficiar da detalhada no conhecimento vitro, que pode ser usado para estender experiências nas configurações in vivo. No futuro, este protocolo pode ser estendido para o isolamento de OMVs de material biológico primário, tais como soro ou lav broncoalveolarfluido de idade, para obter insights sobre a composição da OMV libertada em condições fisiológicas. Isso ajudará a determinar os parâmetros-chave da composição OMV e compreender as propriedades de in vitro OMVs -generated.
Divulgações
The authors have nothing to disclose.
Agradecimentos
Agradecemos Prof. Dr. Markus Schnare por nos fornecer as TLR2 - / - e TLR2 / 4 - / - ratos e Prof. Dr. Carsten Kirschning para TRIF / MyD88 - / - ratos. Partes deste trabalho foi financiado pelo Bundesministerium für Bildung und Forschung (e: miRSys bio - FKZ 0316175B, e: Med CAPSYS - FKZ 01X1304E; http://www.bmbf.de/), Deutsche Forschungsgemeinschaft (SFB / TR-84; http://www.sfb-tr84.de/) e Hessisches Ministerium für Wissenschaft und Kunst (LOEWE médicos RNomics - FKZ 519/03 / 00.001- (0003); http://www.proloewe.de/medicalrnomics), toda a BS.
Materiais
| Name | Company | Catalog Number | Comments |
| 10 cm Petri dish | Sarstedt AG & Co KG (Nuembrecht, Germany) | 82.1473 | |
| 70 Ti rotor | Beckman Coulter Incorporation (California, USA) | 337922 | |
| ACES | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | 9138.2 | |
| activated charcoal | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | X865.2 | |
| agar-agar, Kobe I | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | 5210.2 | |
| Columbia agar with 5% sheep blood | Becton Dickinson GmbH (Heidelberg, Germany) | 254005 | |
| cuvettes | Sarstedt AG & Co KG (Nuembrecht, Germany) | 67.742 | |
| ELISA (human) | BD OptEIA™; Becton Dickinson GmbH (Heidelberg, Germany) | IL-8: 555244 IL-6: 550799 | |
| ELISA (murine) | DuoSet, R&D (Minneapolis, USA) | CXCL1: DY453-05 | |
| Fe(NO3)3x9H2O | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | 5632.1 | |
| Fetal calf serum (FCS) | Life Technologies GmbH (Darmstadt, Germany) | 10270-106 | |
| Heracell 240i CO2 incubator | Thermo Fisher Scientific Germany BV & Co KG (Braunschweig, Germany) | 40830469 | |
| Heraeus Multifuge X3R | Thermo Fisher Scientific Germany BV & Co KG (Braunschweig, Germany) | 75004515 | |
| Inoculation loop | Sarstedt AG & Co KG (Nuembrecht, Germany) | 86.1567.010 | |
| KOH | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | 6751.1 | |
| L. pneumophila Corby | --- | --- | kindly provided by Prof Dr Antje Flieger (RKI, Berlin, Germany) |
| L. pneumophila Corby ΔflaA | --- | --- | kindly provided by Prof Dr Klaus Heuner (RKI, Berlin, Germany) |
| L-cystein | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | ||
| mBMDM | --- | --- | kindly provided by Prof Dr Markus Schnare (Philipps Univeristy Marburg, Marburg, Germany) and Prof Dr Carsten Kirschning (University Duisburg Essen, Essen, Germany) |
| PBS | Biochrom GmbH (Berlin, Germany) | L 1825 | |
| phorbol 12-myristate 13-acetate | Sigma-Aldrich Chemie GmbH (Taufkirchen, Germany) | P8139-1MG | |
| rotating shaker (MaxQ 6000) | Thermo Fisher Scientific Germany BV & Co KG (Braunschweig, Germany) | SHKE6000 | |
| RPMI 1640 high glucose | Life Technologies GmbH (Darmstadt, Germany) | 11875-093 | |
| saponin | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | 9622.1 | |
| Ultrospec 10 | Biochrom Ltd (Cambridge, England) | 80-2116-30 | |
| sterile filter (pore size: 0.22 µm) | Corning Incorporated (new York, USA) | 431096 | |
| THP-1 | Sigma-Aldrich Chemie GmbH (Taufkirchen, Germany) | 88081201-1VL | |
| Sorvall Discovery 100 SE | Thermo Fisher Scientific Germany BV & Co KG (Braunschweig, Germany) | ||
| yeast extract | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | 2363.2 | |
| Pierce BCA protein assay kit | Thermo Fisher Scientific Germany BV & Co KG (Braunschweig, Germany) | 23225 |
Referências
- Cambronne, E. D., Roy, C. R. Recognition and delivery of effector proteins into eukaryotic cells by bacterial secretion systems. Traffic. 7 (8), 929-939 (2006).
- Ellis, T. N., Kuehn, M. J. Virulence and immunomodulatory roles of bacterial outer membrane vesicles. Microbiol Mol Biol Rev. 74 (1), 81-94 (2010).
- Beveridge, T. J. Structures of gram-negative cell walls and their derived membrane vesicles. J Bacteriol. 181 (16), 4725-4733 (1999).
- Kuehn, M. J., Kesty, N. C. Bacterial outer membrane vesicles and the host-pathogen interaction. Genes Dev. 19 (22), 2645-2655 (2005).
- Chi, B., Qi, M., Kuramitsu, H. K. Role of dentilisin in Treponema denticola epithelial cell layer penetration. Res Microbiol. 154 (9), 637-643 (2003).
- Kolling, G. L., Matthews, K. R. Export of virulence genes and Shiga toxin by membrane vesicles of Escherichia coli O157:H7. Appl Environ Microbiol. 65 (5), 1843-1848 (1999).
- Horstman, A. L., Kuehn, M. J. Enterotoxigenic Escherichia coli secretes active heat-labile enterotoxin via outer membrane vesicles. J Biol Chem. 275 (17), 12489-12496 (2000).
- Dorward, D. W., Schwan, T. G., Garon, C. F. Immune capture and detection of Borrelia burgdorferi antigens in urine, blood, or tissues from infected ticks, mice, dogs, and humans. J Clin Microbiol. 29 (6), 1162-1170 (1991).
- Mashburn, L. M., Whiteley, M. Membrane vesicles traffic signals and facilitate group activities in a prokaryote. Nature. 437 (7057), 422-425 (2005).
- Kesty, N. C., Mason, K. M., Reedy, M., Miller, S. E., Kuehn, M. J. Enterotoxigenic Escherichia coli vesicles target toxin delivery into mammalian cells. EMBO J. 23 (23), 4538-4549 (2004).
- Abu Kwaik, Y., Gao, L. Y., Stone, B. J., Venkataraman, C., Harb, O. S. Invasion of protozoa by Legionella pneumophila and its role in bacterial ecology and pathogenesis. Appl Environ Microbiol. 64, 3127-3133 (1998).
- Winn, W. C., Myerowitz, R. L. The pathology of the Legionella pneumonias. A review of 74 cases and the literature. Hum Pathol. 12 (5), 401-422 (1981).
- Ge, J., Shao, F. Manipulation of host vesicular trafficking and innate immune defence by Legionella Dot/Icm effectors. Cell Microbiol. 13 (12), 1870-1880 (2011).
- Hubber, A., Roy, C. R. Modulation of host cell function by Legionella pneumophila type IV effectors. Annu Rev Cell Dev Biol. 26, 261-283 (2010).
- Fernandez-Moreira, E., Helbig, J. H., Swanson, M. S. Membrane vesicles shed by Legionella pneumophila inhibit fusion of phagosomes with lysosomes. Infect Immun. 74 (6), 3285-3295 (2006).
- Galka, F., et al. Proteomic characterization of the whole secretome of Legionella pneumophila and functional analysis of outer membrane vesicles. Infect Immun. 76 (5), 1825-1836 (2008).
- Jager, J., et al. Human lung tissue explants reveal novel interactions during Legionella pneumophila infections. Infect Immun. 82 (1), 275-285 (2014).
- Ellis, T. N., Leiman, S. A., Kuehn, M. J. Naturally produced outer membrane vesicles from Pseudomonas aeruginosa elicit a potent innate immune response via combined sensing of both lipopolysaccharide and protein components. Infect Immun. 78 (9), 3822-3831 (2010).
- Jager, J., Keese, S., Roessle, M., Steinert, M., Schromm, A. B. Fusion of Legionella pneumophila outer membrane vesicles with eukaryotic membrane systems is a mechanism to deliver pathogen factors to host cell membranes. Cell Microbiol. , (2014).
- Jung, A. L., et al. Legionella pneumophila-Derived Outer Membrane Vesicles Promote Bacterial Replication in Macrophages. PLoS Pathog. 12 (4), (2016).
- Jiang, Y., Kong, Q., Roland, K. L., Curtiss, R. Membrane vesicles of Clostridium perfringens type A strains induce innate and adaptive immunity. Int J Med Microbiol. 304 (3-4), 431-443 (2014).
- Whitmire, W. M., Garon, C. F. Specific and nonspecific responses of murine B cells to membrane blebs of Borrelia burgdorferi. Infect Immun. 61 (4), 1460-1467 (1993).
- Ismail, S., Hampton, M. B., Keenan, J. I. Helicobacter pylori outer membrane vesicles modulate proliferation and interleukin-8 production by gastric epithelial cells. Infect Immun. 71 (10), 5670-5675 (2003).
- Jager, J., Steinert, M. Enrichment of outer membrane vesicles shed by Legionella pneumophila. Methods Mol Biol. 954, 225-230 (2013).
- Park, E. K., et al. Optimized THP-1 differentiation is required for the detection of responses to weak stimuli. Inflamm Res. 56 (1), 45-50 (2007).
- Casson, C. N., et al. Human caspase-4 mediates noncanonical inflammasome activation against gram-negative bacterial pathogens. Proc Natl Acad Sci U S A. 112 (21), 6688-6693 (2015).
- Molofsky, A. B., Shetron-Rama, L. M., Swanson, M. S. Components of the Legionella pneumophila flagellar regulon contribute to multiple virulence traits, including lysosome avoidance and macrophage death. Infect Immun. 73 (9), 5720-5734 (2005).
- Isaac, D. T., Laguna, R. K., Valtz, N., Isberg, R. R. MavN is a Legionella pneumophila vacuole-associated protein required for efficient iron acquisition during intracellular growth. Proc Natl Acad Sci U S A. 112 (37), 5208-5217 (2015).
- Zhu, W., et al. Sensing cytosolic RpsL by macrophages induces lysosomal cell death and termination of bacterial infection. PLoS Pathog. 11 (3), 1004704 (2015).
- Chutkan, H., Macdonald, I., Manning, A., Kuehn, M. J. Quantitative and qualitative preparations of bacterial outer membrane vesicles. Methods Mol Biol. 966, 259-272 (2013).
- Macdonald, I. A., Kuehn, M. J. Stress-induced outer membrane vesicle production by Pseudomonas aeruginosa. J Bacteriol. 195 (13), 2971-2981 (2013).
- Klimentova, J., Stulik, J. Methods of isolation and purification of outer membrane vesicles from gram-negative bacteria. Microbiol Res. 170, 1-9 (2015).
- . Novartis.com Available from: https://www.novartis.com/news/media-releases/novartis-bexsero%C2%AE-vaccine-approved-fda-prevention-meningitis-b-leading-cause (2016)
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados