Method Article
A técnica de fracionador óptico para estimar números de células em um modelo de rato de terapia eletroconvulsiva
Neste Artigo
Resumo
Aqui, apresentamos um método estereológico, o fraccionador óptico, usado para quantificar a formação de novos neurônios e sua sobrevivência, no hipocampo do rato após a estimulação eletroconvulsiva. Quando implementado corretamente, a sensibilidade e a eficiência dos métodos estereológicos garantem estimativas precisas com uma precisão fixa e predeterminada.
Resumo
Métodos estereológicos são projetados para descrever parâmetros quantitativos sem fazer suposições sobre tamanho, forma, orientação e distribuição de células ou estruturas. Esses métodos têm sido revolucionários para a análise quantitativa do cérebro de mamífero, em que as populações de células volumétricas são muito altas para contar manualmente e a estereologia é agora a técnica de escolha sempre que as estimativas de quantidades tridimensionais precisam ser extraídas das medidas em duas dimensões Seções. Todos os métodos estereológicos são, em princípio, imparciais; No entanto, eles confiam no conhecimento adequado sobre a estrutura de interesse e as características do tecido. A estereologia é baseada em amostras aleatoriamente aleatórias sistemáticas (SURS), com ajuste de amostragem para o nível mais eficiente em relação à precisão, fornecendo informações confiáveis e quantitativas sobre toda a estrutura de interesse. Aqui apresentamos o fracionador óptico em conjunto com a imuno-histoquímica BrdU tO estimar a produção e sobrevivência de neurônios recém-formados na camada de células granulares (incluindo a zona subgranular) do hipocampo de rato após a estimulação eletroconvulsiva, que está entre os estimuladores mais potentes da neurogênese. A técnica do fraccionador óptico foi projetada para fornecer estimativas do número total de células de seções grossas amostradas da estrutura completa. Seções grossas proporcionam a oportunidade de observar as células em sua extensão total de 3-D e, portanto, permitir uma classificação celular fácil e robusta com base em critérios morfológicos. Quando implementado corretamente, a sensibilidade e a eficiência do fracionador óptico fornecem estimativas precisas com uma precisão fixa e predeterminada.
Introdução
A quantificação de células em uma estrutura tridimensional (3-D) pode exigir a obtenção de estimativas com base em princípios imparcial. Ainda hoje, estudos freqüentemente usam métodos bidimensionais (2-D) para relatar dados de estruturas 3-D. No entanto, esses métodos não consideram a natureza heterogênea da estrutura em termos de forma e distribuição de células resultando em limitações metódicas; Eles fazem suposições sobre a estrutura 3-D de interesse e os resultados não se referem à estrutura completa. Essas limitações reduzem a sensibilidade e precisão dos métodos, além de aumentar o risco de erros 1 .
O desvio na contagem de células pode ser evitado pela aplicação da estereologia baseada em design, que é de importância geral para obter informações quantitativas sobre o número de células em um determinado tecido ou estrutura. Embora a estereologia tenha sido um método muito demorado, avanços em procedimentos, softWare e imagens, tornou-se muito mais eficiente e amplamente aplicável. A estereologia implica princípios de amostragem estatística e teoria geométrica estocástica para fornecer ferramentas eficientes para estimativa de volume, área de superfície, comprimento e número de objetos em uma estrutura 3-D por amostragem em seções 2 -D 2 . Assim, a estereologia permite obter dados quantitativos imparciais em mudanças estruturais em seções de tecido, que dão estimativas médias dos números verdadeiros, sem análise exaustiva 1 . A estereologia é definida como a inferência estatística de parâmetros geométricos a partir de informações amostradas. Isso pode ser alcançado por meio de amostragem imparcial, ou seja, amostragem aleatória sistemática, de seções, bem como regras de contagem que asseguram que todos os objetos tenham iguais probabilidades de serem contados 3 . Enquanto os resultados estereológicos podem ter diferentes graus de precisão como indicado pelo coeficiente de erro (CE), isso pode ser o anúncioAjustado para se adequar à variância biológica inerente (coeficiente de variância (CV)), ajustando a quantidade de amostragem conforme necessário 4 , 5 . Alguns estudos estereológicos anteriores examinaram os efeitos a curto prazo da estimulação eletroconvulsiva (ECS) na plasticidade do hipocampo em roedores 6,7 . Os dados desses estudos mostram um aumento inicial no número total de neurônios, bem como a diferenciação sináptica elevada após ECS repetido. No entanto, esses estudos não estimam a neurogênese diretamente, pois não usam marcadores específicos para a proliferação celular.
Aqui apresentamos uma aplicação de um método estereológico, a técnica de fracionamento óptico 8 , 9 , para quantificar o número total de neurônios recém-formados na camada celular de grânulo do hipocampo de rato (GCL), incluindo a zona subgranular (SGZ) também Como a longo prazoUrvival 10 , 11 . Nós submetimos os ratos a um cronograma clínico relevante de ECS (três vezes por semana durante 3 semanas), que é um dos estimuladores mais potentes da neurogênese 12 . Os animais de controle foram tratados usando o mesmo procedimento, mas sem passagem de corrente. Em cada um dos 21 dias de experimentação, todos os ratos foram injetados intraperitonealmente com 5-bromo-2 '-desoxiuridina (BrdU) que incorpora em DNA em lugar de timidina durante a divisão celular 13 . Após a experimentação, os ratos foram mantidos por quatro períodos diferentes (24 horas, 3 meses, 6 meses e 12 meses). Usando o princípio do fraccionador, obtivemos uma fração conhecida do hipocampo através de amostragem aleatória uniforme de seções, e disjuntores ópticos aplicados (sondas 3-D) às seções de tecido grosso amostrado e imunossinado. Observa-se especialmente que as seções congeladas geralmente se colapsam no eixo z durante o processoIng, e que os disectores ópticos com base na espessura média da seção ponderada em número devem ser usados neste caso particular 14 . À medida que o plano focal dos disjuntores ópticos foi movido para uma distância conhecida para baixo através da seção, os neurônios negativos de BrdU foram contados quando sua característica de interesse foi claramente reconhecida. No campo da estereologia há algum debate sobre o número total de partículas que devem ser contadas 15 ; Tipicamente 150-200 neurônios são contados na estrutura de interesse para obter uma precisão adequada, ou seja, um coeficiente de 7-8% 8 . As contagens neuronais positivas para BrdU foram completadas usando software estereologico com imagens por um microscópio padrão equipado com câmera e os seguintes objetivos: 2X, 4X e 10X, bem como um objetivo de imersão em óleo 100X (abertura numérica = 1.40) e um estágio motorizado . Os movimentos na direção z foram medidos com um microcator digital. A ampliação finalEra 3000X.
Protocolo
Todos os procedimentos dos animais foram realizados de acordo com as diretrizes da Inspecção Dinamarquesa de Experimentação Animal e aprovados pelo comitê de ética local para Animais Experimentais.
1. Processamento de tecido
NOTA: Após perfusão transcardial e fixação pós em paraformaldeído a 4% (PFA) diluído em tampão fosfato 0,2 M durante a noite a 4 ° C, os cérebros são transferidos para sacarose a 30% em solução salina tamponada com fosfato (PBS) por três dias a 4 ° C. Posteriormente, os cérebros são congelados em gelo seco em pó e armazenados a -80 ° C até seccionar.
- Separe os hemisférios direito e esquerdo ao longo da linha média do cérebro usando um bisturi e depois escolha um ou outro hemisfério aleatoriamente no primeiro cérebro, depois deslize sistematicamente entre hemisfério direito e esquerdo ( Figura 1A ). Monte o hemisfério amostrado em um disco de amostra com o eixo longo perpendicular ao discoUsando um meio de montagem.
- Coloque os recipientes multidiscados numerados para pré-arrefecimento no criostato.
- Monte o disco de amostra no criostato e corte a totalidade do hipocampo (Bregma 1,80 a - 7,04 16 ) em seções de 80 μm de espessura no plano coronal ( Figura 1B ).
- Coloque todas as seções amostradas consecutivamente nos recipientes multidiscados refrigerados, para garantir que as seções sejam mantidas em corte.
- Cubra completamente as secções com crioprotetor e segure os recipientes a -20 ° C até o uso posterior.
2. Imunossinção
NOTA: Para acompanhar as seções individuais ao longo do procedimento de coloração, coloque as seções amostradas em redes de manchas de 25 poços. Use cada 5ª seção, dando um número final médio de 12 (8-16) seções por hipocampo para imunomarcação e posterior contagem de células.
- Antes da subseqüência a cada n ª seção com um início aleatório entre a seção um e a seção n ( Figura 1C ), transfira os recipientes de -20 ° C para a temperatura ambiente (RT).
- Use, por exemplo, um pincel, para transferir as seções em ordem numérica para as redes de coloração de 25 poços colocadas em placas de petri preenchidas com PBS.
NOTA: A partir deste ponto, mantenha as seções nas redes de coloração que são colocadas em pratos de vidro correspondentes colocados em um agitador orbital (seção 2.3 a 2.9). - Transfira as redes de coloração para os pratos de vidro correspondentes e lave as secções duas vezes por 10 min em PBS à TA antes da incubação em 3% de peróxido de hidrogênio (H2O2) diluído em água destilada (dH2O) durante 20 min.
- Transfira as secções para três soluções diferentes de ácido clorídrico (HCl) (1 M a 0 ° C durante 10 min, 2 M à TA durante 10 min e 2 M a 37 ° C durante 20 min) antes da neutralização em tetraborato de sódio 0,1 M umaT RT por 20 min.
- Após 3 × 10 min de incubação em Triton X-100 a 1% diluído em PBS (tampão de lavagem), transfira as secções para o tampão de lavagem contendo 10% de soro bovino fetal (solução de bloqueio) durante 1 h à TA.
- Incubar as secções durante 48 h a 4 ° C em solução de bloqueio de 1: 100 diluída com mouse-anti-BrdU.
- Lavar as secções 3 × 10 min em tampão de lavagem e incubar durante 48 h em peroxidase de rabanete diluído 1:10 em tampão de lavagem.
- Transfira as secções para PBS durante 5 × 10 min e depois durante 7 minutos em 0,01% de diaminobenzidina (DAB) diluída em PBS antes de serem transferidas para uma solução DAB semelhante contendo 0,02% de H2O2 durante 10 min à TA.
- Complete uma série de lavagens (2 × 10 min em PBS e 2 × 10 min em tampão de fosfato sem cloreto de sódio adicionado) e monte as seções em ordem numérica em lâminas de microscópio.
- Secar as secções por aproximadamente 30 min antes da contra-coloração com cresyltolet.
- Coloque as lâminas do microscópio em uma cremalheira deslizante.
- Reidratar as secções durante 10 min em pratos de coloração de deslizamento contendo dH2O e depois transferir as lâminas para 0,02% de violeta de cresil em dH2O durante 15 min.
- Repita a etapa 2.12 antes que as seções sejam desidratadas três vezes em etanol (96% durante 5 min e 99% durante 2 × 2 min).
- Coloque as seções em xileno durante 2 × 15 min e deslize as lâminas usando um meio de secagem rápido para montagem.
- Finalmente, deixe as lâminas deslizantes por aproximadamente 24 h antes de poderem ser usadas para microscopia.
3. Estimativa do número total de neurônios marcados com BrdU usando o fracionador óptico
NOTA: Realize um estudo piloto incluindo alguns animais para determinar os parâmetros de amostragem ótimos, como o número de seções a serem analisadas e o número de distribuidores ópticos dentro das seções amostradas. Este piloto também fornece umCV preliminar (desvio padrão / média) e a possibilidade de ajustar a CE (ver seção 3.9.3) para obter uma precisão satisfatória das estimativas determinadas pelo investigador (para mais detalhes, veja abaixo). De igual modo, realize uma análise de distribuição z para abordar os seguintes pontos: encolhimento do tecido, qualidade da coloração ao longo da seção e distribuição das células no eixo z 14 .
- Verifique a espessura do tecido nas seções para confirmar que são adequadas para o uso do fracionador óptico, por exemplo , é suficientemente espessa para a altura escolhida do separador incluindo as zonas de proteção (veja abaixo). NOTA: A espessura do tecido é medida em diversos locais dentro da região de interesse.
- Coloque as lâminas na fase motorizada do microscópio e ative o software estereológico preferido.
- Delinear a área de interesse usando um objetivo de baixa ampliação (2X ou 4X) antes de mudar para um óleo de 100XObjetivo da ersão (ver Figura 2A ).
- Usando um ponto específico de um quadro de contagem ( por exemplo, em ou adjacente a um canto), localize a parte superior da seção movendo-se ao longo do plano focal até que alguma característica da seção apareça em foco. Registre esta posição z como 0 (veja a Figura 2B ).
- Mova o plano focal para baixo através do tecido até que o mesmo ponto específico do quadro de contagem esteja no último nível z de tecido em foco e marque essa posição. A espessura local do tecido é definida de 0 a este ponto final e pode ser lida no eixo z. Registre a espessura do tecido (veja a Figura 2B ).
- Documentar a penetração total da mancha e distribuição das células na espessura total da seção.
NOTA: A distribuição de neurônios marcados com BrdU é usada como guia para determinar as zonas de proteção necessárias. Embora uma distribuição uniforme de células seja crítica,É aceitável observar menos células perto da parte superior e inferior da seção, indicando o efeito de boné perdido (para mais detalhes, veja Dorph-Petersen et al., 2009).- Experimente os neurônios marcados com BrdU e registre sua posição z juntamente com a espessura da seção local medida no canto selecionado de cada quadro de contagem.
- Trace o número de neurônios BrdU-positivos como uma função de sua posição z.
- Corrija a altura do disector e das zonas de proteção com base na espessura média da seção e na distribuição das células (ver 3.1 e 3.2).
NOTA: A altura do disector deve ser menor do que a espessura da seção para evitar artefatos próximos das superfícies. Este risco é contornado pela inclusão de zonas de guarda para a parte superior e inferior da seção. - Determine o comprimento do passo entre os disectores.
- Delineie a região de interesse em todas as seções a serem analisadas e registre as áreas.
- Soma essas áreas e depois divida bE o número de setores a serem colocados nesta área.
NOTA: Com base na experiência anterior, um bom ponto de partida envolve 75 sondas. Isso proporcionará uma aproximação da área e as posições de amostragem correspondentes ( passo A) (para mais detalhes, consulte West, 2012). - Pegue a raiz quadrada de um passo , que fornecerá o tamanho xy-step.
- Determine o tamanho do quadro de contagem.
- Defina o tamanho do quadro de contagem para uma unidade arbitrária e realize uma amostragem piloto de neurônios BrdU positivos usando os parâmetros obtidos na seção 3.3 e 3.4.
NOTA: O tamanho deve ser determinado empiricamente por tentativa e erro, mas recomenda-se que ele seja ajustado para permitir a amostragem de 2-3 células por disector 8 .
- Defina o tamanho do quadro de contagem para uma unidade arbitrária e realize uma amostragem piloto de neurônios BrdU positivos usando os parâmetros obtidos na seção 3.3 e 3.4.
- Seguindo este passo final do estudo piloto, começam a amostragem celular.
NOTA: Os parâmetros de amostragem obtidos devem resultar em contagens de aproximadamente 150-200 células iN cada animal que é suficiente para obter um design estereológico eficiente 8 . - Contagem de neurônios positivos de BrdU usando um objetivo de imersão de óleo de 100 × e uma ampliação final de 2000-3000 ×. Em cada disector óptico, identifique os neurônios marcados com BrdU que são claramente reconhecidos pela característica de interesse (no presente estudo, o critério é quando a borda principal do neurônio marcado com BrdU se aproxima pela primeira vez), estão localizados Dentro do quadro de contagem ou toque as linhas de inclusão ( Figura 2B ). Não conte os neurônios BrdU-positivos que, quando claramente reconhecidos pela característica de interesse dentro da altura do disjuntor, tocam as linhas de exclusão. É extremamente importante seguir escrupulosamente essas regras de contagem ao longo de toda a quantificação estereológica.
NOTA: À medida que a BrdU incorpora em todas as células separadoras, a morfologia é usada para distinguir entre neurônios e outros tipos de células. NeuAs características do ron são um núcleo claramente definido com um citoplasma neutro e um nucleolo escuro. As células BrdU-positivas são reconhecidas como neurônios recém-formados com base em seu tamanho relativamente maior comparado às células gliais. Deve-se mencionar que, em estudos de proliferação a curto prazo (por exemplo, <24 h), a colagem dupla utilizando marcadores neuronais imaturos pode ser um pré-requisito 17 . - Estimar o número total de neurônios positivos a BrdU em cada cérebro multiplicando o número total de células contadas (Σ Q - ) com as frações de amostragem recíprocas:

para
Onde Q- é a espessura média da seção ponderada em número, h é a altura do distrutor, pois a fração de amostragem da área é ssf , a seção sFração de amplificação e t i é a espessura da seção no i contador de contagem com uma contagem de células de
Q- é a espessura média da seção ponderada em número, h é a altura do distrutor, pois a fração de amostragem da área é ssf , a seção sFração de amplificação e t i é a espessura da seção no i contador de contagem com uma contagem de células de  No disector 14 , 18 .
No disector 14 , 18 . - Calcule o coeficiente de erro (CE) 8, que é a variância de amostragem de neurônios positivos a BrdU em amostragem sistemática aleatoriamente aleatória (SURS).
- Primeiro, calcule o ruído , que é igual ao número total de neurônios negativos de BrdU contados:

- Em seguida, calcule a variância em SURS:
NOTA: Nós julgamos a área e a contagem de células no hipocampo para mudar suavemente de seção para seção e, conseqüentemente, usado "classe de suavidade" m = 1 (1/240) 8 , 19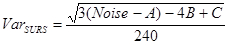
Onde
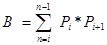

P i é o número de pontos contados para o objeto na seção i th e n é o número de seções 4 , 20 . - Finalmente, calcule o CE da estimativa:
NOTA: Em geral, a precisão ideal é geralmente alcançada quando o valor CE é inferior a metade do CV observado, como OCV 2 = ICV 2 + CE 2 , onde OCV é o CV observado e ICV é o CV 4 inerente.
- Primeiro, calcule o ruído , que é igual ao número total de neurônios negativos de BrdU contados:
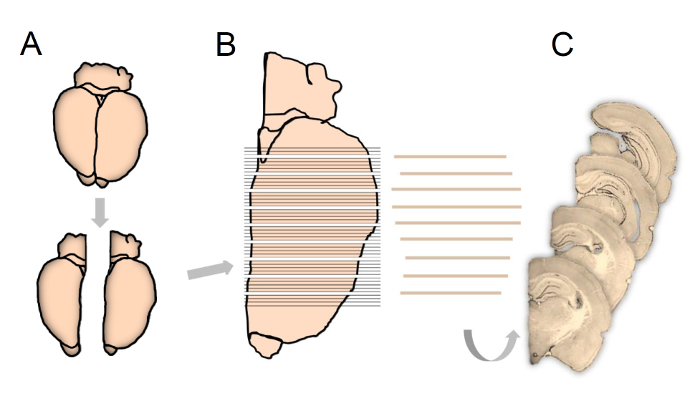
FFigura 1: Ilustração esquemática que mostra o processamento de tecidos de acordo com os princípios do fraccionador utilizados no presente estudo.
Após a experimentação, os hemisférios são separados eo hemisfério direito ou esquerdo escolhido sistematicamente e aleatoriamente (A). O cérebro completo que se estende por todo o hipocampo é cortado em seções coronais de 80 μm de espessura (B), após o que cada 5ª seção é sub-amostrada, começando aleatoriamente entre as seções 1 a 5, para imunocoloração final e quantificação estereológica (C). Clique aqui para ver uma versão maior dessa figura.

Figura 2: Ilustração que mostra o procedimento de amostragem estereológica usando os dispositivos ópticos.
(A) Após processamento histológico, o hO ippocampal GCL / SGZ foi delimitado e os produtos ópticos aplicados uniformemente e aleatoriamente sobre a região. (B) Nos disjuntores ópticos (à esquerda), os neurónios BrdU positivos foram contados apenas se a característica de interesse fosse claramente reconhecida dentro da altura do disjuntor e localizada dentro do quadro de contagem ou tocando na linha de inclusão (direita). Os neurônios que tocaram a linha de exclusão não foram contados. Barras de escala = 10 μm. Clique aqui para ver uma versão maior dessa figura.
Resultados
Parâmetros de amostragem
Ao analisar a distribuição z em um estudo piloto ( Figura 3 ), encontramos uma distribuição uniforme de neurônios positivos a BrdU na altura do distrutor. O encolhimento das seções foi medido; A espessura média final foi de 26,4 μm (19,0-32,0 μm) em cortes originalmente cortados a 80 μm. Com base na espessura do tecido e na distribuição dos neurônios marcados com BrdU, a altura do disjuntor foi ajustada para 10 μm, e as zonas de proteção na parte superior e inferior da seção foram ajustadas para 5 μm e 4-17 μm, respectivamente. Dependendo da densidade das células, a área dos quadros de contagem foi de 1414 ou 5210 μm 2 . O comprimento do passo foi de 220 μm nas direções x e y e a contagem celular foi realizada em uma média de 12 (intervalo 8-16) seções por animal. Estes parâmetros de amostragem resultaram em uma média de 133 (intervalo 33-372) BrdU- células positivas contadas em 173 (107-204) disectores em cada hemisfério cerebral.
Como exemplo, obtivemos os seguintes valores CV e CE para estimativas neuronais positivas para BrdU em ratos tratados ECS: 24 horas: CV = 0,59, CE = 0,11; 3 meses: CV = 0,34, CE = 0,12; 6 meses: CV = 0,43, CE = 0,09; 12 meses: CV = 0,22, CE = 0,09.
Quantificamos o número total de neurônios recém-formados e sua sobrevivência a longo prazo no hipocampo do rato após ECS usando o fracionador óptico em conjunto com uma técnica de coloração BrdU 10 , 11 . Os resultados finais mostraram uma neurogênese basal nos quatro grupos de animais de controle, que não diferiu significativamente em função do tempo de sobrevivência ( Figura 3 ). Além disso, ECS induziu um aumento significativo no número total de neurônios BrdU positivos às 24Horas (259%, p <0,0001), 3 (229%, p <0,001), 6 (152%, p <0,05) e 12 meses (162%, p <0,05) após a experimentação, em comparação com os animais controles.
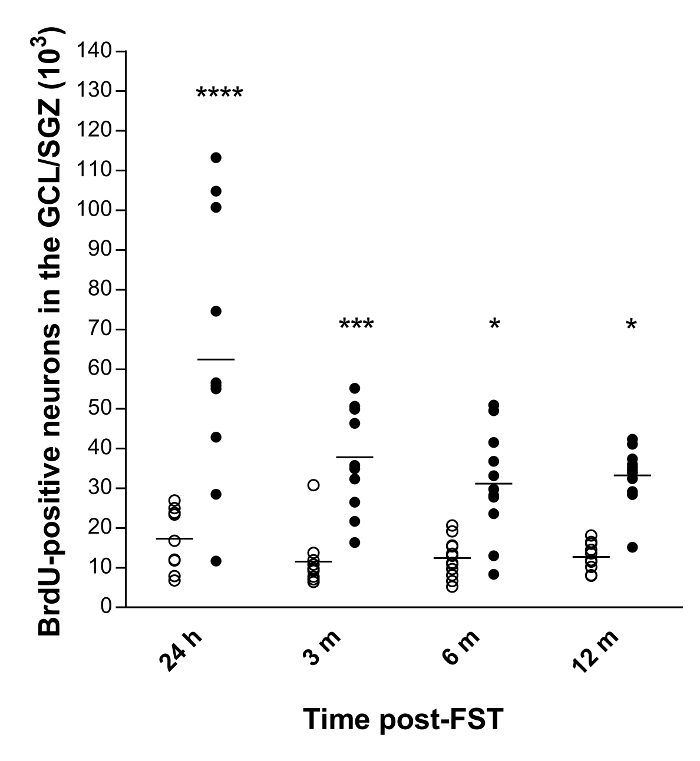
Figura 3: Dados quantitativos do número total de neurônios positivos a BrdU na GCL / SGZ do hipocampo de rato 10 , 11 .
As barras horizontais representam os valores médios. Abreviações: GCL, camada de células granuladas; SGZ, zona subgranular; H, horas; M, meses. **** p <0,0001, *** p <0,001 e * p <0,05 versus controle (n = 11-12 por grupo). Clique aqui para ver uma versão maior dessa figura.
Discussão
Usando ECS como uma metodologia para induzir neurogênese, encontramos um aumento imediato de 260% na formação de novos neurônios BrdU positivos no hipocampo. Neste grupo de neurônios gerados agudamente, encontramos 40% de atrito desde o dia 1 até três meses, com quase 50% dos neurônios recém formados sobrevivendo pelo menos 12 meses após o tratamento 10 , 11 . A contagem de neurônios marcados com BrdU seguiu um esquema de amostragem rigoroso, pelo qual todo o hipocampo foi cortado em seções de 80 μm de espessura seguido de sub-amostragem de cada 5ª seção com um começo de amostragem aleatório entre a seção um e a seção cinco. Fornecer estas seções são escolhidas de maneira aleatória e sistemática, isto é, demonstravelmente, um método excelente para reduzir a variância do resultado final, sem contagem exaustiva 1 . Este esquema de amostragem nos permitiu contar os neurônios negativos de BrdU em uma média de 12 (8-16) hipocampoEm cada cérebro de ratos, com uma precisão final de 9-11%.
Ao usar o método do fraccionador, é essencial conhecer a fração da altura da seção em que a contagem é realizada, uma vez que o encolhimento e a deformação do tecido ocorrem freqüentemente durante o processamento histológico 14 . De fato, vimos um encolhimento substancial da espessura neste estudo. Além disso, deve notar-se que pode ocorrer encolhimento diferencial do tecido, conforme apresentado em Dorph-Petersen et al. 2001. No entanto, desde que a estrutura completa de interesse esteja disponível para análise, essas limitações não resultam em uma polarização do número total de partículas, isto é , neurônios positivos a BrdU. Em estudos em que o encolhimento de tecido é uma questão particular, deve sempre ser afirmado que os resultados são obtidos em tecido deformado. Neste estudo, contamos com uma altura de um detetor de 10 μm. As seções do presente estudo tiveram uma espessura média final de 26 μm, um 5 μmZona de guarda na parte superior e uma zona de proteção de 11 μm (média) na parte inferior da seção. Esses parâmetros são aceitáveis, uma vez que as zonas de proteção devem ser aproximadamente o diâmetro das partículas amostradas.
Após a delimitação da GCL / SGZ, os setores foram uniformemente colocados aleatoriamente dentro da área delineada. Os disectores devem ser posicionados com um comprimento de passo fixo que otimize a amostragem e a contagem para obtenção eficiente de estimativas com uma precisão determinada pelo investigador. A precisão ideal geralmente é alcançada contando até 150-200 células em cada estrutura de interesse 5 . No presente estudo, contamos uma média de 133 (intervalo 33-372) neurônios BrdU positivos em cada hipocampo de ratos. Devido a um baixo número de células em alguns dos animais de controle, nossas contagens de neurônios negativos de BrdU caíram abaixo do número geralmente aceitável de células necessárias para obter uma precisão adequada, o que resultou em valores CE relativamente altos para esses casos. HNo entanto, como obtivemos valores CE de menos de metade dos valores de CV (ver seção de resultado representativo) não era necessária amostragem e contagem adicionais. Os altos valores de CV mostram que o maior contribuinte para a variação observada é originado pela variação biológica. Na verdade, podemos afirmar que o número médio de neurônios positivos a BrdU contados no presente estudo foi maior do que o necessário. Por exemplo, em um grupo de ratos, alcançamos um valor de CE de 9% e observamos um CV de 43%. Neste caso particular, poderíamos ter apontado para uma precisão de aproximadamente 20%. Em resumo, a precisão do número total de neurônios positivos a BrdU no presente estudo é suficiente na medida em que ele captura efeitos reais sobre o verdadeiro número de partículas. Devido à variação biológica bastante grande em certos grupos de animais, as mesmas estimativas poderiam ter sido obtidas com uma precisão aceitável, apesar de menos gastos de esforço. As altas variações biológicas dentro dos grupos só podemSer compensado pelo aumento do número de animais.
Pode-se argumentar que o padrão-ouro para a obtenção de números de células exatas implica uma contagem exaustiva de todos os objetos de interesse. No entanto, na maioria dos estudos do cérebro, isso não é uma possibilidade devido ao grande número de células. Embora seja muito mais eficiente do que a contagem de células exaustivas, o fraccionador opcional é relativamente demorado em comparação com o rastreio simples das diferenças nos números de células, o que é preferido se o número exato de células não for essencial. É nossa experiência que as diferenças de mais de 20-30% podem ser detectadas puramente por procedimentos de triagem.
Se realizada corretamente, a amostragem usando estereologia baseada em design fornece estimativas imparciais e precisas de maneira eficiente 1 . A propriedade imparcial da estereologia produz estimativas que, quando replicadas, aproximam-se da população real, e melhoram a reprodutibilidade daEstimativa 21 . Inicialmente, uma amostra representativa de toda a estrutura de interesse (neste estudo o GCL / SGZ do hipocampo) deve ser obtida, permitindo uma estimativa em um subconjunto estatisticamente válido das seções 4 . Para obter um número adequado de seções e sondas de contagem, aplicamos SURS, o que reduz a variância em comparação com a amostragem aleatória 8 . Além disso, o SURS garante que as partículas de interesse dentro da estrutura sejam amostradas com as mesmas probabilidades, independentemente do tamanho, forma, orientação e distribuição na estrutura. Como tal, a estereologia deve ser altamente recomendada ao obter estimativas precisas e imparciais é um aspecto central do projeto.
Divulgações
Os autores não têm interesses financeiros concorrentes.
Agradecimentos
Agradecemos a Susanne Sørensen pela habilitada assistência técnica. Este trabalho foi apoiado por bolsas da The Velux Foundation; Fundação Jascha; Fundação Aase e Ejnar Danielsens; Fundação Hartmann Brothers; Diretor Jacob Madsen e esposa Olga Madsens Foundation; Doutor Sofus Carl Emil Friis e esposa Doris Friis 'Trust; A Fundação de 1870; Torben e Alice Frimodts Foundation e The Foundation for Neurological Research. A edição de manuscrito foi realizada pela Inglewood Biomedical Editing.
Materiais
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 5'-bromo-2'deoxyuridine - BrdU | Sigma-Aldrich | 19-160 | |
| Cresyl Violet | Sigma-Aldrich | C5042 | Contains the following materials for 1 L: 0.2 g cresyl violet; 2.0 g sodiumacetate, 3 H2O; 3 ml glacial acetic acid; 1000 ml destilled water |
| Cryoprotectant | Capital Region Pharmacy, DK | 861334 | Contains the following materials: Sucrose; polyvinylpyrrolidon PVP 40; sodiumphosphatebuffer (0.2 M); ethylenglycol; demineralized water. |
| dH2O | Capital Region Pharmacy, DK | 817205 | |
| Diaminobenzidine – DAB | Sigma-Aldrich | D5637 | |
| Envision-HRP | DAKO | K4001 | Peroxidase labeled polymer conjugated to goat anti-mouse immunoglobulins |
| Ethanol - 70 % | Plum A/S | 201098 | |
| Ethanol - 96 % | Plum A/S | 201104 | |
| Ethanol - 99.9 % | Plum A/S | 201111 | |
| Fetal Bovine Serum | In Vitro | BI-04-003-1A | |
| H2O2 30% | Capital Region Pharmacy, DK | 896456 | |
| HCl | J. T. Baker | 6081 | |
| Mounting medium | Sakura | 4583 | Tissue Tek |
| Mouse-anti-BrdU | Becton-Dickinson | 347580 | |
| PBS buffer | Capital Region Pharmacy, DK | 853436 | pH = 7.4 |
| PFA | VWR | 28,794,295 | pH = 7.4 |
| Phosphate buffer | Capital Region Pharmacy, DK | 866533 | 0.1 mol/l, pH 7.4 |
| Rapid drying mounting medium | Histolab Products AB | 801 | Pertex |
| Sodium Tetraborate | Merck A/S | 1,063,080,500 | |
| Sucrose | Merck A/S | 1,076,515,000 | |
| Triton X-100 | Merck A/S | 1,086,031,000 | |
| Xylene | VWR | 28,973,363 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Cover slips | Menzel-Gläser | 24x50 mm #0 | |
| Cryostat | Leica | CM1860 | |
| Digital Microcator | Heidenhain | VRZ 401 | |
| Glass dishes | Brain Resaerch Laboratories | 1256 | |
| Microscope | Nikon | Eclipse 80i | |
| Microscope camera | Olympus | DP72 | |
| Microscope slides | VWR | 48311-703 | SuperFrost+ |
| Motorized stage | Prior | H101A | |
| Multidish Containers | Sigma-Aldrich | D6315-1CS | Nuclon 12-wells |
| New-Cast software | Visiopharm | ver. 4.5.6.440 | |
| Objective 2x | Nikon | CFI Plan UW 2X | |
| Objective 4x | Nikon | CFI Plan Fluor 4X | |
| Objective 10x | Nikon | CFI Plan Fluor 10X | |
| Objective 100x oil immersion | Nikon | CFI Plan Apo Lambda DM 100X Oil | Numerical aperture 1.40 |
| Orbital shaker | Gemini BV | CM-9 | Sarstedt |
| Slide rack | Sakura | 4465 | |
| Slide staining dishes | Sakura | 4457 | Tissue-Tek |
| Specimen disc | Leica | 14037008637 | |
| Staining nets | Brain Research Laboratories | 2512 | 25-wells |
Referências
- Boyce, R. W., Dorph-Petersen, K. A., Lyck, L., Gundersen, H. J. Design-based stereology: Introduction to basic concepts and practical approaches for estimation of cell number. Toxicol. Pathol. 38 (7), 1011-1025 (2010).
- West, M. J. Introduction to stereology. 2012 (8), Cold Spring Harb. Protoc. 843-851 (2012).
- West, M. J. Stereological methods for estimating the total number of neurons and synapses: issues of precision and bias. Trends Neurosci. 22 (2), 51-61 (1999).
- Gundersen, H. J., Jensen, E. B. The efficiency of systematic sampling in stereology and its prediction. J. Microsc. 147 (Pt 3), 229-263 (1987).
- West, M. J., Slomianka, L., Gundersen, H. J. Unbiased stereological estimation of the total number of neurons in the subdivisions of the rat hippocampus using the optical fractionator. Anat. Rec. 231 (4), 482-497 (1991).
- Kaae, S. S., Chen, F., Wegener, G., Madsen, T. M., Nyengaard, J. R. Quantitative hippocampal structural changes following electroconvulsive seizure treatment in a rat model of depression. Synapse. 66 (8), 667-676 (2012).
- Chen, F., Madsen, T. M., Wegener, G., Nyengaard, J. R. Repeated electroconvulsive seizures increase the total number of synapses in adult male rat hippocampus. Eur Neuropsychopharmacol. 19 (5), 329-338 (2009).
- Gundersen, H. J., Jensen, E. B. V., Kiëu, K., Nielsen, J. The efficiency of systematic sampling in stereology - reconsidered. J.Microsc. 193 (3), 199-211 (1999).
- West, M. J. Design based stereological methods for estimating the total number of objects in histological material. Folia Morphol.(Warsz). 60 (1), 11-19 (2001).
- Olesen, M. V., Wörtwein, G., Pakkenberg, B. Electroconvulsive stimulation, but not chronic restraint stress, causes structural alterations in adult rat hippocampus - a stereological study. Hippocampus. 25 (1), 72-80 (2015).
- Olesen, M. V., Wortwein, G., Folke, J., Pakkenberg, B. Electroconvulsive stimulation results in long-term survival of newly generated hippocampal neurons in rats. Hippocampus. 27 (1), 52-60 (2017).
- Madsen, T. M., et al. Increased neurogenesis in a model of electroconvulsive therapy. Biol Psychiat. 47 (12), 1043-1049 (2000).
- Cameron, H. A., Mckay, R. D. G. Adult neurogenesis produces a large pool of new granule cells in the dentate gyrus. J.Comp. Neurol. 435 (4), 406-417 (2001).
- Dorph-Petersen, K. A., Nyengaard, J. R., Gundersen, H. J. G. Tissue shrinkage and unbiased stereological estimation of particle number and size. J.Microsc. 204 (3), 232-246 (2001).
- Schmitz, C., Hof, P. R. Recommendations for straightforward and rigorous methods of counting neurons based on a computer simulation approach. J Chem. Neuroanat. 20 (1), 93-114 (2000).
- Paxinos, G., Watson, C. The rat brain in stereotaxic coordinates. , 2nd edn, Academic Press. Sydney. (1986).
- Kempermann, G., Gast, D., Kronenberg, G., Yamaguchi, M., Gage, F. H. Early determination and long-term persistence of adult-generated new neurons in the hippocampus of mice. Development. 130 (2), 391-399 (2003).
- Fabricius, K., Wortwein, G., Pakkenberg, B. The impact of maternal separation on adult mouse behaviour and on the total neuron number in the mouse hippocampus. Brain Struct. Funct. 212 (5), 403-416 (2008).
- Dorph-Petersen, K. A., et al. Volume and neuron number of the lateral geniculate nucleus in schizophrenia and mood disorders. Acta neuropathologica. 117 (4), 369-384 (2009).
- Eriksen, N., et al. Application of stereological estimates in patients with severe head injuries using CT and MR scanning images. Br. J. Radiol. 83 (988), 307-317 (2010).
- Gundersen, H. J. Stereology: the fast lane between neuroanatomy and brain function--or still only a tightrope? Acta Neurol. Scand. Suppl. 137, 8-13 (1992).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados