Method Article
Ensaios de eletroquimioluminescência para humano ilhéu auto-anticorpos
Neste Artigo
Resumo
Aqui, apresentamos os métodos para detectar autoanticorpos ilhota humana utilizando ensaios de eletroquimioluminescência (ECL). O protocolo, usado para prever o tipo 1 diabetes, pode ser expandido em cima para detectar autoanticorpos para outras doenças auto-imunes.
Resumo
Identificação de autoanticorpos ilhéu associados com diabetes tipo 1 (T1D) lidera o caminho para o projeto e dissuadir desta doença na população em geral. Um romance ensaio ECL é um ensaio de fase fluida nonradioactive para auto-anticorpos ilhéu com maior sensibilidade e especificidade do que a atual 'ouro' padrão rádio-ensaio (RBA). ECL ensaios mais precisamente podem definir o início da T1D pré-sintomático, distinguem os auto-anticorpos de alto risco, alta afinidade os auto-anticorpos de baixo risco, baixa afinidade gerados em RBAs e ensaios convencionais imunoenzimático (ELISA ). A proteína de antígeno utilizada neste ensaio ECL é rotulada com Sulfo-tag e biotina, respectivamente. Cada ensaio de auto-anticorpos ECL que usa uma proteína antígeno particular precisa de um passo de otimização antes ele pode ser usado para aplicação de laboratório. Este passo é especialmente vital em determinar os requisitos para soro ácido tratamentos, concentrações e proporções dos dois antígenos diferentes rotulados com Sulfo-tag e biotina. Para realizar o ensaio, soro amostras são misturadas com Sulfo-marca-conjugados e biotinilado capturam proteínas do antígeno em solução tamponada fosfato (PBS), que contém 5% albumina de soro bovino (BSA). Posteriormente, as amostras são incubadas durante a noite a 4 ° C. No mesmo dia, um prato streptavidin-revestido é preparado com buffer de bloqueador e incubado durante a noite a 4 ° C. No segundo dia, lavar a placa streptavidin e transfira a mistura soro-antígeno na chapa. Coloque a placa sobre o agitador de placa, defini-lo em baixa velocidade e incubar a temperatura ambiente durante 1 h. Posteriormente, a placa é lavada novamente, e buffer de leitor é adicionado. A placa é então contava com a máquina de leitor de placa. Os resultados são transportados através de um índice, que é gerado a partir de amostras de soro de controlo positivo e negativo de padrão interno.
Introdução
Um sistema de classificação de preparo recente foi criado para auxiliar no diagnóstico de estágios iniciais de T1D em pacientes. Exato da detecção de auto-anticorpos ilhéu humano desempenha um papel importante na identificação e estadiamento pré-sintomático diabetes tipo 1, como a presença de auto-anticorpos ilhéu indica a presença de auto-imunidade células β. A taxa na qual diabetes afeta pacientes da ocorrência inicial de auto-imunidade células β a doença sintomática, associado com o número e tipo de auto-anticorpos ilhéu, é variável de2,3.
A idade de seroconversão de auto-anticorpos, título e afinidade de auto-anticorpos ilhéu pode afetar a taxa da progressão sintomática tipo 1 diabetes4,5,6,7,8 ,9,10. Recentemente, desenvolvidos ensaios ECL extensivamente validados, demonstraram aumento da sensibilidade e são mais específicos de doença10,11,12,13. Estes ensaios melhorar a previsão e a encenação do risco de diabetes por meio de detecção precoce de auto-anticorpos ilhéu. Mais precisamente, eles marcam o início de auto-imunidade ilhéu e ignoram os sinais de baixa afinidade e baixo risco não relevantes para a diabetes.
Em um ensaio de ECL, os auto-anticorpos no soro, se presente, ponte do antigénio Sulfo-marca-conjugados ao antígeno biotinilado captura na fase fluida. Depois da ponte, o vinculador de biotina é apanhado em fase sólida e detecção por ECL pelo Sulfo-tag na placa streptavidin revestido (Figura 1).
Nesta revisão, ensaios de ECL único anticorpo com auto-anticorpos ilhota humana são principalmente utilizados. Brevemente, multiplexados anticorpo ensaios com base em ensaios de ECL único serão discutidos. O ensaio multiplex pode ser usado para identificar múltiplas, até 10, os auto-anticorpos dentro de um único bem, usando 15 µ l de soro. Este ensaio simples alta taxa de transferência pode ser usado para a tela, simultaneamente, múltiplos auto-anticorpos para várias doenças auto-imunes relevantes na população em geral.
Protocolo
1. preparação buffer
- Rotulagem de reserva (2 x PBS, pH 7.9): em 400 mL de água destilada deionizada (DD), adicionar 100 mL de PBS de x 10, ajustar o pH a 7,9 com NaOH.
- 3mm de biotina: dissolver 1 mg de biotina, em 588 µ l de tampão de rotulagem.
- 3mm de Sulfo-tag: dissolver 150 nmol de Sulfo-tag em 50 µ l de tampão de rotulagem.
- Buffer de antígeno (5% BSA): em 500 mL de 1X PBS, adicionar 25g de albumina de soro bovino (BSA).
- Prepare a solução de ácido acético 0,5 M.
- 1,0 M de tampão Tris-HCl com pH 9.0: preparar 1 M Tris-HCl de buffer e ajustar o pH a 9.0 com HCl.
- Buffer de revestimento (3% A do bloqueador): em 500 mL de 1X PBS, adicione 15 g de bloqueador A.
- Tampão de lavagem (0,05% Tween 20, PBST): em 5000 mL de 1X PBS, adicionar 2,5 mL de Tween 20.
- Buffer de leitura (2x Buffer de leitura T com surfactante): em 500 mL de água DD, adicionar 500ml de 4x do Buffer de leitura T com o surfactante (Tabela de materiais).
- Loja biotina e Sulfo-tag em um congelador-20 ° C.
Nota: Ambos biotina e Sulfo-tag soluções sempre devem ser preparadas antes do procedimento de rotulagem.
2. etiqueta o Autoantigen ilhota humana com biotina e Sulfo-tag
Nota: Recomenda-se uma alta concentração de antígeno, ≥0.5 mg/mL, para uma reação de rotulagem mais eficiente.
- Determine a razão molar de ilhota humana autoantigen para biotina e Sulfo-tag.
- Obter o número de molar de antígeno, dividindo o peso do antígeno pelo peso molecular.
- Use a razão molar de 1:5 para o antígeno com menor peso molecular (≤ 10 kd) e a razão molar entre 01:20 para o antígeno com maior peso molecular (> 50 kd).
- Calcule o volume para biotina ou Sulfo-tag, dividindo o número molar por sua concentração.
- Misture o autoantigen ilhota humana com biotina ou Sulfo-tag com a relação molar de 1:5.
Nota: A proteína em sistemas de tampão tris ou glicina deve ser trocada para 2 x tampão PBS com pH 7,9 usando o spin de dimensionamento coluna. - Desde que a biotina e Sulfo-tag são sensíveis à luz, cobrir os tubos de reação com folha de alumínio. Incube a reação na temperatura de quarto (RT) por 1h.
- Durante a incubação, prime a coluna de rotação por aplicadora 2 x tampão PBS na coluna três vezes. Centrifugue a solução a 1000 x g por 2 min cada tempo.
Nota: Atualmente a reação de rotulagem, através da ponte, ainda está ocorrendo e precisa ser parado. - Pare a reação de rotulagem por purificar o autoantigen rotulado ilhota humana. Para purificar, passar o autoantigen através da coluna de rotação e centrifugar a coluna a 1000 x g por 2 min.
- Determine a concentração do antígeno etiquetado (µ g / µ l) usando a quantidade de proteína de antigénio e o volume final.
Nota: Aproximadamente, haverá retenção de 90-95% de antígeno etiquetado após passe de cada coluna de rotação. - Alíquota do antígeno etiquetado e loja rotulado antígeno a-80 ° C.
3. definir os melhores concentrações e proporções para os dois antígenos rotulados para o ensaio (ensaio de Checker Board)
- Preparar duas amostras de soro, um alto positivo e um negativo, com um volume total de 200 µ l de cada um.
- µ L de 4 alíquotas de soro e adicionar 1X PBS até o volume final é de 20 µ l por alvéolo por um prato PCR de 96 poços. Use metade de uma placa para a amostra positiva alta e a outra metade para a amostra negativa, como mostrado na Figura 2A.
- Adicione 10 µ l de biotina e 10 µ l de Sulfo-marca rotulado de diluições em série do antígeno e conduta para os dois antígenos rotuladas de forma diferente, como mostrado na Figura 2A. Execute uma diluição serial horizontal para um antígeno etiquetado e uma diluição serial vertical para o antígeno outro rotulado.
- Continue o resto dos passos do ensaio descrito no 5.3 para 9.1.
- Calcule a relação dos sinais da amostra positiva alta contra cada um dos sinais de correspondente da amostra negativa mostrado na Figura 2B.
- Identificar as melhores concentrações de biotina e Sulfo-marca rotulado antígenos selecionando um ponto com o mais alto ou perto de um rácio mais elevado de positivo para negativo. Considere o sinal baixo fundo da amostra negativa para identificar a proporção.
Nota: O ensaio dia 1 inclui passo 4 ao passo 6.
4. prepare o antígeno Buffer usando a concentração correta da biotina/Sulfo-tag rotulado antígeno
- Selecione a concentração racional de cada antígeno com base no ensaio de placa do verificador.
- Prepare-se 3 mL da solução do antígeno por placa, usando a concentração racional da biotina/Sulfo-tag rotulado antigen para o buffer de antígeno.
5. Incubar as amostras de soro com o antígeno etiquetado
Nota: Existem dois protocolos nesta seção, um sem tratamento com soro ácido e outro com tratamento ácido de soro. Todos os ensaios de auto-anticorpos ilhéu exceto ensaio de IAA usam protocolo regular sem tratamento com soro ácido de etapas 5.1 a 5.5, Considerando que o ensaio de IAA ignora estes passos e usa o protocolo com tratamento ácido de soro da escadaria de 5,6 a 5,9.
- µ L de 4 alíquotas de soro e adicionar 1X PBS até o volume final é de 20 µ l por alvéolo por um prato PCR de 96 poços.
- Adicione 20 µ l da solução do antígeno rotulada por bem.
- Cobrir a placa PCR com selagem da folha para evitar a luz.
- Colocar a placa em um shaker (baixa velocidade) em RT por 2 h.
- Colocar a placa na geladeira a 4 ° C e incubar durante a noite (18-24 h).
Nota: O seguinte protocolo de passos de 5,6 a 5,9 é projetado apenas para o ensaio do IAA e outros ensaios de auto-anticorpos pular etapas. - Mix 15 µ l de soro com 18 µ l de 0,5 M de ácido acético para cada amostra de soro. Incube a esta mistura a RT por 45 min.
- Prepare a solução do antígeno com a concentração racional de biotina e Sulfo-tag rotulado de antígeno, com base no ensaio de placa do verificador, usando buffer de antígeno. Em cada bem, alíquota 35 μL de tampão de antígeno, contendo biotina e Sulfo-marca rotulado antígeno, em um novo prato PCR.
- Antes de terminar a etapa de incubação (etapa 5.6) 45 min, adicione 8,3 µ l de tampão de pH 9.0 Tris 1 M para o lado de cada poço da placa de antígeno (etapa 5.6). É importante limitar a mistura entre o tampão Tris e o antígeno. Imediatamente transferir 25 µ l do soro, que é tratado com ácido, na etapa 5.6, em cada poço e agitar a solução. Cobrir a placa PCR com selagem da folha para evitar a luz.
- Colocar a placa em um shaker (baixa velocidade) em RT por 2 h. colocar a placa na geladeira a 4 ° C e deixar a placa incubar durante a noite (18-24 h).
6. prepare a placa Streptavidin
- Levar um prato de estreptavidina na geladeira de 4 ° C e deixar a placa vir para RT
- Uma vez que a placa de estreptavidina no RT, adicione 150 µ l de 3% A de bloqueador para cada poço.
- Cobrir a placa PCR com selagem da folha.
- Incube a placa na geladeira a 4 ° C durante a noite.
Nota: Ensaio dia 2 inclui a etapa 7 para a etapa 9.
7. transferência de soro/antígeno incuba a placa Streptavidin
- No dia seguinte, retire a placa de estreptavidina da geladeira e descarte o buffer da placa. Estabelecidas algumas toalhas de papel seco em cima da mesa e toque o prato de cabeça para baixo, até que não haja nenhum buffer mais dentro dos poços.
- Encher o prato de estreptavidina vazio com 150 µ l de PBST por alvéolo e descartar o PBST da placa para um total de três lavagens.
- Transferir 30 µ l de soro/antígeno incuba por alvéolo na placa da estreptavidina.
- Cubra o prato com papel alumínio para evitar a luz. Agite a placa, em uma configuração baixa, em RT por 1h.
8. Lave o prato e adicionar o Buffer de leitura
- Descarte incuba da placa. Adicionar 150 µ l de PBST por alvéolo e descartar o PBST da placa para um total de três lavagens.
- Após a lavagem, adicione 150 µ l por alvéolo do buffer de leitura.
Nota: É importante evitar bolhas de ar na solução, pois isto afetará como a placa é ler sobre a máquina de leitor de placa.
9. Leia a placa e analisar dados
- Conte a placa na máquina do leitor de placa. Valores de anticorpos são mostrados como contagens por segundo (CPS).
- Transmita os níveis de anticorpos receberam da máquina de leitor de placa como um índice relativo. Calcule o índice a partir da seguinte equação:
Valor do índice = [CPS (amostra) - CPS (controle negativo)] / [CPS (controle positivo) - CPS (controle negativo)]. - Identifica os resultados positivos e negativos de anticorpo usando o cut-off para positividade, definida com base no percentil 99 de 100 indivíduos saudáveis de controle (indivíduos não-diabéticos sem qualquer doenças auto-imunes conhecidas e que têm sem histórico familiar de diabetes).
Resultados
Figura 2 exibe o checker bordo. É mostrado que 250 ng/mL de biotina e 250 ng/mL de antígeno etiquetado são as concentrações mais racionais utilizadas no ensaio considerando os sinais a partir da amostra de controlo, a amostra de controlo negativo como plano de fundo do ensaio e a relação de Sulfo-tag positivo para sinais negativos. Com as concentrações otimizadas destes dois antígenos rotulados, o ensaio foi realizado com as amostras de soro de 100 pacientes recentemente diagnosticados com T1D e 100 controles saudáveis. O valor de índice de 0,023 foi definido como o limite do ensaio de positividade. Isto representa 85% sensibilidade em pacientes e 99% de especificidade em controles saudáveis usando o receptor operam curva característica (ROC), mostrada na Figura 3A. O ensaio para as amostras desconhecidas foi conduzido com internos positivos de altos padrão, baixos positivos e amostras de controlo negativo. Os resultados das contagens CPS são mostrados em tabela 2A. A média de CPS de controlos positivos alta e baixa são destacadas em vermelho, [(19940+15866) 17903/2] e [(857+820) 839/2], e os controles negativos são destacados em verde, [(170+165)/168 2]. É calculado o índice para amostras desconhecidas "(CPSamostra-168)/(17903-168)." Tabela 2B mostra os valores de índice calculado para todas as amostras. Os valores de índice que são maiores do que 0,023 são escritos em vermelho, correspondentes aos valores de CPS, também escritos em vermelho na tabela 2A. Esses valores serão definidos como os resultados positivos que são maiores do que os 99% deth da população controle saudável. Quando é usada uma concentração de antígeno irracional, o ensaio terá um fundo elevado, conforme mostrado na tabela 2 C. Baixos níveis de anticorpos positivos fará falta como os valores de A2, A5, D1 e H4 destacadas em cinza na tabela 2D.
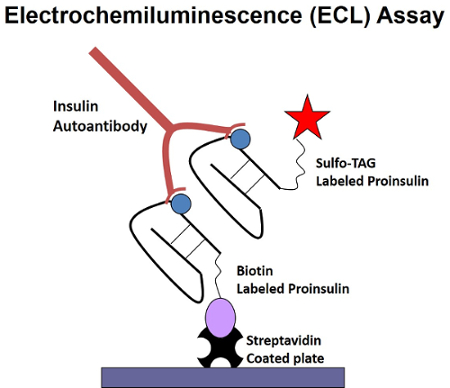
Figura 1 : Ilustração de uma bivalente placa captura em um único ensaio ECL-IAA. Os auto-anticorpos ilhéu nas pontes de soro o Sulfo-tag conjugado antígeno ao antígeno biotinilado captura, que é capturado na fase sólida na placa streptavidin-revestido. Detecção do antigénio de conjugados de Sulfo-marca placa-capturado é realizada através de ECL. Esta figura foi modificada de Yu, et al. 11. clique aqui para ver uma versão maior desta figura.
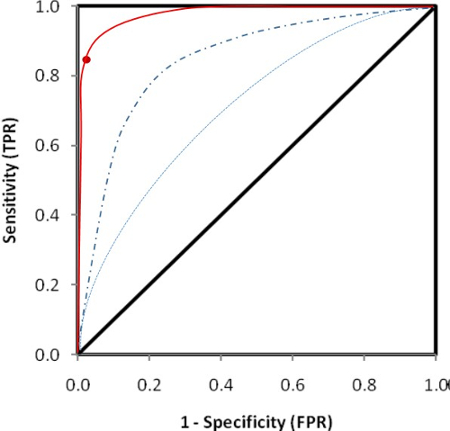
Figura 2 : Curva ROC para determinar o limiar de positividade do ensaio. Os 99% deth de especificidade correspondente à sensibilidade de 85% foi selecionado e é representado como um valor de índice de 0,023. Este limite superior do ensaio foi retirado 100 controles saudáveis. Clique aqui para ver uma versão maior desta figura.

Figura 3 : Ilustração de soro humano normal bloqueio ECL-IAA sinais. R: os sinais de ensaios ECL-IAA com um anticorpo monoclonal de insulina (MoAb) drasticamente foram bloqueados pela adição de soro humano normal. Quando comparando MoAb em PBS, o sinal foi parcialmente restaurado quando o soro humano foi tratado com ácido. B: sinais de um ensaio de ECL-IAA com 4 dos doentes foram significativamente melhorados com tratamento ácido. Esta figura foi modificada de Yu, et al. 11. clique aqui para ver uma versão maior desta figura.

Figura 4 : Ilustração do ensaio Mutiplex ECL. Complexos de antígeno-anticorpo são formados na fase líquido com linkers específicos. Os complexos antígeno-anticorpo-linker específicos são contidos em cada um dos pontos-vinculador específicos no mesmo bem. A máquina de leitor de placa é capaz de distinguir os sinais de diferentes fontes de manchas e dá conta de CPS em 10 diferentes canais, respectivamente. Clique aqui para ver uma versão maior desta figura.
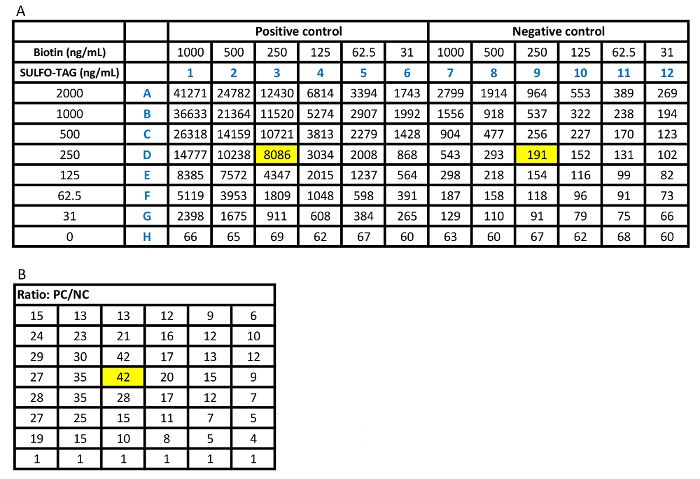
Tabela 1: ensaio de placa verificador determina as concentrações e proporções de biotina e Sulfo-marca rotulado antígenos. R: raw CPS conta a placa placa do verificador com soro positivo alto no meio da placa e soro negativo na outra metade. A concentração do antígeno biotinilado foi diluída horizontalmente em série e a concentração de Sulfo-tag rotulado antígeno foi diluída verticalmente em série. B: os valores de relação dos Condes CPS do soro positivo alto contra cada um dos seus correspondentes contagens de CPS do soro negativo. Os poços de destaque amarelos representam a melhor relação de positivo para negativo no painel B. Esta proporção corresponde a 250 ng/mL, biotina e 250 ng/mL Sulfo-marca rotulado concentrações de antígeno no painel A com um aceitavelmente baixa contagem de CPS para soro negativo. Clique aqui para ver uma versão maior desta tabela.
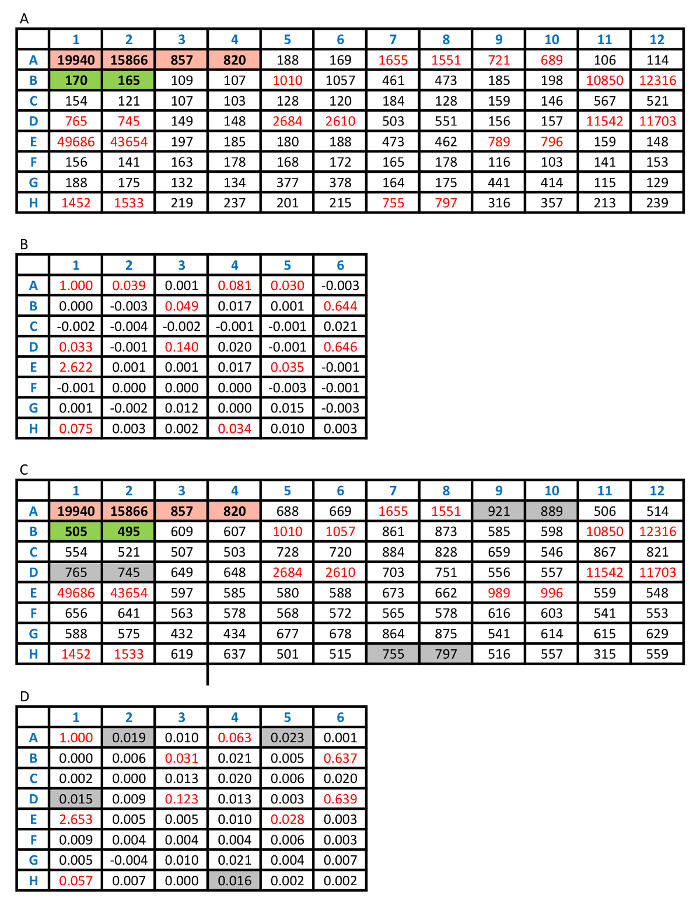
Tabela 2: análise dos resultados do ensaio. R: raw CPS conta da placa de ensaio com os controles padrão de alto e baixo positivos destacados em vermelho e os controles padrão negativos realçados em verde. Cada amostra foi duplicada no ensaio. B: índice valores foram calculados, conforme descrito no protocolo do ensaio. Qualquer valor de índice que foi superior a 0,023 foi definido como um resultado positivo, destacado em vermelho. C: raw CPS conta da placa com o mesmo conjunto de amostras de ensaio quando utilizou-se uma concentração de antígeno irracional. Isto resultou em um plano elevado e alguns positivos baixos normalmente detectados, como mostrado no painel B, foram convertidos para negativos, destacados em cinza no painel D. , por favor clique aqui para ver uma versão maior desta tabela.
Discussão
Os auto-anticorpos ilhéu são atualmente os biomarcadores mais confiáveis para a auto-imunidade de diabetes tipo 1. Eles marcam o início da auto-imunidade específico ilhéu e determinar os riscos de doença evidente. O ensaio de ECL, para auto-anticorpos ilhéu, foi extensivamente validado em vários ensaios clínicos diabetes de tipo nacional e internacional 1. O ensaio mostrou aumento da sensibilidade e especificidade em comparação com o atual 'ouro' RBAs padrão. O ensaio de ECL demonstrou sua vantagem superior para maior especificidade da doença por discriminar alta afinidade e auto-anticorpos de alto risco ilhéu de baixo risco, baixa afinidade os sinais gerados pela RBA. Isso é notado especialmente em indivíduos que são somente único ilhéu auto-anticorpos positivos e nunca progrediram para diabetes tipo 1. A maioria destes baixa afinidade auto-anticorpos foram encontrados para ser perdida durante a acompanhar testes feitos dentro de meses a anos, comportando-se como um 'positivo transitório'. Como anteriormente a hipótese, estes baixa afinidade 'único' auto-anticorpos provavelmente resultaram de vacinação com uma molécula cross-reactive. Enquanto maior afinidade, auto-anticorpos de ilhéu de risco mais elevados resultaram da imunização com os antígenos do Ilhéu próprios. Além disso, ECL-ensaios têm demonstrado a capacidade de antedate o tempo de 'soroconversão' de ensaios de ligação de rádio padrão atuais (RBA) por anos em crianças com pré-diabetes, que foram seguidos para diabetes clínico desde o nascimento. Um ensaio clínico internacional em curso, a determinantes ambientais da Diabetes em jovens (TEDDY), depende de uma detecção precisa de identificar o calendário e a aparência do primeiro auto-anticorpos ilhéu 'soroconversão' para marcar o início do Ilhéu autoimunidade e para a identificação de causas ambientais. Uma possível razão para o aumento da sensibilidade no ensaio de ECL é que o ensaio capta todas as classes de imunoglobulinas: IgG, IgM, IgA, IgE, ao invés de tradicionais RBA ou do ELISA, que contam apenas com a detecção de IgG.
Em ensaios de ECL, para alguns auto-anticorpos específicos como IAA, a ligação de anticorpos ao antígeno parece ser inibido por algum componente presente no soro humano normal. Para remover ou liberar esta inibição, tratamento com ácido de amostras de soro foi necessário fazer antes que o soro foi incubado com antígeno. Como mostrado no [Figura 5], ensaio ECL-IAA, as atividades de ligação do anticorpo monoclonal rato insulina e anticorpos de soro dos pacientes com o antígeno foi bastante reforçada. A acidificação de amostras de soro, usadas em ensaios de anticorpos, geralmente é aplicada para desassociar complexos vinculados pré-existente. O mecanismo por trás como sinais de IAA são inibidos em amostras de soro humano e lançados pela acidificação do soro não é conhecido, mas este método tem sido utilizado em outros ensaios de ECL baseado14,15.
Em alguns casos, quando moléculas de rotulagem, biotina ou Sulfo-marca, a rotulagem positionsinside das moléculas de proteína do antígeno são em, ou muito próximo de epitopos chaves de ligação do anticorpo, que pode interferir com a actividade de ligação de anticorpos. Isto irá reduzir a sensibilidade do ensaio e completamente pode derrubar o ensaio. Para rotular o procedimento de rotina, maximização ou saturação é desejada por cada molécula de proteína antígeno gerar atividade máxima ou sinal por molécula rotulada por maximizar a capacidade de rotulagem de cada possível posição de rotulagem. Insaturados de rotulagem deve ser realizada, reduzindo a razão molar de moléculas (biotina e Sulfo-tag) à proteína antígeno de rotulagem se rotulando no antígeno torna-se um possível motivo para interrupção da actividade de ligação do anticorpo. Os resumos de Major pode melhor ser reservados e interrupção da actividade de ligação de anticorpo pode ser liberada usando a estratégia de rotulagem insaturada na maioria dos casos.
Cada ensaio deve incluir um interno padrão elevado controlo positivo e negativo para cálculos de índice de amostras desconhecidas. Um controle positivo baixo perto do limite superior do ensaio de controles normais é importante incluir para o controlo de sensibilidade do ensaio. O laboratório deve manter suficiente alíquotas de padrão controles positivos e negativos para o uso a longo prazo e todas as alíquotas devem ser armazenadas a-20 ° C. Para garantir a qualidade do ensaio, ensaios devem ser executados em duplicatas para cada amostra e cada resultado positivo deve ser confirmado pela repetição da amostra em um ensaio separado. Um terceiro ensaio é necessário quando o segundo teste de confirmação não concorda com o primeiro ensaio e os resultados dos dois ensaios, que concordo (EG., +, + ou-, -), será a decisão final de um resultado positivo ou negativo.
Com a plataforma definida para ensaios de ECL único, um ensaio multiplexado pode ser expandido em cima destes. Pode determinar simultaneamente até 10 autoanticorpos diferentes em um único poço com uma pequena quantidade de soro. Atualmente, quatro auto-anticorpos ilhéu incluindo IAA, GADA, IA-2A e ZnT8A são iguais em importância para a previsão do risco de progressão para T1D em ambos os parentes de pacientes com T1D e a população em geral. Os métodos utilizados para a seleção destes 4 auto-anticorpos usando medições de auto-anticorpos único atual são trabalhosos e ineficientes, especialmente para a seleção de população em grande escala. Importante, até 40% dos pacientes com T1D têm uma condição auto-imune adicional16,17,18. Infelizmente, não há nenhuma ferramenta fácil e barata a tela para estas condições. O ensaio de ECL multiplex não só é capaz de combinar 4 ensaios de auto-anticorpos ilhéu grande atual em um, mas também é capaz de ainda combinar mais ensaios de auto-anticorpos de outras doenças auto-imunes relevantes. Isto torna possível conduzir com eficiência elevada da seleção para várias doenças auto-imunes simultaneamente nas populações de grande escala da produção. No ensaio de multiplex ECL, conforme [Figura 6], cada complexo antígeno-anticorpo formado na fase líquido vai ser contido a um ponto de origem de vinculador específicos no mesmo bem. O receptor de sinal na máquina do leitor de placa é capaz de reconhecer os sinais de 10 fontes diferentes de manchas. No entanto, as manchas com um sinal extremamente elevado podem gerar um plano de fundo do ensaio de alta e causar interferência de manchas vizinhas através de conversas cruzadas. Por esta razão, os sinais de limite superior para cada ensaio de auto-anticorpos devem ser limitados a menos de 20.000 contagens. Em nossa experiência, os auto-anticorpos com fundos inferiores devem ser colocados relativamente longe dessas manchas tendo maior contagem quando o mapa local é projetado. Para estudos de longo prazo usando multiplex ensaios ECL, recomenda-se que o vinculador mesmo ser usado para o mesmo ensaio de auto-anticorpos para manter o ensaio consistente.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi financiado pelo NIH conceder DK32083, JDRF Grant 2-SRA-2015-51-Q-R.
Materiais
| Name | Company | Catalog Number | Comments |
| Human recombinant proinsulin protein(PINS) | AmideBio | Human Proinsulin, Rec | |
| Human recombinant GAD65 protein | Diamyd | rhGAD65 | |
| Human recombinant IA-2 protein | Creative BioMart | IA2 | |
| 1x Phosphate Buffered Saline (PBS), pH 7.4 | Thermo Fisher Scientific | 10010-023 | |
| 10x PBS, pH 7.4 | Thermo Fisher Scientific | 70011-044 | |
| Bovine Serum Albumin (BSA) | SIGMA-ALORICH | A7906-500G | |
| 96-well PCR plate | Fisher | 14230232 | |
| Streptavidin coated plate | MSD | L15SA | |
| Zeba sizing spin column | Thermo Fisher Scientific | 89890 | |
| Twen-20 | Fisher | BP337-500 | |
| HCl | Fisher | A144-500 | |
| NaOH | Fisher | SS255-1 | |
| Trizma Base | Fisher | BP152-5 | |
| EZ-Link Biotin | Thermo Fisher Scientific | PI21329 | |
| Sulfo-tag | MSD | R91AO-1 | |
| Blocker A | MSD | R93AA-1 | |
| 4x Read Buffer T with Surfactant | MSD | R92TC-1 | |
| EZ-Link NHS-PEG4-Biotin | ThermoScience | 21329 | |
| Sulfo-TAG | MSD | R91AO-1 | |
| 96-well polymerase chain reaction (PCR) plate | Fisher brand | 14230232 | |
| 96-Well Streptavidin plate | MSD GOLD | L 15SA-1 | |
| Zeba Spin Desalting Column | ThermoScience | PL208984 | |
| 96-well Plate Shaker | Perkin Elmer | 1296-003 | |
| Plate Reader | MSD | QuickPlex SQ120 | |
| Benchtop centrifuge with bucket rotary | Beckman | Allegra X-15R |
Referências
- Insel, A. I., et al. Staging presymptomatic type 1 diabetes: a scientific statement of JDRF, the Endocrine Society, and the American Diabetes Association. Diabetes Care. 38 (10), 1964-1974 (2015).
- Atkinson, M. A., Eisenbarth, G. S. . Type 1 diabetes: new perspectives on disease pathogenesis and treatment. Lancet. 358 (9277), 221-229 (2001).
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. . Type 1 diabetes. Lancet. 383 (9911), 69-82 (2014).
- Steck, A. K., et al. TEDDY Study Group. Predictors of progression from the appearance of islet autoantibodies to early childhood diabetes: The Environmental Determinants of Diabetes in the Young (TEDDY). Diabetes Care. 38 (5), 808-813 (2015).
- Krischer, J. P., et al. TEDDY Study Group. The 6 year incidence of diabetesassociated autoantibodies in genetically at-risk children: the TEDDY study. Diabetologia. 58 (5), 980-987 (2015).
- Achenbach, P., et al. Stratification of type 1 diabetes risk on the basis of islet autoantibody characteristics. Diabetes. 53 (2), 384-392 (2004).
- Achenbach, P., Bonifacio, E., Koczwara, K., Ziegler, A. G. . Natural history of type 1 diabetes. Diabetes. 54 (Suppl. 2), S25-S31 (2005).
- Steck, A. K., et al. Age of islet autoantibody appearance and mean levels of insulin, but not GAD or IA-2 autoantibodies, predict age of diagnosis of type 1 diabetes: diabetes autoimmunity study in the young. Diabetes Care. 34 (6), 1397-1399 (2011).
- Achenbach, P., Koczwara, K., Knopff, A., Naserke, H., Ziegler, A. G., Bonifacio, E. Mature high-affinity immune responses to (pro)insulin anticipate the autoimmune cascade that leads to type 1 diabetes. J Clin Invest. 114 (4), 589-597 (2004).
- Yu, L., Dong, F., Miao, D., Fouts, A. R., Wenzlau, J. M., Steck, A. K. . Proinsulin/insulin autoantibodies measured with electrochemiluminescent assay are the earliest indicator of prediabetic islet autoimmunity. Diabetes Care. 36 (8), 2266-2270 (2013).
- Yu, L., Miao, D., Scrimgeour, L., Johnson, K., Rewers, M., Eisenbarth, G. S. . Distinguishing persistent insulin autoantibodies with differential risk: nonradioactive bivalent proinsulin/insulin autoantibody assay. Diabetes. 61 (1), 179-186 (2012).
- Miao, D., et al. GAD65 autoantibodies detected by electrochemiluminescence assay identify high risk for type 1 diabetes. Diabetes. 62 (12), 4174-4178 (2013).
- Yu, L. . Islet Autoantibody Detection by Electrochemiluminescence (ECL) Assay. Methods Mol Biol. 1433, 85-91 (2016).
- Myler, H. A., McVay, S., Kratzsch, J. . Troubleshooting PEG-hGH detection supporting pharmacokinetic evaluation in growth hormone deficient patients. J Pharmacol Toxicol Methods. 61 (2), 92-97 (2010).
- Zhong, Z. D., Dinnogen, S., Hokom, M., et al. Identification and inhibition of drug target interference in immunogenicity assays. J Immunol Methods. 355 (1-2), 21-28 (2010).
- Barker, J. M., Yu, J., Yu, L., Wang, J., Miao, D., Bao, F., et al. Autoantibody "subspecificity" in type 1 diabetes: risk for organ-specific autoimmunity clusters in distinct groups. Diabetes Care. 28 (4), 850-855 (2005).
- Triolo, T. M., Armstrong, T. K., McFann, K., Yu, L., Rewers, M. J., Klingensmith, G. J., et al. Additional autoimmune disease found in 33% of patients at type 1 diabetes onset. Diabetes Care. 34 (5), 1211-1213 (2011).
- de Graaff, L. C., Smit, J. W., Radder, J. K. . Prevalence and clinical significance of organ-specific autoantibodies in type 1 diabetes mellitus. Neth J Med. 65 (7), 235-247 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados