Method Article
Saggi di elettrochemiluminescenza autoanticorpi anti-umano dell'isolotto
In questo articolo
Riepilogo
Qui, abbiamo presentato i metodi per rilevare i autoantibodies di insule umane utilizzando dosaggi di elettrochemiluminescenza (ECL). Il protocollo usato per predire il diabete di tipo 1, può essere estesa, per rilevare gli autoanticorpi per altre malattie autoimmuni.
Abstract
Individuando i autoantibodies isolotto associati al diabete di tipo 1 (T1D) apre la strada al progetto e scoraggiare questa malattia nella popolazione generale. Un'analisi novella ECL è un test di fase fluida non radioattivi per autoantibodies dell'isolotto con maggiore sensibilità e la specificità dell'analisi radio-associazione standard di 'oro' attuale (RBA). Saggi di ECL possono definire più precisamente l'insorgenza di T1D presintomatici distinguendo gli autoanticorpi ad alto rischio, ad alta affinità da autoanticorpi basso rischio, basso-affinità generati in RBAs e saggi convenzionali enzima-collegata dell'immunosorbente (ELISA ). La proteina antigene usata per questo test di ECL è etichettata con Sulfo-tag e biotina, rispettivamente. Ogni dosaggio autoanticorpi ECL che utilizza una proteina antigene particolare ha bisogno di un passaggio di ottimizzazione prima può essere utilizzato per applicazioni di laboratorio. Questo passaggio è particolarmente importante nel determinare i requisiti per trattamenti acido del siero, concentrazioni e i rapporti dei due antigeni differenti etichettati con Sulfo-tag e biotina. Per eseguire il test, siero campioni sono mescolati con Sulfo-tag-coniugati e biotinilati catturare proteina antigene in soluzione tamponata fosfato (PBS), contenente 5% albumina di siero bovino (BSA). In seguito, i campioni sono incubati durante la notte a 4 ° C. Lo stesso giorno, una piastra rivestita con streptavidina è preparata con tampone bloccante e incubata overnight a 4 ° C. Il secondo giorno, lavare la piastra di streptavidina e trasferire la miscela siero-antigene sulla piastra. Collocare la piastra sull'agitatore, impostarlo a bassa velocità e incubare a temperatura ambiente per 1 h. Successivamente, il piatto è lavato nuovamente e buffer di lettore viene aggiunto. La piastra è quindi conteggiata sulla macchina di lettore di piastra. I risultati vengono convogliati attraverso un indice, che viene generato da campioni di siero di controllo positivo e negativo standard interno.
Introduzione
Un recente sistema di classificazione dell'organizzazione è stato creato per aiutare con la diagnosi delle fasi iniziali di T1D in pazienti. Esatta rilevazione dei autoantibodies isolotto umana svolge un ruolo importante nell'identificazione e stadiazione presintomatici diabete di tipo 1, come la presenza di autoantibodies dell'isolotto indica la presenza di autoimmunità della β-cellula. Il tasso al quale diabete colpisce pazienti da ricorrenza iniziale dell'autoimmunità β-cellulare della malattia sintomatica, associato il numero e il tipo di autoanticorpo isolotto, è variabile2,3.
L'età di sieroconversione di autoanticorpi, titolo e affinità dei autoantibodies dell'isolotto può influenzare il tasso di progressione a sintomatico tipo 1 diabete4,5,6,7,8 ,9,10. Recentemente, sviluppati ECL saggi sono stati ampiamente validati, hanno dimostrato una maggiore sensibilità e sono più specifici di malattia10,11,12,13. Queste analisi che permettono di migliorare la previsione e la messa in scena di rischio del diabete attraverso l'individuazione tempestiva dei autoantibodies dell'isolotto. Più precisamente segnano l'inizio dell'autoimmunità dell'isolotto e ignorare i segnali di bassa affinità e a basso rischio non pertinenti al diabete.
In un'analisi di ECL, gli autoanticorpi nel siero, se presente, ponte l'antigene Sulfo-tag-coniugato all'antigene di cattura biotinilato nella fase fluida. Dopo bridging, il linker di biotina è catturato in fase solida e rilevato tramite ECL dal Sulfo-tag sulla piastra di streptavidina (Figura 1).
In questa recensione, saggi di ECL singolo anticorpo con i autoantibodies umano dell'isolotto sono principalmente utilizzate. Brevemente, multiplex anticorpo saggi basati sulla singola ECL saggi saranno discussi. L'analisi multiplex può essere usata per identificare multiplo, fino a 10, autoanticorpi all'interno di un singolo bene, utilizzando 15 µ l di siero. Questo test semplice e ad alta velocità effettiva utilizzabile per schermo, simultaneamente, i autoantibodies multiple per più rilevanti malattie autoimmuni nella popolazione generale.
Protocollo
1. preparazione buffer
- Etichettatura di buffer (2 x PBS, pH 7,9): In 400 mL di acqua distillata o deionizzata (DD), aggiungere 100 mL di PBS 1x 10, regolare il pH a 7,9 con NaOH.
- 3 mM di biotina: sciogliere 1 mg di biotina nel 588 µ l di tampone di etichettatura.
- 3 mM di Sulfo-tag: sciogliere 150 nmol di Sulfo-tag in 50 µ l di tampone di etichettatura.
- Buffer di antigene (5% BSA): In 500 mL di PBS 1X, aggiungere 25 g di albumina di siero bovino (BSA).
- Preparare soluzione 0,5 M di acido acetico.
- 1,0 M di tampone Tris-HCl pH 9.0: preparare 1 M Tris-HCl buffer e regolare il pH a 9.0 con HCl.
- Tampone di rivestimento (3% un Blocker): In 500 mL di PBS 1X, aggiungere 15 g di stampo A.
- Tampone di lavaggio (0.05% Tween 20, PBST): In 5000 mL di PBS 1X, aggiungere 2,5 mL di Tween 20.
- Buffer di lettura (2 x lettura Buffer T con tensioattivo): In 500 mL di acqua DD, aggiungere 500 mL di Buffer di lettura T con tensioattivo (Tabella materiali): 4x.
- Conservare la biotina e Sulfo-tag in un congelatore a-20 ° C.
Nota: Entrambe le soluzioni di biotina e Sulfo-tag sempre devono essere preparate appena prima la procedura di etichettatura.
2. etichettare il Autoantigen umano dell'isolotto con biotina e Sulfo-tag
Nota: Un'alta concentrazione di antigene, ≥0.5 mg/mL, è consigliata per una reazione d'etichettatura più efficiente.
- Determinare il rapporto molare di autoantigen umano dell'isolotto per biotina e Sulfo-tag.
- Ottenere il numero di molare di antigene dividendo il peso di antigene per il peso molecolare.
- Utilizzare il rapporto molare di 1:5 per l'antigene con peso molecolare più piccola (≤ 10 kd) e il rapporto molare di 01:20 per l'antigene con peso molecolare più grande (> 50 kd).
- Calcolare il volume per biotina o Sulfo-tag dividendo il numero molare dalla sua concentrazione.
- Mescolare il autoantigen umano dell'isolotto con biotina o Sulfo-tag con il rapporto molare di 1:5.
Nota: La proteina in sistemi tampone tris o glicina dovrebbe essere scambiata a 2 x tampone PBS pH 7,9 utilizzando lo spin di dimensionamento colonna. - Dal momento che la biotina e Sulfo-tag sono sensibili alla luce, coprire le provette di reazione con foglio di alluminio. Incubare la reazione a temperatura ambiente (TA) per 1 h.
- Durante l'incubazione, adescare la colonna di spin da erogazione 2 x tampone PBS nella colonna tre volte. Centrifugare la soluzione a 1000 x g per 2 minuti ogni volta.
Nota: Attualmente la reazione d'etichettatura, tramite bridging, è ancora in corso e deve essere fermato. - Fermare la reazione d'etichettatura purificando il autoantigen con etichetta umano dell'isolotto. Per purificare, passare il autoantigen attraverso la colonna di spin e centrifugare la colonna a 1000 x g per 2 min.
- Determinare la concentrazione di antigene con etichetta (µ g / µ l) utilizzando la quantità di proteina antigene e il volume finale.
Nota: All'incirca, ci sarà 90-95% conservazione dell'antigene con etichetta dopo ogni colonna spin passare. - Aliquota dell'antigene con etichetta antigene e negozio con etichetta a-80 ° C.
3. definire le concentrazioni ed i rapporti migliori per i due antigeni con etichettati per il dosaggio (Checker Board Assay)
- Preparare due campioni di siero, uno positivo e uno negativo, con un volume totale di 200 µ l per ogni.
- Aliquota 4 µ l di siero e aggiungere 1X PBS fino a quando il volume finale è di 20 µ l per pozzetto di una piastra PCR a 96 pozzetti. Utilizzare la metà di una piastra per il campione positivo alto e l'altra metà per l'esempio negativo, come mostrato nella Figura 2A.
- Aggiungere 10 µ l di biotina e 10 µ l di Sulfo-tag etichettato diluizioni seriali di antigene e di condotta per i due antigeni etichettati in modo diverso, come mostrato nella Figura 2A. Eseguire una diluizione seriale orizzontale per un antigene con etichetta e una diluizione seriale verticale per l'altro antigene con etichetta.
- Continuare il resto la procedura di test descritta in 5.3 a 9,1.
- Calcolare il rapporto dei segnali dall'alto esempio positivo contro ciascuno dei corrispondenti segnali dal campione negativo mostrato nella Figura 2B.
- Identificare le migliori concentrazioni di biotina e Sulfo-tag antigene marcato selezionando un punto con il più alto o vicino a più alto rapporto di positivo a negativo. Considera il segnale di fondo basso dal campione negativo per identificare il rapporto.
Nota: 1 ° giorno di test include passaggio 4 al passaggio 6.
4. preparare il tampone di antigene usando la corretta concentrazione di biotina/Sulfo-tag denominata antigene
- Selezionare la concentrazione razionale di ogni antigene basato sul saggio consiglio di correttore.
- Preparare 3 mL di soluzione dell'antigene per piastra, usando la concentrazione razionale di biotina/Sulfo-tag denominata antigene per il buffer di antigene.
5. Incubare i campioni di siero con l'antigene con etichetta
Nota: Esistono due protocolli in questa sezione, uno senza trattamento acido del siero e uno con trattamento acido del siero. Tutte le analisi di autoanticorpo isolotto tranne dosaggio IAA utilizzano protocollo regolare senza il trattamento acido del siero da 5.1 a 5.5, passaggi mentre IAA analisi ignora questi passaggi e utilizza il protocollo con il trattamento acido del siero da passaggi 5.6 a 5,9.
- Aliquota 4 µ l di siero e aggiungere 1X PBS fino a quando il volume finale è di 20 µ l per pozzetto di una piastra PCR a 96 pozzetti.
- Aggiungere 20 µ l di soluzione dell'antigene con etichetta per pozzetto.
- Coprire la piastra PCR con stagnola per evitare luce di tenuta.
- Mettere la piastra su un agitatore (bassa velocità) a temperatura ambiente per 2 h.
- Mettere il piatto in frigorifero a 4 ° C ed incubare durante la notte (18-24 h).
Nota: Il seguente protocollo di passi da 5,6 a 5,9 è progettato solo per l'analisi di IAA e altri saggi di autoanticorpi ignorare questi passaggi. - Mix 15 µ l di siero con 18 µ l di acido acetico 0,5 M per ciascun campione di siero. Incubare la miscela a RT per 45 min.
- Preparare la soluzione di antigene con la concentrazione razionale di biotina e Sulfo-tag denominata antigene, basato sull'analisi checker board, utilizzando antigene buffer. In ogni bene, aliquotare 35 µ l di tampone di antigene, che contiene biotina e Sulfo-tag etichettato antigene, in una nuova piastra PCR.
- Prima che sia terminata la fase di incubazione (punto 5.6) 45 min, aggiungere 8,3 µ l di tampone a pH 9.0 Tris 1 M al lato di ciascun pozzetto della piastra di antigene (punto 5.6). È importante limitare la miscelazione tra il tampone Tris e l'antigene. Immediatamente trasferire 25 µ l di siero, che viene trattato con acido, al punto 5.6, in ciascun pozzetto e agitare la soluzione. Coprire la piastra PCR con stagnola per evitare luce di tenuta.
- Messo il piatto su un agitatore (bassa velocità) a temperatura ambiente per 2 h. mettere il piatto in frigorifero a 4 ° C e fate Incubare la piastra durante la notte (18-24 h).
6. preparare la piastra di streptavidina
- Prendere un piatto di streptavidina dal frigorifero 4 ° C e lasciare la piastra a venire a RT.
- Una volta che la piastra di streptavidina è a RT, aggiungere 150 µ l del 3% un bloccante in ciascun pozzetto.
- Coprire la piastra PCR con lamina di tenuta.
- Incubare la piastra in frigorifero a 4 ° C durante la notte.
Nota: 2 ° giorno di test include Step 7 al passaggio 9.
7. trasferimento del siero/antigene incuba per la piastra di streptavidina
- Il giorno successivo, prendere la piastra di streptavidina dal frigorifero e scartare il buffer dalla piastra. Impostare alcuni asciugamani di carta a secco sul tavolo e toccare la piastra capovolta finché non ci sarà nessun buffer più all'interno dei pozzetti.
- Riempire il piatto vuoto streptavidina con 150 µ l di PBST e scartare il PBST dalla piastra per un totale di tre lavaggi.
- Trasferimento di 30 µ l di siero/antigene incuba per pozzetto nella piastra streptavidina.
- Coprire la piastra con un foglio per evitare la luce. Agitare la piastra, con un'impostazione bassa, a temperatura ambiente per 1 h.
8. lavare la piastra e aggiungere Buffer di lettura
- Scartare incuba dalla piastra. Aggiungere 150 µ l di PBST e scartare il PBST dalla piastra per un totale di tre lavaggi.
- Dopo il lavaggio, aggiungere 150 µ l di buffer di lettura.
Nota: È importante evitare bolle d'aria nella soluzione, perché questo influenzerà come la piastra viene letto sulla macchina di lettore di piastra.
9. leggere la piastra e analizzare i dati
- Contare la targhetta posta sull'apparecchio piastra lettore. I valori dell'anticorpo sono mostrati come conteggi al secondo (CPS).
- Trasmettere i livelli dell'anticorpo ha ricevuto dalla macchina lettore piatto come un indice relativo. Calcolare l'indice dalla seguente equazione:
Valore di indice = [CPS (campione) - CPS (controllo negativo)] / [CPS (controllo positivo) - CPS (controllo negativo)]. - Identificare i risultati positivi e negativi dell'anticorpo usando il cut-off per la positività, definito basato sul 99 ° percentile di 100 soggetti sani di controllo (gli individui non-diabetico senza qualsiasi malattie autoimmuni conosciute e che non hanno nessuna storia familiare di diabete).
Risultati
Figura 2 consente di visualizzare la scacchiera. È dimostrato che 250 ng/mL di biotina e 250 ng/mL di Sulfo-tag con etichetta antigene sono le concentrazioni più razionale usate nell'analisi considerando i segnali dal campione di controllo positivo alto, il campione di controllo negativo come sfondo del dosaggio e il rapporto di positivo per segnali negativi. Con le concentrazioni ottimizzate di questi due antigeni con etichettati, l'analisi è stata eseguita con i campioni di siero da 100 pazienti recentemente diagnosticati con T1D e 100 controlli sani. Il valore di indice di 0,023 è stato definito come il cut-off di dosaggio per la positività. Questo rappresenta la sensibilità dell'85% in pazienti e 99% specificità nei comandi sani utilizzando il ricevitore curva ROC (ROC) mostrato in Figura 3A. Il dosaggio per gli esempi di sconosciuto è stato condotto con interni standard positivi di alte, bassa positivi e campioni di controllo negativo. I risultati dei conteggi CPS sono mostrati tabella 2A. La media CPS di controlli positivi ad alta e bassa sono evidenziati in rosso, 17903 [(19940+15866)/2] e 839 [(857+820)/2], e controlli negativi sono evidenziati in verde, 168 [(170+165)/2]. L'indice di campioni incogniti è calcolato da "(CPScampione-168)/(17903-168)." Tabella 2B Mostra i valori di indice calcolato per tutti i campioni. I valori di indice che sono maggiori del 0,023 sono scritti in rosso, corrispondente ai valori CPS anche scritti in rosso nella tabella 2A. Questi valori saranno definiti come i risultati positivi che superano il 99° percentile della popolazione sani di controllo. Quando viene utilizzata una concentrazione di antigene irrazionale, l'analisi avrà un fondo elevato, come mostrato in tabella 2 C. Bassi livelli di anticorpi positivi ci mancherà come i valori A2, A5, D1 e H4 evidenziati in grigio nella tabella 2D.
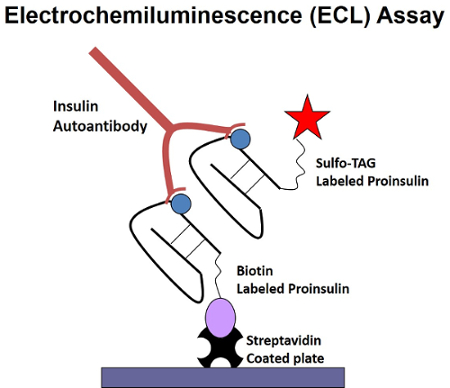
Figura 1 : Illustrazione di un'acquisizione di piastra bivalente su una sola analisi di ECL-IAA. Autoanticorpo isolotto nei ponti di siero il Sulfo-tag coniugato antigene biotinilato cattura all'antigene, che è catturato in fase solida sulla placca rivestita con streptavidina. Rilevazione dell'antigene di coniugati Sulfo-tag di piastra-catturato avviene tramite ECL. Questa figura è stata modificata da Yu, et al. 11. Clicca qui per visualizzare una versione più grande di questa figura.
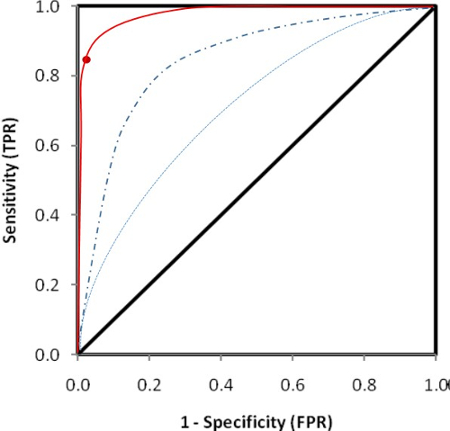
Figura 2 : Curva ROC the per determinare la soglia di positività del test. Il 99° percentile della specificità corrispondente alla sensibilità dell'85% è stato selezionato e viene rappresentato come un valore di indice di 0,023. Questo limite superiore del dosaggio è stata presa da 100 comandi sani. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3 : Illustrazione di siero umano normale bloccando i segnali ECL-IAA. R: i segnali provenienti dai saggi di ECL-IAA con un anticorpo monoclonale di insulina (MoAb) erano drasticamente bloccati tramite l'aggiunta di siero umano normale. Quando si confrontano MoAb in PBS, il segnale è stato parzialmente restaurato quando il siero umano è stato trattato con acido. B: segnali da un'analisi di ECL-IAA con 4 sieri dei pazienti sono stati migliorati significativamente con trattamento acido. Questa figura è stata modificata da Yu, et al. 11. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 : Illustrazione del dosaggio Mutiplex ECL. Complessi dell'anticorpo-antigene si formano in fase di fluido con linker specifici. I complessi dell'anticorpo-antigene-linker specifici sono trattenuti su ciascuno dei punti del linker specifici nello stesso bene. La macchina di lettore di piastra è in grado di distinguere i segnali provenienti da diverse fonti di macchie e dà CPS conta su 10 canali diversi, rispettivamente. Clicca qui per visualizzare una versione più grande di questa figura.
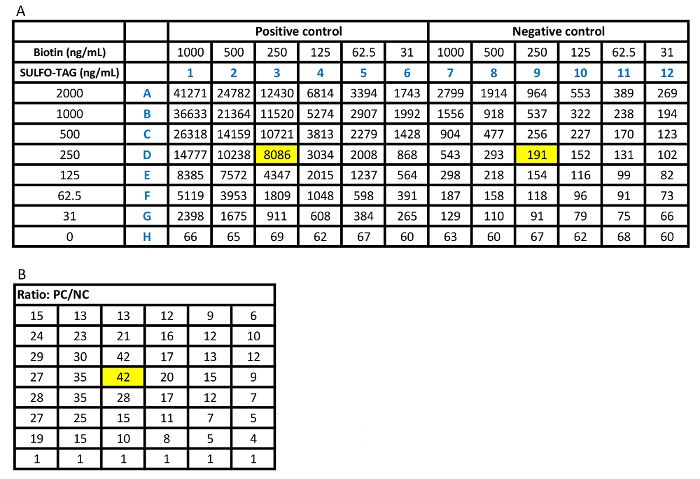
Tabella 1: dosaggio di Checker board determina le concentrazioni ed i rapporti di biotina e Sulfo-tag antigene marcato. R: raw CPS conta per la targa di bordo correttore con alto siero positivo sulla metà del piatto e siero negativo su altra metà. La concentrazione dell'antigene biotinilato è stata diluita in orizzontale in serie e la concentrazione di Sulfo-tag identificato l'antigene è stata diluita verticalmente in serie. B: i valori di rapporto dei conteggi CPS da elevato del siero positivo nei confronti di ciascuno di loro conteggi CPS corrispondente dal siero negativo. I pozzetti evidenziati gialli rappresentano il miglior rapporto positivo a negativo nel pannello B. Questo rapporto corrisponde a 250 ng/mL biotina e 250 ng/mL Sulfo-tag etichettato le concentrazioni di antigene in pannello A con un conteggio di CPS accettabilmente basso per siero negativo. Clicca qui per visualizzare una versione più grande di questa tabella.
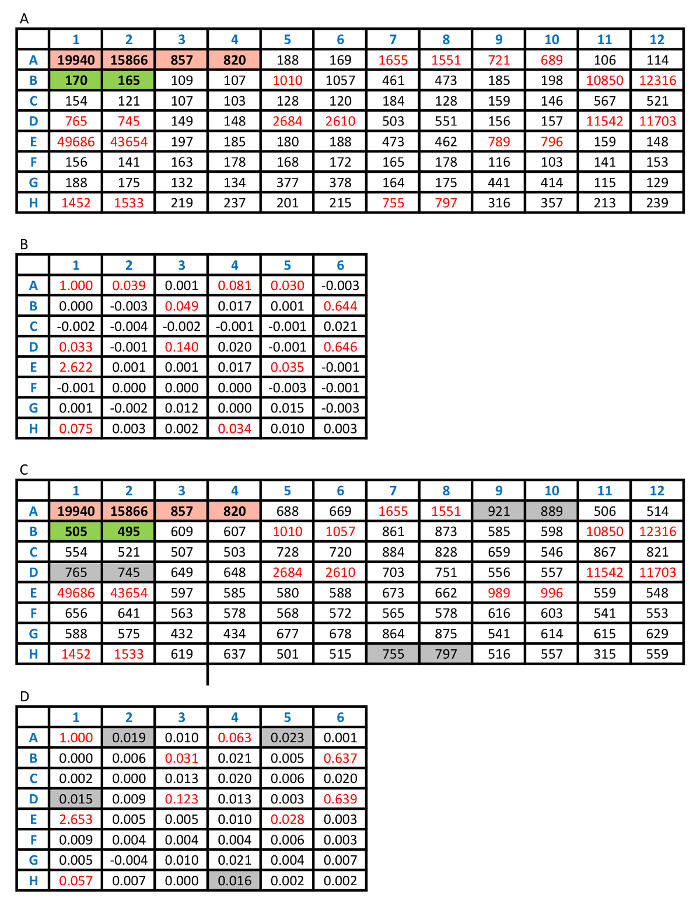
Tabella 2: analisi dei risultati del test. R: raw CPS conta dalla piastra di test con i controlli standard di alta e bassa positivi evidenziati in rosso e i controlli standard negativi evidenziati in verde. Ogni campione è stato duplicato nel dosaggio. B: Indice valori sono stati calcolati, come descritto nel protocollo di dosaggio. Qualsiasi valore di indice che era maggiore di 0,023 è stato definito come un risultato positivo, evidenziato in rosso. C: raw CPS conta dalla piastra di test con lo stesso set di campioni quando è stata usata una concentrazione di antigene irrazionale. Ciò ha provocato un'alta priorità bassa e alcuni aspetti positivi bassi normalmente rilevati, come mostrato nel pannello B, sono stati convertiti ai lati negativi, evidenziati in grigio nel pannello D. Clicca qui per visualizzare una versione più grande di questa tabella.
Discussione
Autoantibodies dell'isolotto sono attualmente i biomarcatori più affidabili dell'autoimmunità del diabete di tipo 1. Segnano l'inizio dell'autoimmunità specifici dell'isolotto e determinare i rischi di malattia evidente. Il test di ECL, per autoantibodies dell'isolotto, è stato ampiamente convalidato nei test clinici nazionali ed internazionali di tipo 1 diabete multipli. L'analisi ha dimostrato una maggiore sensibilità e specificità rispetto alla corrente 'oro' RBAs standard. Il dosaggio di ECL ha mostrato il suo vantaggio superiore per maggiore specificità di malattia da discriminante ad alta affinità e autoantibodies dell'isolotto ad alto rischio da basso rischio, basso-affinità segnali generati da RBA. Questo è notato soprattutto in soggetti che sono solo degli autoanticorpo isolotto singolo positivo e non hanno mai progredito per diabete di tipo 1. La maggior parte di queste affinità bassa autoanticorpi sono stati trovati per essere persi durante il follow-up test fatto nei mesi e anni, comportandosi come un 'transitorio positivo'. Come precedentemente ipotizzato, queste affinità bassa 'singoli' autoanticorpi probabilmente è derivati da immunizzazione con una molecola Cross-reattivo. Mentre maggiore affinità, i autoantibodies dell'isolotto di rischio superiori è derivato da immunizzazione con gli antigeni di isolotto se stessi. Inoltre, ECL-saggi hanno dimostrato la capacità di scaduti al momento della 'sieroconversione' da saggi di radio-associazione standard attuale (RBA) da anni in bambini con pre-diabete, che sono stati seguiti per diabete clinico dalla nascita. Uno studio clinico internazionale in corso, determinanti ambientali di diabete nei giovani (TEDDY), dipende dalla rilevazione accurata per individuare i tempi e la comparsa degli autoanticorpi primo isolotto 'sieroconversione' per contrassegnare l'inizio dell'isolotto autoimmunità e per l'identificazione dei fattori ambientali. Un motivo possibile per una maggiore sensibilità nell'analisi della ECL è che il dosaggio cattura tutte le classi di immunoglobuline: IgG, IgM, IgA, o IgE, piuttosto che il tradizionale RBA o ELISA, che si basano solo sulla rilevazione di IgG.
Nelle analisi di ECL, per alcuni determinati autoanticorpi come IAA, l'associazione di autoanticorpi contro l'antigene sembra essere inibita da alcuni componenti presenti nel siero umano normale. Per rimuovere o eliminare questa inibizione, trattamento acido di campioni di siero era necessario fare prima il siero è stato incubato con l'antigene. Come mostrato in [Figura 5], analisi di ECL-IAA, le attività di associazione di autoanticorpi nel siero dei pazienti con l'antigene e l'anticorpo monoclonale di topo dell'insulina è stata grandemente valorizzata. L'acidificazione dei campioni di siero, utilizzato nell'analisi dell'anticorpo, è solitamente applicato per dissociare preesistenti complessi associati. Il meccanismo dietro come segnali di IAA sono inibiti in campioni di siero umano e rilasciati dall'acidificazione del siero non è noto, ma questo metodo è stato utilizzato in altri ECL basato saggi14,15.
In alcuni casi, quando molecole di etichettatura, biotina o Sulfo-tag, l'etichettatura positionsinside delle molecole della proteina antigene sono, o molto vicino alla chiavi epitopi del legame dell'anticorpo, che può interferire con l'attività di associazione agli anticorpi. Questo ridurrà la sensibilità del test e può completamente abbattere il dosaggio. Per la procedura di etichettatura di routine, massimizzazione o saturazione è desiderato per ogni molecola di proteina antigene generare attività massima o segnale per molecola con etichetta massimizzando la capacità di etichettatura di tutte le posizioni d'etichettatura. Insaturi etichettatura deve essere eseguita riducendo il rapporto molare di etichettatura molecole (biotina e Sulfo-tag) alla proteina antigene se etichettatura sull'antigene diventa un motivo possibile per interruzione di attività obbligatoria dell'anticorpo. Gli epitopi principali può essere meglio riservati e interruzione dell'attività di legame dell'anticorpo può essere rilasciato utilizzando la strategia di etichettatura insatura nella maggior parte dei casi.
Ogni dosaggio dovrebbe includere un interno standard alto controllo positivo e negativo per il calcolo di indici dei campioni sconosciuti. Un controllo positivo basso vicino il limite superiore del dosaggio dei comandi normali è importante includere per il monitoraggio di sensibilità del test. Il laboratorio deve conservare abbastanza aliquote dei controlli positivi e negativi standard per uso a lungo termine e tutte le aliquote devono essere conservate a-20 ° C. Per garantire la qualità saggio, le analisi devono essere eseguite in duplicati per ogni campione e ogni risultato positivo dovrebbe essere confermata ripetendo il campione in un'analisi separata. Un terzo saggio è necessario quando il secondo test di conferma non è d'accordo con il primo test e i risultati di due test, che si impegnano (ad es., +, + o-, -), sarà la determinazione finale di un risultato positivo o negativo.
Con la piattaforma impostata per singole analisi di ECL, un'analisi multiplex può essere estesa da questi. È possibile determinare simultaneamente fino a 10 diversi autoanticorpi in un unico pozzetto con una piccola quantità di siero. Attualmente, quattro autoantibodies dell'isolotto tra cui IAA, GADA, IA-2A e ZnT8A sono uguale importanza per la previsione di rischio di progressione a T1D in entrambi parenti di pazienti affetti da T1D e popolazione in generale. I metodi utilizzati per lo screening di questi 4 autoanticorpi utilizzando misure di corrente singolo autoantibody sono laboriosi e inefficiente, soprattutto per uno screening su larga scala della popolazione. D'importanza, fino al 40% dei pazienti con T1D hanno un ulteriore condizione autoimmune16,17,18. Purtroppo, non c'è nessun strumento facile e poco costoso per schermo per queste condizioni. Il dosaggio di ECL multiplex non è solo capace di unire 4 saggi di autoanticorpo isolotto principale corrente in uno, ma è anche in grado di coniugare ulteriormente più saggi di autoanticorpi da altre malattie autoimmuni pertinenti. Questo rende possibile effettuare in modo efficiente elevato throughput screening per malattie autoimmuni multiple simultaneamente in popolazioni di larga scala. Nell'analisi della ECL multiplex, come illustrato nella [Figura 6], ogni complesso antigene-anticorpo formato in fase di fluido sarà trattenuto in un punto di origine del linker specifici nello stesso bene. Il ricevitore di segnale sulla macchina di lettore di piastra è in grado di riconoscere i segnali provenienti da 10 diverse fonti di macchie. Tuttavia, le macchie con un segnale estremamente elevata possono generare uno sfondo di alto dosaggio e causare interferenze ai vicini luoghi tramite cross-talk. Per questo motivo, i segnali di limite superiore per ogni dosaggio autoanticorpi dovrebbero essere limitati a meno di 20.000 conteggi. Nella nostra esperienza, gli autoanticorpi con sfondi inferiore devono essere posizionati relativamente lontano da quei punti avendo più alti conteggi quando la mappa delle località è stata progettata. Per studi a lungo termine utilizzando dosaggi di ECL multiplex, è consigliabile che il linker stesso essere utilizzato per il dosaggio di autoanticorpi stesso per mantenere coerente il dosaggio.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato supportato da NIH concedere DK32083, JDRF Grant 2-SRA-2015-51-Q-R.
Materiali
| Name | Company | Catalog Number | Comments |
| Human recombinant proinsulin protein(PINS) | AmideBio | Human Proinsulin, Rec | |
| Human recombinant GAD65 protein | Diamyd | rhGAD65 | |
| Human recombinant IA-2 protein | Creative BioMart | IA2 | |
| 1x Phosphate Buffered Saline (PBS), pH 7.4 | Thermo Fisher Scientific | 10010-023 | |
| 10x PBS, pH 7.4 | Thermo Fisher Scientific | 70011-044 | |
| Bovine Serum Albumin (BSA) | SIGMA-ALORICH | A7906-500G | |
| 96-well PCR plate | Fisher | 14230232 | |
| Streptavidin coated plate | MSD | L15SA | |
| Zeba sizing spin column | Thermo Fisher Scientific | 89890 | |
| Twen-20 | Fisher | BP337-500 | |
| HCl | Fisher | A144-500 | |
| NaOH | Fisher | SS255-1 | |
| Trizma Base | Fisher | BP152-5 | |
| EZ-Link Biotin | Thermo Fisher Scientific | PI21329 | |
| Sulfo-tag | MSD | R91AO-1 | |
| Blocker A | MSD | R93AA-1 | |
| 4x Read Buffer T with Surfactant | MSD | R92TC-1 | |
| EZ-Link NHS-PEG4-Biotin | ThermoScience | 21329 | |
| Sulfo-TAG | MSD | R91AO-1 | |
| 96-well polymerase chain reaction (PCR) plate | Fisher brand | 14230232 | |
| 96-Well Streptavidin plate | MSD GOLD | L 15SA-1 | |
| Zeba Spin Desalting Column | ThermoScience | PL208984 | |
| 96-well Plate Shaker | Perkin Elmer | 1296-003 | |
| Plate Reader | MSD | QuickPlex SQ120 | |
| Benchtop centrifuge with bucket rotary | Beckman | Allegra X-15R |
Riferimenti
- Insel, A. I., et al. Staging presymptomatic type 1 diabetes: a scientific statement of JDRF, the Endocrine Society, and the American Diabetes Association. Diabetes Care. 38 (10), 1964-1974 (2015).
- Atkinson, M. A., Eisenbarth, G. S. . Type 1 diabetes: new perspectives on disease pathogenesis and treatment. Lancet. 358 (9277), 221-229 (2001).
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. . Type 1 diabetes. Lancet. 383 (9911), 69-82 (2014).
- Steck, A. K., et al. TEDDY Study Group. Predictors of progression from the appearance of islet autoantibodies to early childhood diabetes: The Environmental Determinants of Diabetes in the Young (TEDDY). Diabetes Care. 38 (5), 808-813 (2015).
- Krischer, J. P., et al. TEDDY Study Group. The 6 year incidence of diabetesassociated autoantibodies in genetically at-risk children: the TEDDY study. Diabetologia. 58 (5), 980-987 (2015).
- Achenbach, P., et al. Stratification of type 1 diabetes risk on the basis of islet autoantibody characteristics. Diabetes. 53 (2), 384-392 (2004).
- Achenbach, P., Bonifacio, E., Koczwara, K., Ziegler, A. G. . Natural history of type 1 diabetes. Diabetes. 54 (Suppl. 2), S25-S31 (2005).
- Steck, A. K., et al. Age of islet autoantibody appearance and mean levels of insulin, but not GAD or IA-2 autoantibodies, predict age of diagnosis of type 1 diabetes: diabetes autoimmunity study in the young. Diabetes Care. 34 (6), 1397-1399 (2011).
- Achenbach, P., Koczwara, K., Knopff, A., Naserke, H., Ziegler, A. G., Bonifacio, E. Mature high-affinity immune responses to (pro)insulin anticipate the autoimmune cascade that leads to type 1 diabetes. J Clin Invest. 114 (4), 589-597 (2004).
- Yu, L., Dong, F., Miao, D., Fouts, A. R., Wenzlau, J. M., Steck, A. K. . Proinsulin/insulin autoantibodies measured with electrochemiluminescent assay are the earliest indicator of prediabetic islet autoimmunity. Diabetes Care. 36 (8), 2266-2270 (2013).
- Yu, L., Miao, D., Scrimgeour, L., Johnson, K., Rewers, M., Eisenbarth, G. S. . Distinguishing persistent insulin autoantibodies with differential risk: nonradioactive bivalent proinsulin/insulin autoantibody assay. Diabetes. 61 (1), 179-186 (2012).
- Miao, D., et al. GAD65 autoantibodies detected by electrochemiluminescence assay identify high risk for type 1 diabetes. Diabetes. 62 (12), 4174-4178 (2013).
- Yu, L. . Islet Autoantibody Detection by Electrochemiluminescence (ECL) Assay. Methods Mol Biol. 1433, 85-91 (2016).
- Myler, H. A., McVay, S., Kratzsch, J. . Troubleshooting PEG-hGH detection supporting pharmacokinetic evaluation in growth hormone deficient patients. J Pharmacol Toxicol Methods. 61 (2), 92-97 (2010).
- Zhong, Z. D., Dinnogen, S., Hokom, M., et al. Identification and inhibition of drug target interference in immunogenicity assays. J Immunol Methods. 355 (1-2), 21-28 (2010).
- Barker, J. M., Yu, J., Yu, L., Wang, J., Miao, D., Bao, F., et al. Autoantibody "subspecificity" in type 1 diabetes: risk for organ-specific autoimmunity clusters in distinct groups. Diabetes Care. 28 (4), 850-855 (2005).
- Triolo, T. M., Armstrong, T. K., McFann, K., Yu, L., Rewers, M. J., Klingensmith, G. J., et al. Additional autoimmune disease found in 33% of patients at type 1 diabetes onset. Diabetes Care. 34 (5), 1211-1213 (2011).
- de Graaff, L. C., Smit, J. W., Radder, J. K. . Prevalence and clinical significance of organ-specific autoantibodies in type 1 diabetes mellitus. Neth J Med. 65 (7), 235-247 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon