É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Manipulação de micropartículas de ondas acústicas de superfície com dupla frequência excitações de pé
Neste Artigo
Resumo
É apresentado um protocolo para manipular as micropartículas em um canal de microfluidic com uma excitação de dupla frequência.
Resumo
Vamos demonstrar um método para aumentar a capacidade de sintonia de uma pé onda acústica de superfície (SSAW) para manipulação de micropartículas num sistema lab-on-a-chip (LOC). A excitação simultânea de frequência fundamental e sua terceira harmônica, que é denominada como excitação de dupla frequência, para um par de transdutores interdigitais (IDTs) poderia gerar um novo tipo de ondas acústicas em um canal microfluidic de pé. Variar o poder e a fase da excitação de dupla frequência sinais resulta em um campo reconfigurável da força de radiação acústica aplicada as micropartículas através do microchannel (por exemplo, o número e a localização de nós de pressão e o concentrações de micropartículas em nós de pressão correspondente). Este artigo demonstra que é possível reduzir o tempo de movimento das micropartículas de nó único pressão ~ 2 vezes para a relação de poder da frequência fundamental superior a 90%. Em contraste, existem três nós de pressão na microchannel se menos do que este limiar. Além disso, ajustar a fase inicial entre a frequência fundamental e terceiros harmônicos resultados em taxas diferentes do movimento dos três nós SSAW pressão, bem como no percentual de micropartículas em cada nó de pressão na microchannel. Existe um bom acordo entre a observação experimental e as previsões numéricas. Este método de excitação romance pode facilmente e de forma não-invasiva integrar o sistema LOC, com uma ampla tenability e apenas algumas alterações para a montagem experimental.
Introdução
Tecnologia LOC integra uma ou várias funções em um microchip para biologia, química, biofísica e processos biomédicos. LOC permite uma configuração de laboratório em uma escala menor do que o sub milímetros, taxas de reação rápida, um tempo de resposta curto, um controle de processo de alta, um consumo de baixo volume (menos reagentes desperdício, menor custo e menos volume de amostra necessário), uma alta taxa de transferência devido à paralelização, um baixo custo no futuro da produção em massa e cost-effective descartáveis, uma segurança elevada para estudos químicos, radioativos ou biológicos e as vantagens de um dispositivo compacto e portátil,1,2. Manipulação de célula precisa (ou seja, acumulação e separação) é fundamental num LOC-com base em análise e diagnóstico3,4. No entanto, a precisão e a reprodutibilidade da manipulação de micropartículas têm uma variedade de desafios. Muitas técnicas, tais como electro-osmose5, Dieletroforese (DEP)6, magnetophoresis7, thermophoresis8,9, uma abordagem óptico10, um optoelectronic abordagem11 , uma abordagem hidrodinâmico12e acoustophoresis13,14,15, foram desenvolvidos. Em comparação, abordagens acústicas são apropriadas para um aplicativo LOC porque, teoricamente, muitos tipos de micropartículas/células podem ser manipulados de forma eficaz e canaliza com um suficientemente alto contraste (densidade e compressibilidade) comparados com o fluido circundante. Portanto, comparado a suas contrapartes, abordagens acústicas são inerentemente elegíveis para a maioria das micropartículas e objetos biológicos, não importa suas propriedades ópticas, elétricas e magnéticas de16.
Ondas acústicas superficiais (serras) dos IDTs propagam principalmente na superfície de um substrato piezoelétrico na espessura de vários comprimentos de onda e, em seguida, vazamento no ângulo Rayleigh no fluido no microchannel, de acordo com a lei de Snell, o17, 18,19,20,21,22. Eles têm as vantagens técnicas de uma alta eficiência de energia ao longo da superfície devido a sua localização de energia, uma flexibilidade excelente design em alta frequência, um bom sistema de integração com o canal microfluídicos e miniaturização usando tecnologia de sistema de microeletrônica-mecânica (MEMS) e um elevado potencial de produção em massa23. Neste protocolo, serras são geradas a partir de um par de idênticos IDTs e propagadas na direção oposta para gerar uma onda estacionária, ou SSAW, em microchannel, onde as micropartículas suspensas são empurradas para nós de pressão, principalmente pela acústica aplicada força de radiação24. A amplitude de tal força resultante é determinada pelo seu fator de contraste acústico22,25, microparticulado tamanho e a frequência de excitação.
Tal acoustophoresis tem a limitação de padrões de manipulação predeterminados que não são facilmente ajustáveis. A frequência de excitação dos IDTs é determinada pela sua distância periódica, assim a largura de banda é bastante limitada. Várias estratégias foram desenvolvidas para aumentar a capacidade de manipulação e pré-definido. Os primeiros e segundo modos de ondas acústicas em pé, aplicados em diferentes partes do microchannel poderiam separar micropartículas mais eficazmente, de acordo com velocidades diferentes de movimento em direção a linhas nodal26. Estes dois modos também podem ser aplicados a toda a parte do microchannel e trocou como alternativa de28,de27,29. No entanto, para isso, um grande número de equipamentos (ou seja, três geradores de função, duas unidades de impedâncias e um relé eletromagnético) é necessário, com o aumento de custo e controle complexidade a montagem experimental devido a diferentes impedâncias elétricas na frequência fundamental e terceira harmônica do piezoceramic placa30. Além disso, dedos inclinados transdutores interdigitais (SFITs) poderiam ser aplicadas para ajustar as células e as micropartículas padronização excitando um período dos dedos inclinados para uma certa ressonância de20,31. No entanto, em seguida, a largura de banda é inversamente proporcional ao número de dedos inclinados. Várias linhas de pressão nodal têm uma maior eficiência de separação e sensibilidade em comparação com a única linha nodal no separador convencional baseada em SSAW micropartículas. Alternativamente, a localização de nós de pressão também pode ser alterada simplesmente ajustando a diferença de fase aplicada para os dois IDTs no projeto de32,33.
A frequência fundamental e a terceira harmônica de IDTs tem respostas semelhantes de frequência para que eles podem ser um pouco excitados ao mesmo tempo, que fornece mais pré-definido para a manipulação de micropartículas34. Em comparação com a excitação de IDT convencional em uma única frequência, ajustar as pressões acústicas de fases entre eles e a excitação de dupla frequência fornece exclusividade técnica, tais como o de até ~ 2 dobras reduziu o tempo de movimento à pressão nodal linha ou o centro da microchannel, variado número e localização das linhas nodal pressão e as concentrações de micropartículas.
Protocolo
1. preparação do canal microfluídicos
- Misture o poli-dimetilssiloxano (PDMS) com base na proporção de 10:1 um elastômero.
- Desgaseificar a mistura em um forno a vácuo e despeje-o em uma bolacha de silício com um padrão de fotorresiste Tom negativo na parte superior.
- Desgaseificar a bolacha de silício modelado novamente e aqueça-a 70 ° C por 3 h na incubadora para solidificação.
2. fabricação de transdutores interdigitais
- Depósito 20 nm de Cr e 400 nm de Al em uma bolacha de3 LiNbO; padrão de 20 tiras com uma largura de 150 µm e uma abertura de 2 cm em uma máscara de plástico para fotolitografia depositando o fotorresiste positiva sobre o substrato.
- Remova a camada de Cr-Al na área não-expostos com acetona.
- Tratar a superfície deles com plasma de oxigênio (com uma proporção de nitrogênio e oxigênio de 2:1) com a potência de 30 W para 60 s.
- Alinhar o microchannel PDMS e relacionar isso ao substrato de3 LiNbO pressionando com o polegar por alguns segundos.
- Coloque o dispositivo integrado na câmara de aquecimento a 60 ° C por 3 h.
3. dual-frequência excitação
- Aplicar simultaneamente duas componentes de frequência (f1 e f3, a frequência fundamental e seu terceiro harmônico da IDT fabricado, respectivamente) com a diferença de fase φ entre eles para o par de IDTs, para que a serra produzida pode ser expressos como segue.
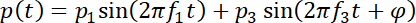
Aqui, e
e 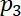 = as pressões acústicas.
= as pressões acústicas. - Sintetizar a forma de onda de dupla frequência usando o Equation Editor do software aplicativo de ArbExpress com a frequência de amostragem de 100 MS/s e depois armazená-lo para o gerador de função como entrada arbitrária para a excitação de serra no experimento através um cabo USB.
- Variar o poder da frequência fundamental para a potência total emitida
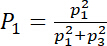 de 100% (excitação na frequência fundamental puramente) para 0% (excitação na terceira puramente harmônica); para uma boa comparação, mudar, mas mantenha o poder total da mesma.
de 100% (excitação na frequência fundamental puramente) para 0% (excitação na terceira puramente harmônica); para uma boa comparação, mudar, mas mantenha o poder total da mesma. - Varia a diferença de fase de excitação dupla frequência de 0° a 360°.
4. simulação numérica
- Descrever o movimento do fluxo incompressível laminar com baixo Reynolds (ou seja, Re = 0,55) e Mach os seguintes números35.
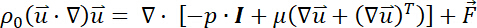

Aqui, = a velocidade do fluido,
= a velocidade do fluido,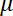 = a viscosidade dinâmica,
= a viscosidade dinâmica,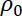 = a densidade do fluido,
= a densidade do fluido,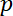 = a pressão sobre o fluido,
= a pressão sobre o fluido, = a matriz de identidade, e
= a matriz de identidade, e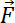 = uma força externa.
= uma força externa. - Descreva a força de arrasto do Stoke produzida no objeto como segue36.
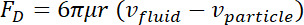
Aqui, = raio das micropartículas,
= raio das micropartículas,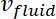 = a velocidade do fluido, e
= a velocidade do fluido, e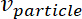 = a velocidade da micropartículas.
= a velocidade da micropartículas. - Derivar a força de radiação acústica aplicada a micropartículas nos microcanais ao longo do x-eixo (em toda a largura do microchannel) em uma única frequência como segue16 .
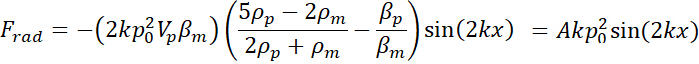
Aqui,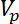 = volume das micropartículas,
= volume das micropartículas,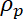 = a densidade das micropartículas,
= a densidade das micropartículas,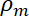 = a densidade do meio,
= a densidade do meio,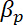 = a compressibilidade das micropartículas, e
= a compressibilidade das micropartículas, e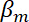 = a compressibilidade do meio.
= a compressibilidade do meio. - A força de radiação acústica resultante da excitação de dupla frequência derivam da seguinte maneira.
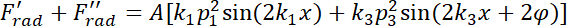
- Expressar o movimento transversal a toda a largura do canal (ao longo do y-axis) sob a força de radiação acústica e o Stokes arraste vigor regida pela segunda lei de Newton como segue.
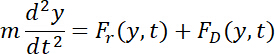
- Resolva as equações diferenciais ordinárias (EDOs) acima usando a método de Runge-Kutta de quarta ordem em um computador pessoal. Definir o passo do tempo e duração total como 1 µs e 20 s, respectivamente.
5. observação experimental
- Girar a solução na concentração de 5,9 x 107 com 4 µm verde fluorescentes esferas de poliestireno por 1 mL por vórtice por cerca de 2-3 min e em seguida, mergulhe-a em um sonicador de ultra-som por 10 min para interromper qualquer aglomeração antes de cada teste.
- Preencher a mistura em uma seringa de 3 mL e depois jogá-la com uma bomba de seringa com um caudal de 3 a 5 µ l/min.
- Dirigir o IDT com o sinal de dupla frequência de um gerador de função, seguido de um amplificador de potência.
- Observar as micropartículas estabilizadas na jusante microchannel sob um microscópio de luz em uma ampliação de 40 X e gravar a imagem com uma câmera digital.
- Medir a localização das micropartículas acumuladas em imagens capturadas Digitas usando o ImageJ e a escala estabelecida e determinar quantitativamente a concentração de micropartículas a acumulado com o brilho da fluorescência normalizados no cada nó de pressão.
Resultados
As distribuições da pressão acústica e a força de radiação acústica de um SSAW com a excitação de dupla frequência (6.2 e 18,6 MHz) são mostrados na Figura 1. Aqui, a excitação de dupla frequência ocorre em micropartículas de poliestireno (4 µm de diâmetro) em um microchannel com uma largura de 300 µm com uma potência acústica de 146 mW. A pressão acústica resultante é sempre na fase quando P1 > 90% que somente um ...
Discussão
O movimento de micropartículas no microchannel por um SSAW com a excitação de dupla frequência foi extensivamente investigado neste estudo, e uma técnica de padronização efetivamente sintonizável variando os sinais de excitação de dupla frequência foi desenvolvida e testada. A produção de uma forma de onda é facilmente realizada pela maioria dos geradores de função, e a abordagem de ajuste é muito conveniente. O S12- e S11-respostas de frequência dos IDTs fabricados ilustram vário...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi patrocinado pela camada de fundo de pesquisa acadêmica (AcRF) 1 (RG171/15), Ministério da educação, Singapura.
Materiais
| Name | Company | Catalog Number | Comments |
| poly-dimethylsiloxane | Dow Corning | Sylgard 184 | |
| poly-dimethylsiloxane elastomer base | Dow Corning | Sylgard 184 | |
| silicon wafer | Bonda Technology | SI8PSPD | |
| negative tone photoresist | Microchem | SU-8 | |
| double-side polished LiNbO3 wafer | University Wafer | Y-128° | |
| positive photoresist | Nicolaus-Otto-Straße | AZ 9260 | |
| oxygen plasma | Harrick Plasma | ||
| plastic mask | Infinite Graphics |
Referências
- Chin, C. D., Linder, V., Sia, S. K. Commercialization of microfluidic point-of-care diagnostic devices. Lab on a Chip. 12 (12), 2118-2134 (2012).
- Figeys, D., Pinto, D. Lab-on-a-chip: a revolution in biological and medical sciences. Analytical Chemistry. 72 (9), 330 A-335 A (2000).
- den Toonder, J. Circulating tumor cells: the Grand Challenge. Lab on a Chip. 11 (3), 375-377 (2011).
- Yu, L., et al. Advances of lab-on-a-chip in isolation, detection and post-processing of circulating tumour cells. Lab on a Chip. 13 (16), 3163-3182 (2013).
- Jorgenson, J. W., Lukacs, K. D. High-resolution separations based on electrophoresis and electroosmosis. Journal of Chromatography A. 218, 209-216 (1981).
- Gascoyne, P. R., Vykoukal, J. Particle separation by dielectrophoresis. Electrophoresis. 23 (13), 1973 (1973).
- Xia, N., et al. Combined microfluidic-micromagnetic separation of living cells in continuous flow. Biomedical Microdevices. 8 (4), 299-308 (2006).
- Garcés-Chávez, V., et al. Extended organization of colloidal microparticles by surface plasmon polariton excitation. Physical Review B. 73 (8), 085417 (2006).
- Zhu, T., Ye, W. Origin of Knudsen forces on heated microbeams. Physical Review E. 82 (3), 036308 (2010).
- Ashkin, A., Dziedzic, J., Yamane, T. Optical trapping and manipulation of single cells using infrared laser beams. Nature. 330 (6150), 769-771 (1987).
- Chiou, P. Y., Ohta, A. T., Wu, M. C. Massively parallel manipulation of single cells and microparticles using optical images. Nature. 436 (7049), 370-372 (2005).
- Yamada, M., Seki, M. Hydrodynamic filtration for on-chip particle concentration and classification utilizing microfluidics. Lab on a Chip. 5 (11), 1233-1239 (2005).
- Burguillos, M. A., et al. Microchannel acoustophoresis does not impact survival or function of microglia, leukocytes or tumor cells. PLoS One. 8 (5), e64233 (2013).
- Lin, S. -. C. S., Mao, X., Huang, T. J. Surface acoustic wave (SAW) acoustophoresis: now and beyond. Lab on a Chip. 12 (16), 2766-2770 (2012).
- Petersson, F., Åberg, L., Swärd-Nilsson, A. -. M., Laurell, T. Free flow acoustophoresis: microfluidic-based mode of particle and cell separation. Analytical Chemistry. 79 (14), 5117-5123 (2007).
- Ding, X., et al. On-chip manipulation of single microparticles, cells, and organisms using surface acoustic waves. Proceedings of the National Academy of Sciences. 109 (28), 11105-11109 (2012).
- Friend, J., Yeo, L. Y. Microscale acoustofluidics: Microfluidics driven via acoustics and ultrasonics. Reviews of Modern Physics. 83 (2), 647 (2011).
- Destgeer, G., Lee, K. H., Jung, J. H., Alazzam, A., Sung, H. J. Continuous separation of particles in a PDMS microfluidic channel via travelling surface acoustic waves (TSAW). Lab on a Chip. 13 (21), 4210-4216 (2013).
- Guo, F., et al. Controlling cell-cell interactions using surface acoustic waves. Proceedings of the National Academy of Sciences. 112 (1), 43-48 (2015).
- Ding, X., et al. Cell separation using tilted-angle standing surface acoustic waves. Proceedings of the National Academy of Sciences. 111 (36), 12992-12997 (2014).
- Roshchupkin, D., et al. X-ray diffraction by standing surface acoustic waves. Nuclear Instruments and Methods in Physics Research Section B: Beam Interactions with Materials and Atoms. 142 (3), 432-436 (1998).
- Shi, J., Mao, X., Ahmed, D., Colletti, A., Huang, T. J. Focusing microparticles in a microfluidic channel with standing surface acoustic waves (SSAW). Lab on a Chip. 8 (2), 221-223 (2008).
- Ding, X., et al. Surface acoustic wave microfluidics. Lab on a Chip. 13 (18), 3626-3649 (2013).
- King, L. V. On the acoustic radiation pressure on spheres. Proceedings of the Royal Society of London A: Mathematical, Physical and Engineering Sciences. , 212-240 (1934).
- Yosioka, K., Kawasima, Y. Acoustic radiation pressure on a compressible sphere. Acta Acustica United with Acustica. 5 (3), 167-173 (1955).
- Ratier, C., Hoyos, M. Acoustic programming in step-split-flow lateral-transport thin fractionation. Analytical Chemistry. 82 (4), 1318-1325 (2010).
- Mandralis, Z., Feke, D., Bolek, W., Burger, W., Benes, E. Enhanced synchronized ultrasonic and flow-field fractionation of suspensions. Ultrasonics. 32 (2), 113-122 (1994).
- Laurell, T., Petersson, F., Nilsson, A. Chip integrated strategies for acoustic separation and manipulation of cells and particles. Chemical Society Reviews. 36 (3), 492-506 (2007).
- Liu, Y., Lim, K. -. M. Particle separation in microfluidics using a switching ultrasonic field. Lab on a Chip. 11 (18), 3167-3173 (2011).
- Brissaud, M. Characterization of piezoceramics. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 38 (6), 603-617 (1991).
- Ding, X., et al. Tunable patterning of microparticles and cells using standing surface acoustic waves. Lab on a Chip. 12 (14), 2491-2497 (2012).
- Jo, M. C., Guldiken, R. Particle manipulation by phase-shifting of surface acoustic waves. Sensors and Actuators A: Physical. 207, 39-42 (2014).
- Meng, L., et al. Transportation of single cell and microbubbles by phase-shift introduced to standing leaky surface acoustic waves. Biomicrofluidics. 5 (4), 044104 (2011).
- Sriphutkiat, Y., Zhou, Y. Particle manipulation using standing surface acoustic waves (SSAW) at dual frequency excitation: effect of power ratio. Sensors and Actuators A: Physical. 263, 521-529 (2017).
- Batchelor, G. K. . An Introduction to Fluid Dynamics. , (2000).
- Glynne-Jones, P., Hill, M. Acoustofluidics 23: acoustic manipulation combined with other force fields. Lab on a Chip. 13 (6), 1003-1010 (2013).
- Winkler, A., Brünig, R., Faust, C., Weser, R., Schmidt, H. Towards efficient surface acoustic wave (SAW)-based microfluidic actuators. Sensors and Actuators A: Physical. 247, 259-268 (2016).
- Chen, Y., et al. Standing surface acoustic wave (SSAW)-based microfluidic cytometer. Lab on a Chip. 14, 916-923 (2014).
- Devendran, C., et al. The importance of travelling wave components in standing surface acoustic wave (SSAW) systems. Lab on a Chip. 16, 3756-3766 (2016).
- Destgeer, G., et al. Submicron separation of microspheres via travelling surface acoustic waves. Lab on a Chip. 14, 4665-4672 (2014).
- Ding, X., et al. Standing surface acoustic wave (SSAW) based multichannel cell sorting. Lab on a Chip. 12, 4228-4231 (2012).
- Chen, Y., et al. Continuous enrichment of low-abundance cell samples using standing surface acoustic waves (SSAW). Lab on a Chip. 14, 924-930 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados