É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Estruturas de nível molecular interfacial de polímeros e biomacromoléculas reveladas através de espectroscopia vibracional de geração de frequência de soma
Neste Artigo
Resumo
Sendo utilizado de forma abrangente, a espectroscopia vibracional de geração de frequência de soma (SFG) pode ajudar a revelar a ordem conformacional da cadeia e a mudança estrutural secundária acontecendo em interfaces de polímero e biomacromolécula.
Resumo
Como espectroscopia óptica não linear de segunda ordem, a espectroscopia vibracional de geração de frequência de soma (SFG) tem sido amplamente utilizada na investigação de várias superfícies e interfaces. Esta técnica ótica não invasora pode fornecer a informação local do molecular-nível com monoolayer ou sensibilidade do submonolayer. Nós estamos aqui fornecendo a metodologia experimental em como detectar seletivamente a relação enterrada para macromoléculas e biomacromoléculas. Com isto na mente, as estruturas secundárias interfaciais do fibroína e das estruturas de água de seda em torno do duplex modelo da curto-corrente do oligonucleotide são discutidas. O primeiro mostra uma sobreposição da cadeia de cadeia ou o efeito de confinamento espacial e o último mostra uma função de proteção contra os íons Ca2 + resultantes da superestrutura da coluna quiral da água.
Introdução
O desenvolvimento da espectroscopia vibracional de geração de frequência de soma (SFG) pode ser datado de volta ao trabalho realizado por Shen et al. há trinta anos1,2. A singularidade da seletividade interfacial e da sensibilidade da submonocamada faz com que a espectroscopia vibracional SFG seja apreciada por um grande número de pesquisadores nas áreas de física, química, biologia e ciência dos materiais, etc3,4 ,5. Atualmente, uma ampla gama de questões científicas relacionadas a superfícies e interfaces estão sendo investigadas usando o SFG, especialmente para interfaces complexas com relação a polímeros e biomacromoléculas, como as estruturas da cadeia e o relaxamento estrutural no interfaces de polímeros enterradas, as estruturas secundárias proteicas e as estruturas de água interfacial9,10,11,12,13,14, 15,16,17,18,19,20,21,22,23, 24,25,26.
Para superfícies e interfaces de polímeros, as amostras de película fina são geralmente preparadas por spin-coating para obter as superfícies ou interfaces desejadas. O problema surge devido à interferência do sinal das duas interfaces dos filmes preparados, o que leva à inconveniência para analisar os espectros coletados do SFG27,28,29. Na maioria dos casos, o sinal vibracional apenas a partir de uma única interface, quer filme/substrato ou filme/o outro meio, é desejável. Na verdade, a solução para este problema é muito fácil, ou seja, para maximizar experimentalmente os campos de luz na interface desejável e minimizar os campos de luz na outra interface. Assim, os coeficientes de Fresnel ou os coeficientes de campo local precisam ser calculados por meio do modelo de filme fino e ser validados em relação aos resultados experimentais3,9,10,11, 12,13,14,15,30.
Com o fundo acima na mente, algumas relações do polímero e as biológicas podiam ser investigadas a fim compreender a ciência fundamental do nível molecular. A seguir, tomando três questões interfaciais como exemplos: sondagem de superfície poli (2-hidroxietil metacrilato) (PHEMA) e interface enterrada com substrato9, formação de fibroína de seda (SF) estruturas secundárias sobre a superfície de POLIESTIRENO (PS) e estruturas de água em torno do modelo de curto-cadeia de oligonucleotídeo duplex16,21, vamos mostrar como a espectroscopia vibracional SFG ajuda a revelar as estruturas de nível molecular interfacial em conexão com a ciência subjacente.
Protocolo
1. SFG experimental
- Use um sistema comercial degradam SFG (tabela de materiais), que fornece um feixe de 1064 nm fundamental com uma largura de pulso de ~ 20 PS e uma freqüência de 50 Hz, com base em um Nd: YAG laser.
- Converta o feixe de 1064 nm fundamental em um feixe de 532 nm e um feixe de 355 NM usando módulos de segundo e terceiro harmônicos. Orientar diretamente o feixe de 532 nm como um feixe de luz de entrada e gerar o outro feixe de entrada Mid-Infrared (IR) cobrindo a faixa de freqüência de 1000 a 4000 cm-1 através da geração óptica paramétrica (OPG)/Optical amplificação paramétrica (OPA)/ processo de geração de frequência de diferença (DFG).
- Defina os ângulos de incidente de duas vigas de entrada para ser 53 ° (IR) e 64 ° (visível), respectivamente, versus a superfície normal.
- Para detectar as estruturas interfaciais do polímero (relação da película/carcaça ou película/a outra relação média), use o SSP (feixe s-polarizado da soma-freqüência, feixe visível s-polarizado e feixe infravermelho p-polarizado) e combinações da polarização do PPP.
- Para detectar as estruturas secundárias de proteínas interfaciais e estruturas de água ao redor do DNA, além de SSP e PPP, utilizaram-se combinações de polarização quiral spp e PSP.
- Para garantir que as amostras não foram danificadas, controlar as energias de pulso infravermelho e visível para ser ~ 70 e ~ 30 mJ, respectivamente. Um esquema do processo de SFG com o diagrama de nível de energia foi mostrado na Figura 1. A Figura 2 mostra o sistema SFG em nossa sala limpa.
2. coeficientes de Fresnel
- Use prismas de ângulo reto como substratos para todos os experimentos discutidos aqui. Existem duas interfaces para uma película de polímero sobre o substrato sólido, ou seja, a superfície do polímero no ar e interface de polímero/substrato. Ambos podem gerar sinais de SFG desde que a simetria da inversão é quebrada em ambas as relações. Conseqüentemente, um espectro coletado de SFG é interferido um. Entretanto, os coeficientes locais do campo ou os coeficientes de Fresnel nas duas relações podem ser ajustáveis variando os ângulos do incidente ou a espessura de película uma de cada vez ou simultaneamente31,32. Isto fornece a oportunidade para que nós sonhe o sinal vibracional de SFG de somente uma relação. Aqui, o filme de PHEMA no prisma de CaF2 foi tomado como um exemplo9.
- Como mostrado na Figura 3, empregar a geometria de prisma de ângulo reto para detectar os sinais SFG gerados a partir do filme PHEMA inferior. A intensidade de saída do SFG no modo refletido é expressa como
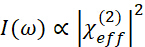 1
1
onde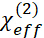 denota o tensor de susceptibilidade não linear de segunda ordem eficaz.
denota o tensor de susceptibilidade não linear de segunda ordem eficaz.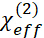 consiste em três partes, a saber, a relação do prisma/polímero, a relação do meio do polímero/fundo (o meio inferior inclui o gás, o líquido ou o sólido.) e o fundo objetos, segundo as indicações da seguinte equação.
consiste em três partes, a saber, a relação do prisma/polímero, a relação do meio do polímero/fundo (o meio inferior inclui o gás, o líquido ou o sólido.) e o fundo objetos, segundo as indicações da seguinte equação.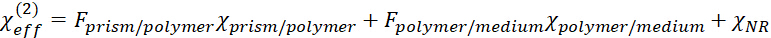 2
2
Aqui o meio inferior poderia ser ar, água ou qualquer outra coisa. F representa o correspondente coeficiente de Fresnel responsável pela correção de campo local. - Aplique um modelo de filme fino para calcular os coeficientes de Fresnel neste caso. Aqui somente os procedimentos de cálculo breves são apresentados.
- Para a interface prisma/polímero, use
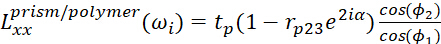 3
3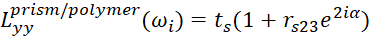 4
4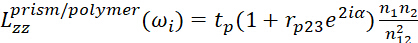 5
5
O significado de cada parâmetro mostrado é apresentado abaixo.- ωi denota a frequência do feixe.
-
tp e ts denotam os coeficientes de transmissão globais e podem ser expressos
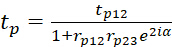 6
6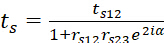 7
7 - tP12 e tS12 denotam os coeficientes de transmissão linear do feixe luminoso na interface prisma/polímero.
- rP23 e rS23 denotam os coeficientes de reflexão linear do feixe luminoso na interface polímero/meio.
-
α representa a diferença da fase entre um feixe reflexivo e seu feixe reflexivo secundário depois que se propaga através da película fina do polímero e reflete então para trás, que pode ser expressado como
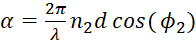 8
8 - λ representa o comprimento de onda do feixe de luz e d é a espessura da película do polímero.
- Φ1 e φ2 representam os ângulos do incidente na relação do prisma/polímero e na relação do polímero/meio respectivamente.
- n1 e n2 representam os índices refrativos do filme prisma e polímero, respectivamente.
- n . º 12 representa os índices refrativos das camadas interfaciais do polímero para o prisma/polímero.
- Para a interface de polímero/meio, use
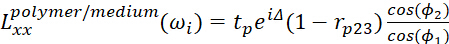 9
9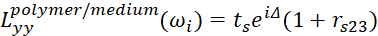 10
10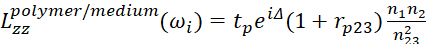 11
11- Δ representa a diferença de fase dos campos elétricos leves em duas interfaces.
- Porque a largura de pulso para nossos feixes de entrada é ~ 20 picosegundo, o erro do atraso de tempo associado com o efeito da dispersão pode ser negligenciado.
- A expressão de tal diferença de fase para a saída SFG, a entrada visível e os feixes infravermelhos de entrada pode ser escrito separadamente como
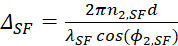 12
12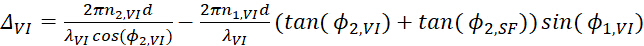 13
13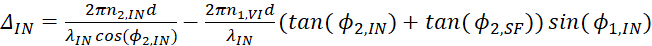 14
14
- Para a interface prisma/polímero, use
- A partir da discussão acima, para o prisma-polímero filme-médio (1-2-3) sistema, expressar o total de coeficientes de Fresnel para o prisma/polímero e polímero/médio interfaces como as seguintes equações, para SSP e PPP polarização combinações . Naturalmente, ambas as interfaces são consideradas azimuthally isotropic.
- Para a interface prisma/polímero, as expressões dos coeficientes de Fresnel total para as combinações de polarização SSP e PPP são apresentadas da seguinte forma.
- Para SSP, a equação é
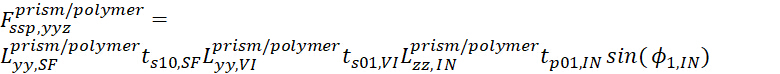 15
15 - E para PPP, a equação é
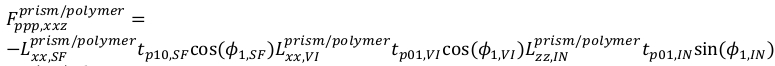 16
16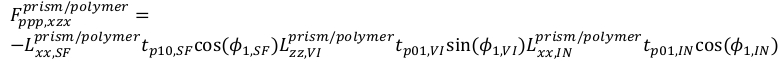 17
17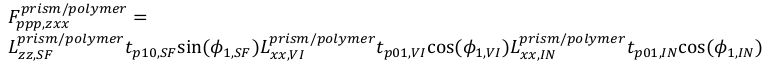 18
18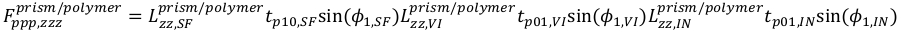 19
19
- t10 e t01 denotam os coeficientes de transmissão linear nas interfaces ar/prisma e prisma/ar respectivamente.
- Para SSP, a equação é
- Para a interface polímero/médio, as expressões dos coeficientes de Fresnel totais para as combinações de polarização SSP e PPP são descritas a seguir.
- Para SSP, a equação é
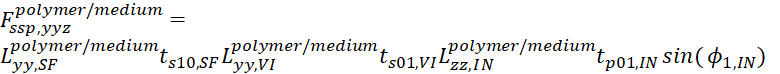 20
20 - Para PPP, as equações são
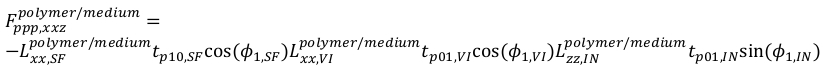 21
21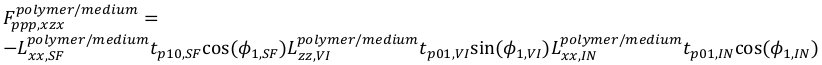 22
22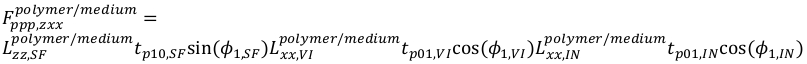 23
23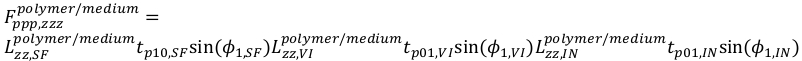 24
24
- Para SSP, a equação é
- Para a interface prisma/polímero, as expressões dos coeficientes de Fresnel total para as combinações de polarização SSP e PPP são apresentadas da seguinte forma.
- Depois de calcular os coeficientes de Fresnel usando o modelo imprensado, plotar-los como uma função da espessura do filme, como mostrado na Figura 4.
Nota: neste caso, existe uma faixa de espessura para coletar o sinal SFG da interface do CaF2 Prism/PHEMA com contribuição negligenciável da outra interface, que é de cerca de 150 nm. Similarmente, uma espessura apropriada pode ser escolhida para a deteção da relação média de PHEMA/Bottom com contribuição negligenciectable da relação de CaF2 Prism/PHEMA.
3. combinação da polarização de CHiral SFG
- Para a interface aquiral normal, comumente, use C∞ v simetria em termos de Ensemble média33,34. Com a operação de simetria de inversão, os componentes do tensor de susceptibilidade não linear de segunda ordem diferente de zero podem ser deduziram, que são cxxz, cXzX, cZxx, cYYZ, cYZY, czyy e czzz (o os termos existentes podem ser ainda mais reduzidos se uma interface isotrópica for assumida, o que significa que x e y são os mesmos). No entanto, para a interface quiral, a situação será diferente. A interface quiral possui a simetria C ∞, apenas a operação de simetria de rotação é permitida. Neste caso, além dos termos aquiral normais, mais susceptibilidades não lineares de segunda ordem será diferente de zero, que pode ser denominado como os termos quirais, a saber, cZYX, cZXY e cyzx a consideração de não-eletrônico Ressonância. Portanto, usando as combinações de polarização PSP, PPS e spp , os espectros quiral SFG podem ser coletados33,34.
4. preparação da amostra
- Preparação do filme PHEMA
- Dissolva o pó de PHEMA (veja a tabela de materiais) no etanol anidro para preparar a solução com 2 WT% e 4 WT% respectivamente.
- Antes da deposição dos filmes PHEMA, mergulhe os prismas do ângulo reto do CaF2 no solvente de tolueno em primeiro lugar e depois lave-os com etanol e água ultrapura (18,2 MΩ · cm).
- Em seguida, expor os substratos (CaF2 prismas de ângulo reto) ao plasma de oxigênio para remover possíveis contaminantes orgânicos por limpador de plasma (ver tabela de materiais).
- Primeiro ligue o limpador de plasma e colocar os substratos nele.
- Em seguida, ligue a bomba de vácuo para aspirar o limpador. Introduza o oxigénio.
- Finalmente, definir 4 minutos para a limpeza. Depois disso, preserve os substratos limpos para a preparação sequencial do filme PHEMA.
- Em seguida, prepare os filmes PHEMA sobre os prismas CaF2 por um spin-Coater (ver tabela de materiais). Ajuste as espessuras da película pela concentração da solução e pela velocidade da rotação.
- Imobilize o CaF2 prisma no disco de sucção de spin-Coater.
- Soltar uma gota da solução PHEMA preparada antes para os substratos limpos em 1.500 RPM por 1 min (espessura de filme 2 WT% para 100 nm e 4 WT% para 200 nm).
- Anneal todas as películas preparadas de PHEMA em um forno do vácuo em 80 ° c durante a noite.
- Preparação de fibroína de seda (SF)
Nota: adotou-se o protocolo sugerido por Kaplan et al.35 .- Coloque 7,5 g de casulos de seda de B. Mori na solução aquosa de carbonato de sódio a ferver (na2co3, 0, 2 M) (3 L) durante 30 min. Retire o SF fibroso para um recipiente limpo.
- Lave o SF fibroso obtido com água deionizada por três vezes agitação, a fim de remover as moléculas de sericina e deixar apenas as moléculas SF na amostra fibrosa.
- Seque a amostra fibrosa de SF em um forno a vácuo a 60 ° c durante a noite.
- Em seguida, dissolver a amostra de SF fibrosa degomado em uma solução aquosa de brometo de lítio (LiBr, 9,3 M) (1 g de SF foi resolvido em ~ 4 ml de solução de libr.) e incubar-lo a 60 ° c por 2 h agitação.
- Dialyze a solução SF contra a água deionizada (3.500 da diálise sacos) por 3 dias para remover o LiBr dissolvido. Mude a água deionizada nova três vezes todos os dias. Armazene finalmente a solução processada SF em 4 ° c para uns experimentos mais atrasados de SFG.
- Preparação do duplex do oligonucleotide da curto-corrente
- Encomende a amostra de oligonucleotídeo com a sua 3 '-End modificada pelo colesterol-trietileno glicol (Chol-TEG) (5 '-GCTTCCGAAGGTCGA-3 ') de uma corporação comercial (ver tabela de materiais), bem como a complementar. Para cada uma das vertentes, dissolver 10 nmol do pó da amostra em 0,5 ml de água ultrapura. Em seguida, misture-os para formar a solução de oligonucleotídeo duplex (10 nmol/mL).
- Misture 2 mg de 1,2-Dipalmitoyl-SN-glicero-3-fosfocolina (DPPC) e 2 mg de DPPC deuterado (d-DPPC) e dissolva-os em 1 mL de clorofórmio para preparar a solução lipídica.
- Preparação do DPPC & monocamada d-DPPC por uma calha Langmuir − Blodgett (LB)
- Prenda o prisma do CaF2 do direito-ângulo a um suporte caseiro da amostra com um rosto prisma mergulhado perpendicularmente no ambiente aquoso da calha lb.
- Depois, injete a solução lipídica mista preparada antes na superfície da água até que a pressão superficial tenha atingido um certo valor abaixo de 34 mN · m− 1.
- Após os níveis da pressão de superfície fora, use duas barreiras do Teflon para comprimir o monocamada do lipido em uma relação de 5 milímetros/minuto até que uma pressão de superfície de 34 MN · m− 1 estêve alcançada.
- Levante o prisma com uma monocamada lipídica para fora da água a uma taxa de 1 mm/min verticalmente.
- Preparação da outra monocamada lipídica
- Para facilitar a montagem do oligonucleotide duplex e as moléculas lipídicas através da interação hidrofóbica (colesterol e uma cadeia alquil lipídica), misture a solução de oligonucleotídeo duplex com a solução lipídica em uma proporção molar de 1:100 (oligonucleotídeo para lipídico).
- Injete a solução misturada do oligonucleotide do lipido e do duplex na superfície da água em um recipiente caseiro do Teflon até que uma pressão de superfície de 34 mN · m− 1 estêve alcançada.
- Finalmente, coloque a monocamada lipídica na parte inferior do prisma em contato com a monocamada lipídica com oligonucleotídeos duplex inseridos na superfície da água para formar a amostra final para a medida do SFG.
- Equação de Lorentz
- Use a equação de Lorentz para ajustar os espectros de SFG para extrair a informação vibracional para um modo vibracional específico .
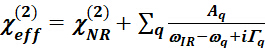 25
25
onde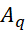 representa a intensidade do modo vibracional QTH ,
representa a intensidade do modo vibracional QTH , 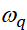 representa a freqüência ressonante,
representa a freqüência ressonante, 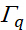 denota a meia largura ao meio máximo (hwhm) e
denota a meia largura ao meio máximo (hwhm) e 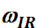 representa a freqüência de digitalização do feixe de ir incidente.
representa a freqüência de digitalização do feixe de ir incidente.
- Use a equação de Lorentz para ajustar os espectros de SFG para extrair a informação vibracional para um modo vibracional específico .
Resultados
Na parte do coeficiente de Fresnel da seção do protocolo, nós mostramos que, teoricamente, é praticável detectar seletivamente somente uma única relação em uma vez. Aqui, experimentalmente, confirmamos que essa metodologia está basicamente correta, como mostra a Figura 5 e a Figura 6.
A Figura 5 mostra a estrutura de PHEMA interfacial enterrada após a intrusão da água com uma película do hidr...
Discussão
Para investigar as informações estruturais a partir de um nível molecular, a SFG tem suas vantagens inerentes (ou seja, sensibilidade monocamada ou submonocamada e seletividade interfacial), que pode ser aplicada para estudar várias interfaces, como o sólido/sólido, sólido/ líquido, sólido/gás, líquido/gás, líquido/líquido interfaces. Embora a manutenção do equipamento e o alinhamento ótico sejam ainda demorados, o retorno é significativo em que a informação detalhada do nível molecular nas superfíc...
Divulgações
Não temos nada a revelar.
Agradecimentos
Este estudo foi apoiado pelo programa de desenvolvimento chave do estado para a pesquisa básica de China (2017YFA0700500) e a Fundação Nacional da ciência natural de China (21574020). Os fundos de pesquisa fundamentais para as universidades centrais, um projeto financiado pelo programa de desenvolvimento acadêmico prioritário das instituições de ensino superior de Jiangsu (PAPD) e o centro nacional de demonstração de Engenharia Biomédica experimental Educação (Universidade do sudeste) também foram muito apreciados.
Materiais
| Name | Company | Catalog Number | Comments |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) | Avanti Polar Lipids, Inc. | 850355P-1g | |
| Anhydrous ethanol | Sinopharm Chemical Reagent Co., Ltd | 100092680 | ≥99.7% |
| CaF2 prism | Chengdu YaSi Optoelectronics Co., Ltd. | ||
| Calcium chloride anhydrous | Sinopharm Chemical Reagent Co., Ltd | 10005817 | ≥96.0% |
| deuterated DPPC (d-DPPC) | Avanti Polar Lipids, Inc. | 860345P-100mg | |
| Electromagnetic oven | Zhejiang Supor Co., Ltd | C21-SDHCB37 | |
| Langmuir-Blodgett (LB) trough | KSV NIMA Co., Ltd. | KN 2003 | |
| Lithium bromide anhydrous | Sinopharm Chemical Reagent Co., Ltd | 20056926 | |
| Milli-Q synthesis system | Millipore | Ultrapure water | |
| Plasma cleaner | Chengdu Mingheng Science&Technology Co., Ltd | PDC-MG | Oxygen plasma cleaning |
| Poly(2-hydroxyethyl methacrylate) (PHEMA) | Sigma-Aldrich Co., LLC. | 192066 MSDS | Mw = 300 000 |
| Polystyrene | Sigma-Aldrich Co., LLC. | 330345 MSDS | Mw = 48 kDa and Mn = 47 kDa |
| Silk cocoons | From Bombyx mori | ||
| Single complementary strand of oligonucleotide | Nanjing Genscript Biotechnology Co., Ltd. | H03596 | 5'-CGAAGGCTTCCAGCT-3' |
| Single strand of oligonucleotide | Nanjing Genscript Biotechnology Co., Ltd. | H04936 | 3¢-end modified by cholesterol-triethylene glycol(Chol-TEG) (5¢-GCTTCCGAAGGTCGA-3¢) |
| Sodium carbonate anhydrous | Sinopharm Chemical Reagent Co., Ltd | 10019260 | ≥99.8% |
| Spin-coater | Institute of Microelectronics of the Chinese Academy of Sciences | KW-4A | For the prepartion of ploymer films |
| Step profiler | Veeco | DEKTAK 150 | For the measurement of film thickness |
| Sum frequency generation (SFG) vibrational spectroscopy system | EKSPLA | A commercial picosecond SFG system |
Referências
- Shen, Y. R. Optical Second Harmonic Generation at Interfaces. Annual Review of Physical Chemistry. 40, 327-350 (1989).
- Shen, Y. R. Surface properties probed by second-harmonic and sum-frequency generation. Nature. 337, 519-525 (1989).
- Lu, X., et al. Studying Polymer Surfaces and Interfaces with Sum Frequency Generation Vibrational Spectroscopy. Analytical Chemistry. 89 (1), 466-489 (2017).
- Chen, X., Clarke, M. L., Wang, J., Chen, Z. Sum Frequency Generation Vibrational Spectroscopy Studies on Molecular Conformation and Orientation of Biological Molecules at Interfaces. International Journal of Modern Physics B. 19 (4), 691-713 (2005).
- Eisenthal, K. B. Liquid Interfaces Probed by Second-Harmonic and Sum-Frequency Spectroscopy. Chemical Reviews. 96 (4), 1343-1360 (1996).
- Richmond, G. L. Molcular Bonding and Interactions at Aqueous Surfaces as Probed by Vibrational Sum Frequency Spectroscopy. Chemical Reviews. 102 (8), 2693-2724 (2002).
- Wang, H., Gan, W., Lu, R., Rao, Y., Wu, B. Quantitative spectral and orientational analysis in surface sum frequency generation vibrational spectroscopy(SFG-VS). International Reviews in Physical Chemistry. 24 (2), 191-256 (2007).
- Shultz, M. J., Schnitzer, C., Simonelli, D., Baldelli, S. Sum frequency generation spectroscopy of the aqueous interface: Ionic and soluble molecular solutions. International Reviews in Physical Chemistry. 19 (1), 123-153 (2010).
- Li, X., et al. Detecting Surface Hydration of Poly(2-hydroxyethyl methacrylate) in Solution in situ. Macromolecules. 49, 3116-3125 (2016).
- Li, X., Lu, X. Evolution of Irreversibly Absorbed Layer Promotes Dewetting of Polystyrene Film on Sapphire. Macromolecules. 51, 6653-6660 (2018).
- Lu, X., Spanninga, S. A., Kristalyn, C. B., Chen, Z. Surface Orientation of Phenyl Groups in Poly(sodium 4-styrenesulfonate) and in Poly(sodium 4-styrenesulfonate): Poly(3,4-ethylenedioxythiophene) Mixture Examined by Sum Frequency Generation Vibrational Spectroscopy. Langmuir. 26 (17), 14231-14235 (2010).
- Lu, X., Clarke, M. L., Li, D., Wang, X., Chen, Z. A Sum Frequency Generation Vibrational Study of the Interference Effect in Poly(n-butyl methacrylate) Thin Films Sandwiched between Silica and Water. Journal of Physical Chemistry C. 115, 13759-13767 (2011).
- Lu, X., et al. Directly Probing Molecular Ordering at the Buried Polymer/Metal Interface 2: Using P-Polarized Input Beams. Macromolecules. 45, 6087-6094 (2012).
- Lu, X., Myers, J. N., Chen, Z. Molecular Ordering of Phenyl Groups at the Buried Polystyrene/Metal Interface. Langmuir. 30, 9418-9422 (2014).
- Li, B., Lu, X., Ma, Y., Han, X., Chen, Z. Method to Probe Glass Transition Temperatures of Polymer Thin Films. ACS Macro Letters. 4, 548-551 (2015).
- Li, X., Deng, G., Ma, L., Lu, X. Interchain Overlap Affects Formation of Silk Fibroin Secondary Structure on Hydrophobic Polystyrene Surface Detected via Achiral/Chiral Sum Frequency Generation. Langmuir. 34, 9453-9459 (2018).
- Kai, S., Li, X., Li, B., Han, X., Lu, X. Calcium-dependent hydrolysis of supported planar lipids was triggered by honey bee venom phospholipase A2 with the right orientation at the interface. Physical Chemistry Chemical Physics. 20, 63-67 (2018).
- Wang, J., Buck, S., Chen, Z. Sum Frequency Generation Vibrational Spectroscopy Studies on Protein Adsorption. Journal of Physical Chemistry B. 106, 11666-11672 (2002).
- Wang, J., et al. Detection of Amide I Signals of Interfacial Proteins in Situ Using SFG. Journal of American Chemical Society. 125, 9914-9915 (2003).
- Nguyen, K. T., et al. Probing the Spontaneous Membrane Insertion of a Tall-Anchored Membrane Protein by Sum Frequency Generation Spectroscopy. Journal of American Chemistry Society. 132, 15112-15115 (2010).
- Li, X., Ma, L., Lu, X. Calcium Ions Affect Water Molecular Structures Surrounding an Oligonucleotide Duplex as Revealed by Sum Frequency Generation Vibrational Spectroscopy. Langmuir. , (2018).
- Sartenaer, Y., et al. Sum-frequency generation spectroscopy of DNA monolayers. Biosensors & Bioelectronics. 22, 2179-2183 (2007).
- Asanuma, H., Noguchi, H., Uosaki, K., Yu, H. Metal Cation-induced Deformation of DNA Self-Assembled Monolayers on Silicon: Vibrational Sum Frequency Generation Spectroscopy. Journal of American Chemistry Society. 130, 8016-8022 (2008).
- Howell, C., Schmidt, R., Kurz, V., Koelsch, P. Sum-frequency-generation spectroscopy of DNA films in air and aqueous environments. Biointerphases. 3 (3), FC47 (2008).
- Walter, S. R., Geiger, F. M. DNA on Stage: Showcasing Oligonucleotides at Surfaces and Interfaces with Second Harmonic and Vibrational Sum Frequency Generation. Journal of Physical Chemistry Letters. 1, 9-15 (2010).
- Li, Z., Weeraman, C., Azam, M. S., Osman, E., Gibbs-Davis, J. The thermal reorganization of DNA immobilized at the silica/buffer interface: a vibrational sum frequency generation investigation. Physical Chemistry Chemical Physics. 17, 12452-12457 (2015).
- Lambert, A. G., Neivandt, D. J., Briggs, A. M., Usadi, E. W., Davies, P. B. Interference Effects in Sum Frequency Spectra from Monolayers on Composite Dielectric/Metal Substrates. Journal of Physical Chemistry B. 106, 5461-5469 (2002).
- Tong, Y., et al. Interference effects in the sum frequency generation spectra of thin organic films. I. Theoretical modeling and simulation. Journal of Chemical Physics. 133, 034704 (2010).
- McGall, S. J., Davies, P. B., Neivandt, D. J. Interference Effects in Sum Frequency Vibrational Spectra of Thin Polymer Films: An Experimental and Modeling Investigation. Journal of Physical Chemistry B. 108, 16030-16039 (2004).
- Li, B., et al. Interfacial Fresnel Coefficients and Molecular Structures of Model Cell Membranes: From a Lipid Monolayer to a Lipid Bilayer. Journal of Physical Chemistry C. 118, 28631-28639 (2014).
- Zhou, J., Anim-Danso, E., Zhang, Y., Zhou, Y., Dhinojwala, A. Interfacial Water at Polyurethane-Sapphire Interface. Langmuir. 31 (45), 12401-12407 (2015).
- Gautam, K. S., et al. Molecular Structure of Polystyrene at Air/Polymer and Solid/Polymer Interfaces. Physical Review Letters. 85 (18), 3854-3857 (2000).
- Yan, E. Y., Fu, L., Wang, Z., Liu, W. Biological Macromolecules at Interfaces Probed by Chiral Vibrational Sum Frequency Generation Spectroscopy. Chemical Reviews. 114, 8471-8498 (2014).
- Belkin, M. A., Kulakov, T. A., Ernst, K. H., Yan, L., Shen, Y. R. Sum-Frequency Vibrational Spectroscopy on Chiral Liquids: A Novel Technique to Probe Molecular Chirality. Physical Review Letters. 85, 4474 (2000).
- Rockwood, D. N., et al. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols. 6, 1612-1631 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados