Method Article
Processamento de fluido de lavagem broncoalveolar e sangue pareado para macrófago alveolar e CD4+ T-Cell immunophenotyping e avaliação do reservatório de HIV
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Nós descrevemos um método para processar o líquido broncoalveolar do lavagem e o sangue periférico combinado dos indivíduos cronicamente HIV-contaminados na terapia antiretroviral para avaliar reservatórios pulmonars do HIV. Estes métodos resultam na aquisição de células T CD4 altamente puras e macrófagos alveolares que posteriormente podem ser utilizados para a imunofenotipagem e quantificações de DNA/RNA do HIV por reação em cadeia da polimerase ultrassensora.
Resumo
A broncoscopia é um procedimento médico pelo qual a solução salina normal é injetada nos pulmões através de um broncoscópio e, em seguida, a sucção é aplicada, removendo o fluido de lavagem broncoalveolar (LBA). O fluido de LBA é rico em células e pode, assim, fornecer um "instantâneo" do ambiente imunológico pulmonar. As células T CD4 são os melhores reservatórios de HIV caracterizados, enquanto há evidências fortes para sugerir que os macrófagos teciduais, incluindo macrófagos alveolares (AMs), também servem como reservatórios virais. No entanto, muito ainda é desconhecido sobre o papel da AMs no contexto do estabelecimento e manutenção do reservatório de HIV. Portanto, o desenvolvimento de um protocolo de processamento do fluido BAL para obtenção de células que possam ser utilizadas em ensaios virológicos e imunológicos para caracterizar e avaliar as populações celulares e subconjuntos dentro do pulmão é relevante para a compreensão do papel dos pulmões como HIV Reservatórios. Nisto, nós descrevemos tal protocolo, empregando técnicas padrão tais como a centrifugação simples e a citometria do fluxo. As células T CD4 e AMs podem então ser utilizadas para aplicações subsequentes, incluindo a imunofenotipagem e a quantificação do ADN e do RNA do VIH.
Introdução
Um dos desafios mais significativos enfrentados pela cura para a infecção pelo HIV é a presença do reservatório latente de HIV que provoca uma repercussão da viremia plasmática após a interrupção da terapia antirretroviral (Art)1,2. Enquanto o reservatório de HIV durante a Long-Term ART está bem documentado em vários compartimentos de tecido, incluindo órgãos linfóides secundários, tecido linfóide associado ao intestino (GALT), e o sistema nervoso central (CNS), os pulmões têm sido negligenciados como uma área de estudo desde a era da pré-arte3. No entanto, os pulmões desempenham um papel central na patogênese do HIV. De fato, os sintomas pulmonares estavam entre os primeiros indicadores de infecções oportunistas relacionadas à AIDS4. Mesmo na era da arte moderna, as pessoas com HIV estão em maior risco de desenvolver doenças pulmonares infecciosas e não infecciosas do que as pessoas sem HIV. Por exemplo, pessoas com infecção por HIV estão em risco elevado de infecção invasiva por pneumoniae estreptocócica , bem como doença pulmonar obstrutiva crônica (DPOC)5,6. Além disso, a coinfecção da tuberculose (TB) e do HIV é um importante desafio de saúde pública em certas regiões do mundo, notadamente, a África Subsaariana, como indivíduos infectados pelo HIV são 16 a 27 vezes mais propensos a ter TB do que as pessoas sem HIV7. Embora algumas explicações para essa suscetibilidade à infecção pulmonar e doença crônica tenham sido propostas8,9,10, os mecanismos celulares precisos pelos quais indivíduos com HIV suprimido a carga viral do plasma permanece em um risco mais elevado para complicações pulmonaas não foi elucidada inteiramente. É importante ressaltar que o HIV é um fator de risco muito forte para infecção pulmonar e doença crônica, independente do estado de tabagismo6.
A análise do ambiente imunológico do pulmão é, portanto, crucial para compreender seu papel na saúde e na doença. Embora as amostras não invasoras, induzidas do escarro tendem a conter grandes quantidades de pilhas epithelial e de restos com linfócitos pulmonars raros e nenhum AMS, limitando seu papel às aplicações específicas. Inversamente, as grandes biópsias do tecido não podem ser obtidas na ausência de doença suspeitada devido aos riscos associados do sangramento e do pneumotórax significativos (colapso do pulmão). Além disso, a maioria das células imunes pulmonares estão localizadas principalmente no nível da mucosa, onde os pulmões são continuamente estimulados por antígenos durante a respiração. Para esse fim, a broncoscopia para obter o fluido de LBA tem a vantagem de fornecer acesso relativamente seguro aos linfócitos e AMs (ver Figura 1). Os macrófagos constituem a maior proporção de células dentro do líquido LBA, seguidos dos linfócitos11. É útil, portanto, estabelecer um método pelo qual o fluido de LBA pode ser processado para uso em aplicações subsequentes, como imunofenotipagem, cultura celular, transcriptomics ou quaisquer outras aplicações. O protocolo de processamento do fluido BAL delineado aqui é adaptado de procedimentos gerais previamente descritos e otimizados para os vários ensaios a jusante empregados. Esta metodologia permite o isolamento de células imunes da mucosa pulmonar linfoide e mielóide para sua caracterização fenotípica e funcional, bem como uma avaliação do reservatório de HIV em adultos vivendo com HIV.
Para estabelecer este protocolo, utilizamos os seguintes critérios para recrutar participantes do estudo15. Para que os participantes sejam elegíveis para participar deste estudo, tiveram de ser indivíduos infectados pelo VIH que preencheram os seguintes critérios: (1) no ART durante pelo menos 3 anos; (2) carga viral suprimida (LV) por um período mínimo de 3 anos; (3) contagem de células T CD4 ≥ 200/mm3; (4) dispostos a submeter-se a espirometria de pesquisa e broncoscopia. Os pacientes com os seguintes critérios foram excluídos do estudo: (1) contraindicação (s) à broncoscopia; (2) risco elevado do sangramento: coagulopatia ou na terapia do Warfarin ou do Clopidogrel; (3) trombocitopenia (plaquetas baixas); (4) infecção pulmonar ativa ou outro processo pneumóico agudo; (5) grávida/tentando engravidar.
Protocolo
Este protocolo de pesquisa foi estabelecido diretamente com base nos princípios incluídos na declaração de Helsínquia e recebeu aprovação dos conselhos de revisão institucional do centro de saúde da Universidade McGill (RI-MUHC, #15-031), da Université du Québec à Montreal (UQAM, #602) e o Centre de recherche du Centre hospitalier de l' Université de Montréal (CR-CHUM, #15-180).
1. lavage broncoalveolar
Nota: Esta seção descreve broncoscopia como executado por um pneumologista licenciado com auxílio de um terapeuta respiratório16,17.
- Prepare as peças de aparelhos necessários para o procedimento, incluindo um broncoscópio e soro fisiológico. Administrar spray anestésico na parte de trás da garganta do paciente. Evite o uso excessivo de anestesia tópica quando possível. Aplique ligações cardíacas ao tórax, a fim de monitorar a freqüência cardíaca e ritmo e uma sonda de oxigênio para o primeiro dedo de uma mão, a fim de monitorar a saturação de oxigênio. Insira a cânula nasal nas narinas para fornecer oxigênio suplementar.
- Posicione o paciente, preferencialmente na posição supina. Administrar a sedação da seguinte forma: midazolam 0,01-0,04 mg/kg e fentanil 50-100 μg (para facilitar o conforto do paciente e minimizar o reflexo da tosse) intravenosamente, na presença de um respirologista ou anestesista.
- Avance o Broncoscópio flexível até que esteja encravado no brônquio subsegmentares desejado. Instill Saline (50-60 mL de cada vez) com a seringa e, em seguida, aplique sucção suave (50-80 mmHg). O fluido de lavagem irá recolher na seringa e, em seguida, ser transferido para um recipiente de coleta.
- Repita o flush para um total de 200-300 mL de lavagem. Colete pelo menos 100 mL de fluido de LBA, se possível.
- Coloque o fluido BAL no gelo.
2. isolamento de células BAL
Nota: O procedimento a seguir deve ser realizado condições estéreis em um armário de segurança biológico, classe II (BSL2) ou superior.
-
Mantenha as amostras de BAL no gelo até que sejam processadas.
- Vórtice o BAL no tubo de recolha original e transfira-o para um tubo de 50 mL utilizando uma pipeta serológica. Se o fluido BAL aparecer muito turvo ou contaminado por tecido filamentoso, filtre o fluido através de um filtro de malha de nylon de 70 μm em um novo tubo de 50 mL.
- Centrifugador a 200 x g durante 10 min a 4 ° c. Transfira o sobrenadante para um novo tubo de 50 mL. Quebre suavemente a pelota com uma ponta de pipeta e resuma-a em 1 mL de meio RPMI 1640.
- Transfira 1 mL do sobrenadante para cada um dos tubos de microcentrífuga de 10x 1,5 mL e o sobrenadante restante para tubos de 15 mL, 10 mL em cada um. Armazene todos os tubos sobrenadantes a-80 ° c.
-
Processe o pellet Cell BAL.
- Ressuscitem o pellet em 10 mL de RPMI 1640 para cada 25 mL da amostra original. Centrifugador a 200 x g durante 10 min a 4 ° c. Transfira o sobrenadante para um novo tubo de 15 mL (descarte depois de garantir que existam células suficientes no pellet).
- Ressuscitada a pelota em 1 ml de RPMI 1640 + 10% de soro bovino fetal (FBS) e contagem usando o azul do Tripan e um Hemocytometer.
Nota: Se o fluido BAL não for separado pela aderência das células antes da triagem, prossiga para a seção 4.
3. aderência de células BAL (opcional)
Nota: Esse protocolo alternativo pode ser executado antes ou em vez de classificação de célula. O procedimento a seguir deve ser realizado condições estéreis em um armário BSL2 (ou superior).
- Transfira o número desejado de células BAL para a triagem para um novo tubo de 15 mL e faça o volume correto para 1,5 x 106 macrófagos/ml. Placa 2 mL de células por poço em placas de 6 poços e incubar por 2 h a 37 ° c com 5% de CO2, para permitir tempo de adesão.
- Após a incubação, aspirar cuidadosamente a mídia contendo células não aderentes e transferi-la para um tubo de 15 mL. Centrifugador a 300 x g durante 10 min à temperatura ambiente (RT). Retire o sobrenadante e ressuspender a 1 x 107 células/ml em solução salina tamponada com fosfato (PBS) + 2% FBS e transferir a suspensão para um tubo de poliestireno de fundo redondo de 5 ml. Esta fração do linfócito está agora pronta para manchar para a classificação da pilha.
- Para as restantes células aderentes na placa, adicione 1 mL por poço de solução de desassociação celular (ver a tabela de materiais) e incubar por pelo menos 15 min a 37 ° c com 5% co2, até que as células se separem facilmente da placa com uma ponta de pipeta.
- Delicadamente mas raspe completamente as pilhas aderentes da superfície do poço usando uma ponta da pipeta, e use 1 mL do líquido no poço para ajudar com o destacamento. Transfira as células para um novo tubo de 15 mL. Lave os poços com 1 mL de PBS e acrescente-o ao mesmo tubo. Compo o índice do tubo a 5 mL com PBS.
- Centrifugador em 300 x g por 10 min em RT. Retire o sobrenadante, Ressuspender a 1 x 107 células/ml PBS + 2% FBS, e transfira a suspensão para um tubo de poliestireno de fundo redondo de 5 ml. Esta fração Myeloid está agora pronta para manchar para a classificação da pilha.
4. isolamento de células mononucleares do sangue periférico
Nota: O procedimento a seguir deve ser realizado condições estéreis em um armário BSL2 (ou superior).
- No mesmo dia da broncoscopia (geralmente diretamente antes da coleta de LBA), obter seis tubos de sangue venoso de um doador em tubos de ácido etilenodiaminotetracético (EDTA) (aproximadamente 10 mL por tubo).
- Separe o sangue por centrifugação dos tubos de sangue a 300 x g durante 15 min em RT. Transfira o plasma para tubos de microcentrífuga de 1,5 ml em alíquotas de 1 ml e armazene-o a-80 ° c.
-
Execute a separação de gradiente de densidade.
- Adicione 2 mL de RPMI 1640 a cada tubo sanguíneo e misture bem utilizando uma pipeta serológica.
- Transferir para 3x 50 mL tubos e compõem o volume em cada tubo para 25 mL com RPMI 1640.
- Prepare outro lote de 3x 50 mL de tubos, cada um contendo 20 mL de meio de separação de linfócitos (LSM) (ver a tabela de materiais) na RT. lentamente e suavemente a camada de 25 ml de sangue diluído em cima do LSM para cada um dos três tubos, segurando o tubo em um ângulo de 45 ° .
- Centrifugador a 600 x g durante 25 min a RT com baixa aceleração e sem desaceleração (travão desligado).
-
Realize uma lavagem de células mononucleares do sangue periférico (PBMCs).
- Transfira a camada de células na interface das duas fases líquidas do tubo para um tubo de 50 mL utilizando uma pipeta serológica; Se houver mais de 30 mL de volume, divida-o em dois tubos. Compo o volume em cada tubo a 50 mL com PBS.
- Centrifugue a 700 x g durante 5 min em RT e remova o máximo de sobrenadante possível.
- Ressuscite a pelota e compo o volume a 25 mL com PBS. Centrifugue a 350 x g durante 10 min em RT e remova o máximo de sobrenadante possível.
- Repita o passo de lavagem descrito no passo 4.4.3.
- Ressuspender o pellet em 5 mL de PBS + 2% FBS e contar as células.
5. classificando células inteiras de BAL e PBMCs
Nota: O procedimento a seguir deve ser realizado em condições estéreis em um BSL2 (ou superior).
- Prepare o tampão de ordenação contendo PBS + 5% FBS + 25 mM HEPES (pH 7,4). Prepare 5 mL de tubos de poliestireno de fundo redondo com 1 mL de FBS para a recolha de subconjuntos de células ordenadas.
-
Realize a coloração.
- Prepare 3x 5 mL de tubos de poliestireno de fundo redondo, cada um para BAL (células inteiras ou frações linfóides e mielóides após a adesão) e PBMCs (ver secção 4). Para cada subconjunto, prepare um tubo com células para classificar e dois tubos de 5 x 105 células para usar para controles de compensação de mancha de viabilidade e não manchados.
- Centrifugador a 350 x g durante 5 min a 4 ° c. Retire os sobrenadantes, ressuscitem as células para controles em 100 μL de PBS, e armazená-los a 4 ° c até que os controles de compensação podem ser preparados conforme descrito na etapa 5.2.6.
- Prepare uma diluição 1:20 do reagente de bloqueio do receptor FC (FCR) em PBS + 5% FBS (veja a tabela de materiais-para impedir a ligação inespecíficos do anticorpo a FCR em pilhas FCR-expressando). Ressuscitem as células para classificá-las em 1 x 107 células em 250 μL de mistura de bloqueio de FCR. Incubar-os durante 1 h a 4 ° c.
- Após a incubação, adicione o coquetel de anticorpos apropriado (ver tabela 1) às células e incubar por 1 h a 4 ° c no escuro.
- Após 1 h de coloração, adicione 1 mL de PBS às células e centrifugue a 350 x g durante 5 min a 4 ° c. Remova as células sobrenadantes e ressuscitem no buffer de ordenação para ter 1 x 107 células em 250 ΜL. filtre as células através de um filtro de 70 μm, se necessário.
- Prepare controles de remuneração.
- Adicione três gotas de cada um dos grânulos de compensação de controle IG, κ e negativo do mouse (consulte a tabela de materiais) por 1 ml de PBS em um tubo de microcentrífuga e transfira 100 μl para cada tubo de poliestireno de fundo redondo de 5 ml a ser usado para compensação. Prepare um tubo para cada fluorocromo presente no coquetel a ser usado.
- Adicionar 1 μL de cada anticorpo no cocktail a um tubo diferente contendo grânulos. Adicionar 1 μL de mancha de viabilidade a um dos tubos de 5 x 105 células retiradas no passo 5.2.1. Incubar por 20 min a 4 ° c no escuro.
- Adicionar 1 mL de PBS a cada tubo e centrifugar a 350 x g durante 5 min a 4 ° c. Retire o sobrenadante e ressuscitem o pellet em 250 μL de PBS. Conservar a 4 ° c no escuro até ser necessário.
- Ordenar as células por fluorescência-ativado célula de triagem (FACS) em tubos de coleta preparados com 1 mL de FBS e redemoinho suavemente para revestir os lados dos tubos com soro.
- Classifique as células BAL em baixa pressão. As células da porta primeiro excluem o ruído e incluem células ao vivo, CD45+ , e dentro desta população, as células de dúvida (veja a Figura 3). Dentro da população Myeloid maior classifique CD206 e CD169 pilhas positivas dobro como o AMs; dentro da população menor do linfócito isolam pilhas CD3+ e classificam as únicas populações positivas CD4 e CD8 (veja Figura 3; estratégia de gating detalhada na seção representativa dos resultados).
- Ao classificar PBMCs, as células de portão primeiro para excluir o ruído e incluir ao vivo, CD45+ células, e dentro desta população portão de células de dúvida. Em seguida, portão em células CD3 e dentro do CD3- população, portão primeiro em CD14 e ordenar monócitos único-positivos, e, em seguida, dentro do portão de população CD3+ em CD4 e CD8 e classificar ambas as populações únicas positivas (estratégia de gating detalhado na Seção de resultados representativos.
6. immunophenotyping de AMs e PBMCs
Nota: O procedimento a seguir deve ser realizado condições estéreis em um armário BSL2 (ou superior).
- Adicione até 1 milhão cada um dos AMs e PBMCs a dois tubos de poliestireno de fundo redondo de 5 mL separados. Centrifugador a 300 x g durante 5 min a 4 ° c e retire o sobrenadante.
- Realize o bloqueio do FcR para melhorar a especificidade da coloração do anticorpo. Para isso, Ressuspender as células em 100 μL de PBS + 2% FBS e adicionar 1,4 μL de reagente de bloqueio de FcR. Incubar por 20 min a 4 oC.
-
Realizar coloração extracelular.
- Após a incubação com bloco FcR, adicione o coquetel de anticorpo extracelular desejado, vórtice dos tubos e incubar por 1 h a 4 ° c no escuro.
- Lave 2x adicionando 500 μL de PBS e centrifugação a 350 x g durante 5 min a 4 ° c.
-
Prepare-se para fixação e permeabilização (ver a tabela de materiais para reagentes específicos utilizados).
- Prepare solução de permeabilização com tampão de permeabilização de 1 parte e tampão diluente de 3 partes. Ressuspender o pellet em 1 mL de solução de permeabilização e incubar por 40 min a 4 ° c no escuro.
- Prepare a solução da lavagem usando 1 tampão de lavagem da parte e 4 porções H2O. adicionar 2 ml de solução de lavagem às células permeabilizadas e centrifugar a 350 x g durante 5 min a 4 ° c. Retire o sobrenadante.
-
Realizar coloração intracelular.
- Suspender as células em 100 μL de solução de lavagem 1X, adicionar os anticorpos intracelulares desejados, vórtice dos tubos e incubar por pelo menos 1 h a 4 ° c no escuro.
- Adicionar 2 mL de solução de lavagem e centrifugar a 350 x g durante 5 min em RT. Retire o sobrenadante e resuma o pellet em 200 ΜL de PBS. Guarde as células a 4 ° c no escuro até que seja necessário.
7. restante das células BAL
Nota: O procedimento a seguir deve ser realizado condições estéreis em um armário BSL2 (ou superior).
- Números de células que permitem, criconservpreservam células ao vivo da pelota da célula BAL (da etapa 2.2.2).
- Prepare o meio de congelamento contendo 90% de FBS + 10% de dimetil sulfóxido (DMSO).
- Centrifugue as células a 300 x g durante 10 min a 4 ° c. Retire o sobrenadante e ressuscite em 1,5 mL de meio de congelamento em um frasco criogênico. Transfira os frascos criogênicos para um recipiente de congelamento de taxa controlada (consulte a tabela de materiais) e coloque-os em-80 ° c. Transfira as pilhas ao nitrogênio líquido para o armazenamento a longo prazo uma vez que a temperatura é alcançada.
-
Preservar as células BAL como pelotas secas.
- Transfira as células restantes para um tubo de microcentrífuga de 1,5 mL. Centrifugador em um centrifugador do Counter-top em 6.000 x g por 1 min. Remove tanto sobrenadante como possível sem perturbar a pelota. Conservar o pellet a-80 ° c.
8. DNA do HIV e quantificação do RNA
Nota: O procedimento a seguir deve ser realizado condições estéreis em um armário BSL2 (ou superior).
- Quantificação total do DNA do HIV
- Para evitar a inibição da reacção em cadeia do polymerase (PCR) com restos do lisado do Bal, use um jogo da extração do ADN (veja a tabela dos materiais) para extrair o ADN de uma amostra de pilhas do Bal de acordo com as instruções do fabricante. Use 15 μL deste DNA combinados com uma mistura mestra na etapa de pré-amplificação descrita abaixo (etapa 8.1.3).
- Prepare diluições de curva padrão.
- Como acima, use um kit de extração de DNA para extrair o DNA de uma pelota de 2 x 106 ach-2 células (veja a tabela de materiais).
- Após a eluição do DNA, realize diluições seriadas de 10 vezes do DNA ACH-2 para gerar seis diluições, variando de 3 x 105 células a 3 células por 15 μl.
- Realize uma etapa de pré-amplificação.
- Em uma sala separada, prepare a mistura mestra para amostras n + 2 compreendendo o tampão da polimerase 1x, 3 milímetros de MgCl2, 300 μm dntps, e 2,5 U da polimerase do ADN de Taq (veja a tabela dos materiais) e 300 nanômetro de cada um dos quatro primers (veja Passo 8.1.3.2). Realize todas as medidas em poços triplicados.
- Use primers hCD3OUT5 ', hCD3OUT3 ', ULF1 e UR1 para gerar DNA amplificado tanto do CD3 humano quanto do HIV (ver as sequências na tabela 2). Note-se que ambos os genes são pré-amplificados no mesmo tubo. Misture suavemente e gire para baixo o tubo para garantir a mistura completa.
- Distribuir 35 μL de mistura mestre por poço em uma placa de PCR de 96 poços e adicionar 15 μL de DNA padrão ou de amostra. O volume total de reacção é de 50 μL.
- Realize a pré-amplificação (desnaturação a 95 ° c por 8 min, seguida de 12 ciclos de 95 ° c por 1 min, 55 ° c para 40 s, 72 ° c por 1 min e alongamento a 72 ° c por 15 min).
- Realize PCR em tempo real.
- Para quantificar o DNA do CD3 e do HIV, prepare duas misturas mestras contendo a mistura mestre da reação do PCR 1x (veja a tabela dos materiais), 1.250 primers apropriados do nanômetro, e 100 a ponta de prova do nanômetro. Use primers HCD3IN5 ' e HCD3IN3 ' e sonda CD3 FamZen para quantificar o CD3 humano em uma reação, e primers UR2 e LambdaT e sonda UHIV FamZen para quantificar o DNA do HIV em outra reação (ver as sequências na tabela 2). Distribuir 13,6 μL de cada mistura em tubos adaptados à qPCR.
- Diluir o produto da PCR da pré-amplificação em 1:10 na água estéril, no DNase, no RNase, e na protease livre. Adicionar 6,4 μL de cada amostra diluída a 13,6 μL de mistura de qPCR em tubos adaptados à qPCR para um volume total de reacção de 20 μL.
- Realize a PCR em tempo real usando o seguinte programa: desnaturação a 95 ° c por 4 min e 40 ciclos de 95 ° c para 3 s e 60 ° c para 10 s com aquisição única.
- Extrapolar o número de cópias de HIV e equivalentes de células numéricas em cada tubo de reação das curvas padrão. Calcule o número de cópias do DNA do HIV/106 células.
- Quantificação do RNA do VIH
- Extraia o RNA de uma amostra de células BAL, usando um kit de extração de RNA (veja a tabela de materiais) de acordo com as instruções do fabricante. Use 17 μL deste RNA na transcrição reversa e na etapa de pré-amplificação descrita abaixo (etapa 8.2.4).
- O RNA LTR-gag sintetizado in vitro e precisamente quantificado é utilizado como padrão; é cravado em extrato de RNA doador saudável para normalização GUSB. Prepare seis diluições seriais de 10 vezes deste padrão, correspondendo a 3 x 105 células a três cópias de RNA de LTR-gag em 17 μl.
- Distribuir 17 μL de cada diluição padrão e cada amostra em uma placa do PCR 96-well e tratar as amostras com DNase (veja a tabela dos materiais) por 10 minutos em 25 ° c para remover o ADN genomic do contaminante. Pare a reacção adicionando 2 μL de EDTA de 25 mM e incubar as amostras durante 10 min a 65 ° c.
- Realize a transcrição reversa (RT) e a PCR de pré-amplificação.
- Execute esta etapa usando um kit de RT-PCR de uma etapa (consulte a tabela de materiais) de acordo com as instruções do fabricante. Use primers GUSB para a frente 1, GUSB reverso 1, UR1 e ULF1 para gerar cDNA amplificada de ambos os GUSB humanos como gene de limpeza e RNA de LTR-gag HIV (ver as sequências na tabela 2). Os valores de GUSB serão usados para normalizar os valores de HIV.
- Distribuir 31 μL de mistura mestra por poço na mesma placa PCR 96-well contendo as normas e amostras tratadas com DNase e misturar bem. O volume total de reacção é de 50 μL.
- Executar a placa para 16 ciclos de acordo com as instruções do fabricante, com uma temperatura de recozimento de 55 ° c.
- Realize PCR em tempo real.
- Prepare duas misturas mestras contendo a mistura do mestre da reação do PCR 1x (como acima na etapa 8.1.4.1), 1250 de primers apropriados do nanômetro, e 100 a ponta de prova do nanômetro. Use primers GUSB para a frente 2, GUSB reverso 2, e sonda GUSB-HEX para quantificar GUSB cDNA em uma reação; Use primers UR2, LambdaT e sonda UHIV FamZen para quantificar o cDNA de HIV em outra reação (ver as sequências na tabela 2).
- Distribuir 13,6 μL de cada mistura mestre em tubos adaptados à qPCR. Diluir os produtos de PCR de pré-amplificação RT 1:10 em água estéril, DNase, RNase e protease livre, e adicionar 6,4 μL de cada amostra diluída ou padrão à mistura de PCR adequada. O volume total de reacção é de 20 μL.
- Realize a PCR em tempo real usando o seguinte programa: desnaturação a 95 ° c por 4 min e 40 ciclos de 95 ° c para 3 s e 60 ° c por 10 s com aquisição única (selecione o canal verde para FamZen e amarelo para HEX).
Resultados
Na maioria dos não fumantes, o fluido BAL é recebido em um recipiente estéril e é um líquido levemente turvo amarelo-laranja-colorido. O fluido pode ser Pinker na cor se o doador submeteu-se a biópsias endobrônquicas durante o broncoscopia e algum sangramento ocorreu. O fluido pode ser mais escuro na cor se o doador é um fumante. Após a centrifugação, o sobrenadante BAL será quase claro e ligeiramente laranja, enquanto o pellet celular pode variar em cor de Off-White para marrom muito escuro, dependendo da condição da amostra e se o doador era um fumante ou não.
Ao contar toda a amostra de LBA, diferentes tipos de células podem ser visualizados, incluindo macrófagos maiores e redondos em torno de 17 μm de diâmetro e linfócitos redondos menores em torno de 7,3 μm de diâmetro18,19 (ver Figura 2). Os macrófagos são aumentados em fumantes por cerca de 40%18. A distinção entre os tipos de células permite a contagem dos macrófagos e linfócitos separadamente. Também pode haver alguns detritos visíveis no campo, especialmente em amostras de fumantes. Os macrófagos são o tipo de célula mais abundante no LBA, representando aproximadamente 85% das células em não fumantes20, e eles são enriquecidos em fumantes para que possam parecer quase exclusivos.
As células BAL têm uma tendência para agregar, então eles devem ser misturados bem durante todas as manipulações. A pelota pode parecer escura mesmo depois de várias etapas de lavagem. Se restos filamentosos é evidente na fração após a coloração para a triagem celular, passar as células através de um filtro de 70 μm antes de executá-los através do classificador de células.
A triagem de células BAL deve ser feita a uma baixa pressão para garantir tamanhos de gotas grandes o suficiente para acomodar os macrófagos. As células são primeiro gated para incluir todas as células CD45+21 e, em seguida, com base na viabilidade para garantir que todas as células mortas são excluídas (ver Figura 3). As células singlet são então escolhidas e, dentro disso, duas populações são fechadas com base no tamanho e morfologia, ou seja, células mielóides maiores e linfócitos menores (ver Figura 3). Dentro das células maiores, as células são bloqueadas em CD20622,23 e CD16922 e as células de duplo-positivo são classificadas como AMS, enquanto dentro das células menores, células CD3+ são escolhidos e fechados em CD4 e CD8; Células monopositivas e CD8 únicas CD4 são classificadas (ver Figura 3). Os marcadores utilizados foram escolhidos com base em fenótipos previamente descritos de AMs, como o receptor de manose CD206, encontrado nas células fagocíticas23, e o receptor de sialoaderina CD169,22.
Ao classificar os PBMCs, as células são primeiro bloqueadas na dispersão de frente e de lado, que deve mostrar uma população de linfócitos homogêneo, todos os quais são tomados, excluindo o ruído próximo ao eixo zero (dados não mostrados). A população é bloqueada na viabilidade e CD45, e as células CD45+ ao vivo são usadas. Esta população é então bloqueada no CD3; para isolar monócitos, a população CD3 é posteriormente bloqueada em CD14 e todas as células positivas únicas são classificadas. Para isolar os subconjuntos de linfócitos, as células CD3+ são bloqueadas em CD4 e CD8 e as populações únicas positivas e celulares são classificadas.
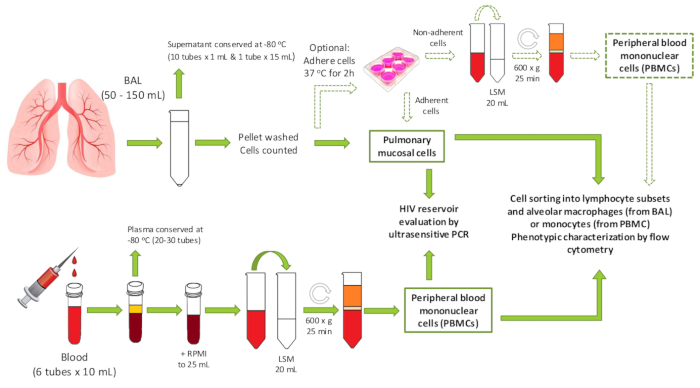
Figura 1 : Visão geral do protocolo. Um esquema mostrando o fluxo de trabalho do protocolo, incluindo potenciais usos downstream das amostras geradas. PBMC = células mononucleares do sangue periférico; LBA = lavado broncoalveolar; LSM = meio de separação do linfócito. Por favor clique aqui para ver uma versão maior desta figura.
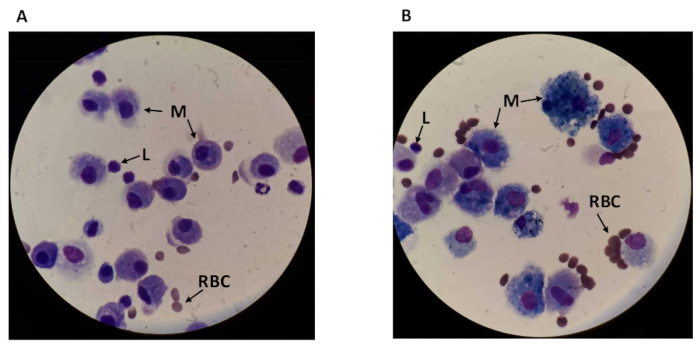
Figura 2 : Opinião do campo do microscópio do líquido inteiro do Bal. Imagens do microscópio de (a) um não fumador e (B) um smoker com linfócitos visíveis (L), macrófagos (M), e glóbulos vermelhos (RBC). A ampliação é 1, 000x (ocular 10x e lente 100x com imersão do óleo). Por favor clique aqui para ver uma versão maior desta figura.
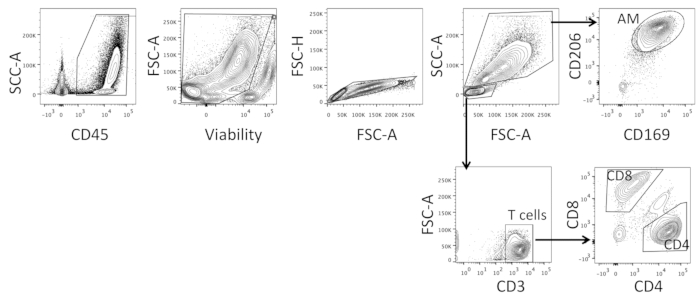
Figura 3 : Estratégia de gating representativa para a classificação da pilha de pilhas inteiras do Bal. Estratégia de gating usada para classificar macrófagos alveolares (AM), CD4, e células T CD8 de amostras inteiras da pilha do BAL. Por favor clique aqui para ver uma versão maior desta figura.
| Amostra | Anticorpo | Fluorochrome | Clone | Volume por teste (μL) |
| BAL e PBMC | Vivo/morto | APC-H7 | - | 1 |
| CD45 | PE-Cy7 | HI30 | 5 | |
| CD3 | Alexa700 | UCHT1 | 2 | |
| CD4 | PE-Cy5 | RPA-T4 | 4 | |
| CD8 | BV605 | SK1 | 3 | |
| Apenas BAL | CD206 | Pe | 19,2 | 10 |
| CD169 | BB515 | 7-239 | 5 | |
| Somente PBMC | CD14 | BV786 | M5E2 | 5 |
Tabela 1: painel de fluxo para a triagem de células BAL inteiras e PBMCs isolados.
| Alvo | Passo | Nome da cartilha | Seqüência de primer | |||
| DNA total do HIV ou RNA de LTR-gag do HIV | PCR pré-amplificação | UR1 | 5 '-CCA TCT CTC TCC TTC TAG C-3 ' | |||
| ULF1 | 5 '-ATG CCA CGT AAG CGA AAC TCT GGG TCT CTC TGG TTA GAC-3 ' | |||||
| PCR em tempo real | UR2 | 5 '-CTG AGG GAT CTC TAG TTA CC-3 ' | ||||
| O LambdaT | 5 '-ATG CCA CGT AAG CGA AAC T-3 ' | |||||
| UHIV FamZen: | 5 '-/56-FAM/CA CTC AAG G/ZEN/C AAG CTT TAT TGA GGC/3IABkFQ/-3 ' | |||||
| DNA CD3 | PCR pré-amplificação | HCD3 para fora 5 ' | 5 '-ACT GAC ATG GAA CAG GGG AAG-3 ' | |||
| HCD3 para fora 3 ' | 5 '-CCA GCT CTG AAG TAG GGA ACA TAT-3 ' | |||||
| PCR em tempo real | HCD3 em 5 ' | 5 '-GGC TAT CAT TCT TCT TCA AGG T-3 ' | ||||
| HCD 3 em 3 ' | 5 '-CCT CTC TTC AGC CAT TTA AGT A-3 ' | |||||
| FamZen CD3: | 5 '-/56-FAM/AG CAG AGA A/ZEN/C AGT TAA GAG CCT CCA T/3IABkFQ/-3 ' | |||||
| RNA GUSB | PCR pré-amplificação | GUSB para a frente 1: | 5 '-ACC TAG AAT CTG CTG GCT ACT A-3 ' | |||
| GUSB reverso 1: | 5 '-GTT CAA ACA GAT CAC ATC CAC ATA C-3 ' | |||||
| PCR em tempo real | GUSB para a frente 2: | 5 '-TGC TGG CTA CTA CTT GAA GAT G-3 ' | ||||
| GUSB reverso 2: | 5 '-CCT TGT CTG CTG CAT AGT TAG A-3 ' | |||||
| GUSB-HEX: | 5 '-/5HEX/TCGCTCACA/ZEN/CCAAATCCTTGGACC/3IABkFQ/-3 ' | |||||
Tabela 2: sequências de primer e sonda para quantificação do DNA e RNA do HIV.
Discussão
Nisto nós descrevemos um método para processar o líquido do BAL para obter pilhas de T CD4 e AMs, ao lado dos PBMCs combinados, que podem ser estudados para investigar o reservatório do HIV dentro dos pulmões. Nós relatamos recentemente na quantificação do ADN do HIV em pilhas de T CD4 das amostras periféricas combinadas do sangue e do BAL, e nosso grupo demonstrou que o HIV é 13 vezes mais abundante em pilhas de T CD4 pulmonaas do que naqueles do sangue periférico15. Entretanto, os níveis de DNA do HIV em AMs são doador-dependentes e assim, até agora, não houve uma correlação consistente entre os níveis de DNA do HIV nos linfócitos comparados aos macrófagos15. O acesso a esses subconjuntos primários de células de macrófago, no entanto, será uma ferramenta vital para interrogar essa questão e obter uma melhor compreensão da carga viral no pulmão no contexto do reservatório do HIV.
Na era pré-arte e em vários outros estudos utilizando o líquido LBA, os participantes realizaram broncoscopia para diagnosticar uma suspeita de patologia ou obter um diagnóstico microbiológico para os sintomas respiratórios3. No entanto, pudemos recrutar participantes sem quaisquer sintomas ou patologias pulmonares ativas e todos os participantes assinaram o termo de consentimento livre e esclarecido15. Fomos capazes de recrutar participantes de nosso centro que participavam de outros estudos, como um estudo de triagem espirometria para doença pulmonar obstrutiva24, bem como aqueles submetidos a outros procedimentos de pesquisa, como leucaferese e Colonoscopia. Pesquisas anteriores entre pessoas vivendo com HIV demonstraram que o altruísmo é um fator-chave motivando a participação em estudos de pesquisa25. Como com muitos espécimes humanos, observamos uma grande quantidade de variabilidade pessoa-a-pessoa. Não havia nenhuma maneira de "prever" a partir do qual os participantes obteríamos BAL com boa versus rendimentos de células pobres. Ao contrário do sangue periférico, que rende números razoavelmente consistentes dos linfócitos, os números de pilha no líquido do BAL são muito variáveis. Injetar um maior volume de soro fisiológico nos pulmões (com a esperança de obter um maior retorno do fluido BAL) nem sempre é possível, pois volumes maiores de soro fisiológico normal são frequentemente associados com mais tosse e maior risco de febre pós-broncoscopia. Observamos que o uso de um broncoscópio de diâmetro menor (em vez de maior) permitiu que o respirologista alcançe mais profundamente os brônquios e obtivesse fluido contendo maiores quantidades de células. Um achado consistente foi que os fumantes de tabaco tinham proporções muito maiores de AMs do que os linfócitos dentro de seu fluido de LBA, o que é esperado como AMs engolfo detritos e material particulado. Além disso, observou-se que o líquido LBA de fumantes continha detritos que podem bloquear o equipamento utilizado, como máquinas de PCR e citometros de fluxo. Problemas semelhantes podem ser observados em áreas de alta poluição ou indivíduos expostos com maior frequência à má qualidade do ar.
No que diz respeito ao seu papel no estabelecimento de reservatórios de HIV e persistência viral, a pureza das células T CD4 e AMs é uma consideração fundamental. Por esta razão, optou-se por usar a triagem celular ativada por fluorescência (FACS) para obter populações de células altamente puras. Também é possível que o fluido de LBA coletado possa estar contaminado com sangue, pois algum sangramento menor é esperado durante uma broncoscopia; a presença de pilhas B ingênuas indicaria esta, e as pilhas podem ser lavadas em uma reserva vermelha do lysis do glóbulo para contornar este problema. Outro desafio com o estudo do fluido BAL refere-se à quantificação de marcadores inflamatórios e citocinas, que são importantes para a compreensão da persistência do HIV26. Como a salina instilada dilui o fluido de LBA, os níveis de mediadores inflamatórios e citocinas podem ser difíceis de medir. Embora um fator de correção da ureia tenha sido proposto para dar conta da diluição, há relativamente pouca literatura descrevendo seu uso27,28.
Os AMs são altamente autofluorescentes, o que representa um problema durante a triagem celular e análise fenotípica de citometria de fluxo. Em particular, o efeito é mais pronunciado em fumantes cujo AMs pode ser completamente de cor preta, afetando significativamente a sua autofluorescência. Quando excitado por um laser azul padrão de 488 nm, o autofluorescence do am está em seu pico em aproximadamente 540 nanômetro, que se sobrepõe com os espectros da fluorescência de conjugados comumente usados tais como FITC e PE29,30. Vale a pena notar que dois lasers separados podem ser usados para excitar FITC e PE (por exemplo, PE pelo amarelo/verde e FITC pelo laser azul 488). Para superar o autofluorescence inerente com FITC, nós usamos o AMs unmanchado para determinar o fundo do autofluorescence. Além disso, o uso de fluorescência menos um (FMO) controles pode ser muito útil para combater essas questões técnicas. Os grânulos maiores (por exemplo, 7,5 μm) podem ser usados, que são mais próximos no tamanho para compensar populações do macrófago, comparados aos grânulos menores (por exemplo, 3,0 μm), que podem ser usados para compensar populações do linfócito. Uma aproximação ainda mais apropriada seria usar uma fração pequena das pilhas como os controles da único-mancha, usando um marcador conhecido, altamente expressado no subconjunto, tal como HLA-DR ou CD45, conjugados a cada um dos fluorochromes desejados, que permitisse muito mais compensação exata do que pode ser conseguido com grânulos. No caso de amostras de fumantes, essa tática é particularmente útil, pois os macrófagos são muito maiores e mais autofluorescentes. Além disso, a partir da etapa de preparo, toda a amostra de LBA poderia ser cultivada em uma placa antes da triagem, conforme descrito na seção 3 do protocolo, para permitir a separação das populações por adesão. Desta forma, os macrófagos aderentes podem ser isolados de outras células não aderentes, como os linfócitos. A compensação é muito menos desafiadora se o linfócito e as populações de AM são separadas um pouco do que examinadas junto; no entanto, depender da adesão resultará em uma perda de macrófagos, que é uma consideração importante quando os números das células já estão limitando. Além disso, uma etapa de adesão pode resultar na ativação indesejada de monócitos aderentes, o que pode afetar os resultados a jusante gerados usando essas células. O valor de classificar eficientemente pilhas em populações mais puros deve ser pesado de encontro à limitação de ter menos tais pilhas para experiências subseqüentes.
Outros modelos, mais notavelmente modelos murinos, têm sido utilizados para estudar as características imunológicas do macrófago e a biologia. Embora esses modelos sejam extremamente úteis e permitam uma grande percepção de um tipo de célula que é difícil de manipular, eles têm limitações. Muitos dos marcadores de superfície da pilha variam entre ratos e seres humanos tais que o immunophenotype do AMs humano não é compreendido completamente. No entanto, este sistema de modelo requer o agrupamento de vários camundongos para ensaios devido aos baixos números de células disponíveis de cada animal. Além disso, a necessidade de agrupamento de espécimes impede considerações de predisposição genética e sexo. Recentemente, tem sido demonstrado que o sexo desempenha um papel na infectividade dos macrófagos pelo HIV-1 devido à expressão díspares do fator de restrição SAMHD-131. Os primatas não humanos (NHP) representam o modelo mais próximo para os seres humanos e facilitaram o estudo da infecção pelo vírus da imunodeficiência simiana (SIV) e seu efeito sobre o sistema imunológico, proporcionando uma visão sobre o papel dos macrófagos residentes no tecido em comparação com macrófagos derivados de monócitos. Em macaques do rhesus, foi mostrado igualmente que os isolados do macrófago do pulmão do BAL abrigam um vírus replicação-competente; um ensaio de conseqüência viral (voa) foi usado para analisar o comportamento do SIV em pilhas tecido-residentes32. Tal achado é de valor de pesquisa significativo, mas ainda deve ser validado em humanos antes que possa ser aplicado, e o alto custo do uso de NHPs impede o uso de grandes populações amostrais. Além disso, o AMs humano será útil para muitas outras aplicações, como ensaios de infecção viral/microbiana in vitro e em estudos de outros patógenos, como a co-infecção tuberculose/HIV.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores gostariam de reconhecer seus financiadores: os institutos canadenses de pesquisa em saúde (CIHR) (subvenção #153082 ao CC, MAJ, NC); o Réseau SIDA et doenças infectieuses du Fonds de recherche du Québec-Santé (FRQ-S) que concedeu financiamento à CC e Maj e à faculdade de medicina da Universidade McGill, que concedeu financiamento ao CC. Este estudo também foi apoiado em parte os institutos canadenses de pesquisa em saúde (CIHR)-financiado Canadian HIV Cure Enterprise (CanCURE) Team Grant HB2-164064 para MAJ, CC e NC. A MAJ detém a cadeira de pesquisa CIHR Canada Tier 2 em Imunovirologia e CC e NC mantêm um prêmio de salário de pesquisa FRQ-S Junior 1 e Junior 2, respectivamente. ET detém um prêmio RI-MUHC Studentship MSc.
Além disso, os autores gostariam de reconhecer Josée Girouard e todos os funcionários clínicos envolvidos na coordenação e obtenção das amostras, bem como os terapeutas respiratórios; Ekaterina Iourtchenko, Hélène pagé-Veillette, e Marie-Hélène Lacombe na plataforma de immunophenotyping de RI-MUHC; e Dr. Marianna Orlova para a provisão das fotos da microscopia. Mais importante ainda, os autores desejam agradecer aos muitos voluntários sem os quais esta pesquisa não seria possível.
Materiais
| Name | Company | Catalog Number | Comments |
| 70 µm Sterile Cell Strainer | Fisher Scientific | 22363548 | Nylon mesh filters with 70 µm pores to remove impurities from BAL sample before sorting |
| ACH-2 Cells | NIH | 349 | HIV-1 latent T cell clone with one integrated proviral copy which do not express CD4 |
| BD FACSAria | BD Biosciences | N/A | Cell sorter (configured to detect 16 colours simultaneously) |
| BD LSRFortessa X-20 | BD Biosciences | N/A | Flow cytometer (configured to detect 14 colours simultaneously) |
| Bronchoscope | Olympus | BF-1TH190 | EEIII HD therapeutic bronchoscope; channel width 2.8 mm; outer diameter 6.0 mm |
| Cell Disassociation Solution | Sigma | C5914 | Non-enzymatic formulation for gently dislodging adherent cell types from plastic or glass surfaces. |
| CD169 BB515 | BD Biosciences | 565353 | Sialic acid-binding molecule antibody used for flow cytometry |
| CD14 BV786 | BD Biosciences | 563698 | Endotoxin receptor antibody used for flow cytometry |
| CD206 PE | BD Biosciences | 555954 | Mannose receptor antibody used for flow cytometry |
| CD3 Alexa700 | BD Biosciences | 557943 | T cell co-receptor antibody used for flow cytometry |
| CD4 PE-Cy5 | BD Biosciences | 555348 | T cell co-receptor antibody used for flow cytometry |
| CD45 PE Cy-7 | BD Biosciences | 557748 | Receptor-linked protein tyrosine phosphatase antibody used for flow cytometry |
| CD8 BV605 | BD Biosciences | 564116 | T cell co-receptor antibody used for flow cytometry |
| CompBead Plus | BD | 560497 | Anti-mouse Ig, κ and negative control polystyrene microparticles used to optimize fluorescence compensation in flow cytometry |
| DNase I | Invitrogen | 18068015 | Digests single- and double-stranded DNA to oligodexyribonuleotides containing a 5' phosphate to remove contamination from RNA |
| dNTP Set 100 mM | Invitrogen | 10297-018 | Consists of four deoxynucleotides (dATP, dCTP, dGTP, dTTP) for use in PCR |
| Dimethyl Sulfoxide (DMSO) | Sigma | D8418 | Apolar, protic solvent used to make media for cryopreserving live cells |
| EDTA | Invitrogen | AM9912 | Used to stop Dnase I enzyme activity |
| FBS | Wisent Bioproducts | 080-150 | Premium fetal bovine serum to supplement media |
| FcR Blocking Reagent, Human | Miltenyi | 130-059-901 | Binds to Fc receptor on the cell surface to prevent non-specific binding of flow antibodies |
| FlowJo v10 | FlowJo LLC | N/A | Flow cytometry analysis software used for all analyses |
| HLA-DR BV650 | BD Biosciences | 564231 | MHC class II cell surface receptor antibody used for flow cytometry |
| HyClone HEPES solution | Fisher Scientific | SH3023701 | Buffer providing maintenance of physiological pH |
| Live/Dead APC-H7 | Invitrogen | L34975 | Viability marker used for flow cytometry |
| Lymphocyte Separation Medium (LSM) | Wisent Bioproducts | 350-000-CL | Polysucrose for isolation of PBMC from whole blood |
| Mr. Frosty Freezing Container | ThermoFisher | 5100-0001 | Freezing container ensuring rate of cooling very close to -1 °C/min, the optimal rate for cell preservation |
| OneComp eBeads | Invitrogen | 01-1111-41 | Anti-mouse, rat and hamster antibodies for compensation of PBMC samples |
| PBS 1x | Wisent Bioproducts | 311-010-CL | Phosphate buffered saline for cell washing and staining |
| PCR Tubes Corbett Rotor-Gene | Axygen | PCR-0104-C | 4-strip PCR tubes with 0.1 mL capacity for use with Corbett Rotor-Gene |
| PerfeCTa qPCR ToughMix | Quantabio | 95112 | 2x concentrated ready-to-use reaction cocktail for PCR amplification of DNA templates |
| QiaAmp DNA Mini Kit | Qiagen | 51304 | Kit for isolation of genomic, mitochondrial, bacterial, parasite or viral DNA. Includes QIAamp Mini Spin Columns, QIAGEN Proteinase K, Reagents, Buffers, Collection Tubes |
| RNeasy Mini Kit | Qiagen | 74104 | Kit for purification of up to 100 µg total RNA from cells, tissues, and yeast. Includes RNeasy Mini Spin Columns, Collection Tubes, RNase-free Reagents and Buffers |
| Rotor-Gene Q | Qiagen | 9001550 | Real-time PCR cycler |
| RPMI 1640 1x | Wisent Bioproducts | 350-000-CL | Cell culture media |
| Sterile Water | Wisent Bioproducts | 809-115-CL | DNase, RNase & protease free |
| Superscript™ III One-Step RT-PCR System | Invitrogen | 12574018 | RT-PCR kit which performs both cDNA synthesis and PCR amplification in a single tube. Includes SuperScript III RT/Platinum Taq Mix, 2x Reaction Mix (containing 0.4 mM of each dNTP, 3.2 mM MgSO4), magnesium sulfate |
| Taq DNA Polymerase | Invitrogen | 18038-042 | Thermostable enzyme that synthesizes DNA from single-stranded templates in the presence of dNTPs and a primer. Includes Taq DNA Polymerase, 10x PCR buffer, magnesium chloride |
| Transcription Factor Buffer Set | BD Biosciences | 562725 | Buffers for intracellular staining for flow cytometry. Includes fixation/permeabilization buffer, diluent buffer, perm/wash buffer |
| Trypan Blue | Sigma | T8154 | Viability dye to count cells using haemacytometer |
Referências
- Chun, T. W., Fauci, A. S. Latent reservoirs of HIV: obstacles to the eradication of virus. Proceedings of the National Academy of Sciences of the United States of America. 96, 10958-10961 (1999).
- Finzi, D., et al. Latent infection of CD4+ T cells provides a mechanism for lifelong persistence of HIV-1, even in patients on effective combination therapy. Nature Medicine. 5, 512-517 (1999).
- Costiniuk, C. T., Jenabian, M. A. The lungs as anatomical reservoirs of HIV infection. Reviews in Medical Virology. 24, 35-54 (2014).
- Center for Disease Control and Prevention. A cluster of Kaposi's sarcoma and Pneumocystis carinii pneumonia among homosexual male residents of Los Angeles and Orange Counties, California. Morbidity and Mortality Weekly Report. 31, 305-307 (1982).
- Fitzpatrick, M., Crothers, K., Morris, A. Future directions: lung aging, inflammation, and human immunodeficiency virus. Clinics in Chest Medicine. 34, 325-331 (2013).
- Kunisaki, K. M. Will expanded ART use reduce the burden of HIV-associated chronic lung disease?. Current Opinion in HIV and AIDS. 9, 27-33 (2014).
- World Health Organization. . WHO | Tuberculosis and HIV. , (2018).
- Jambo, K. C., et al. Small alveolar macrophages are infected preferentially by HIV and exhibit impaired phagocytic function. Mucosal Immunology. 7, 1116-1126 (2014).
- Yeligar, S. M., et al. Dysregulation of Alveolar Macrophage PPARγ, NADPH Oxidases, and TGFβ. AIDS Research and Human Retroviruses. 33, 1018-1026 (2017).
- Cribbs, S. K., Lennox, J., Caliendo, A. M., Brown, L. A., Guidot, D. M. Healthy HIV-1-infected individuals on highly active antiretroviral therapy harbor HIV-1 in their alveolar macrophages. AIDS Research and Human Retroviruses. 31, 64-70 (2015).
- Holt, P. G., et al. Extraction of immune and inflammatory cells from human lung parenchyma: evaluation of an enzymatic digestion procedure. Clinical & Experimental Immunology. 66, 188-200 (1986).
- Brenchley, J. M., et al. High frequencies of polyfunctional HIV-specific T cells are associated with preservation of mucosal CD4 T cells in bronchoalveolar lavage. Mucosal Immunology. 1, 49 (2007).
- Mwandumba, H. C., et al. Mycobacterium tuberculosis; Resides in Nonacidified Vacuoles in Endocytically Competent Alveolar Macrophages from Patients with Tuberculosis and HIV Infection. The Journal of Immunology. 172, 4592 (2004).
- Gordon, S. B., et al. Inhaled delivery of 23-valent pneumococcal polysaccharide vaccine does not result in enhanced pulmonary mucosal immunoglobulin responses. Vaccine. 26, 5400-5406 (2008).
- Costiniuk, C. T., et al. HIV persistence in mucosal CD4+ T cells within the lungs of adults receiving long-term suppressive antiretroviral therapy. AIDS. 32, 2279-2289 (2018).
- American Thoracic Society. . American Thoracic Society - Bronchoalveolar Lavage. , (2004).
- King, T. E. . Basic principles and technique of bronchoalveolar lavage - UpToDate. , (2018).
- Lea, S., Dungwa, J., Ravi, A., Singh, D. Alveolar macrophage size is increased in COPD patients compared to controls. European Respiratory Journal. 50, (2017).
- Kuse, R., Schuster, S., Schübbe, H., Dix, S., Hausmann, K. Blood lymphocyte volumes and diameters in patients with chronic lymphocytic leukemia and normal controls. Blut. 50, 243-248 (1985).
- Heron, M., et al. Bronchoalveolar lavage cell pattern from healthy human lung. Clinical & Experimental Immunology. 167, 523-531 (2012).
- Rheinländer, A., Schraven, B., Bommhardt, U. CD45 in human physiology and clinical medicine. Immunology Letters. 196, 22-32 (2018).
- Yu, Y. R. A., et al. Flow Cytometric Analysis of Myeloid Cells in Human Blood, Bronchoalveolar Lavage, and Lung Tissues. American Journal of Respiratory Cell and Molecular Biology. 54, 13-24 (2015).
- Geiser, M. Update on Macrophage Clearance of Inhaled Micro- and Nanoparticles. Journal of Aerosol Medicine and Pulmonary Drug Delivery. 23, 207-217 (2010).
- Costiniuk, C. T., et al. Prevalence and predictors of airflow obstruction in an HIV tertiary care clinic in Montreal, Canada: A cross sectional study. HIV Medicine. , (2019).
- Balfour, L., et al. Altruism motivates participation in a therapeutic HIV vaccine trial (CTN 173). AIDS Care. 22, 1403-1409 (2010).
- Vandergeeten, C., Fromentin, R., Chomont, N. The role of cytokines in the establishment, persistence and eradication of the HIV reservoir. Cytokine & Growth Factor Reviews. 23, 143-149 (2012).
- Rennard, S. I., et al. Estimation of volume of epithelial lining fluid recovered by lavage using urea as marker of dilution. Journal of Applied Physiology (1985). 60, 532-538 (1986).
- Twigg, H. L., et al. Effect of highly active antiretroviral therapy on viral burden in the lungs of HIV-infected subjects. The Journal of Infectious Diseases. 197, 109-116 (2008).
- Duan, M., et al. Distinct Macrophage Subpopulations Characterize Acute Infection and Chronic Inflammatory Lung Disease. The Journal of Immunology. 189, 946 (2012).
- Garn, H. Specific aspects of flow cytometric analysis of cells from the lung. Experimental and Toxicologic Pathology. 57, 21-24 (2006).
- Szaniawski, M. A., Spivak, A. M., Bosque, A., Planelles, V. Sex influences SAMHD1 activity and susceptibility to HIV-1 in primary human macrophages. The Journal of Infectious Diseases. , (2018).
- Avalos, C. R., et al. Quantitation of Productively Infected Monocytes and Macrophages of Simian Immunodeficiency Virus-Infected Macaques. Journal of Virology. 90, 5643-5656 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados