Method Article
기관지 충혈 유체 및 폐포 대식세포 및 CD4+ T 세포 면역체노티핑 및 HIV 저수지 평가를 위한 일치하는 혈액 처리
* 이 저자들은 동등하게 기여했습니다
요약
우리는 폐 HIV 저수지를 평가하기 위하여 항레트로바이러스 치료에 만성 HIV 에 감염된 개별에게서 기관지 정맥 세척 액 및 일치한 말초 혈액을 처리하는 방법을 기술합니다. 이러한 방법은 초과민성 중합효소 연쇄 반응에 의한 면역phenotyping 및 HIV DNA/RNA 정량화에 사용될 수 있는 고순도 CD4 T 세포 및 폐포 대식세포의 획득을 초래한다.
초록
기관지 내시경 검사는 정상적인 식염수가 기관지 경을 통해 폐에 주입 된 다음 흡입이 적용되어 기관지 용포 (BAL) 유체를 제거하는 의료 절차입니다. BAL 유체는 세포가 풍부하고 따라서 폐 면역 밀리외의 '스냅 샷'을 제공 할 수 있습니다. CD4 T 세포는 가장 특징이 가장 좋은 HIV 저장소이며, 폐포 대식세포(AMS)를 포함한 조직 대식세포가 바이러스 성 저수지역할을 한다는 강력한 증거가 있습니다. 그러나 HIV 저수지 설립 및 유지 보수의 맥락에서 AM의 역할에 대해서는 아직 많이 알려지지 않았습니다. 따라서, 바이러스학 및 면역학적 분석에서 사용될 수 있는 세포를 얻기 위해 BAL 유체를 처리하기 위한 프로토콜을 개발하여 폐 내의 세포 집단 및 하위 집합을 특성화하고 평가하는 것은 HIV와 같은 폐의 역할을 이해하는 데 관련이 있습니다. 저수지. 본 명세서에서, 우리는 간단한 원심분리 및 유세포측정과 같은 표준 기술을 채택하는 이러한 프로토콜을 기술한다. CD4 T 세포 및 AMS는 면역phenotyping 및 HIV DNA 및 RNA 정량화를 포함하는 후속 응용을 위해 사용될 수 있습니다.
서문
HIV 감염에 대한 치료법에 직면한 가장 중요한 과제 중 하나는 항레트로바이러스 요법(ART)1,2의중단에 따라 혈장 비혈증의 반동을 유발하는 잠복 HIV 저장소의 존재이다. 장기 ART 도중 HIV 저장소는 이차 림프기관, 창자 관련 림프조직 (GALT) 및 중추 신경계 (CNS)를 포함하여 몇몇 조직 구획에서 잘 문서화되는 동안, 폐는 연구 의 지역으로 간과되었습니다 사전 예술 시대 이후3. 그러나, 폐는 HIV의 병인에 있는 중앙 역할을 합니다. 실제로, 폐 증상은 에이즈 관련 기회 감염의 첫 번째 지표중 하나였다 4. 현대 미술 시대에도 HIV를 가진 사람은 HIV가없는 사람보다 전염성 및 비 감염성 폐 질환을 일으킬 위험이 더 큽습니다. 예를 들면, HIV 감염을 가진 사람은 침략적인 연쇄상 구균 폐염 감염, 만성 폐쇄성 폐 질환(COPD) 5,6에대한 높은 위험에 있습니다. 게다가, 결핵 (TB)와 HIV의 공동 감염은 HIV에 감염된 개별이 HIV가없는 사람 보다는 결핵이 있기 위하여 확률이 16-27 시간 확률이 높기 때문에 세계의 특정 지역, 특히, 사하라 사막 이남아프리카에 있는 중요한 공중 위생 도전입니다 7. 폐 감염 및 만성 질환에 대한 이 감수성에 대한 몇가지 설명이 제안되었지만 8,9,10,HIV를 억제한 개인이 정확한 세포 메커니즘을 제안했습니다. 플라즈마 바이러스 하중은 폐 합병증에 대한 위험이 완전히 해명되지 않은 높은 위험에 남아있다. 중요한 것은, HIV는 흡연 상태 6와 무관하게 폐 감염 및만성 질환에 대한 매우 강력한 위험 인자입니다.
따라서 폐의 면역 환경 분석은 건강과 질병에서의 역할을 이해하는 데 중요합니다. 비록 비침습적, 유도된 가래 견본은 희소한 폐 림프구및 아무 AMS를 가진 상피 세포 및 파편의 다량을 포함하는 경향이 있습니다, 특정 응용에 그들의 역할을 제한하는. 반대로, 조직의 큰 생검은 중요한 출혈과 기흉 (폐의 붕괴)의 관련 위험으로 인해 의심되는 질병의 부재에서 얻을 수 없습니다. 게다가, 폐 면역 세포의 대다수는 폐가 호흡 도중 항원에 의해 지속적으로 자극되는 점막 수준에 주로 있습니다. 이를 위해, BAL 유체를 얻기 위한 기관지 내시경 검사는 림프구 및 AMS에 비교적 안전한 접근을 제공하는 장점이 있다(도 1참조). 대식세포는 BAL 액체 내의 세포의 가장 큰 비율을 구성하고, 림프구11에선행됩니다. 따라서, BAL 유체가 면역phenotyping, 세포 배양, 전사체 학, 또는 임의의 추가 응용 프로그램과 같은 후속 응용 프로그램에서 사용하기 위해 처리 될 수있는 방법을 확립하는 것이 유용하다. 여기에 설명된 BAL 유체를 처리하기 위한 프로토콜은 이전에 설명된 일반적인 절차로부터 채택되고 채택된 다양한 다운스트림 분석에 최적화됩니다. 이 방법론은 그들의 현상형 및 기능적 특성화에 대한 폐 림프성 및 골수성 점막 면역 세포 둘 다의 격리를 허용할 뿐만 아니라 HIV에 감염된 성인의 HIV 저수지에 대한 평가를 가능하게 합니다.
이 프로토콜을 확립하기 위해, 우리는 연구 참가자를 모집하기 위해 다음과 같은 기준을 사용15. 참가자가 이 연구에 참여할 자격이 되려면 다음 기준을 충족하는 HIV 감염 개인이어야 했습니다. (2) 최소 3년 동안 억제된 바이러스 부하(VL); (3) ≥200/mm3의CD4 T 세포 수; (4) 연구 폐활량 및 기관지 내시경 검사를 기꺼이 받아야합니다. 다음 기준을 가진 환자는 연구에서 제외되었다: (1) 기관지 내시경 검사에 금기사항; (2) 높은 출혈 위험: coagulopathy 또는 와파린 또는 클로피도그렐 치료에; (3) 혈소판 감소증 (낮은 혈소판); (4) 활성 폐 감염 또는 다른 급성 폐 과정; (5) 임신/임신 을 시도하는 경우.
프로토콜
이 연구 프로토콜은 헬싱키 선언에 포함 된 원칙에 따라 직접 설립되었으며 맥길 대학 보건 센터 (RI-MUHC, #15-031)의 기관 검토 위원회로부터 승인을 받았습니다. 몬트리올 (UQAM, #602) 및 센터 드 레체르체 뒤 센터 병원 드 l'Université 드 몬트리올 (CR-CHUM, #15-180).
1. 기관지 벌레 세척
참고: 이 섹션에서는 호흡기 치료사16,17의도움을 받아 허가받은 호흡보호구 전문의가 수행한 기관지 내시경 검사에 대해 설명합니다.
- 기관지 내시경과 식염수를 포함하여 절차에 필요한 장치의 조각을 준비합니다. 환자의 목 뒤쪽에 마취 스프레이를 투여하십시오. 가능하면 국소 마취를 과도하게 사용하지 마십시오. 심장 리드를 가슴에 적용하여 심장 포화도를 모니터링하기 위해 손의 첫 번째 손가락에 심박수와 리듬및 산소 프로브를 모니터링합니다. 추가 산소를 제공하기 위해 콧구멍에 비강 캐뉼라를 삽입하십시오.
- 환자를 위치, 바람직하게는 척추 위치에. 다음과 같이 침전을 투여하십시오 : midazolam 0.01-0.04 mg / kg 및 펜타닐 50-100 μg (환자의 편안함을 촉진하고 기침 반사를 최소화하기 위해) 호흡학자 또는 마취전문의가있는 경우 정맥 내.
- 유연한 기관지 내시경이 원하는 하위 세그먼트 기관지에서 쐐기될 때까지 진행합니다. 주사기로 식염수 (한 번에 50-60 mL)를 주입한 다음 부드러운 흡입 (50-80 mmHg)을 적용하십시오. 세척액은 주사기에 수집한 다음 수집 용기로 옮겨집니다.
- 총 200-300 mL의 세척을 반복합니다. 가능하면 BAL 유체를 최소 100 mL 이상 수집하십시오.
- BAL 유체를 얼음 위에 놓습니다.
2. BAL 세포의 격리
참고: 다음 절차는 생물학적 안전 캐비닛, 클래스 II (BSL2) 이상에서 멸균 조건하에서 수행되어야합니다.
-
BAL 샘플이 처리될 때까지 얼음 위에 보관하십시오.
- 원래 수집 튜브에서 BAL을 소용돌이시키고 혈청 학적 파이펫을 사용하여 50 mL 튜브로 옮김. BAL 유체가 필라멘트 조직에 의해 매우 혼탁하거나 오염된 것처럼 보이는 경우, 70 μm 나일론 메쉬 필터를 통해 유체를 새로운 50 mL 튜브로 필터링합니다.
- 200 x g에서 4 °C에서 10 분 동안 원심 분리기. 상급체를 새로운 50 mL 튜브로 옮김. 피펫 팁으로 펠릿을 부드럽게 부수고 RPMI 1640 배지의 1 mL로 다시 놓습니다.
- 상급체의 1 mL을 각각 10x 1.5 mL 미세원원지 튜브 및 나머지 상급튜브 15 mL, 각각 10 mL로 이송한다. 모든 상급 튜브를 -80°C에서 보관하십시오.
-
BAL 세포 펠릿을 처리합니다.
- 원래 샘플의 25 mL마다 RPMI 1640의 10 mL에서 펠릿을 다시 일시 중단하십시오. 200 x g에서 4 °C에서 10 분 동안 원심 분리기. 상급체를 새로운 15 mL 튜브로 옮기십시오 (펠렛에 충분한 세포가 있는지 확인 한 후 폐기하십시오).
- RPMI 1640 + 10% 태아 소 혈청 (FBS)의 1 mL에 펠릿을 다시 중단하고 트라이판 블루와 혈세포계를 사용하여 계산합니다.
참고: BAL 유체가 분류되기 전에 세포의 순차성에 의해 분리되지 않은 경우, 섹션 4로 진행한다.
3. BAL 세포의 준수 (선택 사항)
참고: 이러한 대체 프로토콜은 세포 정렬 전이나 대신에 수행될 수 있다. 다음 절차는 BSL2 캐비닛(또는 그 이상)의 멸균 조건하에서 수행되어야 합니다.
- 새로운 15 mL 튜브로 분류하기 위해 원하는 BAL 셀 수를 전송하고 1.5 x 106 대식세포 / mL에 대한 올바른 볼륨을 구성합니다. 플레이트 2 mL의 세포는 6웰 플레이트에서 웰당 5% CO2로 37°C에서 2시간 동안 배양하고, 준수시간을 허용한다.
- 배양 후, 조심스럽게 부착되지 않은 세포를 포함하는 매체를 흡인하고 15 mL 튜브로 옮김을 전달합니다. 실온(RT)에서 10분 동안 300 x g의 원심분리기. 상급체를 제거하고 인산완충식염수(PBS) + 2% FBS에서 1 x 107 셀/mL에서 재중단하고 서스펜션을 5 mL 둥근 바닥폴리스티렌 튜브로 옮김을 옮니다. 이 림프구 분획은 이제 세포 정렬을 위해 얼룩을 지을 준비가되었습니다.
- 플레이트의 나머지 부착 세포에, 세포 분리 용액의 웰 당 1 mL을 추가하고 (재료 표참조) 5 % CO2로 37°C에서 적어도 15 분 동안 배양하고, 세포가 파이펫 팁으로 플레이트에서 쉽게 분리 될 때까지.
- 피펫 팁을 사용하여 잘 표면에서 부착 된 세포를 부드럽게 철저히 긁어 내고, 분리를 돕기 위해 우물에서 1 mL의 액체를 사용합니다. 세포를 새로운 15 mL 튜브로 옮김. 1 mL의 PBS로 우물을 씻고 동일한 튜브에 추가하십시오. PBS로 튜브의 함량을 5 mL로 구성합니다.
- RT에서 10 분 동안 300 x g의 원심 분리기를 제거하고 1 x 107 셀 / mL PBS + 2 % FBS에서 다시 일시 중단하고 5 mL 둥근 바닥 폴리스티렌 튜브로 현탁액을 옮김을 옮김. 이 골수성 분획은 이제 세포 선별을 위해 얼룩을 지을 준비가 되었습니다.
4. 말초 혈액 단핵 세포의 격리
참고: 다음 절차는 BSL2 캐비닛(또는 그 이상)의 멸균 조건하에서 수행되어야 합니다.
- 기관지 내시경 검사의 같은 날에 (일반적으로 BAL 수집 직전에), 에틸렌디아민테트라 아세트산 (EDTA) 튜브 (튜브 당 약 10 mL)에서 기증자로부터 정맥 혈액 6 관을 얻습니다.
- RT에서 15 분 동안 300 x g에서 혈액 튜브를 원심 분리하여 혈액을 분리. 1 mL aliquots에 1.5 mL 미세 원심 분리 튜브로 혈장 옮기고 -80 °C에 저장하십시오.
-
밀도 그라데이션 분리를 수행합니다.
- 각 혈액 튜브에 RPMI 1640 의 2 mL을 추가하고 혈청 피펫을 사용하여 잘 섞습니다.
- 3x 50 mL 튜브로 전송하고 RPMI 1640으로 각 튜브의 부피를 25 mL로 구성합니다.
- RT에서 20mL의 림프구 분리 매체(LSM)를 함유한 3x 50mL 튜브를 다시 준비합니다(재료 표참조). .
- RT에서 600 x g의 원심분리기는 낮은 가속과 감속(브레이크 오프)이 없는 RT에서 25분 동안 사용할 수 있습니다.
-
말초 혈액 단핵 세포 (PBMC)의 세척을 수행합니다.
- 혈청학적 피펫을 사용하여 튜브 내의 두 액체 상계에서 50 mL 튜브로 세포층을 전달하는 단계; 부피가 30 mL 이상이면 두 개의 튜브로 나눕니다. PBS로 각 튜브의 부피를 50 mL까지 구성합니다.
- RT에서 5 분 동안 700 x g의 원심 분리기를 제거하고 가능한 한 많은 상급을 제거하십시오.
- 펠릿을 다시 일시 중단하고 PBS로 25 mL까지 볼륨을 구성하십시오. RT에서 10 분 동안 350 x g의 원심 분리기를 제거하고 가능한 한 많은 상급을 제거하십시오.
- 4.4.3단계에서 설명한 세척 단계를 반복합니다.
- PBS + 2 % FBS의 5 mL에서 펠릿을 다시 중단하고 세포를 계산합니다.
5. 전체 BAL 세포 및 PBMC 분류
참고: 다음 절차는 BSL2 (이상)의 멸균 조건하에서 수행되어야합니다.
- PBS + 5% FBS + 25 mM HEPES (pH 7.4)를 포함하는 정렬 버퍼를 준비합니다. 정렬 된 셀 하위 세트의 수집을위한 FBS의 1 mL와 5 mL 바닥 폴리스티렌 튜브를 준비합니다.
-
얼룩을 수행합니다.
- BAL (순조 후 전체 세포 또는 림프구 및 골수성 분획) 및 PBMC (섹션 4 참조)에 대해 각각 3x 5 mL 바닥 폴리스티렌 튜브를 준비하십시오. 각 서브세트에 대해 분류할 셀이 있는 튜브 1개와 얼룩이 없고 생존 가능 얼룩 보정 컨트롤에 사용할 5 x 105 셀의 튜브 2개를 준비합니다.
- 4 °C에서 5 분 동안 350 x g의 원심 분리기. 상피제를 제거하고, PBS의 100 μL에서 제어를 위해 세포를 재중단하고, 5.2.6단계에서 설명한 바와 같이 보상 대조군을 제조할 수 있을 때까지 4°C에 저장한다.
- PBS + 5% FBS에서 Fc 수용체(FcR) 차단 시약의 1:20 희석을 준비한다(재료 표참조 -FcR 발현 세포상에서 FcR에 대한 항체의 비특이적 결합을 방지한다). FcR 차단 혼합물의 250 μL에서 1 x 107 셀에서 그들을 분류하기 위해 세포를 다시 중단시다. 4 °C에서 1 시간 동안 배양하십시오.
- 배양 후, 적절한 항체 칵테일을 세포에 첨가하고(표 1참조)을 넣고 어둠 속에서 4°C에서 1시간 동안 배양한다.
- 염색 1 시간 후, 4 °C에서 5 분 동안 350 x g에서 세포및 원심 분리기에 1 mL의 PBS를 추가하십시오. 250 μL에 1 x 107 셀을 가지고 선별 버퍼에서 상류 및 재 중단 세포를 제거. 필요한 경우 70 μm 필터를 통해 세포를 필터링합니다.
- 보상 컨트롤을 준비합니다.
- 미원지소 튜브에서 PBS 1 mL당 마우스 Ig, θ 및 음극 대조보상 비드(재료 표참조)를 각각 3방울씩 떨어뜨리고, 각 5 mL 의 둥근 바닥 폴리스티렌 튜브에 100 μL을 전달하여 보상을 위해 사용한다. 사용할 칵테일에 존재하는 각 불소화에 대해 하나의 튜브를 준비한다.
- 칵테일에 각 항체의 1 μL을 구슬을 함유하는 다른 튜브에 추가합니다. 5.2.1 단계에서 따로 설정된 5 x 105 셀의 튜브 중 하나에 1 μL의 생존 성 얼룩을 추가합니다. 어둠 속에서 4 °C에서 20 분 동안 배양하십시오.
- 각 튜브에 1 mL의 PBS를 추가하고 4 °C에서 5 분 동안 350 x g에서 원심 분리기를 추가하십시오. 상급체를 제거하고 PBS의 250 μL에서 펠릿을 다시 일시 중단합니다. 필요할 때까지 4°C의 어두운 환경에서 보관하십시오.
- 형광 활성화 세포 선별 (FACS)에 의해 세포를 FBS 1 mL로 제조 된 수집 튜브로 분류하고 부드럽게 소용돌이하여 튜브의 측면을 혈청으로 코팅합니다.
- 저압에서 BAL 셀을 정렬합니다. 게이트 셀은 먼저 노이즈를 배제하고 라이브, CD45+ 셀을 포함하며, 이러한 모집단 게이트 내에서 이중 셀을 아웃한다(도 3참조). 더 큰 골수성 집단 내 정렬 CD206 및 CD169 이중 양성 세포로서; 더 작은 림프구 집단 내에서 CD3+ 세포를 분리하고 CD4 및 CD8 단일 양성 집단을 모두 정렬한다(대표적인 결과 섹션에 상세히 기술된 게이팅전략 참조).
- PBMC를 정렬할 때, 게이트 셀은 먼저 노이즈를 배제하고 라이브, CD45+ 셀을 포함하고, 이 모집단 게이트 내에서 더블트 셀을 포함한다. 다음으로, CD3 세포와 CD3 내의 게이트- 모성, CD14의 게이트 를 먼저 정렬하고 단일 양성 단핵구를 정렬한 다음 CD4 및 CD8의 CD3+ 인구 게이트 내에서 단일 양성 집단을 정렬하고 단일 양성 집단(게이팅 전략에 상세히 설명된 게이팅 전략)을 정렬합니다. 대표 결과 섹션.
6. AMS 및 PBMC의 면역 체형
참고: 다음 절차는 BSL2 캐비닛(또는 그 이상)의 멸균 조건하에서 수행되어야 합니다.
- 두 개의 별도의 5 mL 라운드 바닥 폴리스티렌 튜브에 각각 1백만 개의 AM과 PBMC를 추가합니다. 300 x g에서 4°C에서 5분 동안 원심분리기를 제거하고 상위를 제거한다.
- 항체 염색의 특이성을 향상시키기 위해 FcR 차단을 수행한다. 이를 위해, PBS + 2% FBS의 100 μL에서 세포를 재중단하고 FcR 차단 시약의 1.4 μL을 추가한다. 4o C에서 20 분 동안 배양하십시오.
-
세포외 염색을 수행합니다.
- FcR 블록을 사용하여 인큐베이션한 후, 원하는 세포외 항체 칵테일을 추가하고, 튜브를 소용돌이치며, 어둠 속에서 4°C에서 1시간 동안 배양한다.
- PBS 500 μL을 추가하고 4 °C에서 5 분 동안 350 x g에서 원심 분리하여 2 x 씻어.
-
고정 및 투과를 준비하십시오(사용된 특정 시약에 대한 재료 표 참조).
- 1개의 부품 투과 버퍼와 3개의 파트 희석제 버퍼로 투과 솔루션을 준비합니다. 펠릿을 1 mL의 투과 액으로 다시 중단하고 어둠 속에서 4 °C에서 40 분 동안 배양하십시오.
- 1 부분 세척 버퍼와 4 부분 H2O. 4 °C에서 5 분 동안 350 x g에서 350 x g에서 투과 세포 및 원심 분리기에 2 mL의 세척 용액을 추가하여 세척 용액을 준비하십시오. 상급체를 제거합니다.
-
세포내 염색을 수행합니다.
- 1x 세척 용액의 100 μL에서 세포를 다시 중단하고, 원하는 세포 내 항체를 추가하고, 튜브를 소용돌이시키고, 어둠 속에서 4 °C에서 적어도 1 시간 동안 배양하십시오.
- RT에서 5분 동안 350 x g에 2 mL의 세척 용액과 원심 분리기를 추가하십시오. 필요할 때까지 세포를 4°C의 어두운 환경에서 보관하십시오.
7. BAL 세포의 나머지
참고: 다음 절차는 BSL2 캐비닛(또는 그 이상)의 멸균 조건하에서 수행되어야 합니다.
- 허용되는 세포 수, BAL 세포 펠릿으로부터의 냉동 보존 (단계 2.2.2로부터).
- 90% FBS + 10% 디메틸 설폭사이드(DMSO)를 함유하는 동결 매체를 준비한다.
- 4 °C에서 10 분 동안 300 x g에서 세포를 원심 분리합니다. 상류를 제거하고 극저온 바이알에 동결 매체의 1.5 mL에서 다시 중단. 극저온 바이알을 제어 속도의 동결 용기로 옮기고 (재료 표참조) -80°C에 놓습니다. 온도에 도달하면 장기 저장을 위해 세포를 액체 질소로 옮깁니다.
-
BAL 세포를 마른 펠릿으로 보존하십시오.
- 나머지 세포를 1.5 mL 미세 원심 분리튜브로 옮김. 카운터 탑 원심분리기의 원심분리기는 6,000 x g에서 1분 동안 1분 동안 제거합니다. 펠릿을 -80°C에서 보관하십시오.
8. HIV DNA 및 RNA 정량화
참고: 다음 절차는 BSL2 캐비닛(또는 그 이상)의 멸균 조건하에서 수행되어야 합니다.
- 총 HIV DNA 정량화
- BAL 용해 물질 파편이있는 중합효소 연쇄 반응 (PCR)의 억제를 피하려면 DNA 추출 키트 (재료 표참조)를 사용하여 제조업체의 지침에 따라 BAL 세포 샘플에서 DNA를 추출하십시오. 이 DNA의 15 μL을 아래에 기술된 전암화 단계에서 마스터 믹스와 결합하였다(단계 8.1.3).
- 표준 곡선 희석을 준비합니다.
- 위와 같이, DNA 추출 키트를 사용하여 2 x 106 ACH-2 세포의 펠릿에서 DNA를 추출합니다(재료 표참조).
- DNA의 용출 후, ACH-2 DNA의 직렬 10 배 희석을 수행하여 15 μL 당 3 세포에 3 x 105 세포에 이르기까지 6 개의 희석을 생성합니다.
- 사전 증폭 단계를 수행합니다.
- 별도의 방에서, 1x 폴리머라제 완충제, MgCl 2의 3 mM,300 μM dNTPs 및 2.5 U의 타크 DNA 폴리머라제(재료 표참조) 및 4개의 프라이머 각각의 300nM으로 구성된 n+2 샘플에 대한 마스터 믹스를 준비합니다(참조) 8.1.3.2단계)를 참조하십시오. 세 배 우물에서 모든 측정을 수행합니다.
- 프라이머 hCD3OUT5', hCD3OUT3', ULF1 및 UR1을 사용하여 인간 CD3 및 HIV 모두에서 증폭된 DNA를 생성합니다(표 2의서열 참조). 두 유전자는 동일한 튜브에서 미리 증폭됩니다. 부드럽게 혼합하고 완전한 혼합을 보장하기 위해 튜브를 아래로 회전.
- 96웰 PCR 플레이트에 잘 당 35 μL의 마스터 믹스를 분배하고 표준 또는 샘플 DNA 15 μL을 추가합니다. 총 반응 량은 50 μL입니다.
- 전암화(8분 동안 95°C에서 변성, 1분 동안 95°C, 40초동안 55°C, 72°C에서 15분 동안 72°C에서 연신)을 수행한다.
- 실시간 PCR을 수행합니다.
- CD3 및 HIV DNA를 정량화하려면 1x PCR 반응 마스터 믹스(재료 표참조), 1,250 nM 적절한 프라이머 및 100 nM 프로브를 포함하는 2개의 마스터 믹스를 준비합니다. 프라이머 HCD3IN5' 및 HCD3IN3'과 프로브 CD3 FamZen을 사용하여 한 반응에서 인간 CD3를 정량화하고, 프라이머 UR2 및 람다T 및 프로브 UHIV FamZen은 다른 반응에서 HIV DNA를 정량화합니다(표 2의서열을 참조). qPCR 적응 튜브에 각 혼합물의 13.6 μL을 분배합니다.
- 멸균수, DNase, RNase 및 프로테아제 프리에서 1:10에 전암화 PCR 제품을 희석합니다. 20 μL의 총 반응 볼륨에 대한 qPCR 적응 튜브에 qPCR 믹스의 13.6 μL에 각 희석 샘플의 6.4 μL을 추가합니다.
- 다음 프로그램을 사용하여 실시간 PCR을 수행합니다: 단일 획득으로 95°C에서 4분 동안, 40사이클의 95°C에서 3s 및 60°C의 경우 10초동안 변성합니다.
- 표준 곡선에서 각 반응 튜브의 HIV 사본 및 셀 수 등가물의 수를 추정합니다. HIV DNA 사본/106개의 세포 수를 계산합니다.
- HIV RNA 정량화
- 제조업체의 지침에 따라 RNA 추출 키트(재료 표참조)를 사용하여 BAL 세포 샘플에서 RNA를 추출합니다. 아래에 기술된 역전사 및 전암화 단계에서 이 RNA의 17 μL을 사용한다(단계 8.2.4).
- LTR-개그 RNA는 시험관 내에서 합성되고 정밀하게 정량화되어 표준으로 사용된다; 그것은 GUSB 정상화를 위한 건강한 기증자 RNA 추출물로 급증합니다. 17 μL에서 LTR 개그 RNA의 3 개의 사본에 3 x 105 세포에 해당하는 이 표준의 6 개의 직렬 10 배 희석을 준비하십시오.
- 96웰 PCR 플레이트에 각 표준 희석 및 각 시료의 17 μL을 분배하고 오염 물질 게놈 DNA를 제거하기 위해 25°C에서 10분 동안 DNase(재료 표참조)로 시료를 처리합니다. 25 mM EDTA의 2 μL을 첨가하여 반응을 멈추고 65 °C에서 10 분 동안 샘플을 인큐베이션하십시오.
- 역전사(RT) 및 전암화 PCR을 수행합니다.
- 제조업체의 지침에 따라 1단계 RT-PCR 키트(재료 표참조)를 사용하여 이 단계를 수행합니다. 프라이머 를 사용하여 1, GUSB 역1, UR1, 및 ULF1 하우스 키핑 유전자 및 LTR 개그 HIV RNA로 인간 GUSB 모두에서 증폭 된 cDNA를 생성 (표 2의 서열을 참조). GUSB 값은 HIV 값을 정규화하는 데 사용됩니다.
- DNase 처리 된 표준 및 샘플을 포함하는 동일한 96 웰 PCR 플레이트에 잘 당 31 μL의 마스터 믹스를 분배하고 잘 혼합하십시오. 총 반응 량은 50 μL입니다.
- 제조업체의 지침에 따라 55°C의 어닐링 온도로 16사이클 동안 플레이트를 실행합니다.
- 실시간 PCR을 수행합니다.
- 1x PCR 반응 마스터 믹스(단계 8.1.4.1), 1250 nM 적절한 프라이머 및 100 nM 프로브를 포함하는 2개의 마스터 믹스를 준비한다. 프라이머 를 사용하여 GUSB 앞으로 2, GUSB 역2, 프로브 GUSB-HEX는 하나의 반응에서 GUSB cDNA를 정량화; 프라이머 UR2, LambdaT 및 프로브 UHIV FamZen을 사용하여 다른 반응에서 HIV cDNA를 정량화합니다(표 2의서열 참조).
- 각 마스터 믹스의 13.6 μL을 qPCR 적응 튜브에 분배합니다. RT 전증폭 PCR 제품을 멸균수, DNase, RNase 및 프로테아제 프리에서 1:10희석하고, 각 희석시료 또는 표준의 6.4 μL을 적절한 PCR 혼합물에 첨가합니다. 총 반응 량은 20 μL입니다.
- 다음 프로그램을 사용하여 실시간 PCR을 수행합니다: 단일 획득으로 4분 동안 95°C, 95°C의 40사이클, 10초의 경우 60°C의 변성(FAmZen의 경우 녹색 채널 선택, HEX의 경우 노란색).
결과
대부분의 비흡연자에서 BAL 유체는 멸균 용기에 들어있으며 약간 혼탁한 황색-주황색 액체입니다. 기증자가 기관지 내시경 검사 도중 내막염 생검을 겪고 몇몇 출혈이 생기는 경우에 액체는 색깔에 있는 분홍색일지도 모릅니다. 기증자가 흡연자인 경우에 액체는 색깔에서 더 진할 수 있습니다. 원심 분리 후, BAL 상층은 거의 명확하고 약간 주황색이 될 것이며, 세포 펠릿은 샘플의 상태와 기증자가 흡연자인지 여부에 따라 오프 화이트에서 매우 어두운 갈색까지 색상이 다양할 수 있습니다.
전체 BAL 샘플을 계수할 때, 직경 17 μm 의 더 크고 둥근 대식세포를 포함하여 다른 세포 유형을 가시화할수 있으며, 직경 18,19에서 약 7.3 μm의 작은 둥근 림프구가 있다(도 2참조). 대식세포는 흡연자에서 약 40%18로확대됩니다. 세포 모형 사이 구별은 대식세포와 림프톨을 따로 계산하는 것을 허용합니다. 또한 특히 흡연자의 샘플에서 현장에서 볼 수있는 일부 파편이있을 수 있습니다. 대식세포는 BAL에서 가장 풍부한 세포 유형으로, 비흡연자20의세포의 약 85%를 차지하며 흡연자에서 풍부하게 함유되어 거의 배타적인 것처럼 보일 수 있습니다.
BAL 세포는 집계하는 경향이 있으므로 모든 조작 중에 잘 혼합되어야합니다. 펠릿은 몇 번의 세척 후에도 어둡게 나타날 수 있습니다. 필라멘트 파편이 세포 선별을 위해 염색 한 후 분획에서 분명한 경우, 세포 선별기를 통해 실행하기 전에 70 μm 필터를 통해 세포를 통과하십시오.
BAL 세포의 선별은 대식세포를 수용할 수 있을 만큼 큰 액적 크기를 보장하기 위해 저압에서 이루어져야 합니다. 셀은 먼저 모든 CD45+21 셀을 포함하도록 게이트된 다음 모든 죽은 셀이 제외되도록 하는 생존 가능성에 기초하여(그림 3참조). 싱글 트 세포는 다음 선택 하 고이 내에서, 두 인구크기와 형태, 즉 더 큰 골수 성 세포와 작은 림프구에 따라 게이트 (그림 3참조). 더 큰 세포 내에서, 세포는 CD20622,23 및 CD16922에 게이트되고 이중 양성 세포는 AMS로 분류되고, 더 작은 세포 내에서, CD3+ 세포는 CD4 및 CD8에 선택되고 게이트됩니다; CD4 단일 양성 및 CD8 단일 양성 세포가 정렬됩니다(그림 3참조). 사용된 마커는 식세포(23) 및 시아로드헤신 수용체 CD16922에서발견되는 만노수용체CD206과 같은 종족의 이전에 설명된 표현형에 기초하여 선택되었다.
PBMC를 정렬할 때 셀은 먼저 전방 및 측면 산란에 게이트되며, 이는 동종 림프구 모집단을 보여주며, 모두 0축에 가까운 노이즈를 제외하고(데이터는 표시되지 않음)를 제외합니다. 인구는 생존 가능성과 CD45에 문이 있으며, 라이브 CD45+ 세포가 사용됩니다. 이 인구는 다음 CD3에 게이트; 단핵구를 분리하기 위해, CD3- 집단은 이후 CD14에 문이 게이트되고 모든 단일 양성 세포가 정렬됩니다. 림프구 서브세트를 분리하기 위해 CD3+ 세포는 CD4 및 CD8에 문이 정립되고 단일 양성 및 세포 집단이 모두 정렬됩니다.
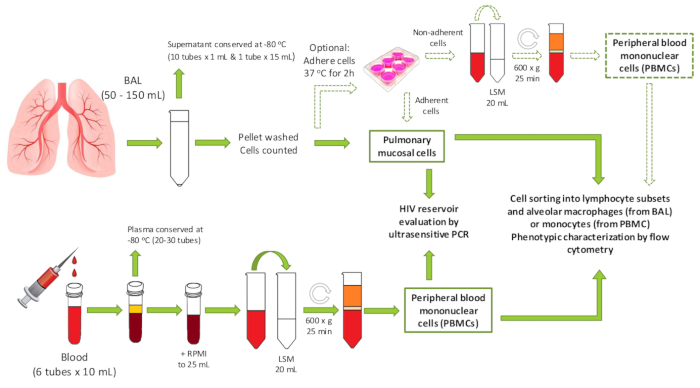
그림 1 : 프로토콜 개요. 생성된 샘플의 잠재적다운 다운스트림 사용을 포함하여 프로토콜의 워크플로우를 보여주는 회로도입니다. PBMC = 말초 혈액 단핵 세포; BAL = 기관지 세척제; LSM = 림프구 분리 배지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
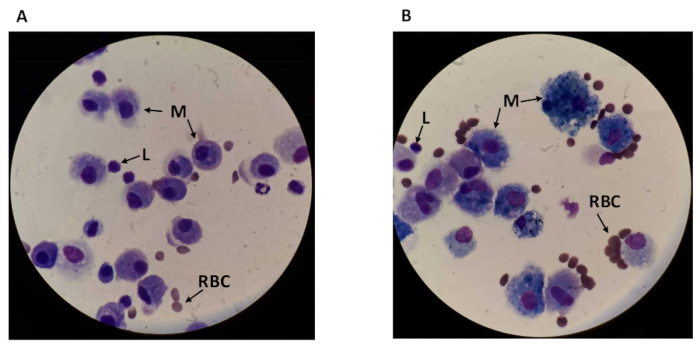
그림 2 : 전체 BAL 유체의 현미경 시야. 현미경 이미지 (A) 비흡연자 및(B)눈에 보이는 림프구 (L), 대식세포 (M) 및 적혈구 (RBC)를 가진 흡연자. 배율은 1,000x (오일 침지 100x 안구 및 100x 렌즈)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
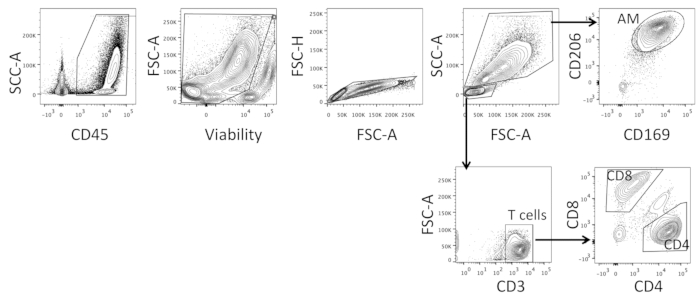
그림 3 : 전체 BAL 세포의 세포 선별을 위한 대표적인 게이팅 전략. 전체 BAL 세포 샘플로부터 폐포 대식세포(AM), CD4 및 CD8 T 세포를 분류하는 데 사용되는 게이팅 전략. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 샘플 | 항 체 | 불소크롬 | 복제 | 테스트당 부피(μL) |
| 발 및 PBMC | 라이브/데드 | APC-H7 | - | 1개 |
| CD45 | PE-Cy7 | HI30 | 5개 | |
| CD3 | 알렉사700 | 우흐트1 | 2개 | |
| CD4 | PE-cy5 | RPA-T4 | 4개 | |
| CD8 | BV605 | SK1 | 3개 | |
| BAL 전용 | CD206 | Pe | 19.2 | 10개 |
| CD169 | BB515 | 7-239 | 5개 | |
| PBMC 전용 | CD14 | BV786 | M5E2 | 5개 |
표 1: 전체 BAL 세포 및 단리된 PBMC의 선별을 위한 유동 패널.
| 대상 | 단계 | 프라이머 이름 | 프라이머 시퀀스 | |||
| HIV 총 DNA 또는 HIV LTR-개그 RNA | 사전 증폭 PCR | UR1 | 5'-CCA TCT CTC TC TTC 태그 C-3' | |||
| ULF1 | 5'ATG CCA CGT AAG CGA AAC TCT TCT TC TGG TTA GAC-3' | |||||
| 실시간 PCR | UR2 | 5'-CTG AGG CTC 태그 TTA CC-3' | ||||
| 람다트 (주) | 5'-ATG CCA CGT AAG CGA AAC T-3' | |||||
| UHIV 팜젠: | 5'/56-FAM/CA CTC AAG G/ZEN/C CTT TAT TGA GGC/3IABkFQ/-3' | |||||
| CD3 DNA | 사전 증폭 PCR | HCD3 아웃 5' | 5'ACT GAC ATG GAA CAG GGG AAG-3' | |||
| HCD3 아웃 3' | 5'-CCA GCT CTG AAG 태그 GGA ACA TAT-3' | |||||
| 실시간 PCR | HCD3 in 5' | 5'-GGC TAT 고양이 TCT TCA AGG T-3' | ||||
| HCD 3 in 3' | 5'-CCT CTC TTC AGC CAT TTA AGT A-3' | |||||
| CD3 팜젠: | 5'/56-FAM/AG CAG AGA A/ZEN/C AGT 타아 개그 CCT CCA T/3IABkFQ/-3' | |||||
| GUSB RNA | 사전 증폭 PCR | GUSB 앞으로 1: | 5'-ACC 태그 AAT CTG CTG GCT ACT A-3' | |||
| GUSB 리버스 1: | 5'- GTT CAA ACA 가트 CAC ATC CAC ATA C-3' | |||||
| 실시간 PCR | GUSB 앞으로 2: | 5'-TGC TGG CTA CTT GAA G-3' | ||||
| GUSB 리버스 2: | 5'- CCT TGT CTG CTG CAT AGT 태그 A-3' | |||||
| GUSB-헥스: | 5'/5HEX/TCGCTCACA/ZEN/CCAAATCCTTGGACC/3IABkFQ/-3' | |||||
표 2: HIV DNA 및 RNA 정량화를 위한 프라이머 및 프로브 서열.
토론
본 명세서에서 우리는 DC4 T 세포 및 AMS를 얻기 위해 BAL 유체를 처리하는 방법을 설명하고, 일치하는 PBMC와 함께, 이는 폐 내의 HIV 저장소를 조사하기 위해 연구될 수 있다. 우리는 최근에 일치하는 말초 혈액 및 BAL 견본에서 CD4 T 세포에 있는 HIV DNA 정량화에 보고하고, 우리의 단은 HIV가 말초 혈액15에서그들에서 보다는 폐 CD4 T 세포에서 13 시간 더 풍부하다는 것을 보여주었습니다. 그러나, AMS에서 HIV DNA의 수준은 기증자 의존적이기 때문에, 지금까지, 대식세포15에비해 림프구에서 HIV DNA 수준 사이의 일관된 상관관계가 없었다. 이 1 차적인 대식세포 세포 서브세트에 접근은, 그러나, 이 질문을 심문하고 HIV 저수지의 맥락에서 폐에 있는 바이러스성 짐의 더 나은 이해를 얻는 중요한 공구일 것입니다.
사전 ART 시대와 BAL 유체를 이용한 여러 다른 연구에서 참가자들은 의심되는 병리학을 진단하거나 호흡기 증상에 대한 미생물 학적진단을 얻기 위해 기관지 내시경 검사를 받았다 3. 그러나, 우리는 어떤 적극적인 폐 현상 또는 병리 없이 참가자를 모집할 수 있었고, 모든 참가자는 윤리적 동의서15에서명했습니다. 폐성 폐질환 폐질환 24에 대한 폐활량측정검사 연구와 백혈구,백혈병 등 다른 연구 절차를 밟고 있는 분과등 다른 연구에 참여하고 있는 우리 센터의 참가자를 모집할 수 있었습니다. 대장 내시경 검사. HIV에 살고 있는 사람들 사이에서 이전 연구는 이타주의가 연구 결과에 참여를 동기를 부여하는 중요한 요인이다는 것을 보여주었습니다25. 많은 인간 표본과 마찬가지로, 우리는 사람 대 사람의 가변성의 큰 거래를 지적했다. 참가자들이 좋은 세포 수율과 가난한 세포 수율로 BAL을 얻을 수있는 "예측"할 수있는 방법은 없었습니다. 림프구의 상당히 일관된 수를 산출하는 말초 혈액과는 달리, BAL 액체에 있는 세포 수는 아주 가변적입니다. 폐에 정상 식염수의 더 큰 볼륨을 주입 (BAL 액체의 더 큰 반환을 얻기의 희망) 정상 식염수의 큰 볼륨은 종종 더 많은 기침과 발열 후 경검사의 높은 위험과 연관되어 있기 때문에 항상 가능하지 않습니다. 우리는 더 작은 (보다는 오히려 더 큰) 직경 기관지 경을 사용하여 호흡보호구가 기관지안으로 더 깊이 도달하고 세포의 다량을 포함하는 액체를 장악하는 것을 가능하게 했다는 것을 것을을 발견했습니다. 일관된 사실 인정은 담배 흡연자가 그들의 BAL 액체 내의 림프구 보다는 AM의 훨씬 더 큰 비율이 있었다는 것을, AMS가 파편과 미립자 물질을 삼키기 때문에 예상됩니다. 또한 흡연자의 BAL 유체에는 PCR 기계 및 유동 세포계와 같은 사용 장비를 차단할 수 있는 파편이 포함되어 있는 것으로 관찰되었습니다. 오염이 높은 지역이나 열악한 대기 질에 더 자주 노출되는 사람에서도 비슷한 문제가 발생할 수 있습니다.
HIV 저장소 및 바이러스 성 지속성의 설치에 그들의 역할에 관하여, CD4 T 세포와 AMS의 순도는 중요 한 고려 사항. 이러한 이유로, 우리는 고도로 순수한 세포 인구를 얻기 위하여 형광 활성화세포 분류 (FACS)를 이용하기로 결정했습니다. 그것은 또한 수집 된 BAL 액체 일부 사소한 출혈 기관지 내 시경 동안 예상 으로 혈액으로 오염 될 수 있습니다.; 순진한 B 세포의 존재는 이것을 나타낼 것이고, 세포는 이 문제를 우회하기 위하여 적혈구 lysis 완충액에서 세척될 수 있습니다. BAL 액체를 공부하는 또 다른 도전은 HIV 지속성을 이해하는 것이 중요한 선동적인 마커 및 사이토카인을 정량화하는 관련됩니다26. 주입된 식염수는 BAL 액체를 희석하기 때문에, 염증성 매개체 및 사이토카인의 수준은 측정하기 어려울 수 있습니다. 우레아 보정 계수는 희석을 설명하기 위해 제안되었지만, 그사용(27,28)을설명하는 문헌은 상대적으로 적다.
AMS는 세포 선별 및 유세포 분석 중에 문제를 제기하는 매우 자동 형광성입니다. 특히, 그 AMS는 크게 자신의 자기 형광에 영향을 미치는 색상이 완전히 검은 될 수 있습니다 흡연자에서 효과가 더 두드러집니다. 표준 블루 488 nm 레이저에 의해 흥분될 때, AM 자동 형광은 FITC 및 PE29,30과같은 일반적으로 사용되는 접합체의 형광 스펙트럼과 겹치는 약 540 nm에서 절정에 있습니다. 두 개의 별도 레이저가 FITC 및 PE를 자극하는 데 사용될 수 있다는 점은 주목할 가치가 있습니다 (예 : 파란색 488 레이저에 의한 노란색 / 녹색 및 FITC에 의한 PE). FITC를 통해 내재된 자가형광을 극복하기 위해 스테인드되지 않은 AM을 사용하여 자동 형광 배경을 결정했습니다. 또한 형광에서 FMO(1개) 컨트롤을 사용하는 것은 이러한 기술적 문제에 대처하는 데 매우 유용할 수 있습니다. 더 큰 구슬(예를 들어, 7.5 μm)은 림프구 집단을 보상하는 데 사용할 수 있는 더 작은 구슬(예: 3.0 μm)에 비해 대식세포 집단을 보상하기 위한 크기가 더 가깝습니다. 더욱 적합한 접근법은 HLA-DR 또는 CD45와 같은 서브셋에 공지된 고도로 발현된 마커를 사용하여, 단일 얼룩 대조군으로서 세포의 작은 부분을 사용하는 것이며, 이는 훨씬 더 많은 것을 허용할 수 있는 각각의 원하는 형광화에 컨쥬게이징된다. 구슬로 얻을 수 있는 것보다 정확한 보상을 받을 수 있습니다. 흡연자의 샘플의 경우, 이 전술은 대식세포가 훨씬 더 크고 더 많은 자가 형광으로 특히 유용합니다. 또한, 제제 단계로부터, 전체 BAL 샘플은 프로토콜의 섹션 3에 기재된 바와 같이 정렬하기 전에 플레이트에서 배양될 수 있으며, 준수에 의해 집단의 분리를 허용할 수 있다. 이러한 방식으로, 부착 대식세포는 림프구와 같은 다른 비부착 세포로부터 분리될 수 있다. 보상은 림프구와 AM 인구가 함께 검사하는 것보다 분리되는 경우에 훨씬 더 도전적입니다; 그러나, 준수에 의존하는 것은 세포 수가 이미 제한될 때 중요한 고려 사항인 대식세포의 손실을 초래할 것입니다. 또한, 준수 단계는 이러한 세포를 사용하여 생성 된 다운 스트림 결과에 영향을 미칠 수있는 부착 단핵구의 원치 않는 활성화를 초래할 수 있습니다. 순수한 인구로 세포를 효율적으로 분류의 가치는 후속 실험을 위해 더 적은 그 같은 세포를 갖는의 제한에 대하여 무게를 달아야 합니다.
그밖 모형, 특히 murine 모형은, 대식세포 면역학 특성 및 생물학을 공부하기 위하여 이용되었습니다. 이러한 모델은 매우 유용하고 조작하기 어려운 세포 유형에 대한 훌륭한 통찰력을 허용하지만 한계가 있습니다. 많은 세포 표면 마커는 인간 AMS의 면역 표현형이 완전히 이해되지 않도록 마우스와 인간 사이에서 변화합니다. 그러나, 이 모형 시스템은 각 동물에게서 유효한 낮은 세포 수 때문에 실험실험을 위한 몇몇 마우스의 풀링을 요구합니다. 또한, 표본을 풀의 필요성은 유전 적 소인과 섹스의 고려를 배제. 최근에는 삼HD-131의이질적인 발현으로 인해 HIV-1에 의한 대식세포의 감염에 성역할이 있는 것으로 나타났다. 비인간 영장류(NHP)는 인간에게 가장 가까운 모델을 나타내며, 시미안 면역 결핍 바이러스(SIV) 감염과 면역 계통에 미치는 영향에 대한 연구를 촉진하여 조직 상주 대식세포의 역할에 대한 통찰력을 제공합니다. 단핵구 유래 대식세포. rhesus 원숭이에서, 그것은 또한 폐 대 식 세포 BAL 항구에서 격리 복제 유능한 바이러스; 바이러스 성 아웃성장 분석(VOA)을 조직 상주세포(32)에서SIV의 거동을 분석하는데 사용되었다. 이러한 발견은 상당한 연구 가치이지만 적용되기 전에 인간에서 여전히 검증되어야하며 NHP를 사용하는 높은 비용은 큰 샘플 집단의 사용을 배제합니다. 또한, 인간 AMS는 시험관 내 바이러스/미생물 감염 검사와 같은 다른 많은 응용 분야와 결핵/HIV 공동 감염과 같은 다른 병원체의 연구에서 유용할 것입니다.
공개
저자는 공개 할 것이 없다.
감사의 말
저자는 그들의 기금을 인정하고 싶습니다: 건강 연구의 캐나다 학회 (CIHR) (CC에 #153082 부여, MAJ, NC); 레소 SIDA 에 질병 감염은 CC와 MAJ와 CC에 자금을 부여 의학의 맥길 대학 학부에 자금을 부여 레소 SIDA 에 질병 감염 뒤 퐁 드 레쉐 뒤 퀘벡 - 산테 (FRQ-S). 이 연구는 또한 부분적으로 지원 되었다 건강 연구의 캐나다 연구소 (CIHR)-자금 캐나다 HIV 치료 기업 (CanCURE) 팀 그랜트 HB2 – 164064 MAJ, CC 및 NC. MAJ는 면역바이러스학과 CC에서 CIHR 캐나다 연구 의자 2등급을 보유하고 있으며 NC는 FRQ-S 주니어 1과 주니어 2 연구 급여 상을 각각 보유하고 있습니다. ET는 RI-MUHC 학생 학 석사 상을 개최.
또한, 저자는 호세 지루어와 호흡 치료사뿐만 아니라 샘플을 조정하고 획득에 관련된 모든 임상 직원을 인정하고 싶습니다; RI-MUHC 면역페노티핑 플랫폼에서 에카테리나 이우르첸코, 헬렌 파제-베일레트, 마리-헬렌 라콤베; 그리고 마이크로 스카널 사진의 제공에 대한 마리아나 Orlova 박사. 가장 중요한 것은, 저자는이 연구가 가능하지 않을 것이다 누구없이 많은 자원 봉사자에게 감사하고 싶다.
자료
| Name | Company | Catalog Number | Comments |
| 70 µm Sterile Cell Strainer | Fisher Scientific | 22363548 | Nylon mesh filters with 70 µm pores to remove impurities from BAL sample before sorting |
| ACH-2 Cells | NIH | 349 | HIV-1 latent T cell clone with one integrated proviral copy which do not express CD4 |
| BD FACSAria | BD Biosciences | N/A | Cell sorter (configured to detect 16 colours simultaneously) |
| BD LSRFortessa X-20 | BD Biosciences | N/A | Flow cytometer (configured to detect 14 colours simultaneously) |
| Bronchoscope | Olympus | BF-1TH190 | EEIII HD therapeutic bronchoscope; channel width 2.8 mm; outer diameter 6.0 mm |
| Cell Disassociation Solution | Sigma | C5914 | Non-enzymatic formulation for gently dislodging adherent cell types from plastic or glass surfaces. |
| CD169 BB515 | BD Biosciences | 565353 | Sialic acid-binding molecule antibody used for flow cytometry |
| CD14 BV786 | BD Biosciences | 563698 | Endotoxin receptor antibody used for flow cytometry |
| CD206 PE | BD Biosciences | 555954 | Mannose receptor antibody used for flow cytometry |
| CD3 Alexa700 | BD Biosciences | 557943 | T cell co-receptor antibody used for flow cytometry |
| CD4 PE-Cy5 | BD Biosciences | 555348 | T cell co-receptor antibody used for flow cytometry |
| CD45 PE Cy-7 | BD Biosciences | 557748 | Receptor-linked protein tyrosine phosphatase antibody used for flow cytometry |
| CD8 BV605 | BD Biosciences | 564116 | T cell co-receptor antibody used for flow cytometry |
| CompBead Plus | BD | 560497 | Anti-mouse Ig, κ and negative control polystyrene microparticles used to optimize fluorescence compensation in flow cytometry |
| DNase I | Invitrogen | 18068015 | Digests single- and double-stranded DNA to oligodexyribonuleotides containing a 5' phosphate to remove contamination from RNA |
| dNTP Set 100 mM | Invitrogen | 10297-018 | Consists of four deoxynucleotides (dATP, dCTP, dGTP, dTTP) for use in PCR |
| Dimethyl Sulfoxide (DMSO) | Sigma | D8418 | Apolar, protic solvent used to make media for cryopreserving live cells |
| EDTA | Invitrogen | AM9912 | Used to stop Dnase I enzyme activity |
| FBS | Wisent Bioproducts | 080-150 | Premium fetal bovine serum to supplement media |
| FcR Blocking Reagent, Human | Miltenyi | 130-059-901 | Binds to Fc receptor on the cell surface to prevent non-specific binding of flow antibodies |
| FlowJo v10 | FlowJo LLC | N/A | Flow cytometry analysis software used for all analyses |
| HLA-DR BV650 | BD Biosciences | 564231 | MHC class II cell surface receptor antibody used for flow cytometry |
| HyClone HEPES solution | Fisher Scientific | SH3023701 | Buffer providing maintenance of physiological pH |
| Live/Dead APC-H7 | Invitrogen | L34975 | Viability marker used for flow cytometry |
| Lymphocyte Separation Medium (LSM) | Wisent Bioproducts | 350-000-CL | Polysucrose for isolation of PBMC from whole blood |
| Mr. Frosty Freezing Container | ThermoFisher | 5100-0001 | Freezing container ensuring rate of cooling very close to -1 °C/min, the optimal rate for cell preservation |
| OneComp eBeads | Invitrogen | 01-1111-41 | Anti-mouse, rat and hamster antibodies for compensation of PBMC samples |
| PBS 1x | Wisent Bioproducts | 311-010-CL | Phosphate buffered saline for cell washing and staining |
| PCR Tubes Corbett Rotor-Gene | Axygen | PCR-0104-C | 4-strip PCR tubes with 0.1 mL capacity for use with Corbett Rotor-Gene |
| PerfeCTa qPCR ToughMix | Quantabio | 95112 | 2x concentrated ready-to-use reaction cocktail for PCR amplification of DNA templates |
| QiaAmp DNA Mini Kit | Qiagen | 51304 | Kit for isolation of genomic, mitochondrial, bacterial, parasite or viral DNA. Includes QIAamp Mini Spin Columns, QIAGEN Proteinase K, Reagents, Buffers, Collection Tubes |
| RNeasy Mini Kit | Qiagen | 74104 | Kit for purification of up to 100 µg total RNA from cells, tissues, and yeast. Includes RNeasy Mini Spin Columns, Collection Tubes, RNase-free Reagents and Buffers |
| Rotor-Gene Q | Qiagen | 9001550 | Real-time PCR cycler |
| RPMI 1640 1x | Wisent Bioproducts | 350-000-CL | Cell culture media |
| Sterile Water | Wisent Bioproducts | 809-115-CL | DNase, RNase & protease free |
| Superscript™ III One-Step RT-PCR System | Invitrogen | 12574018 | RT-PCR kit which performs both cDNA synthesis and PCR amplification in a single tube. Includes SuperScript III RT/Platinum Taq Mix, 2x Reaction Mix (containing 0.4 mM of each dNTP, 3.2 mM MgSO4), magnesium sulfate |
| Taq DNA Polymerase | Invitrogen | 18038-042 | Thermostable enzyme that synthesizes DNA from single-stranded templates in the presence of dNTPs and a primer. Includes Taq DNA Polymerase, 10x PCR buffer, magnesium chloride |
| Transcription Factor Buffer Set | BD Biosciences | 562725 | Buffers for intracellular staining for flow cytometry. Includes fixation/permeabilization buffer, diluent buffer, perm/wash buffer |
| Trypan Blue | Sigma | T8154 | Viability dye to count cells using haemacytometer |
참고문헌
- Chun, T. W., Fauci, A. S. Latent reservoirs of HIV: obstacles to the eradication of virus. Proceedings of the National Academy of Sciences of the United States of America. 96, 10958-10961 (1999).
- Finzi, D., et al. Latent infection of CD4+ T cells provides a mechanism for lifelong persistence of HIV-1, even in patients on effective combination therapy. Nature Medicine. 5, 512-517 (1999).
- Costiniuk, C. T., Jenabian, M. A. The lungs as anatomical reservoirs of HIV infection. Reviews in Medical Virology. 24, 35-54 (2014).
- Center for Disease Control and Prevention. A cluster of Kaposi's sarcoma and Pneumocystis carinii pneumonia among homosexual male residents of Los Angeles and Orange Counties, California. Morbidity and Mortality Weekly Report. 31, 305-307 (1982).
- Fitzpatrick, M., Crothers, K., Morris, A. Future directions: lung aging, inflammation, and human immunodeficiency virus. Clinics in Chest Medicine. 34, 325-331 (2013).
- Kunisaki, K. M. Will expanded ART use reduce the burden of HIV-associated chronic lung disease?. Current Opinion in HIV and AIDS. 9, 27-33 (2014).
- World Health Organization. . WHO | Tuberculosis and HIV. , (2018).
- Jambo, K. C., et al. Small alveolar macrophages are infected preferentially by HIV and exhibit impaired phagocytic function. Mucosal Immunology. 7, 1116-1126 (2014).
- Yeligar, S. M., et al. Dysregulation of Alveolar Macrophage PPARγ, NADPH Oxidases, and TGFβ. AIDS Research and Human Retroviruses. 33, 1018-1026 (2017).
- Cribbs, S. K., Lennox, J., Caliendo, A. M., Brown, L. A., Guidot, D. M. Healthy HIV-1-infected individuals on highly active antiretroviral therapy harbor HIV-1 in their alveolar macrophages. AIDS Research and Human Retroviruses. 31, 64-70 (2015).
- Holt, P. G., et al. Extraction of immune and inflammatory cells from human lung parenchyma: evaluation of an enzymatic digestion procedure. Clinical & Experimental Immunology. 66, 188-200 (1986).
- Brenchley, J. M., et al. High frequencies of polyfunctional HIV-specific T cells are associated with preservation of mucosal CD4 T cells in bronchoalveolar lavage. Mucosal Immunology. 1, 49 (2007).
- Mwandumba, H. C., et al. Mycobacterium tuberculosis; Resides in Nonacidified Vacuoles in Endocytically Competent Alveolar Macrophages from Patients with Tuberculosis and HIV Infection. The Journal of Immunology. 172, 4592 (2004).
- Gordon, S. B., et al. Inhaled delivery of 23-valent pneumococcal polysaccharide vaccine does not result in enhanced pulmonary mucosal immunoglobulin responses. Vaccine. 26, 5400-5406 (2008).
- Costiniuk, C. T., et al. HIV persistence in mucosal CD4+ T cells within the lungs of adults receiving long-term suppressive antiretroviral therapy. AIDS. 32, 2279-2289 (2018).
- American Thoracic Society. . American Thoracic Society - Bronchoalveolar Lavage. , (2004).
- King, T. E. . Basic principles and technique of bronchoalveolar lavage - UpToDate. , (2018).
- Lea, S., Dungwa, J., Ravi, A., Singh, D. Alveolar macrophage size is increased in COPD patients compared to controls. European Respiratory Journal. 50, (2017).
- Kuse, R., Schuster, S., Schübbe, H., Dix, S., Hausmann, K. Blood lymphocyte volumes and diameters in patients with chronic lymphocytic leukemia and normal controls. Blut. 50, 243-248 (1985).
- Heron, M., et al. Bronchoalveolar lavage cell pattern from healthy human lung. Clinical & Experimental Immunology. 167, 523-531 (2012).
- Rheinländer, A., Schraven, B., Bommhardt, U. CD45 in human physiology and clinical medicine. Immunology Letters. 196, 22-32 (2018).
- Yu, Y. R. A., et al. Flow Cytometric Analysis of Myeloid Cells in Human Blood, Bronchoalveolar Lavage, and Lung Tissues. American Journal of Respiratory Cell and Molecular Biology. 54, 13-24 (2015).
- Geiser, M. Update on Macrophage Clearance of Inhaled Micro- and Nanoparticles. Journal of Aerosol Medicine and Pulmonary Drug Delivery. 23, 207-217 (2010).
- Costiniuk, C. T., et al. Prevalence and predictors of airflow obstruction in an HIV tertiary care clinic in Montreal, Canada: A cross sectional study. HIV Medicine. , (2019).
- Balfour, L., et al. Altruism motivates participation in a therapeutic HIV vaccine trial (CTN 173). AIDS Care. 22, 1403-1409 (2010).
- Vandergeeten, C., Fromentin, R., Chomont, N. The role of cytokines in the establishment, persistence and eradication of the HIV reservoir. Cytokine & Growth Factor Reviews. 23, 143-149 (2012).
- Rennard, S. I., et al. Estimation of volume of epithelial lining fluid recovered by lavage using urea as marker of dilution. Journal of Applied Physiology (1985). 60, 532-538 (1986).
- Twigg, H. L., et al. Effect of highly active antiretroviral therapy on viral burden in the lungs of HIV-infected subjects. The Journal of Infectious Diseases. 197, 109-116 (2008).
- Duan, M., et al. Distinct Macrophage Subpopulations Characterize Acute Infection and Chronic Inflammatory Lung Disease. The Journal of Immunology. 189, 946 (2012).
- Garn, H. Specific aspects of flow cytometric analysis of cells from the lung. Experimental and Toxicologic Pathology. 57, 21-24 (2006).
- Szaniawski, M. A., Spivak, A. M., Bosque, A., Planelles, V. Sex influences SAMHD1 activity and susceptibility to HIV-1 in primary human macrophages. The Journal of Infectious Diseases. , (2018).
- Avalos, C. R., et al. Quantitation of Productively Infected Monocytes and Macrophages of Simian Immunodeficiency Virus-Infected Macaques. Journal of Virology. 90, 5643-5656 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유