Method Article
Descongelamento, cultivo e Cryopreserving linhas de células de Drosophila
Neste Artigo
Resumo
Linhas de células de Drosophila são importantes reagentes para investigação fundamental e biomédica. Este artigo fornece protocolos para descongelar, repicagem e a criopreservação de linhas de células de Drosophila comumente usadas para auxiliar pesquisadores em incorporar o uso destes reagentes em suas pesquisas.
Resumo
Existem atualmente mais de 160 linhas celulares Drosophila distintas, distribuídas pelo Drosophila genómica Resource Center (DGRC). Com a engenharia do genoma, o número de linhas celulares romance deverá aumentar. O DGRC visa familiarizar os pesquisadores com o uso de linhas de células de Drosophila como uma ferramenta experimental para complementar e conduzir sua agenda de pesquisa. Procedimentos para trabalhar com uma variedade de linhas de células de Drosophila com características distintas são fornecidos, incluindo protocolos para descongelar, cultivo e cryopreserving linhas celulares. Importante, esta publicação demonstra as melhores práticas necessárias para trabalhar com linhas de células de Drosophila para minimizar o risco de contaminações de microrganismos adventícios ou de outras linhas de célula. Pesquisadores que se familiarizar com estes procedimentos será capazes de mergulhar em muitas aplicações que utilizam células de Drosophila cultivadas, incluindo bioquímica, biologia celular e genômica funcional.
Introdução
O uso da Drosophila cultivadas células in vivo complementa voar análise genética e serve como uma ferramenta de inquérito preliminar para abordar muitas questões biológicas básicas1,2,3. Linhas de células de Drosophila oferecem exclusivas homogêneas populações de células derivadas de fontes de tecidos diferentes com origens genéticas distintas. Linhagens celulares são adequadas para muitas aplicações, incluindo a expressão do gene transgênico, genómica, transcriptomics, proteômica, metabolomics, alta taxa de transferência RNA interferência (RNAi) telas, biologia celular e microscopia. Importante, o uso de cultura de células de Drosophila facilita a caracterização das respostas aos estímulos conhecidos temporais imediatas. Além disso, a cultura de células de Drosophila é passível de genoma CRISPR-Cas9 edição, tornando-se relativamente fácil criar novas linhas de célula com genoma específico modificações4,5,6, 7.
A Drosophila genómica Resource Center (DGRC) serve como um repositório e centro de distribuição para linhas de células de Drosophila . Um dos objetivos da DGRC é auxiliar os membros da comunidade de pesquisa no uso de recursos de cultura de células de Drosophila . Este artigo apresenta os protocolos básicos para o tratamento de linhas de células de Drosophila . Complementa os recursos existentes para ajudar os pesquisadores se sentem confortáveis com a manipulação de culturas de células de Drosophila e alcançar um nível de independência em seus experimentos1,2,8,9 ,10.
As linhas de célula de Drosophila mais comumente usadas são: Schneider linhas11, Kc16712, Mitsubishi/Miyake imaginária disco e sistema nervoso central (SNC) as linhas13,14, linhas de disco imaginária de laboratório Milner 15, a célula adulta ovário linhas16,17e o Ras linhas18 (tabela 1). A Schneider e Kc167 linhas são linhas de celulares para todos os fins gerais para uso em bioquímica, expressão do gene transgênico recombinante e telas genéticas reversos. As linhas de laboratório (ML) Mitsubishi/Miyake foram derivadas de discos imaginária larvas ou no sistema nervoso central (SNC) e eles foram úteis para estudos relacionados ao neurosecretion, regulamento da transcrição e processamento do RNA. As linhas de disco Milner (CME) foram importantes para o estudo de transdução de sinal. As linhas de célula fGS/OSS derivadas mutantes ovários adultos permanecem importantes reagentes para estudar o impacto da não-codificantes pequeno RNA Biologia em células germinativas manutenção e diferenciação17,19. Por último, as linhas de Ras são únicas, porque estas são linhas de células derivadas de embriões ectopically expressando o oncogene Ras. Eles têm a assinatura do transcriptional de células precursoras de músculo e expressa máquinas de piRNA ativo20. Recente revisão de artigos e capítulos de livros cobrem as aplicações destas linhas de celular popular com mais detalhes2,3,9.
Todas essas linhas de célula podem ser submetido a uma repicagem e congeladas. Há pequenas mas importantes requisitos diferentes para como cada linha da célula é mantida e preparada para criopreservação. Por exemplo, linhagens celulares distintas exigem diferentes mídias e suplementos (tabela 1). As linhas variam também nas propriedades de aderência superficial, morfologias (Figura 1 e Figura 2), genótipo e tempo de duplicação (tabela 2). Apresentamos os protocolos básicos e destacar as diferenças únicas para lidar com as várias linhas de células de Drosophila amplamente utilizadas.
Protocolo
1. descongelar e a revitalização de linhas de células congeladas de Drosophila
- Esterilize o capô limpando a superfície de trabalho com 70% de etanol. Diluir 5 mL de meio adequado (tabela 1) em um 25 cm2 T-balão (T-25).
- Remova a cryovial/ampola de líquido N2 ou gelo seco. Limpar o cryovial com etanol a 70%, cuidadosamente soltar e remover o lacre da ampola.
- Utilizando uma pipeta de Pasteur, retire o balão de T-25 1 mL de mídia de temperatura (RT). Adicionar lentamente a mídia para o cryovial e misture suavemente para descongelar as células congeladas, garantindo que a suspensão de eritrócitos não transbordar.
- Transferi todo o volume da suspensão celular descongeladas da ampola para o balão de T-25. Repita o procedimento para garantir que a suspensão celular foi transferida completamente.
- Colocar o balão numa incubadora de 25 ° C, permitindo que as células para se estabelecer e aderir para pelo menos 2 h. examinar as células sob um microscópio para garantir que a maioria das células se instalaram na superfície crescente. Suavemente retire a velha mídia e substituir com 5 mL de mídia fresca. Retorne o frasco para a incubadora.
- No dia seguinte, delicadamente remova a mídia velha e substituir com 5 mL de mídia fresca. Retorno a cultura para a incubadora.
2. descongelação e a revitalização de linhas de células congeladas de Drosophila (alternativa)
- Em uma capa de estéril, descongele as células por resuspending a pelota congelada com 1 mL de mídia RT. Transferi toda a suspensão de células descongeladas em um tubo cônico de 15 mL.
- As células de pelotas por centrifugação a 1.000 x g durante 5 min. descartar o sobrenadante e ressuspender as células em 5 mL de mídia fresca.
- Transferir todo o volume da suspensão de célula para um balão de T-25 e incubar a cultura a 25 ° C.
- 1 a 2 h depois, examinar as células sob o microscópio para garantir que a maioria das células se instalaram na superfície crescente. No dia seguinte, substituir a velha mídia com 5 mL de mídia fresca e retornar a cultura para a incubadora.
3. repicagem semi aderentes células cultivadas em placas de cultura de 100mm
- Esterilize o capô limpando com etanol a 70%. Trazer o material esterilizado para repicagem para o capô, incluindo garrafas de mídia, pipetas, auxílio de pipeta e placas de cultura.
- Examine a morfologia e a confluência da cultura sob um microscópio. Procure por sinais claros de contaminações microorganismal na cultura. Determinar se as células estão prontas para ser passadas, baseado nas características da cultura: densidade e tempo, incluindo a última vez que eles foram a repicagem de duplicação celular.
- Se a cultura aparece altamente confluente (Figura 1), determinar a densidade de células. No bairro estéril, desalojar as células da superfície crescente por pipetagem até 10 mL do meio da placa e dispensa-lo sobre as células. Repita algumas vezes, assegurando para não criar espuma, até que a superfície crescente torna-se claro. Determine a densidade de células usando um hemocytometer ou um contador de partículas automático (seção 5, Figura 3). Subcultura das células se a densidade celular é entre 5 x 106 e 1 x 107 células/mL.
Nota: Fazer não subcultura Drosophila linhas celulares para uma densidade de célula abaixo de 1 x 106 células/mL. -
Dilua a suspensão de eritrócitos em conformidade, usando um meio apropriado para uma concentração final de semeadura de no mínimo 1 x 106 células/mL.
- Para a rotina passagem e manutenção, adicione um volume adequado de suspensão de células para um volume pré-determinado de meio em uma placa de cultura de novo para atingir a densidade de células de semeadura desejada.
- Para o dimensionamento de uma cultura, transferi toda a suspensão de células para um balão grande. Dilua a suspensão de células para a densidade da célula desejada com um volume adequado de médio porte. Distribua volumes iguais de suspensão de célula diluídos para novas placas. Esse método minimiza as variações na densidade de células entre as placas.
- Cobrir e rotular as placas com as iniciais do operador, data, relação de divisão, semeadura densidade celular, identificador de linha celular, mídia, número de passagem e quaisquer adições de mídia, tais como antibióticos.
- Coloque as placas em um recipiente de plástico e retorne a caixa para a incubadora.
Nota: tabela 3 listas dos navios de cultura comumente utilizados para cultivo de linhas de células de Drosophila e os volumes de trabalho associado.
4. deslocar células aderentes cultivadas em placas de cultura de 100mm
- Transferi todo o meio do prato para um novo frasco estéril. Salve o meio.
- Enxague as células lentamente adicionando 1 mL de 0,05% do trypsin-EDTA para a placa. Agitar suavemente o frasco para assegurar que a solução de tripsina cobre a superfície inteira de crescimento. Descarte a solução de tripsina.
- Delicadamente, adicione 1 mL de 0,05% do trypsin-EDTA para a placa. Incube a placa a 25 ° C entre 3−10 min enquanto monitoramento de sinais visíveis de desanexação de camada a célula e deslizando fora da superfície crescente.
- Adicione 9 mL do meio de salvos para a placa de parar a atividade de tripsina. Misture a suspensão de eritrócitos para dissociar aglomerados de células. Uma vez que todas as células têm sido desalojadas, superfície crescente estará limpa.
Nota: O uso de enzimas digestivas como a tripsina aids na passagem de linhas celulares fortemente aderente. Tripsina é uma mistura de proteases muitas vezes derivada de pâncreas de suínos e está comercialmente disponível em diferentes graus de pureza.
5. manual celular contando usando a célula de Neubauer contando Slide
- Prepare o hemocytometer slide e lamela, limpar a superfície com álcool 70%.
- Misturar a suspensão de eritrócitos e dispensar 15 µ l de suspensão de células na extremidade sulcada da hemocytometer (Figura 3A) para preencher a primeira secção do hemocytometer. Encha a câmara segunda do hemocytometer. A suspensão de células será sorteada em câmara de contagem por ação capilar.
- Usando um 10 x objetivo de microscópio, conte as células da área 1 mm2 no meio da grade de respeitar as linhas paralelas (Figura 3,D). Para evitar duplicar a contar, conte as células que sobreponham a parte superior e esquerda de limites, mas não células que atravessam as fronteiras de direito e inferior de 200 µm2 quadrados. Contam-se entre as células de 100−200. Repita a contagem com a segunda secção.
- Calcular a média das duas contagens e determinar a densidade de células de acordo com a seguinte fórmula: densidade (células/mL) de células = contagem de célula média (n1 + n22) x 104.
Nota: Viabilidade celular é expresso em percentagem de células viáveis sobre células totais. Para determinar a viabilidade celular, misturar a suspensão de células com um volume igual de azul de trypan (0,4%) solução antes da contagem de células manual ou automática. Células vivas não ocupará o corante, enquanto as células mortas vão ser manchadas de azuis.
6. criopreservação de linhas de células de Drosophila
- Verifica a cultura saudável morfologia, crescimento e a ausência de contaminação. Colheita das culturas da meados de fase de crescimento final do log (passo 3.3, ou seção 4). Para muitas linhas de células de Drosophila , é aproximadamente entre 4 x 106 células/mL de 8 x 106 células/mL.
- Transferi a suspensão de toda a célula em um tubo cônico de 15 mL ou 50 mL. Coletar as células por centrifugação a 1.000 x g durante 5 min e descartar o sobrenadante.
- Ressuspender as células em um volume de meio de congelação (tabela 4) que irá resultar em uma densidade de célula final de pelo menos 4 x 107 células/mL.
- Adicione gota a gota a quantidade adequada do crioprotetoras dimetilsulfóxido (DMSO) para a suspensão de eritrócitos tal que a concentração final de DMSO é 10%. Misture suavemente a suspensão de eritrócitos.
- Cuidadosamente, dispense 0,5 mL de suspensão de células em alíquotas do cryovials pre-etiquetados (~ 2 x 107 células/frasco). Coloque as ampola em um recipiente congelação com isopropanol (Figura 4A). Transferir o recipiente de congelamento em um freezer-80 ° C durante a noite para permitir que a temperatura da cryovials a cair lentamente (-1 ° C/min) para a temperatura do congelador.
- Retire os cryovials congelados e rapidamente anexá-los para bastões (Figura 4B). Inserir os bastões contendo cryovials em uma vasilha (Figura 4). Como alternativa, coloque cryovials congelado dentro de uma caixa de congela pre-refrigerada (Figura 4). Loja de congelados cryovials na fase líquida de congeladores de2 N (Figura 4E,F).
Nota: Ao usar o congelamento mídia contendo DMSO, um atraso de até 30 min no RT não é prejudicial para as células.
Resultados
É importante descongelar células de Drosophila congeladas rapidamente e cultura-los em uma densidade de celular que traz a cultura para a fase de crescimento. Se são seguidos os procedimentos de criopreservação e descongelamento, a densidade celular do balão T-25 será pelo menos igual a 4 x 106 células/mL. Uma a duas horas após o descongelamento, a maioria das linhas de células de Drosophila começará a anexar à superfície crescente. Sob a circunstância em que a maioria das células não Anexei na superfície crescente dentro de duas horas após o descongelamento, recomenda-se incubar as células durante a noite antes de alterar a mídia.
O objetivo da repicagem é manter as células saudável exponencial log de fase da curva de crescimento. Os critérios para repicagem dependem a visível falta de contaminação microorganismal, densidade celular e a necessidade de estabelecer um plano de manutenção regular. É preciso primeiro avaliar a integridade das células e determinar a ausência de contaminantes adventícios antes do congelamento. A maioria dos contaminantes bacterianos e fúngicos são fáceis de detectar, simplesmente por inspeções visuais. Culturas contaminadas podem ser identificadas por um aumento na turbidez de mídia. Sob o microscópio, contaminantes podem aparecer como varetas bacterianas, Firmicutes, brotamento de células de levedura ou hifas fúngicas de sequência de caracteres. Outras fontes de contaminação, tais como a não-citopático micoplasma não podem ser detectados visualmente e podem ser testados rotineiramente por ensaios baseados em PCR21.
A confluência de uma linhagem de células pode ser determinada visualmente (Figura 1). Linhas de células de crescimento rápido chegar cedo a confluência e precisam ser passadas regularmente. Tais linhas são repicagem até duas vezes por semana. Em contraste, as células de crescimento lentas são passadas pelo menos uma vez a cada duas semanas ou mais. No entanto, as células precisam de ser alimentados mídia fresca toda semana. Isto é para evitar o esgotamento de mídia e diluir resíduos metabólicos das células. Linhagens celulares derivadas de variando de tecido fontes diferem em sua morfologia (Figura 2), propriedades de aderência, requisitos de mídia (tabela 1) e tempo (tabela 2) de duplicação. Tabela 5, tabela 6, tabela 7e tabela 8 listam as receitas para os vários meios de cultura de célula drosófila .
Contagem de células garante uma densidade de semeadura precisa e uma rotina previsível para repicagem. Para experiências quantitativas, contagem de células é essencial. As células são contadas também, usando um hemocytometer (Figura 3A) ou um contador de partículas automatizado (Figura 3B). Se usando um contador automatizado, siga as instruções do fabricante. Contar as células manualmente usar um hemocytometer é econômica e fácil. O número de células fechado no meio Neubauer grades é contado e a densidade celular é calculada; Por exemplo, n = 214 células, resultando em uma densidade de células de 2,14 x 106 células/mL (Figura 3D).
Suspensão de células de duas chapas de 100 milímetros, cada contendo 10 mL da suspensão de células em 4 x 106 células/mL são coletados e resuspended em 2 mL de congelamento de mídia para atingir uma densidade de 4 x 107 células/mL. Cada cryovial congelado com 0,5 mL de suspensão de células contém 2 x 107 células. Isso resultará em uma cultura com 4 x 106 células/mL quando descongelados de acordo com o protocolo, seção 1.
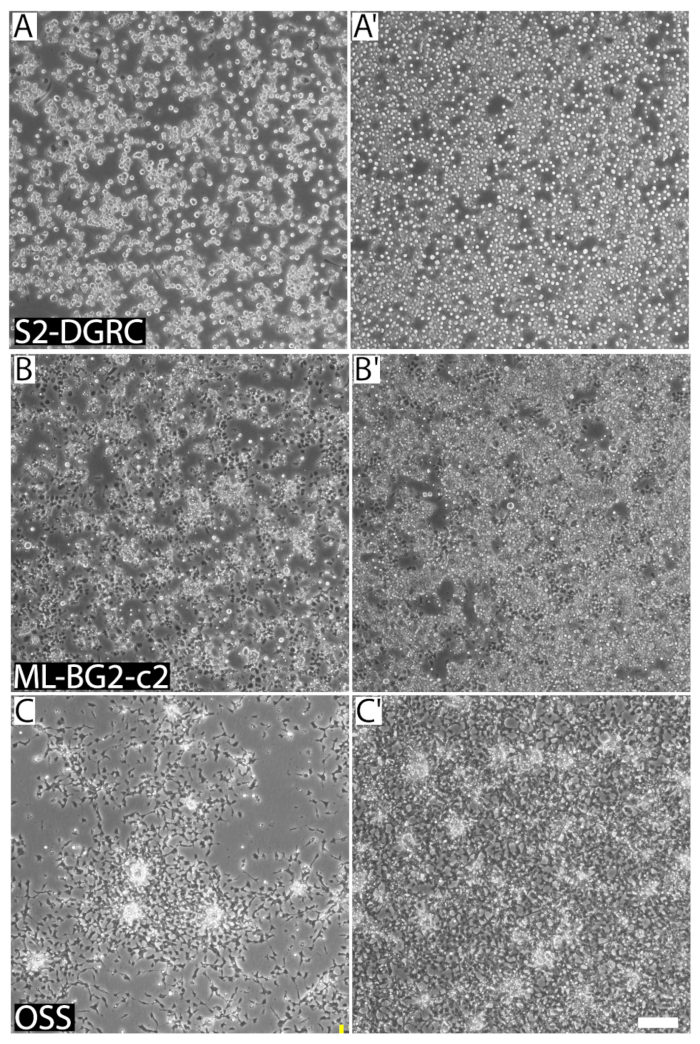
Figura 1 : Imagens representativas de três distintas Drosófila linhas em diferentes densidades de confluência e célula de célula. (A) S2-DGRC cultura a 1 x 106 células/mL. (A') Cultura de S2-DGRC em 4.5 x 106 células/mL. (B) ML-BG2-c2 cultura a 2 x 106 células/mL. (B') ML-BG2-c2 cultura 8 x 106 células/ml em que as células estão empilhando e agregando como focos. (C) OSS cultura a 1 x 106 células/mL. (C') Cultura de OSS em 4 x 106 células/mL. As células em suspensão não são capturadas no mesmo plano focal. Barra de escala = 100 µm. clique aqui para ver uma versão maior desta figura.
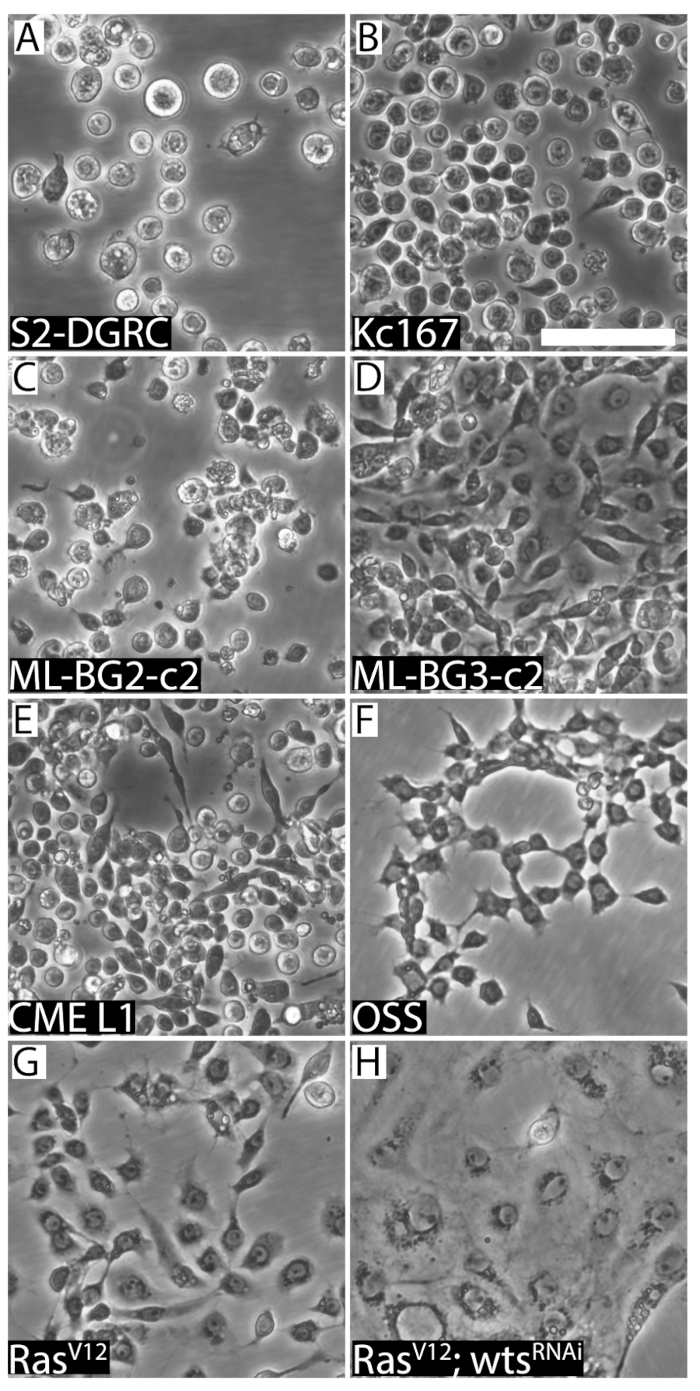
Figura 2 : Imagens representativas das oito linhas de celulares distintas drosófila . S2-DGRC embrião-derivado de redondo (A). (B) rodada embrião-derivado Kc167. (C) redondo larval CNS-derivado ML-BG2-c2. (D) fase larval fusiformes ML-BG3-c2. (E) CME L1, uma linhagem celular derivada dos discos de perna larval imaginária, é menor e tem morfologia redonda/fusiforme. (F) OSS, uma linhagem de células derivada de ovários adultos, exibe morfologia fusiforme. (G), linha de células fusiformes RasV12 expressando ativado Ras. (H) RasV12; wtsRNAi (WRR1), uma linhagem de células expressando Ras ativado e RNA double-stranded alvejando o tumor supressor verrugas (wts), exibe características epiteliais. Barra de escala = 50 µm. clique aqui para ver uma versão maior desta figura.
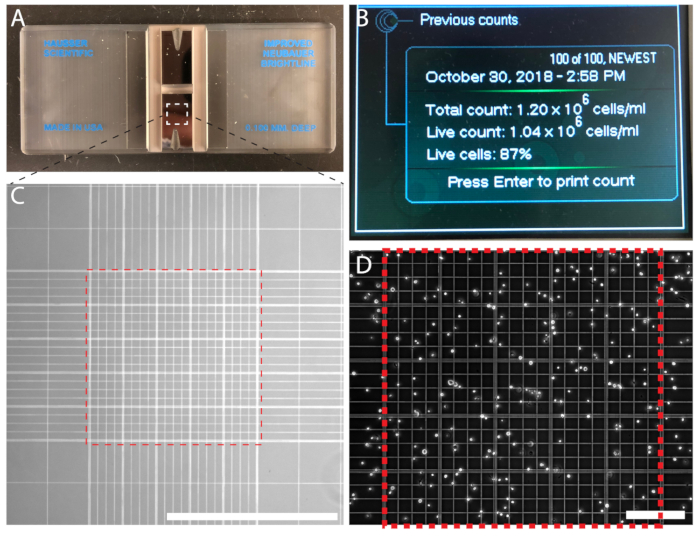
Figura 3 : Densidade de células pode ser contada manualmente usando um hemocytometer ou automaticamente usando um contador de partículas automatizado. (A) A hemocytometer com duas câmaras. (B) um contador automatizado de células exibindo a saída de uma contagem de células. (C) a célula de Neubauer melhorada contando grade visto sob um objectivo de 10x. Contar as células vinculadas a grade central de 0,1 mm3 (Praça Vermelha da linha tracejada). (D) da grade central a hemocytometer cheia de células para a contagem. Barra de escala = 1 mm (C); 0,2 mm (D). Clique aqui para ver uma versão maior desta figura.

Figura 4 : Equipamento para criopreservação. (A), A congelação recipiente lojas as ampolas em uma posição ereta para congelamento lento. (B) um metal cana para a realização de ampolas congeladas. (C) A vasilha para a realização de bastões. (D), A caixa plástica congela (cryobox). (E) A vasilha segurando bastões múltiplo inseridos em um tanque de armazenamento do líquido N2 . (F), um líquido N2 tanque de armazenamento. Clique aqui para ver uma versão maior desta figura.
| Tensão de célula | Meios de comunicação | Aderência | Tripsina |
| Linhas de Schneider | M3 + BPYE + 10% de soro de vitela fetal (FCS), pH 6.6 | Meias aderentes | Não |
| (S2R +, S2-DRSC, S2-DGRC, Sg4) 11 | |||
| Mídia+ + 10% FCS do Schneider | |||
| KC linhas (Kc167, Kc7E10)21,22 | M3 + BPYE + 5% FCS, pH 6.6 | Meias aderentes | Não |
| Hyclone-CCM3, pH 6.2 | |||
| Disco imaginária e CNS (ML-linhas)13,14 | M3 + BPYE + 10% FCS, pH 6.6 | Meias aderentes | Não |
| insulina de 10 µ g/mL | |||
| Milner imaginária disco linhas (CME-linhas)15 | M3 + 2% FCS | Meias aderentes | Não |
| insulina de 5 µ g/mL | |||
| 2,5% de extracto de voar | |||
| fGS/OSS16 | M3 + 10% FCS, pH 6,8 | Aderentes | * |
| insulina de 10 µ g/mL | |||
| 1 mg/mL C5H8KNO4 | |||
| 0,5 mg/mL KHCO3 | |||
| glutationa 0,6 mg/mL | |||
| 10% de extracto de voar | |||
| RasV12 linhas18 | M3 + BPYE + 10% FCS, pH 6.6 | Aderentes | Sim |
Tabela 1: Os requisitos de propriedades e meios de comunicação de várias Drosófila linhas de célula. Diferentes isolados de semi aderentes Schneider linhas incluindo S2R +, S2-drosófila RNAi Screening Center (DRSC), S2-drosófila genómica Resource Center (DGRC) e Sg4 são linhas de célula comumente usada que proliferam robustamente quando cultivadas em meios M3 + Bactopetone extrato de levedura (BPYE) suplementado com 10% de soro fetal bezerro (FCS). Alternativamente, mídia do Schneider (pH 6,8-6,7) é muitas vezes usada no lugar de M3 + BPYE. As linhas de Kc proliferam em qualquer M3 + BPYE (5% FCS) ou mídia de CCM3 isento de soro. O disco imaginária ML e linhas de sistema nervoso central (SNC) exigem suplementação de insulina para proliferação. As linhas de disco imaginária Milner exigem tanto a insulina e a mosca extraem suplementação. Linhas de células aderentes fGS/OSS requerem insulina, uma maior concentração de extrato de mosca, bem como a glutationa para crescimento. Linhas de RasV12 aderentes crescem bem em M3 + BPYE (10% FCS). Tripsina é usada para desalojar linhas de células aderentes da superfície de crescimento.
| Linha de célula (Stock #) | Genótipo | Duplicação da altura (h) * | Fonte de tecido |
| S2R + (150) | OreR | 39 | Embriões de tarde |
| S2-DGRC (6) | OreR | 23 | Embriões de tarde |
| S2-DRSC (181) | OreR | 46 | Embriões de tarde |
| Kc167 (1) | e/se | 22 | 6−12 h embriões |
| ML-BG2-c2 (53) | y v f mal | 48 | 3rd ínstar larval CNS |
| ML-BG3-c2 (68) | y v f mal | 104 | 3rd ínstar larval CNS |
| ML-DmD8 (92) | y v f mal | 66 | 3 disco de asa larval de ínstar derd |
| CME W1 Cl.8+ (151) | OreR | 46 | 3 disco de asa larval de ínstar derd |
| CME L1 (156) | OreR | 47 | 3 disco de perna larval de ínstar derd |
| OSS (190) | bamD86 | 45 | Adult bam ovários mutante |
| Linhas deV12 de Ras | UAS-GFP; P(uas-Ras85D.v12) / P (Act5C-GAL4) 17bFO1 | 41−65 | Embrião |
Tabela 2: Genótipo, dobrando o tempo e fontes de tecido de amplamente utilizado Drosófila linhas de célula. O genótipo de tecido, a origem e o tempo de linhas celulares usados duplicação da população são apresentados. Tempo de duplicação é baseado em crescimento na mídia recomendada a 25 ° C.
| Navio de cultura | Volume de mídia (mL) |
| 12,5 cm2 T-balão | 2.5 |
| 2 T-balão de 25 cm | 5 |
| 75 cm2 T-balão | 15 |
| placa de 35 mm | 1 |
| placa de 60 mm | 4 |
| placa de 100mm | 10 |
| 384-bem placa * | 0,04/poço |
| placa de 96 poços * | 0.1/poço |
| 48-bem placa * | 0.3/poço |
| 24-bem placa * | 0,5/poço |
| placa de 12 | 1.0/poço |
| placa de 6 | 2.0/poço |
Tabela 3: cultura os navios e os volumes de mídia recomendada. Cultura vasos de vários tamanhos estão disponíveis para o cultivo de células de Drosophila . Os volumes de meios adequados (mL) são recomendados para cada navio. Selar bem multi placas contendo menos de 0,5 mL de suspensão de células com película de parafina para reduzir a perda de meios de comunicação devido a evaporação.
| Volume de | |
| M3 + BPYE, pH 6.6 | 70 mL |
| Inactivados por calor, FCS | 20 mL |
| DMSO filtrado estéril * | 10 mL |
Tabela 4: receita para preparar 100 mL de meio de congelação (M3 + BPYE, FCS de 20%, 10% DMSO). Preparar a mídia congelamento conforme necessário e evitar armazenar mídia congela contendo DMSO por período prolongado.
| M3 + médio BPYE | Quantidade |
| Escudos e cantou do M323 | 1 garrafa |
| KHCO3 | 0,5 g |
| Extracto de levedura selecione | 1,0 g |
| Bactopeptone | 2,5 g |
| Água purificada estéril | 1000 mL |
Tabela 5: Receita para preparar 1 L de M3 + BPYE meio de cultura de tecido. Ajuste o pH para 6.6. Esterilize, passando o meio através de um filtro de 0,22 µm.
| Base média de M3 para linha de celular fGS/OSS | Quantidade |
| Escudos e cantou M3 | 1 garrafa |
| KHCO3 | 0,5 g |
| C5H8KNO4 | 1,0 g |
| Água purificada estéril | 1.000 mL |
Tabela 6: Receita para 1 L de base médio fGS/OSS M3. Ajuste o pH para 6,8. Esterilize, passando o meio através de um filtro de 0,22 µm.
| Hyclone-CCM3 | Quantidade |
| Pó de CCM3 | 28,6 g |
| NaHCO3 | 0,35 g |
| 10 N NaOH | 2,5 mL |
| CaCl2 | 0,5 g |
| Água purificada estéril | 1.000 mL |
Tabela 7: Receita para 1 L de meio de cultura de tecido Hyclone-CCM3. Ajuste o pH a 6.2. Esterilize, passando o meio através de um filtro de 0,22 µm.
| M3 + BPYE + 10% FCS | Disco de Miyake e CNS linhas médio | Meio de linhas de disco Milner | médio completo fGS/OSS | |
| M3 + BPYE, pH 6.6 | de 90 mL | de 90 mL | - | - |
| Inactivados por calor, FCS * | 10 mL | 10 mL | 2 mL | 10 mL |
| Insulina (10 mg/mL) | - | 100 Μ l | 50 Μ l | 100 Μ l |
| Extrato de voar | - | - | 2,5 mL | 10 mL |
| Glutationa (60 mg/mL) | - | - | 1 mL | |
| M3, pH 6.6 | - | - | 97,5 mL | - |
| fGS/OSS M3, pH 6,8 | - | - | mL 79 |
Quadro 8: Receita para preparar 100 mL de vários comum Drosófila meios de cultura celular. Incubar a FCS a 56 ° C durante 1 h e agitar a cada cinco minutos para calor-inativar proteínas do complemento.
Discussão
Culturas de células de Drosophila são reagentes primários para ecrãs de alta taxa de transferência baseada em célula. Sua utilização também complementa a pesquisa genética in vivo, fornecendo uma população homogênea de células apropriadas para bioquímica, rápida de teste de transgénicas construções antes da injeção em moscas, biologia celular, microscopia e, mais recentemente, genética de células somáticas manipulações de genoma edição1,2,3,8,9,10.
A viabilidade e a recuperação de células de Drosophila congeladas é sensível às flutuações drásticas mesmo em baixas temperaturas. O DGRC armazena linhas de células congeladas em fase líquida de N2 (196 ° C) e transporta-os em gelo seco (-78,50 ° C). Ampolas congeladas que tenham sido transportadas em gelo seco não devem ser transferidas para líquido N2 ou de um congelador de-80 ° C para armazenamento. Em vez disso, as células congeladas devem ser descongeladas, propagado novamente em uma densidade elevada célula logo que possível após a chegada (protocolo seção 1) e cultivadas para os fins pretendidos (protocolo seção 3). Se as linhas de célula não são imediatamente utilizadas para experiências, a célula linhas devem ser criopreservado (seção de protocolo 6) até que estejam prontos para uso.
Algumas linhas de célula, tais como as linhas ML-BG2-c2 e Ras precisam de vários dias para se recuperar dos efeitos de ser revivida do estado criopreservado. Uma quantidade significativa de restos celulares acompanha estas linhas celulares nos primeiros dias após o descongelamento. Deixado inalterado, as células vão recuperar e proliferar. Muitas linhas de células de Drosophila no DGRC foram adaptadas para crescer em M3 baseado mídia22. Para linhas de celulares que são lentas para se recuperar dos efeitos do descongelamento, o uso das mídias condicionados pode ser útil. Probabilidade condicionada mídia contêm fatores de crescimento secretados pelas células na mídia que pode incentivar a recuperação e a proliferação das células após a descongelação.
Linhas celulares geralmente seguem uma curva de crescimento estereotipada consistindo de uma fase de retardo, fase exponencial, fase de platô e uma fase de deterioração. Muitas linhas de células de Drosophila proliferam na fase de registo de crescimento, quando eles são cultivados em uma densidade entre 1 x 106 e 1 x 107 células/mL a 25 ° C. É essencial que as linhas de célula são passadas tais que eles estão sempre em fase de crescimento exponencial.
A confluência de uma cultura, expressada em percentagem, descreve a área de superfície de crescimento que está coberta por células. Confluência de célula para uma linha celular depende de seu tamanho e forma de célula. Linhagens celulares distintas têm diferentes morfologias e propriedades de aderência. Como resultado, linhas de células diferentes em aproximadamente semelhante confluência podem ter densidade celular vastamente distintos (Figura 1). Confluência de cultura não pode ser um indicador ideal para passagem de culturas de células de Drosophila porque linhas de células de Drosophila continuam a proliferar por empilhar uns sobre os outros como focos ou em suspensão, mesmo depois que a superfície de crescimento tem sido coberto (Figura 1). No entanto, usuários experientes com linhas de célula específica muitas vezes podem usar confluência como um guia visual rápido para quando a subcultura.
Enquanto é possível crescer Drosophila linhas no ambiente RT entre 19−25 ° C, não é recomendável porque as flutuações de temperatura ambiente podem afetar a taxa de proliferação. Recomenda-se a utilização de uma incubadora dedicada a 25 ° C. Incubadora para cultura de células de Drosophila não precisa facilitar a troca de gás CO2 como meios de cultura de células de Drosophila não usam CO2 para o buffer. A umidade dentro da incubadora para cultivo de linhagens celulares é um fator importante para não ser esquecido quando o cultivo de células em placas. Dependendo do tipo de incubadora e o ambiente de trabalho, pode ser necessário colocar um copo de água estéril no interior da incubadora. Para minimizar a evaporação de mídia, use T-frasco fechado ou placas de cultura de armazenar em um recipiente plástico hermeticamente selado dentro da incubadora.
É importante desenvolver uma programação para repicagem linhas de células de Drosophila . Para estimar a consistência de monitor e taxa de crescimento, é conveniente a subcultura com uma relação mesmo geométrica (dividir a proporção 1:2, 1:4, 1:8). Por exemplo, uma placa confluente de 10 mL de células Kc167 8 x 106 células/ml pode ser dividida na proporção de 1:8 para atingir uma densidade de semeadura de 1 x 106 células/mL (1,25 mL de suspensão de células diluída em 8,75 mL de mídia fresca). Em 72 h, Kc167 culturas são esperadas para proliferar a uma densidade de 8 x 106 células/mL, dado seu tempo de duplicação de 24 h. Portanto, a relação de divisão é determinada para facilitar uma rotina de subcultura conveniente de até duas vezes por semana, garantindo que as células são cultivadas sempre na sua fase de log exponencial de crescimento. Isto permite uma programação regular para repicagem as células para que o momento de confluência é muito curto nem muito longo. Se o momento de confluência é muito curto, as células são repicagem em uma menor densidade celular (maior taxa de divisão). Da mesma forma, se o tempo para chegar a confluência é muito longo, as células são repicagem em uma maior densidade de célula (menor taxa de divisão). É importante notar que a maioria das linhas de células de Drosophila são muito sensíveis à densidade celular baixa (< 1 x 105 células/mL), em que as células dificilmente proliferam e podem, eventualmente, morrer.
Linhas de células de Drosophila variam em morfologia e características de crescimento. Como resultado, linhas de células com propriedades distintas podem ter de ser tratadas de maneira diferente. A maioria das linhas de células de Drosophila são semi aderentes. Em baixa densidade celular, aderem mais forte para a superfície de crescimento e como a cultura se torna confluente, as células se tornam menos aderentes e facilmente desanexar. Esta mudança gradual de aderência de célula facilita a repicagem fácil de linhas de células de Drosophila mais amplamente utilizadas (Schneider, linhas de Kc, disco imaginária e CNS) que permite que o operador simplesmente dispensar mídia sobre a monocamada de células de desalojá-los da superfície de crescimento quando a cultura é densa. Para as linhas que são superfície aderente, tais como as linhas de Ras e germe-linha feminina haste/ovário somática da bainha (fGS/OSS) é essencial para incubar as células em tripsina de curta duração ajudar a separar as células da superfície de crescimento.
Adições de mídia para a maioria das linhas de células de Drosophila incluem soro fetal bezerro (FCS). Insulina e extrato de mosca adulto (FEX) são necessárias para algumas linhas específicas. FEX contém indefinidos componentes essenciais para o crescimento das linhas específicas larval disco imaginária e as linhas de célula adulta do ovário. O DGRC prepara e torna disponível FEX adulto derivado de moscas de Oregon-R-modENCODE 1 semana de idade (RRID: BDSC_25211) em alíquotas de 2,5 mL e 10 mL. O DGRC também fornece instruções para a preparação de FEX de pequena escala em seu site < https://dgrc.bio.indiana.edu/include/file/additions_to_medium.pdf>. Preparação de FEX, entretanto, é demorada e requer uma grande quantidade de moscas adultas.
A criopreservação de linhas de células de Drosophila economiza tempo e reagentes para a manutenção de linhas de célula não estiver em uso imediato. Criopreservação é conseguida lentamente, congelando as células (-1 ° C/min) a-80 ° C num meio contendo DMSO, um agente cryoprotective. A etapa de resfriamento lenta é crítica para Criopreservação bem sucedida. Em um freezer-80 ° C, a ampola de células é resfriada a uma taxa de-1 ° C/min, quando colocado em um recipiente de congelação com isopropanol. A partir da temperatura ambiente de 25 ° C, vai demorar até 2 h para a temperatura em ampola para chegar a-80 ° C. Recomenda-se deixar as ampola para congelar durante a noite.
Em seguida, devem ser transferidas rapidamente ampolas congeladas em fase líquida de nitrogênio para armazenamento prolongado. À temperatura ambiente, o cryovial vou esquentar rapidamente, em cerca de 10 ° C/min e a viabilidade será comprometida em acima de-50 ° C23. Para manter a transferência rápida, manipular ampolas em pequenos lotes para minimizar a exposição à temperatura ambiente. Como alternativa, coloque o cryovials congelado em gelo seco enquanto se prepara para sua transferência em líquido N2. Se o nitrogênio líquido não estiver disponível, as células podem ser armazenadas em um freezer-80 ° C, embora com risco de deterioração significativa ao longo do tempo.
Densidade de células é crítica para Criopreservação bem sucedida e o subsequente renascimento de linhas celulares. Em geral, nova célula linhas devem ser congeladas para criar a inicial congelar (ampolas de 1−3), assim como um excesso de células se torna disponível. Uma vez que a linha celular tem sido ainda mais culta estàvel, deve ser criado um estoque congelado de ampola de 10−20. Este estoque é descongelado depois para verificar sua viabilidade, após o qual ele é propagado para experimentações e recuperação de célula pós-congelamento ou para substituir o estoque, quando o número de ampolas de estoque congelados cai abaixo de cinco anos. Finalmente, é importante validar que as células descongeladas mantenham as características de seu estoque parental como linhas celulares são conhecidas como evoluir3,24.
Em conclusão, este artigo apresenta uma cartilha para trabalhar com culturas de células de Drosophila , fornecendo as informações fundamentais sobre a várias linhas, melhores práticas e protocolos de audiovisuais para a manipulação básica de linhas de células de Drosophila . Destina-se este recurso acessível para aliviar suavemente a introdução ao trabalho com culturas de células de Drosophila e para complementar as guias de treinamento existente em qualquer laboratório de pesquisa.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos o National Institutes of Health (NIH de prêmio P40OD010949) e a comunidade científica para a utilização dos vários recursos de DNA/vetor/célula de d. melanogaster curados no DGRC.
Materiais
| Name | Company | Catalog Number | Comments |
| 100 mm tissue culture plates | Corning | 430167 | Subculturing |
| 25 cm2 T-flask | Corning | 430168 | Subculturing |
| 35HC Liquid Nitrogen Storage Tank | Taylor-Wharton | 35HCB-11M | Cryopreservation |
| Automated Cell counter | BIO-RAD | TC20 | Counting |
| Bactopeptone | BD BioSciences | 211677 | Medium additions |
| Counting Slides | BIO-RAD | 145-0011 | Counting |
| Cryovial 1 mL | Greiner | 123263 | Cryopreservation |
| DMSO | Sigma Aldrich | D5879 | Cryopreservation |
| Freezing Box | Nalgene | 5029-0909 | Cryopreservation |
| Freezing Container | Fisher Scientific | 15-350-50 | Cryopreservation |
| Hematocytometer | Fisher Scientific | #0267110 | Counting |
| Human Insulin | Millipore Sigma | I9278 | Medium additions |
| Hyclone CCM3 media | GE Healthcare Life Sciences | SH30061.03 | Medium |
| Hyclone Fetal Bovine Serum | GE Healthcare Life Sciences | SH30070.03 | Medium additions |
| L-Glutamic acid potassium salt monohydrate | Millipore Sigma | G1149 | Medium additions |
| L-Glutathione reduced | Millipore Sigma | G6013 | Medium additions |
| Potassium Bicarbonate | Millipore Sigma | 237205 | Medium additions |
| Select Yeast Extract | Millipore Sigma | Y1000 | Medium additions |
| Shields and Sang's M3 Insect medium | Millipore Sigma | S8398 | Medium |
| Trpsin-EDTA (0.05 %), phenol red | ThermoFisher Scientific | 25300054 | Subculturing |
| Trypan Blue (0.4%) | BIO-RAD | 145-0013 | Counting |
Referências
- Baum, B., Cherbas, L., Dahmann, C. Drosophila: Methods and Protocols. Methods in Molecular Biology. 420, 391-424 (2008).
- Cherbas, L., Gong, L. Cell lines. Methods. 68 (1), 74-81 (2014).
- Luhur, A., Klueg, K. M., Zelhof, A. C. Generating and working with Drosophila cell cultures: Current challenges and opportunities. Wiley Interdisciplinary Reviews: Developmental Biology. , e339 (2018).
- Franz, A., Brunner, E., Basler, K. Generation of genome-modified Drosophila cell lines using SwAP. Fly (Austin). 11 (4), 303-311 (2017).
- Housden, B. E., et al. Identification of potential drug targets for tuberous sclerosis complex by synthetic screens combining CRISPR-based knockouts with RNAi. Science Signaling. 8 (393), r9 (2015).
- Kunzelmann, S., Bottcher, R., Schmidts, I., Forstemann, K. A Comprehensive Toolbox for Genome Editing in Cultured Drosophila melanogaster Cells. G3 (Bethesda). 6 (6), 1777-1785 (2016).
- Ishizu, H., Sumiyoshi, T., Siomi, M. C. Use of the CRISPR-Cas9 system for genome editing in cultured Drosophila ovarian somatic cells. Methods. 126, 186-192 (2017).
- Echalier, G. . Drosophila Cells in Culture. , (1997).
- Echalier, G., Perrimon, N., Mohr, S. . Drosophila cells in culture. 2nd edition. , (2017).
- Cherbas, L., Cherbas, P., Roberts, D. B. . Drosophila: A practical approach. 10, 319-346 (1998).
- Schneider, I. Cell lines derived from late embryonic stages of Drosophila melanogaster. Journal of Embryollgy and Experimental Morphology. 27 (2), 353-365 (1972).
- Echalier, G., Ohanessian, A. Isolement, en cultures in vitro, de lignees cellulaires diploides de Drosophila melanogaster. Comptes rendus de l'Académie des Sciences. 268, 1771-1773 (1969).
- Ui, K., et al. Newly established cell lines from Drosophila larval CNS express neural specific characteristics. In Vitro Cellular & Developmental Biology − Animal. 30A (4), 209-216 (1994).
- Ui, K., Ueda, R., Miyake, T. Cell lines from imaginal discs of Drosophila melanogaster. In Vitro Cellular & Developmental Biology. 23 (10), 707-711 (1987).
- Currie, D. A., Milner, M. J., Evans, C. W. The growth and differentiation in vitro of leg and wing imaginal disc cells from Drosophila melanogaster. Development. 102, 805-814 (1988).
- Niki, Y., Yamaguchi, T., Mahowald, A. P. Establishment of stable cell lines of Drosophila germ-line stem cells. Proceedings of the National Academy of Sciences of the United States of America. 103 (44), 16325-16330 (2006).
- Saito, K., et al. A regulatory circuit for piwi by the large Maf gene traffic jam in Drosophila. Nature. 461 (7268), 1296-1299 (2009).
- Simcox, A., et al. Efficient genetic method for establishing Drosophila cell lines unlocks the potential to create lines of specific genotypes. PLoS Genetics. 4 (8), e1000142 (2008).
- Sumiyoshi, T., et al. Loss of l(3)mbt leads to acquisition of the ping-pong cycle in Drosophila ovarian somatic cells. Genes & Development. 30 (14), 1617-1622 (2016).
- Dequeant, M. L., et al. Discovery of progenitor cell signatures by time-series synexpression analysis during Drosophila embryonic cell immortalization. Proceedings of the National Academy of Sciences of the United States of America. 112 (42), 12974-12979 (2015).
- Young, L., Sung, J., Stacey, G., Masters, J. R. Detection of Mycoplasma in cell cultures. Nature Protocols. 5 (5), 929-934 (2010).
- Shields, G., Sang, J. H. Improved medium for culture of Drosophila embryonic cells. Drosophila Information Service. 52, 161 (1977).
- Freshney, R. I., Capes-Davis, A., Gregory, C., Przyborski, S. . Culture of animal cells : a manual of basic technique and specialized applications. Seventh edition. edn. , (2016).
- Lee, H., et al. DNA copy number evolution in Drosophila cell lines. Genome Biology. 15 (8), R70 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados