Method Article
Plataforma integrada da manipulação da pilha acoplada com a único-ponta de prova para a análise da espectrometria maciça das drogas e dos metabolitos em únicas pilhas da suspensão
Neste Artigo
Resumo
Uma plataforma integrada da manipulação da pilha é desenvolvida para o uso conjuntamente com uma instalação de espectrometria maciça da único-ponta de prova para a análise em linha de pilhas individuais da suspensão circunstâncias ambientais.
Resumo
A espectrometria maciça da única pilha (SCMS) permite a deteção sensível e a análise exata de escalas largas de espécies celulares no nível da individual-pilha. O único-sonda, uma amostragem de microescala e dispositivo de ionização, pode ser acoplado com um espectrómetro de massa para on-line, análise rápida SCMS de constituintes celulares em condições ambientais. Previamente, a técnica de SCMS da único-ponta de prova foi usada primeiramente para medir as pilhas imobilizadas em um substrato, limitando os tipos de pilhas para estudos. No presente estudo, a tecnologia SCMS de sonda única foi integrada com um sistema de manipulação celular, tipicamente utilizado para fertilização in vitro. Essa plataforma integrada de manipulação e análise de células usa uma sonda de seleção de células para capturar células flutuantes individuais identificadas e transferir as células para a ponta de sonda única para lise de microescala, seguida de análise de espectrometria de massa imediata. Este processo de captação e transferência remove as células da solução circundante antes da análise, minimizando a introdução de moléculas matriciais na análise de espectrometria de massas. Esta instalação integrada é capaz da análise de SCMS de pilhas paciente-isoladas alvejadas atuais em amostras dos líquidos de corpo (por exemplo, urina, sangue, saliva, etc.), permitindo aplicações potenciais da análise de SCMS à medicina humana e à biologia da doença.
Introdução
A biologia humana, especialmente a biologia da doença, é cada vez mais entendida como o resultado de atividades no nível de células individuais, mas os métodos analíticos tradicionais, como a espectrometria de massas por cromatografia líquida (LCMS), são geralmente utilizados para analisar amostras preparadas a partir de populações de células, enquanto a informação molecular adquirida não pode representar com precisão os processos químicos no nível de células individuais. Estes métodos padrão, tradicionais são incapazes de discernir os efeitos da heterogeneidade celular em uma medida analítica, e o processo de destruir e de misturar as pilhas para preparar o lisado conduz potencialmente à alteração ou à perda de celular componentes1,2. Essas limitações dos métodos tradicionais são especialmente importantes na análise das células do paciente, nas quais as amostras obtidas podem conter uma mistura complexa de muitos tipos de células diferentes. Para superar essas deficiências, métodos de análise molecular de células únicas, incluindo métodos de espectrometria de massa de células simples (SCMS), estão sendo cada vez mais desenvolvidos e aplicados à Bioanálise, especialmente de metabólitos celulares e de baixo peso molecular biomoléculas3,4.
As primeiras técnicas de SCMS desenvolvidas utilizaram técnicas à base de vácuo para realizar as análises em condições não-ambientais2,5,6,7,8,9, 10,11. As técnicas de SCMS não-ambientais são capazes de analisar lipídios e metabólitos celulares, mas exigem pré-tratamento de amostra em condições artificiais e, portanto, não são adequados para análise em tempo real. O processo de preparação da amostra para a análise não-ambiental inclui a adição de componentes da matriz, e esta preparação pode alterar componentes celulares de seu ambiente natural12. Portanto, técnicas de espectrometria de massa ambiente (MS), que não necessitam de vácuo para o ambiente de amostragem, são utilizadas para analisar as células em um ambiente Near-Native. Não ter um ambiente do vácuo permite a versatilidade no projeto experimental; as câmeras podem ser adicionadas para monitorar o processo celular e técnicas de ionização mais suaves podem ser combinadas com técnicas de separação para receber melhor informação de cada experimento de uma única célula4,12,13 ,14,15,16,17,18,19,20,21,22 ,23,24,25,26,27,28,29,30,31 ,32,33,34,35,36, 37, 38, 39, 40 ,41,42.
O método SCMS de sonda única é uma técnica ambiental que analisa as linhagens celulares de câncer de mamíferos ao vivo em um ambiente próximo-nativo21,43,44,45,46. Além disso, o dispositivo de sonda única tem sido usado para outras aplicações de espectrometria de massas, incluindo a análise de moléculas extracelulares em esferóides multicelulares e MS Imaging dos tecidos47,48,49 ,50,51,52. Entretanto, como a imobilização celular em substratos é necessária para este método, as células de suspensão não podem ser diretamente analisadas por meio dessa técnica3,53. Portanto, o sistema SCMS de sonda única não pôde ser usado diretamente para a amostra de células únicas não aderentes, como linhas celulares não aderentes ou células de suspensão isoladas do sangue de um paciente ou outros fluidos corporais54. Neste trabalho, uma plataforma integrada de manipulação de células (ICMP) é acoplada à técnica SCMS de sonda única para analisar em linha as células de suspensão ao vivo com a preparação mínima da amostra (Figura 1)46. O ICMP consiste em um microscópio invertido para monitorar a seleção de células, uma sonda de seleção de células de vidro, um microinjector para capturar células flutuantes individuais, uma placa aquecida para manter a temperatura celular, dois sistemas de manipulação de células para controlar a movimentos da sonda de seleção de células de vidro e sonda única, e um microscópio digital para observar a transferência celular da ponta da sonda de seleção de células para a ponta de sonda única. A fabricação da sonda única é detalhada em publicações anteriores e não será abordada aqui21,48. O sistema ICMP/sonda única é acoplado a um espectrómetro de massa de alta resolução. Esta configuração integrada permite a amostragem de células individuais identificadas de amostras biológicas complexas com efeitos mínimos de moléculas de matriz.
Protocolo
1. vidro célula-seleção sonda de fabricação
- Converta a tubulação de vidro do único-furo em uma ponta de prova afilada com uma ponta afiada.
- Coloque um tubo de vidro de furo único (ID: 0,3 mm, OD: 1,1. mm) nas braçadeiras de um suporte de pipeta vertical, centrando o vidro em relação à bobina de aquecimento e aperte para fixar o tubo no lugar. A bobina de aquecimento é composta por um fio de resistência de níquel-cromo 18-gauge (~ 60 mm de comprimento) enrolado em torno de uma haste metálica (diâmetro = 3,90 mm) 2,5 vezes.
- Defina a tubagem de vidro com o programa de temperatura 19,5 (unidade do fabricante). Este parâmetro pode ser modificado para um determinado instrumento.
- Ajuste o êmbolo do solenóide em 4 (unidade do fabricante). Este parâmetro pode ser modificado para um determinado instrumento.
- Acionar o solenóide para puxar a tubulação de vidro. Esta etapa cria duas sondas fundidas na ponta.
- Use pinças para cortar ~ 1 mm de distância da ponta de cada sonda, criando um orifício de ~ 10 μm de diâmetro na ponta da sonda.
- Dobre a ponta de prova de vidro para o acoplamento fácil à instalação do ICMP/único-Probe SCMS.
- Definir uma sonda de vidro puxado para o microforge, posicionando a ponta ~ 3 mm acima do fio de aquecimento de platina.
- Gire o calor no fio de platina para 30% da temperatura máxima.
- Dobre a sonda ~ 45 ° da posição original (Figura 2).
2. conjunto integrado da plataforma da manipulação da pilha
- Coloc o microscópio invertido, o microinjector, e os dois sistemas de manipulação da pilha em uma tabela motorizada para o acoplamento fácil com o espectrómetro maciço.
- Modifique um dos sistemas de manipulação de células para acomodar uma única sonda, substituindo o final por um grampo de braço.
- Use uma seringa plástica com uma agulha para encher o microinjector com óleo mineral. Evite bolhas no tubo, pois isso afetará o suctioning.
- Substitua a pastilha de estágio do microscópio invertido pela placa aquecida. Ajuste a placa aquecida a 37 ° c antes da análise.
- Configure o dispositivo de seleção de células de vidro.
- Insira a sonda de seleção de células de vidro no interior do suporte metálico do microinjector colocando o lado longo (não dobrado) no suporte capilar e apertando o parafuso para fixar a sonda no lugar. Posicione o ângulo da ponta da sonda paralelo à placa aquecida.
Cuidado: a sonda de vidro é muito afiada e frágil, e quebra facilmente. Proteja seus olhos e seja extra cauteloso ao introduzir a ponta de prova no microinjector. - Fixe o suporte do metal do microinjector no sistema de manipulação da pilha. Posicione a ponta da sonda perto do meio da luz do microscópio invertido.
- Insira a sonda de seleção de células de vidro no interior do suporte metálico do microinjector colocando o lado longo (não dobrado) no suporte capilar e apertando o parafuso para fixar a sonda no lugar. Posicione o ângulo da ponta da sonda paralelo à placa aquecida.
3. criar um tubo de transferência de íon estendido para a entrada de espectrómetro de massa
- Use um cortador de metal para cortar um pedaço de tubos de aço inoxidável (OD: 0, 625 (1/16) em, ID: 0, 21 in) ~ 250 mm de comprimento.
- Medir 135 mm a partir do fim e colocar um metal Feral assim ~ 135 mm será exposto à atmosfera e ~ 115 mm estará dentro do espectrómetro de massa. Fixe o Feral usando duas chaves para apertá-lo.
4. Acople o ICMP com uma instalação da único-ponta de prova
- Fixe a corrediça de vidro que contem a único-ponta de prova na braçadeira do braço do sistema da manipulação da pilha.
Nota: as pontas de prova únicas são fabricadas de acordo com um protocolo previamente publicado48 com duas mudanças menores no estudo atual: o emissor de nano-ESI é feito mais por muito tempo para o acoplamento fácil ao espectrómetro maciço, e as único-pontas de prova são coladas ao vidro lado direito para evitar interferir com o movimento espacial do dispositivo de seleção de células de vidro (Figura 2). - Conecte o capilar de fornecimento de solvente a uma União condutora colocando o capilar na luva (1/16 x .005 in) da ponteira plástica e apertando o dedo o encaixe.
- Conecte o outro lado da União condutora a um capilar (ID: 40 μm, OD: 150 μm), que é conectado a uma seringa contendo o solvente de amostragem, colocando o capilar na manga (1/32 x .007 in) e apertando o encaixe. Use acetonitrila com 0,1% de ácido fórmico como o solvente de amostragem nestes experimentos.
Nota: o solvente de amostragem é flexível, mas deve conter principalmente acetonitrila (ou acetonitrila com ácido fórmico para melhor ionização) para uma lise celular microescala rápida. - Fixe a seringa na bomba da seringa no Espectrómetro de massas.
- Coloque o cabo de tensão de ionização sobre um fio de cobre ligado à União condutora.
- Conecte o outro lado da União condutora a um capilar (ID: 40 μm, OD: 150 μm), que é conectado a uma seringa contendo o solvente de amostragem, colocando o capilar na manga (1/32 x .007 in) e apertando o encaixe. Use acetonitrila com 0,1% de ácido fórmico como o solvente de amostragem nestes experimentos.
- Posicione o emissor nano-ESI ~ 1 mm no orifício do tubo de transferência de íon estendido.
- Use o sistema de manipulação de células para controlar os movimentos espaciais da sonda única e posicione o emissor nano-ESI centralmente na frente da tubulação de transferência de íons estendida.
5. preparação da amostra de células suspensas
- O dia antes da análise (~ 18-24 h), semente para fora das pilhas para testar em um balão da cultura da pilha (T25). K562 células de leucemia mielóide humana são utilizadas como modelos neste estudo.
- Calor 1x fosfato tampão salino (PBS) e Roswell Park Memorial Institute (RPMI) médio suplementado com 10% de soro fetal bovino sintético (FBS) e 1% de penicilina-estreptomicina a 37 ° c por 30 min.
- Semente ~ 1 x 106 células em um volume total de 10 ml, combinando células com meio quente. Em geral, use uma pipeta de 10 mL para colocar 8 mL de meio RPMI em um balão de cultura celular. Em seguida, use uma pipeta de 2 mL para colocar 2 mL de células k562 confluentes o meio para ~ 1 x 106 células.
- Incubar as células a 37 ° c e 5% CO2 até a análise.
- Prepare células para análise.
- Pipetam as células do balão de cultura celular para um tubo de centrífuga de 15 mL.
- Gire as células para baixo em 400 x g e 37 ° c por 5 min e descarte o sobrenadante.
- Reressuscitem as células em 4 mL de meio RPMI contendo o composto de fármaco na concentração de tratamento desejada.
Nota: para análise das células de controlo, Ressuspender as células em 4 mL de meio RPMI e saltar para o passo 6. - Incubar as células durante a duração do tempo de tratamento a 37 ° c e 5% CO2.
- Gire as células para baixo em 400 x g e 37 ° c por 5 min. aspirar o sobrenadante.
- As células são ressuscipended em 10 mL de PBS, e centrifugar a 400 x g e 37 ° c por 5 min. Depois de girar, descarte o sobrenadante. Repita este passo 3 vezes para minimizar a detecção de drogas de constituintes extracelulares.
- Reressuscitem as células em 4 mL de PBS para análise.
6. realize medições do SCMS usando a configuração ICMP/sonda única
- Personalize parâmetros para o espectrómetro de massa para o experimento.
- No título modo de digitalização do software do instrumento, selecione definir digitalização. Use uma resolução de 60.000 m/∆ m em m/z 400, 1 microscan, 100 ms tempo de injeção máxima, e controle de ganho automático (AGC) em. Uma escala maciça (m/z) de 100-1000 foi utilizada para os experimentos. Os parâmetros podem ser modificados com base no modelo do instrumento.
- a bomba da seringa, selecione uma taxa de fluxo de 150 nl/min. taxa de fluxo precisa ser otimizado para cada experimento.
- Selecione NSI Source e aplique uma voltagem de ~ 4,5 kV. Esse parâmetro também precisa ser otimizado para cada experimento.
- Gire sobre o microscópio invertido (com ampliação 40x selecionada para a placa superior e a lente inferior) e conecte-a ao USB-porto de um portátil para capturar alimentações ao vivo-video. Gire sobre a placa aquecida e ajuste-a a 37 ° c.
- No computador, vá para a guia adquirir dados e selecione continuamente em tempode aquisição .
- Prepare a amostra para análise.
- Pipete 2-3 mL de amostra para a tampa de um pequeno prato de Petri (35 mm x 12 mm).
- 6.4.2 Posicione a amostra no centro da luz do microscópio invertido em cima da placa aquecida.
- Prepare a sonda de seleção de células de vidro para análise. Use o sistema da manipulação da pilha para mover a ponta de prova assim que sua ponta é focalizada o microscópio invertido no mesmo plano que as pilhas.
- Selecione uma célula individual para análise.
- Use o sistema de manipulação de células para mover a ponta da sonda de seleção de célula para uma célula de destino. Este processo é monitorado usando o microscópio invertido.
Nota: se a ponta da sonda de seleção de células não puder ser focada no mesmo plano que as células, é possível que a parte dobrada da sonda não esteja adequadamente inclinada. Ajuste a posição da sonda de seleção de células até que ambas as pontas da sonda possam ser focalizadas junto com as células o microscópio. - Gire delicadamente o punho do microinjector para ajustar a posição do óleo mineral dentro da tubulação. Uma sucção delicada é fornecida pelo microinjector para fixar a pilha alvejada à ponta da ponta de prova da pilha-seleção.
Nota: se a célula não puder ser capturada pela sonda de seleção de células através da força de sucção, verifique a sonda de seleção de células para garantir que está totalmente inserida no suporte capilar. Além, inspecione os níveis do óleo mineral no microinjector e na tubulação, e expelir o ar se há algum. - Use o sistema de manipulação de células para mover a célula na ponta da sonda de seleção de células para a ponta de sonda única, usando um microscópio digital focado na ponta de sonda única para monitorar esse processo. Ao tocar, uma gota pequena do acetonitrila na ponta da único-ponta de prova induz um lise rápido da pilha, e então o lisado da pilha é ionizado imediatamente para a análise em linha do MS.
Nota: uma vez que a célula seleccionada está protegida para a ponta da sonda de selecção de células através de uma sucção suave, esta célula pode ser potencialmente destacada durante a transferência para a ponta de sonda única. Conseqüentemente, se os sinais do íon de lipídios celulares típicos (veja resultados representativos abaixo) não são observados dentro de 5 s, é possível que a pilha se tornou unattached, e a seleção de uma pilha diferente é precisada.
- Use o sistema de manipulação de células para mover a ponta da sonda de seleção de célula para uma célula de destino. Este processo é monitorado usando o microscópio invertido.
Resultados
Primeiro, as células k562 não tratadas são usadas para estabelecer o método experimental. Em um experimento típico do SCMS, alterações óbvias de espectros de massa podem ser observadas a partir da transferência de uma célula, durante a detecção de conteúdo celular, e após o término da medida (Figura S1). Três picos celulares comuns lipídicos (fosfatidilcolina, PC), incluindo PC (34:4) (m/z 754,536), PC (36:4) (m/z 782,567), e PC (38:5) (m/z 808,583), são monitorados para garantir que a célula é transferida com sucesso e celular os conteúdos são detectados (Figura S2)21,43,46,55,56. Se os picos lipídicos não forem observados dentro de 5 s, o nível de óleo mineral no microinjetor é alterado para reduzir a sucção segurando a célula na ponta da sonda de seleção de células; o cuidado precisa de ser tomado de modo que nenhum óleo mineral esteja empurrado para fora da ponta de prova da célula-seleção. A identidade de muitos PC ' s na escala maciça de m/z 750-850 é confirmada usando MS/MS em amostras não tratadas do lisado da pilha (Figura 3, Figura S2, tabela 1)46.
K562 células também são submetidas ao tratamento com vários compostos de drogas para expandir a versatilidade do método. K562 células são incubadas com gemcitabina (1 μM) e Taxol (1 μM) para 1 h e OSW-1 (100 nM, 1 μM) para 4 h e 2 h, respectivamente. As células são então lavadas com PBS para minimizar a detecção de compostos de drogas a partir de conteúdo extracelular. A contribuição da matriz (por exemplo, íons de meio de cultura celular, PBS e solvente) para espectros de massa de conteúdo celular pode ser eliminada através da subtração de dados, devido aos seus sinais de íons significativamente diferentes (Figura S3). Todos os três compostos de drogas são detectados usando a configuração de MS ICMP/única sonda (Figura S4)46. Estes resultados sugerem que este método pode ser usado para estudar lipídeos intracelulares, fármacos e metabólitos no nível de células únicas a partir de pilhas em solução em um ambiente Near-Native.
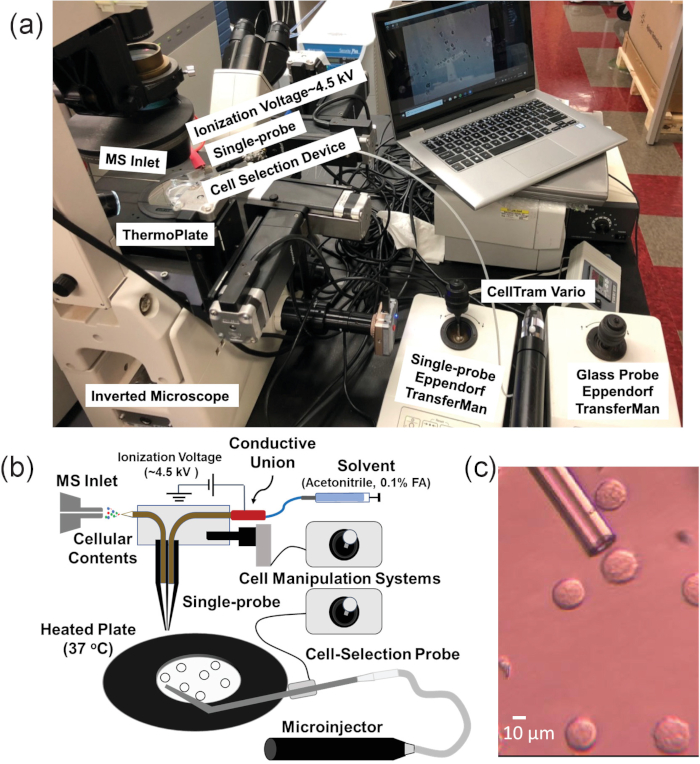
Figura 1. Configuração experimental para experimentos de MS de célula de suspensão única. (A) a plataforma integrada de manipulação de células (ICMP) acoplada a um espectrómetro de massa. (B) esquemático para análise de células suspensas. (C) visão experimental de células k562 a serem selecionadas usando a sonda de seleção de células. Reproduzido com permissão de Standke et al.46. Copyright 2019 sociedade química americana. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2. Fotos de uma única sonda modificada e uma sonda de seleção de células utilizada para experimentos de MS de célula de suspensão única. Por favor clique aqui para ver uma versão maior desta figura.
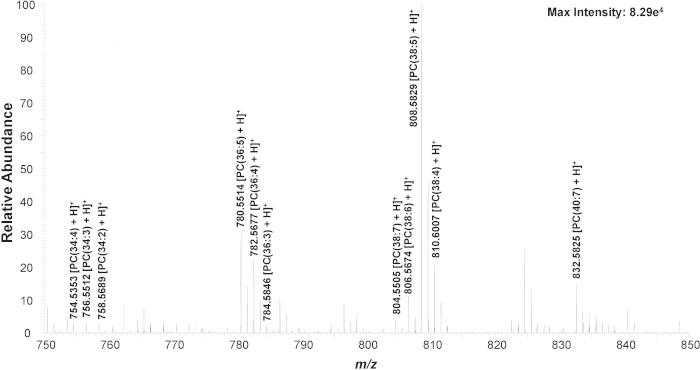
Figura 3. Zoomed-no espectro maciço de uma única pilha que mostra a espécie representativa (m/z 750-850). As estruturas químicas são confirmadas por meio da análise MS/MS (Figura S1). Reproduzido com permissão de Standke et al46. Copyright 2019 sociedade química americana. Por favor clique aqui para ver uma versão maior desta figura.
| Molécula de drogas* | m/z | Erro de massa (ppm) |
| [Gemcitabine + H] + | 264, 76 | 11,32 |
| [Taxol + nd] + | 876,318 | 2,74 |
| [OSW-1 + nd] + | 895,445 | 0,89 |
| Lipídios celulares | ||
| [PC (34:4) + H] + | 754,535 | 3,71 |
| [PC (34:3) + H] + | 756,551 | 3,44 |
| [PC (34:2) + H] + | 758,569 | 0,66 |
| [PC (36:5) + H] + | 780,551 | 3, 7 |
| [PC (36:4) + H] + | 782,568 | 2,17 |
| [PC (36:3) + H] + | 784,585 | 0,64 |
| [PC (38:7) + H] + | 804,551 | 4,1 |
| [PC (38:6) + H] + | 806,567 | 2,48 |
| [PC (38:5) + H] + | 808,583 | 2,72 |
| [PC (38:4) + H] + | 810,601 | 0 |
| [PC (40:7) + H] + | 832,583 | 3,12 |
Tabela 1. Identificou componentes celulares usando a configuração ICMP/sonda única. A detecção de todos os compostos farmacológicos foi confirmada comparando-se os resultados do MS/MS com o composto padrão.
Discussão
A plataforma integrada da manipulação e da análise da pilha é construída para expandir a versatilidade do método da único-ponta de prova MS, permitindo a análise em linha, rápida de pilhas não-aderentes em um ambiente próximo-nativo. Uma grande vantagem da técnica é que a preparação mínima da amostra é necessária, de modo que as células são analisadas em condições que imitam seu estado padrão. Particularmente, células individuais de interesse podem ser visualmente identificadas e selecionadas, minimizando a influência do efeito matricial na eficiência da ionização de MS, mantendo as células em seu ambiente natural, de modo que os resultados são mais representativos das células nativas status (Figura S3). Esta técnica pode potencialmente ser usada para estudar as pilhas pacientes suspendidas nos biofluídos em estudos futuros. Outra vantagem desta técnica é a seleção flexível do solvente de amostragem. É importante incluir o acetonitrila como o solvente principal da amostragem de modo que o lysis da microescala possa ocorrer ràpida. Potencialmente, as normas internas (por exemplo, compostos de medicamentos rotulados isotopicamente) podem ser adicionadas ao solvente de amostragem para quantificação de moléculas de interesse (por exemplo, moléculas de drogas) de células individuais, incluindo aquelas que podem desempenhar um papel fundamental na revolução personalizar os tratamentos medicamentoso no futuro54.
Embora este sistema integrado possa convenientemente ser usado para analisar escalas largas das pilhas, uma limitação do método é que nem a única-ponta de prova nem a sonda de seleção da pilha estão comercialmente-disponíveis; diating a necessidade para a optimização de muitos parâmetros (por exemplo, taxa de fluxo, tensão, comprimento entre o emissor de nano-ESI e a tubulação de transferência do íon, etc.) antes de cada experimento. Além disso, devido à pequenez da sonda de sonda única e seleção de células, a perturbação ambiental (por exemplo, fluxo de ar) pode resultar em dificuldades para estabelecer uma junção entre as duas sondas. Uma solução de curto prazo é a dobra da sonda de seleção de células perto do fim para minimizar o comprimento da afilagem. O trabalho futuro inclui o desenvolvimento de uma habitação para colocar as partes críticas da configuração para minimizar os efeitos ambientais. Devido à quantidade limitada de conteúdo celular e tempo de aquisição curto (~ 2-3 s) de uma célula, a análise de MS/MS só pode ser conduzida para espécies relativamente abundantes. Outros fatores que influenciam a sensibilidade da deteção incluem a eficiência suprimida da ionização devido à introdução da matriz junto com a pilha e a perda potencial do íon através da tubulação prolongada da transferência do íon.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores agradecem a Naga Rama Kothapalli por seu trabalho no desenvolvimento da preparação da amostra para as células de suspensão e experimentos de lisado celular. Além disso, os autores agradecem ao NIH (R01GM116116 e R21CA204706) pelo financiamento.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetontrile | Millipore Co. | AX0145-1 | Sampling solvent |
| CellTram Vario | Eppendorf | 6221 | ICMP |
| Copper wire | stores.ebay.com/jewelerheaven | Dead soft, round, 20 guage, 25 ft | Conductive union setup |
| Digital stereomicroscope | Shenzhen D&F Co. | Supereyes T004 | Analysis |
| Disposable micropipette, 1-5 µL | Rochester Scientific | 5065 | Cell-selection probe fabrication |
| Dual bore quartz tubing, 1.120"x0.005"x12" | Friedrich & Dimmock, Inc. | MBT-005-020-2Q | Single-probe fabrication |
| Epoxy resin | Devcon | Part No. 20945 | Single-probe fabrication |
| Eppendorf cell manipulation system | Eppendorf | Transferman NK517800397-U.R. | ICMP |
| External nut | VALCO*CHEMINERT | EN1 | Ion transfer tube fabrication |
| Formic acid | Sigma-Aldrich | 399388-500ML | Sampling solvent |
| Fused silica capillary, ID: 40 µm, OD: 100 µm | Polymicro Technologies | TSP040105 | Single-probe fabrication, conductive union setup |
| Fused silica capillary, ID: 50 µm, OD: 150 µm | Polymicro Technologies | 1068150015 | Conductive union setup |
| HyClone Synthetic fetal bovine serum (FBS) | Fischer Sci | SH3006603 | Cell culture |
| Inline MicroFilter | IDEX Health & Science LLC | M-520 | Conductive union setup |
| Laser puller | Sutter Instrument Co. | Model P-2000 | Single-probe fabrication |
| LED UV lamp | Foshan Liang Ya Dental Equipment | LY-C240 | Single-probe fabrication |
| LTQ Orbitrap mass spectrometer | Thermo Scientific | LTQ Orbitrap XL | Analysis |
| Microforge | Narishige, Co. | MF-9 | Cell-selection probe fabrication |
| Microunion | IDEX Health & Science LLC | M-539 | Conductive union |
| PEEK tubing, 1/32x0.005x 5ft | IDEX Health & Science LLC | 1576 | Conductive union setup |
| PEEK tubing, 1/32x0.007x 5ft | IDEX Health & Science LLC | 1577 | Conductive union setup |
| Penicillin/Streptomycin | Gibco/Life Technologies | 15140-122 | Cell culture |
| Petri dish, 35x10 mm | VWR | 25382-334 | Sample preparation |
| Phosphate Buffered Saline (PBS) | VWR | 0780-50L | Cell culture |
| Platinum wire | Narishige, Co. | Model PT-A | Microforge |
| Power supply | Nikon | PSM-2120 | ICMP |
| RPMI, 1X with Corning glutagro | Corning | 10-104-CV | Cell culture |
| Single-bore tubes | Boralex | 5065 | Cell-selection probe fabrication |
| Stainless steel ferrules, for 1/16" OD | IDEX Health & Science LLC | VHP-200-01x | Ion transfer tube fabrication |
| Stainless steel tubing, 1/32x 205 µm x30 cm | IDEX Health & Science LLC | U-1128 | Ion transfer tube fabrication |
| Syringe, 250 µL | Hamilton | 1725LTN250UL | Sampling syringe |
| T25 flask | CellStar | 690160 | Cell culture |
| Thermo LTQ XL ion source interface flange | New Objective | PB5500 | Analysis |
| ThermoPlate | TokaiHit | 55R30N | ICMP |
| TrypLE Express | Gibco | 12605-010 | Cell culture |
| Tube cutter, for 1/16" stainless steel | SUPELCO | 58692-U | Ion transfer tube fabrication |
| USB digital photography microscope | dx.com | SO2 25~500X | Analysis |
| UV curing resin | Prime Dental | Item No. 006.030 | Single-probe fabrication |
| Vertical pipette puller | David Kopf Instruments | Model 720 | Cell-selection probe fabrication |
| Voltage housing | PicoChip | PCH-A00120 | ICMP/MS interface |
| Wire cutter | Craftsman | 4 1/2 in end nipper | Conductive union setup |
Referências
- Mao, S., et al. In Scatheless Cell Detachment Reveals Correlation between Adhesion Strength and Viability at Single-Cell Resolution. Angewandte Chemie International Edition. 57 (1), 236-240 (2017).
- Rubakhin, S. S., Romanova, E. V., Nemes, P., Sweedler, J. V. Profiling metabolites and peptides in single cells. Nature Methods. 8 (4), S20-S29 (2011).
- Linwen, Z., Akos, V. Single-Cell Mass Spectrometry Approaches to Explore Cellular Heterogeneity. Angewandte Chemie International Edition. 57 (17), 4466-4477 (2017).
- Chen, X., et al. Single-cell analysis at the threshold. Nature Biotechnology. 34, 1111(2016).
- Fu, Q., Tang, J., Cui, M., Xing, J., Liu, Z., Liu, S. Application of porous metal enrichment probe sampling to single cell analysis using matrix-assisted laser desorption ionization time of flight mass spectrometry (MALDI-TOF-MS). Journal of Mass Spectrometry. 51, (2016).
- Passarelli, M. K., Ewing, A. G., Winograd, N. Single-Cell Lipidomics: Characterizing and Imaging Lipids on the Surface of Individual Aplysia californica Neurons with Cluster Secondary Ion Mass Spectrometry. Analytical Chemistry. 85 (4), 2231-2238 (2013).
- Passarelli, M. K., et al. Single-Cell Analysis: Visualizing Pharmaceutical and Metabolite Uptake in Cells with Label-Free 3D Mass Spectrometry Imaging. Analytical Chemistry. 87 (13), 6696-6702 (2015).
- Ostrowski, S. G., Kurczy, M. E., Roddy, T. P., Winograd, N., Ewing, A. G. Secondary Ion MS Imaging To Relatively Quantify Cholesterol in the Membranes of Individual Cells from Differentially Treated Populations. Analytical Chemistry. 79 (10), 3554-3560 (2007).
- Ibáñez, A. J., et al. Mass spectrometry-based metabolomics of single yeast cells. Proceedings of the National Academy of Sciences of the United States of America. 110 (22), 8790-8794 (2013).
- Lanni, E. J., Rubakhin, S. S., Sweedler, J. V. Mass spectrometry imaging and profiling of single cells. Journal of Proteomics. 75 (16), 5036-5051 (2012).
- Ong, T. -H., Tillmaand, E. G., Makurath, M., Rubakhin, S. S., Sweedler, J. V. Mass spectrometry-based characterization of endogenous peptides and metabolites in small volume samples. Biochimica et biophysica acta. 1854 (7), 732-740 (2015).
- Yang, Y., Huang, Y., Wu, J., Liu, N., Deng, J., Luan, T. Single-cell analysis by ambient mass spectrometry. TrAC Trends in Analytical Chemistry. 90, 14-26 (2017).
- Sims, C. E., Allbritton, N. L. Analysis of single mammalian cells on-chip. Lab on a Chip. 7 (4), 423-440 (2007).
- Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. Live single-cell video-mass spectrometry for cellular and subcellular molecular detection and cell classification. Journal of Mass Spectrometry. 43 (12), 1692-1700 (2008).
- Fujii, T., et al. Direct metabolomics for plant cells by live single-cell mass spectrometry. Nature Protocols. 10, 1445(2015).
- Esaki, T., Masujima, T. Fluorescence Probing Live Single-cell Mass Spectrometry for Direct Analysis of Organelle Metabolism. Analytical Sciences. 31 (12), 1211-1213 (2015).
- Tsuyama, N., Mizuno, H., Tokunaga, E., Masujima, T. Live Single-Cell Molecular Analysis by Video-Mass Spectrometry. Analytical Sciences. 24 (5), 559-561 (2008).
- Mizuno, N., Harada, T., Masujima, T., T, H. Live single-cell video-mass spectrometry for cellular and subcellular molecular detection and cell classification. Journal of Mass Spectrometry. , (2008).
- Phelps, M., Hamilton, J., Verbeck, G. F. Nanomanipulation-coupled nanospray mass spectrometry as an approach for single cell analysis. Review of Scientific Instruments. 85 (12), 124101(2014).
- Phelps, M. S., Verbeck, G. F. A lipidomics demonstration of the importance of single cell analysis. Analytical Methods. 7 (9), 3668-3670 (2015).
- Pan, N., Rao, W., Kothapalli, N. R., Liu, R., Burgett, A. W. G., Yang, Z. The Single-Probe: A Miniaturized Multifunctional Device for Single Cell Mass Spectrometry Analysis. Analytical Chemistry. 86 (19), 9376-9380 (2014).
- Gong, X., et al. Single Cell Analysis with Probe ESI-Mass Spectrometry: Detection of Metabolites at Cellular and Subcellular Levels. Analytical Chemistry. 86 (8), 3809-3816 (2014).
- Lorenzo Tejedor, M., Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. In Situ Molecular Analysis of Plant Tissues by Live Single-Cell Mass Spectrometry. Analytical Chemistry. 84 (12), 5221-5228 (2012).
- Shimizu, T., et al. Live Single-Cell Plant Hormone Analysis by Video-Mass Spectrometry. Plant and Cell Physiology. 56 (7), 1287-1296 (2015).
- Yamamoto, K., et al. Cell-specific localization of alkaloids in Catharanthus roseus stem tissue measured with Imaging MS and Single-cell MS. Proceedings of the National Academy of Sciences. 113 (14), 3891(2016).
- Date, S., Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. Direct Drug Metabolism Monitoring in a Live Single Hepatic Cell by Video Mass Spectrometry. Analytical Sciences. 28 (3), 201(2012).
- Hiyama, E., et al. Direct Lipido-Metabolomics of Single Floating Cells for Analysis of Circulating Tumor Cells by Live Single-cell Mass Spectrometry. Analytical Sciences. 31 (12), 1215-1217 (2015).
- Masuda, K., Abouleila, Y., Ali, A., Yanagida, T., Masujima, T. Live Single-Cell Mass Spectrometry (LSC-MS) for Plant Metabolomics. BT - Plant Metabolomics: Methods and Protocols. , 269-282 (2018).
- Ferreira, C. R., Eberlin, L. S., Hallett, J. E., Cooks, R. G. Single oocyte and single embryo lipid analysis by desorption electrospray ionization mass spectrometry. Journal of Mass Spectrometry. 47 (1), 29-33 (2012).
- Ferreira, C. R., Pirro, V., Eberlin, L. S., Hallett, J. E., Cooks, R. G. Developmental phases of individual mouse preimplantation embryos characterized by lipid signatures using desorption electrospray ionization mass spectrometry. Analytical and Bioanalytical Chemistry. 404 (10), 2915-2926 (2012).
- Lee, J. K., Jansson, E. T., Nam, H. G., Zare, R. N. High-Resolution Live-Cell Imaging and Analysis by Laser Desorption/Ionization Droplet Delivery Mass Spectrometry. Analytical Chemistry. 88 (10), 5453-5461 (2016).
- Bergman, H. -M., Lanekoff, I. Profiling and quantifying endogenous molecules in single cells using nano-DESI MS. Analyst. 142 (19), 3639-3647 (2017).
- Yin, L., Zhang, Z., Liu, Y., Gao, Y., Gu, J. Recent advances in single-cell analysis by mass spectrometry. Analyst. 144 (3), 824-845 (2019).
- González-Serrano, A. F., et al. Desorption Electrospray Ionization Mass Spectrometry Reveals Lipid Metabolism of Individual Oocytes and Embryos. PLoS ONE. 8 (9), e74981(2013).
- Liu, Y., et al. Study on Variation of Lipids during Different Growth Phases of Living Cyanobacteria Using Easy Ambient Sonic-Spray Ionization Mass Spectrometry. Analytical Chemistry. 86 (14), 7096-7102 (2014).
- Shrestha, B., et al. Subcellular Metabolite and Lipid Analysis of Xenopus laevis Eggs by LAESI Mass Spectrometry. PLoS ONE. 9 (12), e115173(2014).
- Stolee, J. A., Shrestha, B., Mengistu, G., Vertes, A. Observation of Subcellular Metabolite Gradients in Single Cells by Laser Ablation Electrospray Ionization Mass Spectrometry. Angewandte Chemie International Edition. 51 (41), 10386-10389 (2012).
- Zhang, L., et al. In Situ metabolic analysis of single plant cells by capillary microsampling and electrospray ionization mass spectrometry with ion mobility separation. Analyst. 139 (20), 5079-5085 (2014).
- Shrestha, B., Nemes, P., Vertes, A. Ablation and analysis of small cell populations and single cells by consecutive laser pulses. Applied Physics A. 101 (1), 121-126 (2010).
- Stolee, J. A., Vertes, A. Toward Single-Cell Analysis by Plume Collimation in Laser Ablation Electrospray Ionization Mass Spectrometry. Analytical Chemistry. 85 (7), 3592-3598 (2013).
- Zhang, L., Vertes, A. Single-Cell Mass Spectrometry Approaches to Explore Cellular Heterogeneity. Angewandte Chemie International Edition. 57 (17), 4466-4477 (2018).
- Onjiko, R. M., Moody, S. A., Nemes, P. Single-cell mass spectrometry reveals small molecules that affect cell fates in the 16-cell embryo. Proceedings of the National Academy of Sciences. 112 (21), 6545 LP-6550 (2015).
- Liu, R., Pan, N., Zhu, Y., Yang, Z. T-Probe: An Integrated Microscale Device for Online In Situ Single Cell Analysis and Metabolic Profiling Using Mass Spectrometry. Analytical Chemistry. 90 (18), 11078-11085 (2018).
- Pan, N., Rao, W., Standke, S. J., Yang, Z. Using Dicationic Ion-Pairing Compounds To Enhance the Single Cell Mass Spectrometry Analysis Using the Single-Probe: A Microscale Sampling and Ionization Device. Analytical Chemistry. 88 (13), 6812-6819 (2016).
- Sun, M., Tian, X., Yang, Z. Microscale Mass Spectrometry Analysis of Extracellular Metabolites in Live Multicellular Tumor Spheroids. Analytical Chemistry. 89 (17), 9069-9076 (2017).
- Standke, S. J., Colby, D. H., Bensen, R. C., Burgett, A. W. G., Yang, Z. Mass Spectrometry Measurement of Single Suspended Cells Using a Combined Cell Manipulation System and a Single-Probe Device. Analytical Chemistry. 91 (3), 1738-1742 (2019).
- Rao, W., Pan, N., Yang, Z. High Resolution Tissue Imaging Using the Single-probe Mass Spectrometry under Ambient Conditions. Journal of The American Society for Mass Spectrometry. 26 (6), 986-993 (2015).
- Rao, W., Pan, N., Yang, Z. Applications of the Single-probe: Mass Spectrometry Imaging and Single Cell Analysis under Ambient Conditions. Journal of Visualized Experiments. (112), 53911(2016).
- Rao, W., Pan, N., Tian, X., Yang, Z. High-Resolution Ambient MS Imaging of Negative Ions in Positive Ion Mode: Using Dicationic Reagents with the Single-Probe. Journal of the American Society for Mass Spectrometry. 27 (1), 124-134 (2016).
- Liu, R., Zhang, G., Yang, Z. Towards rapid prediction of drug-resistant cancer cell phenotypes: single cell mass spectrometry combined with machine learning. Chemical Communications. 55 (5), 616-619 (2019).
- Sun, M., Yang, Z. Metabolomic Studies of Live Single Cancer Stem Cells Using Mass Spectrometry. Analytical Chemistry. 91 (3), 2384-2391 (2019).
- Tian, X., Zhang, G., Shao, Y., Yang, Z. Towards enhanced metabolomic data analysis of mass spectrometry image: Multivariate Curve Resolution and Machine Learning. Analytica Chimica Acta. 1037, 211-219 (2018).
- Hu, P., Zhang, W., Xin, H., Deng, G. Single Cell Isolation and Analysis. Frontiers in Cell and Developmental Biology. 4, 116(2016).
- Wu, C., Wu, P., Zhao, H., Liu, W., Li, W. Clinical Applications of and Challenges in Single-Cell Analysis of Circulating Tumor Cells. DNA and Cell Biology. 37 (2), 78-89 (2017).
- Schober, Y., Guenther, S., Spengler, B., Römpp, A. Single Cell Matrix-Assisted Laser Desorption/Ionization Mass Spectrometry Imaging. Analytical Chemistry. 84 (15), 6293-6297 (2012).
- Pulfer, M., Murphy, R. C. Electrospray mass spectrometry of phospholipids. Mass Spectrometry Reviews. 22 (5), 332-364 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados