Method Article
Preparação de coração e tecido cerebral para fotografia digital de macro após isquemia-reperfusão
Neste Artigo
Resumo
Apresentado aqui é um protocolo para a metodologia padronizada de preparação de tecidos de roedores após o experimento isquemia-reperfusão e diretrizes para estabelecer iluminação e configurações de câmera para aquisição de imagens de alta resolução. Este método é aplicável a toda fotografia experimental de órgãos de pequenos animais.
Resumo
A macrofotografia é aplicável para imagens de várias amostras de tecido em alta ampliação para realizar análises qualitativas e quantitativas. A preparação tecidual e a posterior captura de imagem são etapas realizadas imediatamente após o experimento isquemia-reperfusão (IR) e devem ser realizadas em tempo hábil e com os devidos cuidados. Para a avaliação de danos induzidos pelo IR no coração e no cérebro, este artigo descreve 2,3,5-triphenyl-2H-tetrazolium cloreto (TTC) de coloração, seguido de macro fotografia. A fotografia macro científica requer iluminação controlada e uma configuração de imagem apropriada. A metodologia padronizada garante imagens digitais detalhadas e de alta qualidade, mesmo que seja usada uma combinação de uma câmera digital barata e uma lente macro. Técnicas adequadas e possíveis erros na preparação da amostra e aquisição de imagens são discutidos, e exemplos da influência de configurações corretas e incorretas na qualidade da imagem são fornecidos. Dicas específicas são fornecidas sobre como evitar erros comuns, como sobretensão, armazenamento inadequado de amostras e condições de iluminação subótima. Este artigo mostra a metodologia apropriada para o corte e a coloração de tecidos cerebrais e de coração de rato e fornece diretrizes para o estabelecimento de iluminação e configurações de câmeras e técnicas de fotografia para aquisição de imagens de alta resolução.
Introdução
Por décadas, a fotografia e a análise de espécimes de coração e tecido cerebral têm sido uma parte importante dos experimentos de ciências da vida. O progresso da ciência e da inovação impulsiona o desenvolvimento de microscópios caros capazes de superresolução. Os fotomicrógrafos são obtidos em um ambiente de luz bem controlado, seguindo instruções detalhadas. Em contraste, a macrofotografia (em 1:2 ou maior ampliação) é frequentemente realizada em um ambiente de luz descontrolada usando configurações de imagem inadequadas. Muitas vezes, as técnicas de preparação de amostras e configuração da câmera precisam ser substancialmente otimizadas. Como resultado, fotografias macro de qualidade limitada têm sido amplamente publicadas em revistas científicas. A resolução e o contraste insuficientes limitam as possibilidades de quantificação precisa da imagem em estudos de RI.
Procedimentos experimentais de miocárdio1,2 e infartos cerebrais3,4 foram descritos em detalhes. O objetivo deste estudo é fornecer um guia passo-a-passo sobre como criar um sistema para fotografia e análise padronizada de espécimes de coração e tecido cerebral de roedores após experimentos de infarto. Isso inclui corte de tecido, coloração e macrofotografia de amostras cardíacas e cerebrais. A preparação de amostras de tecido é uma parte essencial do experimento, e os resultados da análise de imagem planimétrica dependem muito da qualidade das imagens obtidas5.
Esses métodos são particularmente úteis para a realização de medições e análises planimétricas de imagem em tecidos de roedores e podem ser de valor para a macro fotografia científica geral. Além disso, a alta qualidade e consistência das imagens permitem a realização de análises automatizadas de fotografias digitais, o que ajuda a economizar tempo, evitar a entrada do usuário e minimizar o risco de erros ou viés durante a análise de imagens. Isso resultará na geração de dados robustos e confiáveis e aumentará a tradução de descobertas pré-clínicas em novos tratamentos antiisquêmicos em clínicas.
Protocolo
Os procedimentos experimentais foram realizados de acordo com as diretrizes da Comunidade Europeia e das leis e políticas locais (Diretiva 2010/63/UE), e todos os procedimentos foram aprovados pelo Serviço de Alimentos e Veterinárias, Riga, Letônia.
1. Coloração e fatiamento do coração
NOTA: As técnicas descritas neste protocolo podem ser usadas após tanto langendorff-perfused coração isolado de rato6,7 e in vivo rat heart IR ensaios8,9,10,11. Para coloração após um ensaio in vivo de lesão de IR, presume-se que o coração está excisado, montado em uma cânula, e brevemente perfusado no modo de perfusão langendorff.
- Retire a cânula do coração da seringa cheia de solução Krebs-Henseleit e conecte-a a uma seringa cheia de uma solução quente (37 °C) de azul metileno de 0,1% na solução Krebs-Henseleit. Use uma seringa de 5 mL para corações de rato e uma seringa de 1-2 mL para corações de rato.
NOTA: Uma alternativa é encher o aparelho controlado por pressão ou fluxo (por exemplo, Langendorff) com uma solução azul contendo corantes. Durante o desprendimento e procedimento de montagem, é essencial não deixar bolhas de ar na cânula e não afrouxar a sutura usada para a reoclusão da artéria coronária. - Mais corações de rato perfuse com 4 mL da solução azul de metileno a uma taxa de ~4 mL/min e corações de rato perfuse com 1 mL de solução azul de metileno a uma taxa de ~0,5-1 mL/min.
NOTA: Com base na experiência, ambas as técnicas são seguras e fornecem coloração adequada; no entanto, o uso de um sistema de pressão controlado por pressão/hidrática é uma opção mais demorada, mas mais segura, contra a sobretenção para cientistas novatos. - Desconecte a cânula da seringa e remova o coração da cânula.
- Remova o excesso de azul de metileno por rolamento suave do coração em papel de tecido. Solte a ligadura ao redor da artéria coronária abrindo as fórceps hemostáticas e removendo o tubo plástico da sutura cirúrgica somente após a remoção do excesso de azul metileno.
NOTA: Nesta fase, é possível colocar o coração do rato em um pequeno saco plástico ou um microtubo centrífuga de 5 mL no congelador (-20 °C) por até 5-10 min. O tempo máximo de congelamento deve ser determinado experimentalmente em cada laboratório. O congelamento a curto prazo de um coração de rato pode ajudar um experimentador novato a cortá-lo em fatias de 1 mm de espessura. O congelamento de corações de rato não é recomendado. O congelamento excessivo por mais de 10 min a -20 °C deve ser evitado. - Coloque o coração de rato manchado em uma matriz de aço inoxidável (ver a Tabela de Materiais) para cortar o coração (Figura 1A). Em seguida, corte os ventrículos do coração em fatias de 2 mm de espessura (aponte para 6-7 fatias de um coração de rato adulto). Para corações de rato, corte os ventrículos do coração em fatias de 1,5 mm de espessura (aponte para pelo menos 4 fatias de um coração de rato adulto).
NOTA: Devem ser utilizadas lâminas de barbear compatíveis com matriz de corte. Em geral, lâminas de barbear de borda única compatíveis (por exemplo, espessura de até 0,01 polegada (0,254 mm)) podem ser usadas para cortar corações de ratos. Lâminas de barbear de duas bordas são geralmente usadas para corações de rato e geralmente são de até 0,004 polegadas (0,1 mm) de espessura.

Figura 1: Matrizes para o coração de rato e corte cerebral. (A) Coração de rato, (B) cérebro de rato. Clique aqui para ver uma versão maior desta figura.
- Após o corte, transfira as fatias para um tubo plástico de 15 mL. Adicione 5 mL de cloreto de tripheniltetrazolium (TTC) dissolvido em soro fisiológico tamponado de fosfato (PBS) ao tubo com as fatias do coração, e incubar por 10 minutos em um banho de água a 37 °C.
- Após a incubação na solução TTC, lave as fatias do coração pelo menos 2-3 vezes com PBS e prepare-se para a captura de imagem.
2. Coloração cerebral e fatiamento
- Após o experimento de oclusão da artéria cerebral média3,12, remova o cérebro, incluindo o tronco cerebral, do crânio, e lave-o em PBS gelado.
- Escolha o tamanho correto da matriz de aço inoxidável cerebral (veja a Tabela de Materiais) dependendo do peso dos animais (Figura 1B). Coloque o cérebro com seu lado ventral na matriz cerebral.
NOTA: Quando sentado na matriz, a superfície ventral do cérebro deve ser paralela à superfície superior do molde. - Usando lâminas, restrinja as partes frontal e caudal (2 lâminas de ambos os lados) do cérebro.
NOTA: Devem ser utilizadas lâminas de barbear compatíveis com matriz de corte. Em geral, uma lâmina de barbear de borda única compatível (espessura de até 0,01 polegada (0,254 mm)) pode ser usada para cortar cérebro de rato. - Coloque as lâminas parcialmente (não cortando totalmente o cérebro) nos canais entre a primeira e as últimas lâminas. Quando todas as lâminas forem inseridas e dispostas em paralelo, pressione todas as lâminas para baixo com a palma ao mesmo tempo para cortar o cérebro em fatias coronais de 2 mm.
- Segure as lâminas firmemente ao longo dos lados com dois dedos e remova-as juntamente com o cérebro fatiado da matriz.
- Disponha as fatias cerebrais uma a uma em uma bandeja (70 mL, 72 x 72 mm). Ao organizar as fatias, certifique-se de que a superfície anterior de cada fatia esteja sempre voltada para cima.
- Despeje quente (+37 °C) solução de 1% TTC em PBS nas fatias cerebrais e incuba-as por 8 min a 37 °C no escuro.
NOTA: As fatias cerebrais devem estar totalmente imersas na solução TTC durante a incubação. - Após a incubação em 1% de solução TTC, transfira as fatias cerebrais para a bandeja de plástico azul para capturar imagens. Organize as fatias cerebrais em ordem sequencial da parte frontal para a parte caudal, e use um bisturi para separar os hemisférios no plano sagital.
NOTA: A superfície da bandeja deve ser lavável, fosca e de uma cor que contraste fatias cerebrais (ou seja, não vermelho, branco ou rosa pálido).
3. Macro fotografia
- Fotografe as fatias de tecido imediatamente após a coloração.
NOTA: As fatias de coração podem ser armazenadas em PBS frio (a +4 °C) ou solução de formalina por até 30 min. As fatias cerebrais podem ser armazenadas em formalina por um período prolongado (1-2 semanas). - Configure a câmera escolhida com uma bateria carregada, cartão de memória e lente anexada em um suporte (Figura 2)
NOTA: Acenda as luzes acesas pelo menos 5-10 minutos antes da aquisição da imagem para aquecer o equipamento. As luzes LED atingem o brilho total em microsegundos.

Figura 2: Câmera e luzes configurada para fotografia macro. A câmera é perpendicular à superfície de imagem para garantir que o plano focal da câmera seja paralelo às amostras. Abreviação: LED = diodo emissor de luz. Clique aqui para ver uma versão maior desta figura.
- Dependendo das fontes de luz disponíveis, selecione as configurações apropriadas de balanço de branco ou realize a calibração da temperatura da cor de acordo com as instruções do manual da câmera.
NOTA: A luz LED branca (temperatura de 6.500 K) é a fonte de luz preferida para evitar a luz piscando por lâmpadas fluorescentes. - Mude a câmera para o modo totalmente manual, defina o ISO 100 e a abertura para f/10 e ajuste a velocidade do obturador para uma exposição ideal à imagem. Certifique-se de que o plano focal da câmera esteja paralelo à superfície onde a amostra será colocada.
NOTA: A função histograma é útil para garantir que as fatias de tecido não sejam superexpostas. - Conecte ou habilite um gatilho remoto com fio ou sem fio para evitar que a câmera trema quando o obturador for liberado.
NOTA: Uma alternativa é habilitar uma função de obturador atrasada, que atrasará o gatilho para 2 ou 10 s depois de pressionar o botão de gatilho. - Mergulhe completamente as fatias do coração em um recipiente com PBS.
NOTA: Slides imersos tendem a flutuar para longe de sua posição. Para minimizar a flutuação das fatias, use a menor bandeja possível na qual todas as fatias podem caber e a quantidade mínima de solução de imersão, garantindo que o espécime esteja totalmente imerso. Métodos alternativos incluem colocar as fatias entre lâminas de vidro ou usar um filtro de polarização na lente. Um filtro de polarização circular é anexado à lente e girado até que reflexos em uma tela de visão ao vivo da câmera desapareçam. - Disponha as fatias cerebrais em uma bandeja seca sem PBS ou outros líquidos.
NOTA: Um filtro polarizador é muito conveniente para capturar imagens de fatias cerebrais. - Coloque o recipiente com fatias sob a câmera com a lente macro e certifique-se de que todas as fatias se encaixem totalmente no campo de visão. Certifique-se de que as fatias estão no mesmo plano, ou seja, não curvadas ou enroladas.
- Verifique a exposição e ajuste as configurações da câmera, se necessário.
NOTA: Uma vez definido, não altere a exposição e outras configurações durante todo o experimento. - Capture o número (ou outra identificação) da amostra e imagem da fatia de tecido usando um gatilho remoto.
NOTA: Um marcador de tamanho, como uma régua mm, deve ser incluído no campo de visão quando for necessária a quantificação absoluta do tamanho da amostra. - Gire as fatias e capture suas imagens do outro lado.
Resultados
Figura 3A é uma fotografia de uma fatia de coração manchada de azul de metileno e TTC após infarto do miocárdio, que contém detalhes e informações de cores suficientes para análises planimétricas adicionais do tamanho do infarto (Figura 3B). Testamos como o congelamento do coração por 24 h afeta a integridade dos tecidos cardíacos (Figura 3C). O congelamento por um período prolongado (>1 h, Figura 3C) reduz a função mitocondrial; assim, a coloração TTC do coração não é vermelha, mas rosa pálida, e a borda entre tecidos necrosados e viáveis é borrada (Figura 3C).
Além disso, dois métodos foram comparados para a redução de reflexos nos espécimes. A imersão é o método mais eficiente e produz imagens detalhadas com bom contraste (Figura 4A). O segundo método é o uso de um filtro polarizador ligado à lente. O filtro de polarização também é eficaz; no entanto, o filtro reduz ligeiramente a resolução e o microcontrasto da imagem (Figura 4B). Uma imagem de exemplo de uma fatia de coração sem imersão ou filtro (Figura 4C) contém muitas reflexões e não é adequada para análises posteriores.
As fatias cerebrais não estão imersas por causa de problemas de gerenciamento de fatias (flutuantes). Na análise planimétrica, é importante comparar o lado não afetado (saudável) do cérebro (Figura 5A) com o lado afetado pelo derrame (Figura 5B). Fatias cerebrais são mais fáceis de gerenciar em uma placa ou bandeja seca, e um filtro polarizador é usado para remover reflexos. Uma bandeja com fundo azul é usada para fotografia de fatia cerebral (seleção de fundo descrita anteriormente5).
As configurações manuais da câmera foram usadas para garantir o controle total da exposição e do balanço de branco. As configurações da câmera devem ser ajustadas antes ou no início do experimento de acordo com a fonte de luz disponível. Isso garante a exposição ideal e o balanço de branco de todas as imagens para permitir a análise uniforme (Figura 6A). As configurações automáticas da câmera não são perfeitas e podem resultar em diferentes parâmetros de câmera, causando resultados inadequados e a introdução da variabilidade imagem-imagem.
A Figura 6 mostra exemplos de imagens superexpostas (Figura 6B) e subexpostas (Figura 6C) de fatias cardíacas. Atenção suficiente deve ser dada às configurações corretas de balanço de branco da câmera para corresponder a uma fonte de luz específica usada na configuração da luz da câmera. As configurações incorretas de equilíbrio de branco podem resultar em uma mudança para azul ou amarelo (Figura 6D) e magenta ou verde (Figura 6E) na imagem.
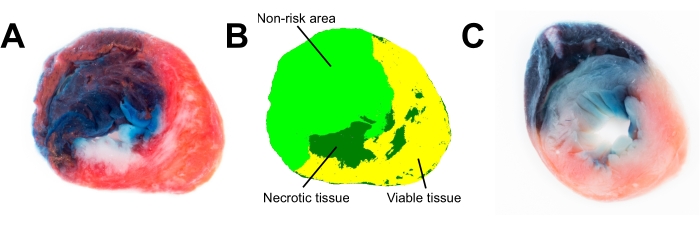
Figura 3: Imagens de fatias cardíacas de rato. (A) A fatia de coração fresco foi analisada no software ImageProPlus 6.3 usando segmentação de cores (B). (C) A coloração ttc discrimina mal entre tecido viável e necrosado na fatia de coração congelado (congelado por 24 h). Abreviação: TTC = 2,3,5-triphenyl-2H-tetrazolium cloreto. Clique aqui para ver uma versão maior desta figura.
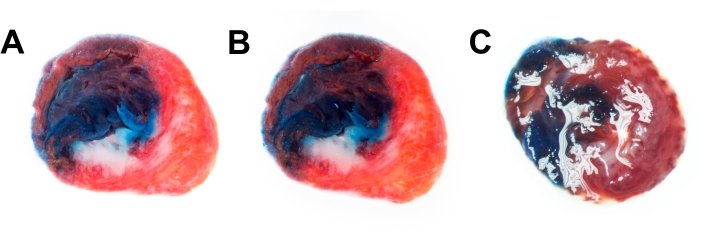
Figura 4: Técnicas para a redução de reflexões. Imagem de fatia de coração de rato capturada imersa em PBS (A) e usando filtro de polarização (B). (C) Corte de coração com reflexos quando nem a imersão nem o filtro são usados. Abreviação = PBS = soro fisiológico tamponado com fosfato. Clique aqui para ver uma versão maior desta figura.
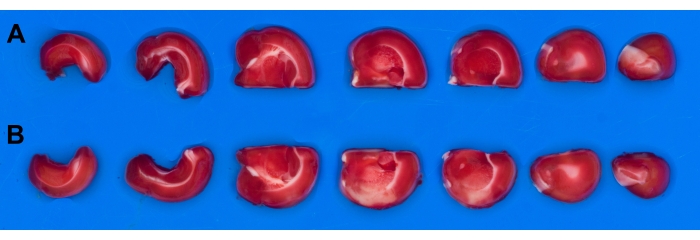
Figura 5: Imagens de fatias cerebrais de ratos. Cérebro de rato foi cortado em sete fatias e manchado com TTC após isquemia-reperfusão. O uso do filtro de polarização resulta na aquisição de imagem livre de reflexão. (A) Fatias do hemisfério não danificado; (B) Fatias do hemisfério afetado pelo derrame. Abreviação: TTC = 2,3,5-triphenyl-2H-tetrazolium cloreto. Clique aqui para ver uma versão maior desta figura.
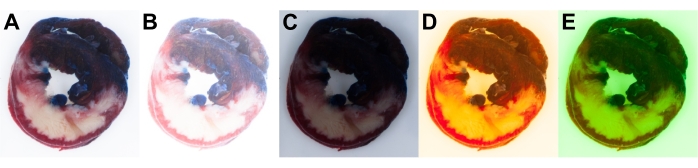
Figura 6: Imagem de corte de coração de rato. Corretamente (A) e incorretamente (B-E) capturaram imagens de corte cardíaca. As configurações de exposição incorretas resultam em imagens superexpostas (B) e subexpostas (C). As configurações incorretas de equilíbrio de branco resultam em amarelo (D) ou verde na imagem (E). Clique aqui para ver uma versão maior desta figura.
Discussão
A preparação do coração após o IR começa com a reoclusão das artérias cardíacas sanguíneas e a perfusão de corante azul para a discriminação de áreas de risco de áreas de não risco. Corantes azuis de metileno ou azul Evans são mais usados para este propósito2. Como uma pressão excessivamente alta pode danificar as válvulas cardíacas e, assim, colorir parcial ou completamente áreas de risco, é melhor perfundir o coração com um sistema controlado por pressão, como o aparelho Langendorff ou uma versão simplificada de uma seringa ou bomba equipada com sistema de pressão hidrostática. A perfusão controlada garantirá pressão fisiológica, e o corante geralmente não entrará na região ocluída do coração. Tanto a velocidade de fluxo quanto as técnicas controladas por pressão são salvaguardas contra a sobretenção.
Um dos erros mais graves no processamento viável de tecidos é manter os tecidos em um congelador por um tempo prolongado antes da coloração. O congelamento é usado principalmente porque os pesquisadores querem realizar a coloração do coração no dia seguinte ao experimento de IR ou mais tarde. Além disso, o congelamento é usado para facilitar o corte do coração. Descobrimos que o congelamento a curto prazo do coração por até 5-10 min, ele afeta a integridade dos tecidos cardíacos e facilita o corte dos tecidos (particularmente para corações de rato) em fatias finas. No entanto, o congelamento por períodos prolongados danifica as membranas e diminui a viabilidade celular e a função mitocondrial13. Como resultado, a coloração TTC das mitocôndrias funcionais é afetada, e a fronteira entre tecidos necrosados e viáveis é mal delineada (embaçada). No geral, o congelamento de peles de rato deve ser evitado, e apenas o congelamento a curto prazo de corações de rato pode ser usado para cortar mais facilmente.
O próximo passo é a coloração tecidual em solução TTC de 1% a 37 °C14. A solução de coloração deve ser pré-armada — particularmente importante para a coloração de fatias cerebrais. Ao usar a solução pré-armada, o tempo ideal de coloração para fatias cardíacas é de 10 minutos. Uma incubação mais longa ou uma temperatura superior a 37 °C resulta na coloração marrom dos tecidos cardíacos. A coloração adequada dos espécimes e a intensidade consistente da cor vermelha são importantes para uma análise mais aprofundada da imagem. Nos passos finais antes da fotografia, as fatias de tecido são enxaguadas 2-3 vezes com PBS frio ou um tampão semelhante para remover TTC e excesso de azul metileno da solução para evitar fundição azul na fotografia. As fatias cardíacas devem ser fotografadas logo após a coloração para obter a melhor qualidade de imagem. A coloração cardíaca permanece de boa qualidade se armazenada por até 60 minutos no PBS frio (+4 °C). Fatias cerebrais manchadas e tecidos aórticos são geralmente armazenados em uma solução de formaldeído neutro de 4% e mantêm boa qualidade por uma semana. O armazenamento noturno de tecidos cerebrais em formalina (+4 °C) não prejudica a intensidade da cor do tecido normal e é aceitável para aquisição de imagens. No entanto, a formalina induz o inchaço e o destantinamento de fatias cardíacas. Portanto, não é recomendado o armazenamento de tecidos cardíacos em formalina.
O próximo passo é a aquisição de imagens. Muitos laboratórios usam scanners de plataforma como uma ferramenta de aquisição de imagens que deverá substituir uma câmera digital e a configuração de iluminação. Determinamos que a digitalização de fatias não fornece resolução de imagem e separação de cores suficientes e, portanto, não é adequada para cortar o coração de imagem. Em particular, a resolução do scanner é insuficiente para corações de camundongos, e notamos má renderização de azul metileno. Em contraste, um scanner pode ser uma alternativa a uma câmera fotográfica para fotos de fotos manchadas apenas com TTC ou outros corantes únicos. Para a varredura de fatias de tecido, o software de digitalização que garante configurações de exposição constante é essencial. No geral, um scanner de plataforma é menos capaz e não pode substituir uma câmera digital para a maioria dos aplicativos de imagem.
O fundo por trás dos espécimes também é importante. Idealmente, o fundo da bandeja deve ser de uma cor não presente no espécime manchado. Por exemplo, para quantificar a área de coloração azul de metileno e TTC (vermelho) de forma automatizada ou semiatomada, devem ser evitadas as origens branca, vermelha, azul, amarela e marrom. Assim, um fundo verde seria preferível. No entanto, a seleção de cores depende das preferências do operador, que posta a imagem. Muitos cientistas preferem um fundo branco porque um fundo branco pode ser excluído no pós-processamento de imagens e convertido em completamente branco (código branco RGB 255.255.255). Em seguida, deve-se excluir completamente branco da lista de cores selecionadas usadas para análise semiautomada e contar apenas áreas necrosadas pálidas, que não são completamente brancas se não superexpostas. Fundos azuis e verdes são adequados para a fotografia de fatias cerebrais e aortas.
A ferramenta de imagem ideal para fotografia de tecido é uma câmera digital de lente única ou sem espelho intercambiável com uma lente macro compatível. Capturar objetos muito pequenos pode exigir uma combinação de uma câmera e um microscópio; no entanto, uma lente macro geralmente tem ampliação suficiente (pelo menos 1:2) para obter imagens detalhadas de um coração de rato. Muitos fabricantes oferecem câmeras digitais acessíveis e lentes macro para obter fotografias de alta resolução e alta ampliação. Todas as câmeras digitais atualizadas possuem características e funções necessárias para a fotografia macro, incluindo a possibilidade de montar em um suporte, um alto número de pixels (geralmente >20 Mpx), visualização ao vivo, bloqueio do espelho, recursos de lapso de tempo, obturador remoto e a capacidade de definir manualmente parâmetros da câmera, garantindo assim uma velocidade constante do obturador, abertura, balanço de branco e configuração ISO. Câmeras compactas com as características acima mencionadas e ampliação da lente de pelo menos 1:2 também podem ser usadas para fotografia macro. Devido às características da lente, algumas câmeras compactas devem ser colocadas próximas ao objeto, e o experimentador deve garantir que o corpo da câmera não afete a iluminação do espécime.
Para fotografia macro com qualquer tipo de câmera de lente intercambiável, é necessária uma lente macro de alta ampliação (1:1-1:2). Sugerimos o uso de lentes macro com distância focal que varia de 50 mm a 100 (120) mm ou equivalente no sensor full-frame (24 mm x 36 mm). Câmeras de sensores menores têm diferentes tamanhos de sensores, e a ampliação deve ser recalculada de acordo. Para a fotografia de fatias cardíacas, uma distância ergonômica do elemento frontal da lente macro de 100 mm para o sujeito é de aproximadamente 150 mm. Esta configuração permite que os operadores mantenham todos os equipamentos em uma mesa, com fácil acesso aos controles da câmera. Uma lente macro de 50 mm pode ser considerada para fotografia de objetos maiores, como fatias cerebrais, porque um campo de visão mais amplo é necessário para obter todas as fatias em uma única fotografia.
Para obter imagens nítidas com alta resolução, uma câmera deve ser montada em um suporte resistente, que, juntamente com uma configuração de luz, é chamado de suporte de cópia de fotografia. Montar a câmera em um suporte e um gatilho remoto (com fio ou sem fio) elimina o aperto da câmera e garante uma distância constante do alvo. Uma configuração de iluminação da câmera com duas fontes de luz constante de ambos os lados, angulada aproximadamente 30-60° em relação ao plano sujeito, garante iluminação suficiente dos espécimes e ajuda a evitar reflexos ao mesmo tempo. A câmera deve ser montada precisamente para que o sensor seja paralelo ao plano de assunto. Para iluminar uniformemente o campo de imagem, ambas as lâmpadas devem ser igualmente orientadas e colocadas à mesma distância do sujeito. Fontes de luz colocadas a várias distâncias do sujeito causam iluminação desigual. Além disso, as fontes de luz piscando são uma razão para variações na exposição da imagem. No geral, é importante colocar com precisão a câmera e fontes de luz para adquirir precisamente imagens de espécimes bem iluminados.
Amostras de tecido refletem a luz (brilho), que aparecem como manchas brancas nas imagens. Estes pontos de reflexão de luz não contêm informações de cores úteis e, portanto, essas partes das imagens não podem ser utilizadas para análise quantitativa precisa das imagens. Reflexos leves de fatias de tecido podem ser removidos por vários métodos. A mais eficiente é a imersão completa de amostras de tecido em um recipiente com solução salina ou PBS. Uma abordagem semelhante é a inserção de fatias de tecido abaixo (ou entre) placas de vidro. Este método é eficiente contra reflexões; no entanto, a resolução da imagem pode ser menor do que a de fotografias de tecidos imersos.
Também se pode usar um filtro polarizador montado em uma lente para eliminar reflexos de luz. Filtros de polarização circulares estão amplamente disponíveis, mas variam consideravelmente em qualidade dependendo do preço, e filtros baratos podem reduzir significativamente a resolução da imagem. A luz refletida pode ser filtrada desligando-se desligando a parte móvel do filtro de polarização em um ângulo. A eficácia do filtro de polarização pode ser afetada por algumas fontes de luz (por exemplo, luz LED forte). No geral, após a remoção do líquido extra, um filtro polarizador pode eliminar todos os reflexos das fatias cerebrais; no entanto, a imersão de amostras na solução tampão é a abordagem mais fácil e econômica para fatias cardíacas.
As configurações manuais da velocidade do obturador, abertura, ISO e balanço de branco são importantes para manter o controle total do processo de imagem. A amostra, o fundo e as características da fonte de luz influenciam o sistema de medição de exposição da câmera em configurações automáticas; portanto, as configurações manuais são necessárias para manter a exposição constante e o equilíbrio de branco entre várias fotografias durante o experimento. Para a macro fotografia, a configuração de abertura sugerida é entre f/8 e f/16. Ao diminuir a abertura, a profundidade de campo aumenta, o que é útil se o objeto não estiver em um único plano. No entanto, a difração limita a resolução total da fotografia no caso de aberturas menores. A abertura ideal para a maioria das lentes geralmente é f/10 porque nesta configuração, a queda de resolução é insignificante, e a profundidade de campo é suficiente. Os valores ISO que variam de 50 a 400 (inferior é melhor) geralmente são ideais para minimizar artefatos de imagem (ruído). A velocidade do obturador permanece então alterada para obter a exposição correta usando as configurações de abertura e ISO mencionadas nas condições de luz existentes. As configurações manuais são importantes para uma análise de imagem consistente. A imagem padronizada garante o uso das mesmas configurações de limiar de cor ao longo de qualquer estudo, o que requer análise de segmentação. Por exemplo, a análise semiautomada pelo software ImagePro baseada em um arquivo de segmentação com cores predefinidas de azul, vermelho e branco (+rosa pálido) pode ser usada ao longo dos anos se as imagens da amostra tiverem cores consistentes, balanço de branco e exposição.
A configuração do balanço de branco deve ser ajustada dependendo da temperatura de cor da fonte de luz que é usada para iluminar uma amostra. O balanço de branco pode ser selecionado a partir de predefinições incorporadas da câmera ou usando a calibração manual de um alvo cinza. O benefício da captura de imagem no formato RAW é que o balanço de branco pode ser ajustado durante o pós-processamento do software da imagem. Como os arquivos RAW contêm muito mais informações do que arquivos JPEG, o pós-processamento de arquivos RAW oferece uma excelente oportunidade para a correção do equilíbrio e exposição de cores, bem como para obter uma melhor resolução de imagem. Como a maioria das câmeras pode capturar arquivos JPEG e RAW simultaneamente, sugerimos capturar o arquivo RAW e salvá-lo como backup.
No geral, este protocolo descreve uma metodologia para corte e coloração de tecidos do coração e do cérebro de ratos e fornece diretrizes para o estabelecimento de configurações de iluminação e câmera e técnicas de fotografia para aquisição de imagens de alta resolução para análise suplementar. Este método é aplicável a toda fotografia experimental de órgãos de pequenos animais.
Divulgações
Os autores declaram que não têm conflitos de interesse.
Agradecimentos
Os autores foram apoiados pelo programa de pesquisa e inovação Horizon 2020 da União Europeia sob o acordo de subvenção No 857394, Projeto FAT4BRAIN.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | Sagimed | N/A | |
| 2,3,5-Triphenyltetrazolium chloride (TTC) | Sigma-Aldrich | 298-96-4 | |
| 5 mL syringe | Sagimed | N/A | |
| 50 mL syringe | Terumo | N/A | |
| Adult Rat Brain Slicer Matrix | Zivic Instruments | BSRAS001-1 | |
| Aortic cannula for mouse heart | ADInstruments | SP3787 | |
| Aortic cannula for rat heart | ADInstruments | SP3786 | |
| Calcium chloride dihydrate, ≥99% | Acros Organics | 207780010 | |
| Cover Glass Forceps, Angled | Fine Science Tools | 11073-10 | |
| Hemostatic forceps | Agnthos | 13008-12 | |
| Hoya 62 mm alpha Circular Polarizer Filter | Hoya | HOCPA62 | |
| Magnesium chloride hexahydrate | Penta | 16330-31000 | |
| Methylene Blue | SigmaAldrich | M9140 | |
| Mouse Heart Slicer Matrix | Zivic Instruments | HSMS005-1 | |
| Polyethylene plastic tubing | BD Intramedic | N/A | |
| Potassium chloride for biochemistry | Acros Organics | 418205000 | |
| Potassium phosphate, monobasic, ≥99% | Acros Organics | 205920025 | |
| Rat Heart Slicer Matrix | Zivic Instruments | HSRS001-1 | |
| Scissors curved with blunt ends | Agnthos | 14013-15 | |
| Scissors for cleaning heart | Agnthos | 14058-11 | |
| Single Edge Razor Blades | Zivic Instruments | BLADE012.1 | |
| Sodium bicarbonate for biochemistry, 99.5% | Acros Organics | 447100010 | |
| Sodium chloride | Fisher bioreagents | BP358-10 | |
| Sony Alpha a6000 Mirrorless Digital Camera | Sony | ILCE6000 | Can be repalaced by any up-to-date digiatal camera |
| Sony FE 90 mm F/ 2.8 Macro G OSS | Sony | SEL90M28G | Important, lens should be compatible with camera |
| Sony SF32UZ SDHC 32 GB Class 10 UHS | Sony | 2190246141 | |
| Surgical blade | Heinz Herenz Hamburg Germany | BS2982 | |
| Thermo-Shaker | BioSan | PST-60HL-4 | |
| Toothed tissue forceps | Agnthos | 11021-12 | |
| Toothed tissue forceps for cleaning heart | Agnthos | 11023-10 | |
| Weigh tray, 70 mL | Sarsted | 71,99,23,212 |
Referências
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: the Langendorff technique of isolated heart perfusion. Journal of Molecular and Cellular Cardiology. 50 (6), 940-950 (2011).
- Botker, H. E., et al. Practical guidelines for rigor and reproducibility in preclinical and clinical studies on cardioprotection. Basic Research in Cardiology. 113 (5), 39 (2018).
- Uluc, K., Miranpuri, A., Kujoth, G. C., Akture, E., Baskaya, M. K. Focal cerebral ischemia model by endovascular suture occlusion of the middle cerebral artery in the rat. Journal of Visualized Experiments: JoVE. (48), e1978 (2011).
- Zvejniece, L., Svalbe, B., Liepinsh, E., Pulks, E., Dambrova, M. The sensorimotor and cognitive deficits in rats following 90- and 120-min transient occlusion of the middle cerebral artery. Journal of Neuroscience Methods. 208 (2), 197-204 (2012).
- Liepinsh, E., Kuka, J., Dambrova, M. Troubleshooting digital macro photography for image acquisition and the analysis of biological samples. Journal of Pharmacological and Toxicological Methods. 67 (2), 98-106 (2013).
- Kolwicz, S. C., Tian, R. Assessment of cardiac function and energetics in isolated mouse hearts using 31P NMR spectroscopy. Journal of Visualized Experiments: JoVE. (42), e2069 (2010).
- Herr, D. J., Aune, S. E., Menick, D. R. Induction and assessment of ischemia-reperfusion injury in Langendorff-perfused rat hearts. Journal of Visualized Experiments: JoVE. (101), e52908 (2015).
- Liepinsh, E., et al. Inhibition of L-carnitine biosynthesis and transport by methyl-gamma-butyrobetaine decreases fatty acid oxidation and protects against myocardial infarction. British Journal of Pharmacology. 172 (5), 1319-1332 (2015).
- Nakamura, K., Al-Ruzzeh, S., Ilsley, C., Yacoub, M. H., Amrani, M. Acute effect of cerivastatin on cardiac regional ischemia in a rat model mimicking off-pump coronary surgery. Journal of Cardiac Surgery. 20 (6), 507-511 (2005).
- Li, Q., Morrison, M. S., Lim, H. W. Using a cardiac anchor to refine myocardial infarction surgery in the rat. Lab Animal. 39 (10), 313-317 (2010).
- Wu, Y., Yin, X., Wijaya, C., Huang, M. H., McConnell, B. K. Acute myocardial infarction in rats. Journal of Visualized Experiments: JoVE. (48), e2464 (2011).
- Vavers, E., et al. The neuroprotective effects of R-phenibut after focal cerebral ischemia. Pharmacological Research. 113, 796-801 (2016).
- Acin-Perez, R., et al. A novel approach to measure mitochondrial respiration in frozen biological samples. EMBO Journal. 39 (13), 104073 (2020).
- Kloner, R. A., Darsee, J. R., DeBoer, L. W., Carlson, N. Early pathologic detection of acute myocardial infarction. Archives of Pathology & Laboratory Medicine. 105 (8), 403-406 (1981).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados