É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Heterojunção de Óxido Metálico para Atividades Fotocatalíticas
Neste Artigo
Resumo
O desenvolvimento de uma heterojunção aumenta as atividades fotocatalíticas da síntese de combustão da solução, que é um processo eficiente em termos de tempo / energia. Técnicas avançadas de caracterização analítica foram utilizadas neste protocolo para avaliar as características dos materiais, e os nanocompósitos demonstraram melhor degradação do corante ácido laranja-8.
Resumo
Há uma demanda global significativa por melhorias nas técnicas de síntese e suas características ideais, especialmente para aplicações em escala industrial. A síntese de combustão de solução à base de Sol-gel (SG-SCS) é um método simples para produzir materiais porosos ordenados. A este respeito, a teoria dos ácidos e bases duras e moles de Pearson auxilia na seleção da reatividade hospedeiro-dopante para formar uma heterojunção adequada.
A formação de uma heterojunção também altera as propriedades essenciais dos materiais, melhorando a fotocatálise por transferência de carga ou atividades sinérgicas. Uma temperatura de calcinação de 500 °C é ideal para este processo com base nos resultados da avaliação da estabilidade por meio de uma análise diferencial da razão de termogravimetria (DTG).
As dimensões em nanoescala das nanopartículas (NPs) e nanocompósitos (NCs) geradas foram validadas usando difração de raios X e microscopia eletrônica de transmissão de alta resolução (HRTEM). Além disso, as micrografias de microscopia eletrônica de varredura e as análises de BET confirmaram a natureza porosa dos materiais. HRTEM, espectroscopia de fotoelétrons de raios-X e investigações de raios-X por dispersão de energia estabeleceram a composição dos materiais. O estudo descobriu que os NCs degradaram a cor laranja ácida 8 (AO8) com mais eficiência do que o ZnO puro.
Introdução
A proteção ambiental tornou-se uma grande preocupação com o rápido aumento de empresas em todo o mundo. Consequentemente, os nanomateriais (NMs) baseados em nanotecnologia e sua síntese atraíram a atenção dos pesquisadores sobre os materiais a granel no mundo científico moderno1. Várias abordagens físico-químicas têm sido adaptadas para tratar contaminantes orgânicos e inorgânicos 2,3. Nesse sentido, devido à sua simplicidade e capacidade de dissolver toxinas sem criar contaminação secundária, a fotocatálise heterogênea é considerada uma técnica de remediação adaptativa4. Estudos projetaram uma heterojunção ou dopagem entre semicondutores bandgap adequados, o que ajuda a reduzir a recombinação, a área de superfície e o volume do elétron-buraco do constituinte. Essa condição subsequentemente aumentou a degradação fotocatalítica dos corantes 5,6,7. Trabalhos recentes também relataram um papel sinérgico e de melhoria da transferência de carregador por meio de heterojunções / híbridos 8,9, e óxidos metálicos semicondutores demonstram propriedades físicas e químicas únicas para aplicações multifuncionais10. Como resultado, as NPs de TiO2 e óxido de zinco (NPs de ZnO) têm recebido atenção significativa11,12 entre os pesquisadores.
Em comparação com materiais únicos, a formação de uma heterojunção tornou-se uma das preferências exclusivas para aumentar a área de superfície e a proporção de volume dos materiais e melhorar o desempenho fotocatalítico e antibacteriano de um material. Além disso, o impacto sinérgico das heterojunções binárias melhora a separação dos pares elétron/buraco fotogerados em comparação com as heterojunções binárias13,14. Estudos mostraram que uma heterojunção entre Mn2O3 e ZnONPs 15 melhora a estabilidade e a capacidade de adsorção do substrato e reduz a resistência à transferência de carga em NPs sintetizadas. Além disso, vários estudos usaram a reatividade hospedeiro-dopante com base na teoria de ácidos e bases duras e moles (HSAB) de Pearson para testar a heterojunção ou a formação de dopantes. Verificou-se que os ácidos duros de Lewis (como Mn (III)) não podem se difundir na fronteira da rede hospedeira Zn (II) na presença de um solvente de base dura como a água16 , 17 . Eles são adsorvidos na superfície do hospedeiro e oxidados para formar um híbrido após calcinação.
Devido ao seu potencial, o foco global atual para aplicações industrialmente escaláveis de síntese de materiais está em melhorar a abordagem e suas perspectivas críticas13. A síntese de combustão em solução (SCS) é um método simples, eficiente em termos de tempo / energia para criar materiais porosos regularmente ordenados18, que desempenham um papel significativo no fenômeno de transporte de íons / massa19. O SCS compreende uma distribuição ou heterojunção dopante-hospedeiro decente com base na teoria de ácidos e bases duras e moles (HSAB) de Pearson. A dopagem/heterojunção pode ajustar as propriedades ópticas, magnéticas e elétricas dos materiais, aumentando subsequentemente a aplicação de materiais por meio de transferência de carga eficaz e/ou papéis sinérgicos20. O SCS assistido por agente direcionador de arquitetura (ADA) também pode produzir estruturas de nanocristais coloidais ordenados (CNFs) usados para transporte de massa / íons em dispositivos de conversão de energia21,22.
Este estudo produziu um surfactante de álcool polivinílico (PVA) e agente complexante para sintetizar NPs de ZnO e heterojunção de nanocompósitos binários (NCs) à base de ZnO por meio de uma abordagem SG-SCS ecologicamente correta. A heterojunção entre os óxidos, que desempenha um papel vital na transferência de carga, foi estimada com base na teoria HSAB. Técnicas de caracterização foram utilizadas para entender as propriedades estruturais, ópticas e morfológicas dos materiais. A eficiência de degradação do material foi testada em corantes AO8 estáveis e tóxicos.
Protocolo
1. Síntese de nanomateriais
- Síntese de nanocompósitos ZnO-Mn2O3
- Sintetizar nanocompósitos usando álcool polivinílico como surfactante e uma abordagem SG-SCS assistida por agente complexante. Para uma ilustração gráfica da abordagem SG-SCS, consulte a Figura Suplementar S1.
- Dissolver 1,5 g de polímero PVA em 100 ml de água destilada com agitação contínua num agitador magnético durante cerca de 15 min a 115 °C23.
- Despeje as soluções precursoras de sal, nitrato de zinco hexahidratado na concentração de 90% v / v e sulfato de manganês na concentração de 10% v / v na solução de PVA dissolvida acima com agitação contínua por cerca de 10 min e diminua a temperatura para 70 ° C.
NOTA: Os precursores de sal foram misturados simultaneamente para equilibrar a reatividade do precursor do nanocompósito para seguir a abordagem de dopagem por nucleação16,24. A temperatura foi reduzida para 70 °C para controlar o crescimento acelerado e a agregação das nanopartículas, seguindo o modelo La Mar25,26. - Envelheça o sol (partículas coloidais) desenvolvido do hidróxido metálico, mantendo-o em uma área fechada e escura por 2 dias. Em seguida, desidrate a solução aquecendo a 110 °C (no ar) para formar um gel.
NOTA: O polímero PVA atua como uma arquitetura, direcionando moldes e agentes complexantes, que auxiliam na dispersão homogênea de cátions metálicos, iniciando o processo de combustão e impedindo propriedades de agregação/aglomeração. - Sujeitar o gel à combustão ao ar aquecendo o forno a uma temperatura de ignição de ~150-250 °C (temperatura aproximada verificada com um termómetro simples). A temperatura de ignição é a temperatura mínima necessária para iniciar a combustão. Durante a combustão, use capuzes para coletar todos os subprodutos de gases tóxicos que afetam a saúde humana.
NOTA: O processo de combustão foi ativado pela formação de complexos entre polímero PVA e precursores de nitrato, que atuam como combustível para facilitar o processo de combustão. - Calcinar os materiais queimados por 3 h a 500 °C em mufla, otimizado usando a técnica analítica de termogravimetria diferencial (DTG). O DTG decompõe as impurezas não queimadas e melhora a cristalinidade dos materiais27.
- Síntese de NPs de ZnO e Mn2O3 nuas
- Sintetize óxidos de metal nu usando a abordagem sol-gel. Sintetize ZnO e Mn2O3 sem PVA usando todas as etapas mencionadas anteriormente, etapas 1.1.1.-1.1.6., exceto a etapa 1.1.2. Devido à ausência dos complexos de nitrato metálico e polímero de PVA, nenhum processo de autopropagação ocorre durante a etapa final de secagem.
2. Caracterização do NP
- Determinar a razão termogravimetria, especificamente a termogravimétrica térmica/térmica diferencial (análise DT/DTA), em uma atmosfera de nitrogênio a uma vazão de 20,0 mL/min e um tempo de rampa de 50 °C/min para estudar a estabilidade térmica e o comportamento de degradação dos NPs e NCs.
- Realize a espectroscopia de infravermelho com transformada de Fourier (FTIR) usando pastilhas KBr na faixa de 400-4000 cm−1 para estudar o comportamento do grupo funcional de superfície de NPs e NCs.
- Realize a difração de raios X (XRD) para estudar a estrutura cristalográfica de PVA, NPs e NCs.
- Use o comando Brunauer-Emmett-Teller (BET; N2 isotermas de adsorção-dessorção) para calcular a área superficial específica das amostras na faixa de pressão relativa (P /P o) de 0,05-0,35. Determine as distribuições de tamanho de poro das amostras usando o método Barrett-Joyner-Halenda (BJH). Por fim, meça a sorção de N2 de todos os NPs e NCs a -196,15 ° C.
- Use microscopia eletrônica de varredura com espectroscopia de raios-X por dispersão de energia (SEM-EDX) e microscopia eletrônica de transmissão de alta resolução (HRTEM) para estudar as morfologias e realizar estudos de composição dos NPs e NCs.
- Realize uma análise de espectroscopia de fotoelétrons de raios-X (XPS) em um sistema integrado a uma lente de imersão magnética patenteada Kratos, sistema de neutralização de carga e analisador de espelho esférico. Calibre as energias de pico com base na energia do carbono externo.
NOTA: O pesquisador adotou todos os procedimentos e protocolos padrão durante o processo de caracterização.
3. Estudos de degradação de lotes
- Realize o experimento fotocatalítico dissolvendo 20 ppm de corante AO8 em 250 mL de solução aquosa (solvente aquoso) com 0,06 g de fotocatalisadores de ZnO NPs e NCs.
- Use o experimento de degradação como condutor em um reator de vidro circular de 176,6 cm2 . Para este experimento, use uma lâmpada de vapor de mercúrio de média pressão (lâmpada Hg) como fonte de luz (λmax = 365 nm, 125 W) 28 . Antes da iluminação, mexa a suspensão de reação continuamente no escuro por 30 min para criar o equilíbrio de adsorção/dessorção de AO8/CR nos NPs/NCs.
- Irradiar as amostras diretamente focalizando a luz na mistura de reação a uma distância de 20 cm. Use um agitador magnético a 110 rpm para misturar continuamente a solução. Controle a temperatura do reator geral durante o experimento usando a circulação de água.
- Retire 5 mL da solução de corante a cada 15 minutos para medir suas concentrações no tempo t por espectrofotômetro UV-vis. Calcular a percentagem de eficiência de degradação fotocatalítica utilizando a equação:
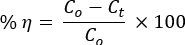
onde Co e Ct são as concentrações iniciais e posteriores à irradiação t , respectivamente, da solução dos corantes AO8 e CR; e η é a eficiência da descoloração da foto, - Use a equação cinética de pseudo-primeira ordem para estudar a dinâmica da reação:
Pseudo cinética de primeira ordem: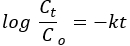
onde Co e Ct são as concentrações inicial e de equilíbrio do corante AO8 (mg/L), respectivamente, k é a constante de taxa e t é o tempo em minutos.
Resultados
A Figura 1A mostra as estabilidades térmicas de NCs binários antes que um instrumento DTG analise a calcinação na atmosfera de N2. Uma sequência de vaporização de moléculas de H2O adsorvidas, decaimento intramolecular, hidróxidos metálicos ou / e decomposição da cadeia lateral de PVA, decomposição da cadeia principal intermolecular / PVA e, finalmente, a parte cristalina ocorreu para dar carbono, hidrocarbonetos e cinzas
Discussão
O presente protocolo descreve a síntese de nanocristais usando uma estratégia de baixo para cima com forma, tamanho e estrutura precisos. O estudo observou que a nucleação e o crescimento dos nanocristais eram significativos antes de formar os nanocristais. Aqui, os óxidos de ZnO e manganês foram sintetizados com base na teoria dos grupos de LaMer25, que postula o processo de formação de nanocristais após a redução de precursores em átomos e núcleos, ...
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Gostaríamos de agradecer à Adama Science and Technology University por seu apoio neste trabalho. O financiamento foi fornecido pelo número do Projeto de Apoio aos Pesquisadores da Universidade de Taif (TURSP-2020/44), Universidade de Taif, Taif, Arábia Saudita.
Materiais
| Name | Company | Catalog Number | Comments |
| Acid orange 8 | Sigma-Aldrich | 65%, | |
| Chlorine | Sigma-Aldrich | 7782-50-5 | |
| Dithienogermole | Sigma-Aldrich | 773881-43-9 | |
| HCl | Sigma-Aldrich | 7647-01-0 | |
| Manganese nitrate (10%) salt | Sigma-Aldrich | 15710-66-4 | 10% |
| Manganese sulfate monohydrate | Sigma-Aldrich | Density: 2.95 g/cm³; solubility in water: 70 g/100 mL (70 °C); 99.95%, MnSO4.H2O | |
| Poly (vinyl alcohol) | Sigma-Aldrich | 9002-89-5 | Density: 1.19–1.31 g/cm³ @20 °C, soluble in water only @ > 80 °C |
| Zinc nitrate hexahydrate (90%) | Sigma-Aldrich | 10196-18-6 | 98%; Density: 2.065 g/cm³ @20 °C; solubility in water: 184.3 g/100 mL @20 °C |
| Instruments used | |||
| Materials name | Model | Analysis | |
| BET (N2 adsorption-desorption isotherms) | Quanta chrome instrument. | Textural properties | |
| DT/DTA | Shimadzu DTG-60H | Measure thermal stability | |
| FTIR | Perkin Elmer FT-IR, Spectrum 65 | Chemical bonding information | |
| HRTEM | JEOL TEM 2100 HRTEM | Morphological, size, and composition analysis | |
| SEM-EDX | SEM-EDX-EVO 18 with low vacuum facility and ALTO 1000 cryo attachment | Morphological analysis | |
| XPS | AXIS ULTRA from AXIS 165 | ||
| XRD | Shimadzu, XRD-7000 | Crystallinity, structure, and approximate average crystallite size | |
| Common software used | |||
| Name | Company | Use | |
| Mendeley | Mendeley-Desktop-1.19.8-win32 | For citing references | |
| Origin | OriginPro 8 | XRD, BET, UV-vis-DRS data analysis |
Referências
- Khort, A., et al. Corrosion and transformation of solution combustion synthesized Co, Ni and CoNi nanoparticles in synthetic freshwater with and without natural organic matter. Scientific Reports. 11 (1), 7860 (2021).
- Pype, M., Lawrence, M. G., Keller, J., Gernjak, W. Reverse osmosis integrity monitoring in water reuse: The challenge to verify virus removal - A review. Water Research. 98, 384-395 (2016).
- Adeleye, A. S., et al. Engineered nanomaterials for water treatment and remediation: Costs, benefits, and applicability. Chemical Engineering Journal. 286, 640-662 (2016).
- Gómez-Pastora, J., et al. Review and perspectives on the use of magnetic nanophotocatalysts (MNPCs) in water treatment. Chemical Engineering Journal. 310 (2), 407-427 (2017).
- Nadeem, M. S., et al. Enhancement in the photocatalytic and antimicrobial properties of ZnO nanoparticles by structural variations and energy bandgap tuning through Fe and Co co-doping. Ceramics International. 47 (8), 11109-11121 (2021).
- Nadeem, M. S., et al. Energy-levels well-matched direct Z-scheme ZnNiNdO/CdS heterojunction for elimination of diverse pollutants from wastewater and microbial disinfection. Environmental Science and Pollution Research International. , (2022).
- Munawar, T., Iqbal, F., Yasmeen, S., Mahmood, K., Hussain, A. Multi metal oxide NiO-CdO-ZnO nanocomposite-Synthesis, structural, optical, electrical properties and enhanced sunlight driven photocatalytic activity. Ceramics International. 46 (2), 2421-2437 (2020).
- Srinivasa, N., et al. Facile synthesis of Ni/NiO nanocomposites: The effect of Ni content in NiO upon the oxygen evolution reaction within alkaline media. RSC Advances. 11 (24), 14654-14664 (2021).
- Chen, P., et al. Solution combustion synthesis of ternary Ni/WC/C composites with efficient electrocatalytic oxygen reduction performance. RSC Advances. 11 (61), 38718-38726 (2021).
- Nagvenkar, A. P., Perelshtein, I., Piunno, Y., Mantecca, P., Gedanken, A. Sonochemical one-step synthesis of polymer-capped metal oxide nanocolloids: Antibacterial activity and cytotoxicity. ACS Omega. 4 (9), 13631-13639 (2019).
- Janotti, A., Van de Walle, C. G. Fundamentals of zinc oxide as a semiconductor. Reports on Progress in Physics. 72 (12), 126501 (2009).
- Abebe, B., Murthy, H. C. A., Amare, E. Enhancing the photocatalytic efficiency of ZnO: Defects, heterojunction, and optimization. Environmental Nanotechnology, Monitoring. & Management. 14, 100336 (2020).
- Abebe, B., Murthy, H. C. A., Zereffa, E. A. Multifunctional application of PVA-aided Zn-Fe-Mn coupled oxide nanocomposite. Nanoscale Research Letters. 16, 1 (2021).
- Shekofteh-Gohari, M., Habibi-Yangjeh, A. Fe3O4/ZnO/CoWO4 nanocomposites: Novel magnetically separable visible-light-driven photocatalysts with enhanced activity in degradation of different dye pollutants. Ceramics International. 43 (3), 3063-3071 (2017).
- Saravanan, R., Gupta, V. K. K., Narayanan, V., Stephen, A. Visible light degradation of textile effluent using novel catalyst ZnO/γ-Mn2O3. Journal of the Taiwan Institute of Chemical Engineers. 45 (4), 1910-1917 (2014).
- Buonsanti, R., Milliron, D. J. Chemistry of doped colloidal nanocrystals. Chemistry of Materials. 25 (8), 1305-1317 (2013).
- Hu, H., He, H., Zhang, J., Hou, X., Wu, P. Optical sensing at the nanobiointerface of metal ion-optically-active nanocrystals. Nanoscale. 10 (11), 5035-5046 (2018).
- Deganello, F., Tyagi, A. K. Solution combustion synthesis, energy and environment: Best parameters for better materials. Progress in Crystal Growth and Characterization of Materials. 64 (2), 23-61 (2018).
- Buonsanti, R., et al. Assembly of ligand-stripped nanocrystals into precisely controlled mesoporous architectures. Nano Letters. 12 (7), 3872-3877 (2012).
- Li, F., Ran, J., Jaroniec, M., Qiao, S. Z. Solution combustion synthesis of metal oxide nanomaterials for energy storage and conversion. Nanoscale. 7 (42), 17590-17610 (2015).
- Williams, T. E., et al. Nearest-neighbour nanocrystal bonding dictates framework stability or collapse in colloidal nanocrystal frameworks. Chemical Communications. 53 (35), 4853-4856 (2017).
- Helms, B. A., Williams, T. E., Buonsanti, R., Milliron, D. J. Colloidal nanocrystal frameworks. Advanced Materials. 27 (38), 5820-5829 (2015).
- Liu, B., et al. Synthesis of ZnO nano-powders via a novel PVA-assisted freeze-drying process. RSC Advances. 6 (111), 110349-110355 (2016).
- Abebe, B., Murthy, H. C. A. Insights into ZnO-based doped porous nanocrystal frameworks. RSC Advances. 12 (10), 5816-5833 (2022).
- LaMer, V. K., Dinegar, R. H. Theory, production and mechanism of formation of monodispersed hydrosols. Journal of the American Chemical Society. 72 (11), 4847-4854 (1950).
- Jun, Y. -. S., et al. Classical and nonclassical nucleation and growth mechanisms for nanoparticle formation. Annual Review of Physical Chemistry. 73, 453-477 (2022).
- Gao, Y., Meng, F., Li, X., Wen, J. Z., Li, Z. Factors controlling nanosized Ni-Al 2 O 3 catalysts synthesized by solution combustion for slurry-phase CO methanation: the ratio of reducing valences to oxidizing valences in redox systems. Catalysis Science & Technology. 6 (21), 7800-7811 (2016).
- Abebe, B., Zereffa, E. A., Murthy, H. C. A. Synthesis of poly(vinyl alcohol)-aided ZnO/Mn 2 O 3 nanocomposites for acid orange-8 dye degradation: Mechanism and antibacterial activity. ACS Omega. 6 (1), 954-964 (2021).
- Kumar, S., Krishnakumar, B., Sobral, A. J. F. N., Koh, J. Bio-based ( chitosan / PVA / ZnO ) nanocomposites fi lm Thermally stable and photoluminescence material for removal of organic dye. Carbohydrate Polymers. 205, 559-564 (2019).
- Dai, Y., et al. Enhanced mechanical, thermal, and UV-shielding properties of poly(vinyl alcohol)/metal-organic framework nanocomposites. RSC Advances. 8 (67), 38681-38688 (2018).
- Munawar, T., et al. Novel tri-phase heterostructured ZnO-Yb2O3-Pr2O3 nanocomposite; structural, optical, photocatalytic and antibacterial studies. Ceramics International. 46 (8), 11101-11114 (2020).
- Mukhtar, F., et al. Enhancement in carrier separation of ZnO-Ho2O3-Sm2O3 hetrostuctured nanocomposite with rGO and PANI supported direct dual Z-scheme for antimicrobial inactivation and sunlight driven photocatalysis. Advanced Powder Technology. 32 (10), 3770-3787 (2021).
- Lachheb, H., et al. Electron transfer in ZnO-Fe 2 O 3 aqueous slurry systems and its effects on visible light photocatalytic activity. Catalysis Science & Technology. 7 (18), 4041-4047 (2017).
- Thommes, M., et al. Physisorption of gases, with special reference to the evaluation of surface area and pore size distribution (IUPAC Technical Report). Pure and Applied Chemistry. 87 (9-10), 1051-1069 (2015).
- Kumar, P., Kim, K. -. H., Kwon, E. E., Szulejko, J. E. Metal-organic frameworks for the control and management of air quality: advances and future direction. Journal of Materials Chemistry A. 4 (2), 345-361 (2016).
- Liu, J., et al. NiO-PTA supported on ZIF-8 as a highly effective catalyst for hydrocracking of Jatropha oil. Scientific Reports. 6, 23667 (2016).
- Fatehah, M. O., Aziz, H. A., Stoll, S. Stability of ZnO nanoparticles in solution. Influence of pH, dissolution, aggregation and disaggregation effects. Journal of Colloid Science and Biotechnology. 3 (1), 75-84 (2014).
- Sigoli, F. A., Davolos, M. R., Jafelicci, M. Morphological evolution of zinc oxide originating from zinc hydroxide carbonate. Journal of Alloys and Compounds. 262-263, 292-295 (1997).
- Wachs, I. E. Raman and IR studies of surface metal oxide species on oxide supports: Supported metal oxide catalysts. Catalysis Today. 27 (3-4), 437-455 (1996).
- Parler, C. M., Ritter, J. A., Amiridis, M. D. Infrared spectroscopic study of sol-gel derived mixed-metal oxides. Journal of Non-Crystalline Solids. 279 (2-3), 119-125 (2001).
- Anžlovar, A., Kogej, K., Crnjak Orel, Z., Žigon, M. Polyol mediated nano size zinc oxide and nanocomposites with poly(methyl methacrylate). Express Polymer Letters. 5 (7), 604-619 (2011).
- Saravanan, R., et al. ZnO/Ag/Mn 2 O 3 nanocomposite for visible light-induced industrial textile effluent degradation, uric acid and ascorbic acid sensing and antimicrobial activity. RSC Advances. 5 (44), 34645-34651 (2015).
- Yang, G., Yan, W., Wang, J., Yang, H. Fabrication and formation mechanism of Mn 2 O 3 hollow nanofibers by single-spinneret electrospinning. CrystEngComm. 16 (30), 6907-6913 (2014).
- Liu, Y., et al. A magnetically separable photocatalyst based on nest-like γ-Fe 2 O 3 /ZnO double-shelled hollow structures with enhanced photocatalytic activity. Nanoscale. 4 (1), 183-187 (2012).
- Hu, Y., et al. A microwave-assisted rapid route to synthesize ZnO/ZnS core-shell nanostructures via controllable surface sulfidation of ZnO nanorods. CrystEngComm. 13 (10), 3438-3443 (2011).
- Zhang, J., et al. Synthesis and gas sensing properties of α-Fe 2 O 3 @ ZnO core-shell nanospindles. Nanotechnology. 22 (18), 185501 (2011).
- Penn, R. L. Imperfect oriented attachment: Dislocation generation in defect-free nanocrystals. Science. 281 (5379), 969-971 (1998).
- Zhang, J., Huang, F., Lin, Z. Progress of nanocrystalline growth kinetics based on oriented attachment. Nanoscale. 2 (1), 18-34 (2009).
- Zeng, Z., et al. A fluorescence-electrochemical study of carbon nanodots (CNDs) in bio- and photoelectronic applications and energy gap investigation. Physical Chemistry Chemical Physics. 19 (30), 20101-20109 (2017).
- Zhai, T., et al. Controllable synthesis of hierarchical ZnO nanodisks for highly photocatalytic activity. CrystEngComm. 14 (5), 1850-1855 (2012).
- Li, N., et al. Efficient removal of chromium from water by Mn3O4 @ZnO/Mn3O4 composite under simulated sunlight irradiation: Synergy of photocatalytic reduction and adsorption. Applied Catalysis B: Environmental. 214, 126-136 (2017).
- Abebe, B. Polymer assisted colloidal nanocrystal framework synthesis: Sol-gel approach. Materials Research Express. 8 (12), 125005 (2021).
- Jiamprasertboon, A., et al. Heterojunction α-Fe2O3/ZnO films with enhanced photocatalytic properties grown by aerosol-assisted chemical vapour deposition. Chemistry - A European Journal. 25 (48), 11337-11345 (2019).
- Mukhtar, F., et al. Dual S-scheme heterojunction ZnO-V2O5-WO3 nanocomposite with enhanced photocatalytic and antimicrobial activity. Materials Chemistry and Physics. 263, 124372 (2021).
- Marschall, R. Semiconductor composites: Strategies for enhancing charge carrier separation to improve photocatalytic activity. Advanced Functional Materials. 24 (17), 2421-2440 (2013).
- Beranek, R. (Photo)electrochemical methods for the determination of the band edge positions of TiO 2-based nanomaterials. Advances in Physical Chemistry. 2011, 786759 (2011).
- Hoffmann, M. R., Martin, S. T., Choi, W., Bahnemann, D. W. Environmental applications of semiconductor photocatalysis. Chemical Reviews. 95 (1), 69-96 (1995).
- Wu, Y., Wang, D., Li, Y. Understanding of the major reactions in solution synthesis of functional nanomaterials. Science China Materials. 59, 938-996 (2016).
- Xia, Y., Xiong, Y., Lim, B., Skrabalak, S. E. Shape-controlled synthesis of metal nanocrystals: Simple chemistry meets complex physics. Angewandte Chemie. 48 (1), 60-103 (2008).
- Kim, S. J., Yoon, S., Kim, H. J. Review of solution-processed oxide thin-film transistors. Japanese Journal of Applied Physics. 53, (2014).
- Zhang, J., Guo, Q., Liu, Y., Cheng, Y. Preparation and characterization of Fe2O3/Al2O3 using the solution combustion approach for chemical looping combustion. Industrial & Engineering Chemistry Research. 51 (39), 12773-12781 (2012).
- Novitskaya, E., Kelly, J. P., Bhaduri, S., Graeve, O. A. A review of solution combustion synthesis: an analysis of parameters controlling powder characteristics. International Materials Reviews. 66 (3), 188-214 (2021).
- González-Cortés, S. L., Imbert, F. E. Fundamentals, properties and applications of solid catalysts prepared by solution combustion synthesis (SCS). Applied Catalysis A: General. 452, 117-131 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados