Method Article
Modelo de lesão de isquemia-reperfusão intestinal por roedores via oclusão da artéria mesentérica superior
Neste Artigo
Resumo
Descrevemos como gerar um modelo cirúrgico amplamente utilizado de lesão de isquemia-reperfusão (IRI) intestinal em roedores. O procedimento envolve a oclusão da artéria mesentérica superior seguida da restauração do fluxo sanguíneo. Este modelo é útil para estudos que investigam causas oclusivas de IRI intestinal em medicina veterinária e humana.
Resumo
A lesão de isquemia-reperfusão intestinal (IRI) está associada a uma miríade de condições na medicina veterinária e humana. Condições de IRI intestinal, como volvo de dilatação gástrica (GDV), torção mesentérica e cólicas, são observadas em animais como cães e cavalos. Uma interrupção inicial do fluxo sanguíneo faz com que os tecidos se tornem isquêmicos. Embora necessária para salvar o tecido viável, a reperfusão subsequente pode induzir novas lesões. O principal mecanismo responsável pela IRI é a formação de radicais livres após a reperfusão e reintrodução de oxigênio no tecido lesado, mas há muitos outros componentes envolvidos. Os efeitos locais e sistêmicos resultantes frequentemente conferem um prognóstico ruim.
A IRI intestinal tem sido objeto de extensa pesquisa nos últimos 50 anos. Um modelo in vivo de roedores em que a base da artéria mesentérica superior (AMS) é ligada temporariamente é atualmente o método mais utilizado para estudar a IRI intestinal. Descrevemos um modelo de IRI intestinal utilizando anestesia com isoflurano em ar medicinalO2 a 21% que produz lesão reprodutível, como demonstrado por histopatologia consistente do intestino delgado. A lesão tecidual também foi avaliada no cólon, fígado e rins.
Introdução
A lesão de isquemia-reperfusão (IRI) pode ocorrer em qualquer órgão e envolve dois componentes sequenciais. Uma cessação inicial do fluxo sanguíneo faz com que os tecidos afetados se tornem isquêmicos e, em seguida, a reperfusão subsequente induz mais lesão celular. O dano da reperfusão muitas vezes excede o causado pela isquemia1. A fisiopatologia da IRI envolve uma complexa cascata de eventos, sendo o mais notável deles a formação de radicais livres na reintrodução de oxigênio, que ocorre durante a reperfusão2. A ativação das células inflamatórias e citocinas também desempenha um papel2. Na RII intestinal, a translocação bacteriana para a corrente sanguínea após dano endotelial pode levar à síndrome da resposta inflamatória sistêmica2. Se o dano devido à IRI for suficientemente grave, os efeitos sistêmicos resultantes podem levar à falência de múltiplos órgãos3.
Os casos de IRI intestinal estão associados a alta morbidade e mortalidade 4,5,6. A IRI intestinal está associada a muitas condições patológicas e procedimentos cirúrgicos em medicina veterinária e humana. Em medicina veterinária, os animais são especialmente propensos a condições intestinais de IRI, como volvo de dilatação gástrica (VGD), torção mesentérica e cólica 7,8. Em humanos, a IRI é um problema importante e frequente na cirurgia de aneurisma de aorta abdominal, hérnias estranguladas, isquemia mesentérica aguda, volvo, trauma, choque, enterocolite necrosante neonatal e ressecção ou transplante de intestino delgado9.
A maioria dos estudos in vivo de IRI intestinal em roedores envolve a oclusão da base da artéria mesentérica superior (AMS), ramo da aorta abdominal que irriga a maioria do intestino delgado e a porção proximal do intestino grosso10,11,12. Apesar do amplo uso e relativa simplicidade desse modelo, um protocolo detalhado utilizando anestesia inalatória em ar medicinalO2 a 21% não foi publicado. A falta de um protocolo padrão dificulta os pesquisadores que não estão familiarizados com o procedimento e impede a consistência entre os estudos. Demonstramos os passos necessários para conduzir o modelo cirúrgico de IRI intestinal em camundongos Swiss Webster, machos e fêmeas com 8-14 semanas de idade. Esse modelo de IRI intestinal produz lesão reprodutível, como demonstrado por histopatologia consistente.
Protocolo
Os procedimentos descritos aqui foram aprovados pelo Comitê Nacional de Cuidados e Uso de Animais do Instituto Nacional do Coração, Pulmão e Sangue nos Institutos Nacionais de Saúde e estão em conformidade com as políticas descritas na Política do Serviço de Saúde Pública sobre Cuidados Humanos e Uso de Animais de Laboratório, na Lei de Bem-Estar Animal e no Guia para o Cuidado e Uso de Animais de Laboratório.
1. Arranjo cirúrgico
- Siga procedimentos assépticos. Use máscara, capa de cabelo e macacão limpo / jaleco / esfoliantes cirúrgicos.
- Prepare os seguintes materiais esterilizados: instrumentos cirúrgicos (ver Tabela de Materiais), soro fisiológico quente, cotonetes, gazes, grampos cirúrgicos, campos cirúrgicos e luvas. Obtenha também fita cirúrgica, que não precisa ser esterilizada. Esterilizar os materiais com técnicas de esterilização em autoclave ou óxido de etileno.
- Coloque uma manta de água circulante aquecida na área da cirurgia e cubra-a com uma toalha estéril ou cortina.
- Use um vaporizador de isoflurano de precisão, ar medicinal pressurizado (21% O2) e um circuito Bain sem reinalação com um cone nasal projetado para camundongos para fornecer anestesia cirúrgica.
2. Preparação dos animais
- Anestesiar o camundongo em uma câmara de indução fornecendo 2%-4% de isoflurano com 21% de ar medicinal O2 a uma taxa de 0,5 L/min para cada litro de volume da câmara.
NOTA: É preferível usar ar medicinal A2 a 21% em vez de 100% A2 para este modelo específico, pois a saturação do sangue com O2 pode interferir com a IRI. - Retire o mouse da câmara e mova-o para uma superfície limpa separada da área da cirurgia. Encaixe-o com um cone nasal fornecendo isoflurano a 1,5% com ar medicinal O2 a 21%.
- Injetar 1 mg/kg de buprenorfina por via subcutânea na área cervicotorácica dorsal.
- Injetar 200-600 UI/kg de heparina por via intraperitoneal para prevenir a formação de trombo durante o período de oclusão.
- Aplique pomada oftálmica nos olhos para evitar danos na córnea.
- Remova os pelos do abdômen ventral usando cortadores.
- Mova o mouse sobre a manta de água aquecida na área da cirurgia. Novamente, encaixe-o com um cone nasal fornecendo isoflurano a 1,5% com ar medicinal O2 a 21% para alcançar um plano cirúrgico de anestesia.
- Posicione o camundongo em decúbito dorsal e fixe os membros à mesa com fita adesiva cirúrgica.
- Monitore a temperatura corporal do animal por via retal usando um termômetro específico para roedores. Manter a temperatura corporal entre 36,5 ± 0,5 °C durante toda a duração da cirurgia.
- Desinfetar o abdome ventral com gaze estéril embebida em esfoliante com clorexidina ou iodopovidona, seguido de álcool a 70%. Repita essa sequência três vezes, alternando entre o esfoliante e o álcool. Um novo conjunto de esfoliantes e gazes de álcool deve ser usado a cada vez.
- Aplicar a esfoliação e o álcool em movimento circular, iniciando com pequenos círculos no centro do sítio cirúrgico e trabalhando gradualmente em direção às bordas, aumentando o tamanho dos círculos. Descarte a gaze uma vez atingida a borda do sítio cirúrgico. Não esfregue para trás de borda a centro.
- Realize um teste de pinça dos dedos dos pés (reflexo do pedal) para garantir que o animal esteja totalmente anestesiado.
- Don luvas estéreis. Cobrir assepticamente o sítio cirúrgico.
3. Cirurgia e isquemia
- Faça uma incisão abdominal ventral de 3-5 cm na pele usando uma lâmina de bisturi #15, disseque-a livre da fáscia muscular subjacente e reflita-a lateralmente. Continue a incisão através da parede abdominal ao longo da linha alba usando uma tesoura microdissecante ou uma microtesoura com mola e coloque um afastador na posição.
- Coloque compressas de gaze estéreis umedecidas com soro fisiológico estéril quente ao redor da área de operação.
- Retire o intestino delgado da cavidade abdominal, vire-o cranialmente e à esquerda do animal e coloque-o sobre as almofadas umedecidas. Coloque outra compressa de gaze umedecida sobre os tecidos para evitar a dessecação. Goteje periodicamente soro fisiológico estéril quente na gaze para manter os tecidos úmidos.
- Isole a AMS, que se localiza ventralmente à veia cava inferior, caudal à artéria celíaca e cranial à artéria renal.
NOTA: A Figura 1 mostra a localização da AME onde ela é isolada durante a cirurgia. A AMS normalmente situa-se ventralmente à veia cava inferior e estende-se para a direita. Quando os intestinos são exteriorizados e virados para a esquerda durante a cirurgia, a AMS fica à esquerda da veia cava inferior. - Coloque um clipe microvascular atraumática na base da AMS, onde ele se ramifica da aorta abdominal, garantindo que o clipe não oclua a veia mesentérica superior.
- Verifique a isquemia do intestino delgado, observando a mudança de cor de rosa para branco-pálido e a perda de pulsação mesentérica.
- Retornar as vísceras à sua posição original dentro da cavidade abdominal durante o período isquêmico. Retire o afastador e cubra a incisão com gaze úmida. Adicione periodicamente soro fisiológico estéril quente à gaze para evitar a dessecação e manter a temperatura corporal.
- Após um período de 45 minutos de isquemia (cujo início é marcado pela aplicação inicial do clipe), remova o clipe ocluindo. Verifique a restauração do fluxo sanguíneo observando uma pulsação mesentérica e cor ruborizada.
- Aplicar soro fisiológico estéril morno intraperitonealmente pouco antes do fechamento final para manter a hidratação adequada.
- Fechar os músculos abdominais com uma sutura de poliglactina 910 6-0. Administrar bupivacaína (até 2 mg/kg) ao longo da linha de incisão muscular para alívio da dor. Feche a pele com grampos cirúrgicos ou clipes de ferida.
4. Recuperação e reperfusão
- Devolva o rato a uma câmara ou gaiola quente sobre uma manta de água circulante, aquecedor de mãos ou outra fonte de calor apropriada. Forneça 21% de O2 a uma taxa de fluxo de 0,5 L/min para cada litro de volume da câmara. Deixe o mouse se recuperar aqui por 90 min. Monitore o mouse a cada 5-10 min em busca de sinais de dor ou angústia, como postura curvada, estrabismo e relutância em se mover.
5. Eutanásia e coleta de sangue
- Ao final do período de recuperação de 90 min, retorne o camundongo à câmara de indução e administre isoflurano a 2%-4% com O2 a 21% a uma taxa de 0,5 L/min de volume da câmara para reinduzir a anestesia completa.
- Transfira o animal de volta para a área da cirurgia e encaixe-o com um cone nasal administrando isoflurano a 2%-4% comO2 a 21% para obter anestesia profunda.
NOTA: OCO 2 não é um método apropriado de eutanásia para esse procedimento, pois induz alterações fisiológicas que podem interferir na lesão isquêmica ou nos analitos teciduais13. - Reabra a incisão ventral na linha média e realize um sangramento terminal coletando o máximo de sangue possível da veia cava abdominal usando uma agulha e seringa 23G. Espere coletar entre 0,3-0,5 mL de sangue (menos em camundongos que foram submetidos a IRI, mais naqueles que receberam laparotomia simulada).
NOTA: O objetivo do sangramento terminal é ajudar na eutanásia humana e coletar e preservar sangue para testes futuros (ou seja, química sérica, PCR, ELISA). - Após a coleta de sangue, a aorta abdominal é cortada para permitir a exsanguinação completa.
- Realizar luxação cervical ou toracotomia como medida secundária para garantir o sucesso da eutanásia.
6. Processamento tecidual para histologia
- Após a eutanásia, colete os tecidos desejados. Garantir que o processamento tecidual seja feito prontamente, pois a autólise começa imediatamente após o óbito14,15.
- Intestinos: Coletar toda a extensão do intestino delgado e intestino grosso. Descarte o ceco.
- Fígado: Coletar os lobos lateral esquerdo, mediano esquerdo e mediano direito.
- Rins: Coletar ambos os rins. Por convenção, o rim esquerdo é cortado longitudinalmente, e o direito é cortado como um corte transversal no momento da necropsia.
NOTA: O cólon, o fígado e os rins podem ser usados para avaliar a falência de múltiplos órgãos ou outros efeitos sistêmicos da IRI. O intestino delgado é usado para avaliar a lesão primária. Não é necessário acompanhar seções individuais do lobo do fígado e dos rins, pois cada órgão será analisado e pontuado como uma unidade. Os segmentos intestinais, no entanto, devem ser mantidos separados e, em seguida, rotulados e pontuados individualmente.
- Divida o intestino em quatro seções: duodeno, jejuno, íleo e cólon. Certifique-se de que os três segmentos do intestino delgado são iguais em comprimento. Faça isso dobrando o intestino delgado em forma de "Z", onde a linha superior é o duodeno, a linha do meio é o jejuno e a linha inferior é o íleo. É importante acompanhar a extremidade proximal versus a distal.
- Lave o lúmen dos segmentos intestinais com soro fisiológico usando uma seringa de 10 mL afixada com um cateter angio de 20 G.
- Antes de fazer os cortes, coloque cada segmento intestinal plano com o lado luminal voltado para cima. Usando uma seringa de 3 mL afixada com uma agulha de 27 G e generosamente aplicar formalina tamponada a 10% gota a gota para revestir toda a extensão da mucosa. Em seguida, enrole cada segmento intestinal individualmente e coloque em de tecido separadas e marcadas.
- Para rolar, coloque cada segmento plano com o lado luminal voltado para cima e, em seguida, enrole circunferencialmente em torno de um palito. A porção proximal deve formar a parte interna do rolo. O lúmen deve estar voltado para o interior/centro. Tente rolar o mais suavemente possível para evitar comprimir as vilosidades.
- Quando enrolado, o intestino deve parecer um rolo suíço. Coloque o rolo suíço espiral virado para cima dentro do.
- Coloque os tecidos em frascos rotulados cheios de formalina tamponada a 10% para fixá-los à temperatura ambiente. A sobrefixação é melhor do que a subfixação. Os frascos para injetáveis devem ser grandes com bastante formalina - pelo menos 20x mais fixador do que tecido.
- Intestinos: Coloque os quatro juntos em um copo de amostra. Correção para 24-48 h.
- Fígado: Coloque os lóbulos do fígado juntos em um tubo cônico de 50 mL. Correção para 24-48 h.
- Rins: Colocar os rins juntos em um tubo cônico de 50 mL. Correção para 48-72 h.
NOTA: Os rins não cortados demoram mais tempo a corrigir do que os rins aparados. Para encurtar o tempo de fixação para 24-48 h, os rins podem ser cortados ao longo do plano mediano, longitudinalmente (rim esquerdo) e transversalmente (rim direito), e colocados em antes de serem depositados no formalina.
- Após os tecidos terem sido fixados em formalina pelo tempo designado, enxaguar com solução salina tamponada com fosfato (PBS) ou água destilada e transferir para frascos marcados preenchidos com EtOH 70%. O tecido pode ser armazenado no EtOH indefinidamente à temperatura ambiente enquanto se aguarda a histologia.
- Intestinos: Coloque os quatro juntos em um copo de amostra.
- Fígado: Coloque os lóbulos do fígado juntos em um tubo cônico de 50 mL.
- Rins: Colocar os rins juntos em um tubo cônico de 50 mL.
- Quando pronto, os tecidos são processados em lâminas de vidro usando coloração de hematoxilina e eosina (H&E). Aparar os tecidos fixados em formalina e, em seguida, incorporá-los em parafina. Monte seções de cinco mícrons nas lâminas e core com H&E.
7. Escore tecidual
- A pontuação tecidual deve ser realizada preferencialmente por pessoal experiente e cego para os grupos amostrais.
- A isquemia intestinal é pontuada pelo sistema de escore de Chiu/Park17.
- A lesão renal é pontuada pelo sistema de escore de Jablonski18,19.
- A lesão hepática é pontuada pelo sistema de pontuação Suzuki 20,21.
NOTA: Existem muitos sistemas de pontuação atualmente em uso para avaliar o dano tecidual em modelos de RI intestinal em roedores. Os sistemas de pontuação utilizados neste estudo foram selecionados para minimizar a estimação arbitrária e maximizar a avaliação qualitativa intencional (Tabela 1).
Resultados
Nós demonstramos um modelo de IRI intestinal em camundongos que produziu resultados consistentes e reprodutíveis. O intestino delgado, cólon proximal, rins e fígado foram seccionados e corados com H&E. Um patologista veterinário classificou a lesão tecidual usando os sistemas de pontuação mencionados anteriormente (Tabela 1). A análise estatística foi realizada por meio da análise de variância (ANOVA) fatorial única, seguida do post hoc de Tukey com comparações pareadas, que determinou se havia ou não diferença significativa nos dados dentro e entre os grupos. Um valor de p menor ou igual a 0,05 foi considerado o ponto de corte para estabelecer significância estatística. Todos os testes estatísticos e gráficos foram realizados em um software de planilha eletrônica (por exemplo, Microsoft Excel) com o complemento Real Statistics Resource Pack. Os dados são apresentados como média ± erro padrão da média (EPM).
Os escores microscópicos das lesões dos três segmentos do intestino delgado (duodeno, jejuno e íleo) estavam significativamente aumentados nos animais submetidos à lesão de isquemia-reperfusão intestinal (IRI; N = 7) versus aqueles submetidos à laparotomia simulada (Sham; N = 6) (Figura 2 e Figura 3). O erro padrão desses dados foi estreito, demonstrando consistência dos resultados dentro e entre os grupos. Cada segmento intestinal no grupo Sham produziu exatamente o mesmo escore médio de Park/Chiu de 0,83. A MEV para duodeno, jejuno e íleo no grupo Sham foi de 0,31, 0,40 e 0,31, respectivamente. Os escores médios de Park/Chiu para duodeno, jejuno e íleo no grupo IRI foram 4,07 ± 0,44, 4,14 ± 0,46 e 5,14 ± 0,40, respectivamente.
Neste estudo, 50% (3/6) dos camundongos iniciais submetidos a isquemia e reperfusão de 120 min (grupo 60/120) morreram. Dois dos três camundongos foram submetidos à necropsia. Ambos os camundongos apresentaram necrose epitelial, congestão e hemorragia do intestino delgado. Além disso, os camundongos apresentaram linfocitólise, alteração inespecífica associada ao estresse fisiológico. Nenhum camundongo apresentava lesões no coração, pulmão, fígado ou rins. O encurtamento dos tempos para 45 min de isquemia e 90 min de reperfusão e a adição de 400 UI/kg de heparina (grupo 45/90/H) reduziram a mortalidade para 20% (1/5) sem alterar os escores de lesão intestinal (Figura 4). O escore médio de Park/Chiu para o grupo 60/120 foi de 4,56 ± 0,38 (N = 3), e o escore médio para o grupo 45/90/H foi de 4,375 ± 0,38 (N = 4).
Achados microscópicos indicativos de lesão no cólon proximal, fígado e rim não foram observados nos camundongos 60/120 ou 45/90/H.
Tabela 1: Sistemas de pontuação para intestinos, rins e fígado. Os danos intestinais foram graduados utilizando-se o sistema Chiu/Park17. A lesão renal foi graduada pelo sistema de escore de Jablonski18,19. A lesão hepática foi graduada pelo sistema de pontuação Suzuki20,21. Essa tabela é adaptada com permissões dos sistemas de pontuação apresentados em Quaedackers et al.17, Du et al.19 e Behrends et al.21. Clique aqui para baixar esta tabela.
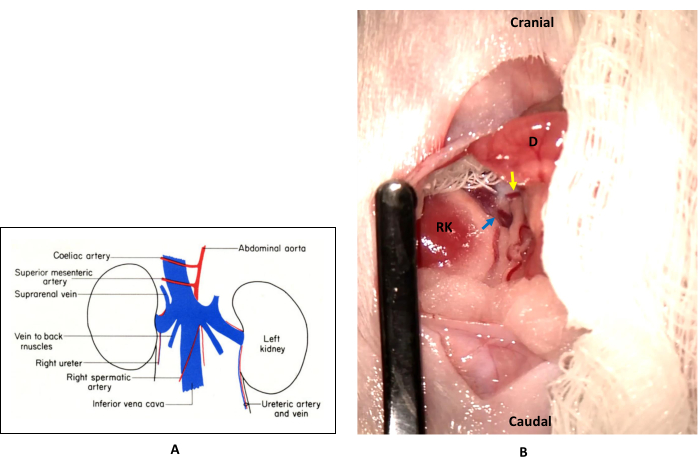
Figura 1: Localização e isolamento da artéria mesentérica superior (AMS). (A) Normalmente, a AMS situa-se ventralmente à veia cava inferior e estende-se para a direita do animal. Situa-se entre a artéria celíaca e a artéria renal. Esta figura é adaptada com permissão de The Anatomy of the Laboratory Mouse, de Margaret Cook (1965)22. (B) Nesse procedimento, os intestinos são exteriorizados e virados para a esquerda (cobertos com gaze umedecida nesta foto), de modo que a AMS (seta amarela) fica à esquerda da veia cava inferior (seta azul). Abreviações: RK = rim direito; D = duodeno. Clique aqui para ver uma versão maior desta figura.
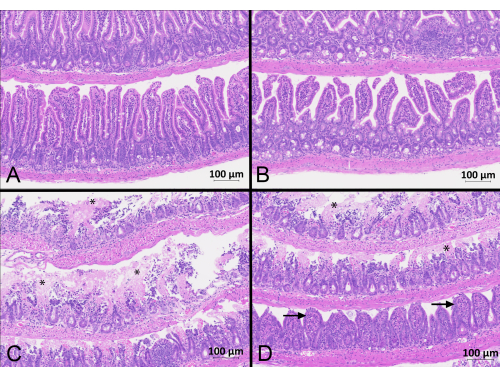
Figura 2: Segmentos do intestino delgado corados pela hematoxilina e eosina. Seções de jejuno (A) e íleo (B) de camundongos do grupo Sham apresentavam vilosidades longas e finas, sem distorção. Cortes de jejuno (C) e íleo (D) de camundongos do grupo IRI apresentaram áreas de necrose (asteriscos) e hemorragia com embotamento e distorção das vilosidades remanescentes (setas). As fotos são de camundongos que foram submetidos a 45 min de isquemia e 90 min de reperfusão e receberam 400 UI/kg de heparina. As fotos foram tiradas em aumento de 20x com zoom de 10%. Barra de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.

Figura 3: Escores de Park/Chiu para segmentos do intestino delgado. O dano microscópico aos três segmentos intestinais (duodeno, jejuno e íleo) dos animais submetidos à lesão de isquemia-reperfusão (IRI) intestinal foi significativamente maior em comparação com aqueles submetidos à laparotomia simulada (Sham). * p < 0,05 para IRI versus Sham. Clique aqui para ver uma versão maior desta figura.
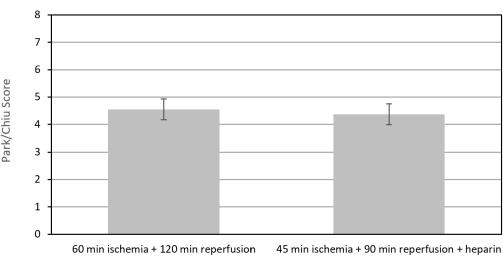
Figura 4: Escores de Park/Chiu para intestino delgado submetidos a isquemia 60 min e 120 reperfusão versus isquemia 45 min e reperfusão 90 min com heparina 400 UI/kg. A diminuição dos tempos de isquemia e reperfusão de 120 min (60/120) para isquemia de 45 min e reperfusão de 90 min com 400 UI/kg de heparina (45/90/H) não criou diferença estatisticamente significativa nos escores de lesão de Park/Chiu do intestino delgado de camundongos do grupo IRI. No entanto, reduziu a mortalidade de 50% para 20%. Clique aqui para ver uma versão maior desta figura.
Discussão
Apesar do amplo uso desse modelo de IRI intestinal, ele não está isento de limitações. Por exemplo, a oclusão exclusiva apenas da base da AME não obstrui completamente o fluxo sanguíneo para o intestino. Isso provavelmente se deve à extensa circulação colateral no mesentério, que pode extrair sangue de ramos vizinhos da aorta abdominal. Em um estudo em gatos, a oclusão da AMS diminuiu o fluxo sanguíneo em 35% no duodeno proximal, 61% no duodeno distal, 71% no jejuno e íleo e 63% no cólon proximal. O fluxo sanguíneo não foi reduzido nos cólons médio e distal, que recebem grande parte de sua circulação da artéria mesentérica inferior23. Em roedores, o jejuno e o íleo são os segmentos intestinais mais citados como os que incorrem em lesão tecidual mais significativa após a oclusão daAMS9.
Uma ampla gama de tempos de isquemia após a oclusão da AMS tem sido citada na literatura, de 1 a 90 min ou mais. Diferentes tempos de isquemia resultam em diferentes níveis de lesão de reperfusão; observaram lesão de reperfusão quando o intervalo isquêmico estava entre 40 e 60 min, mas não quando o intervalo isquêmico era menor ou maior24. Tais resultados sugerem que tempos menores não produzem isquemia suficiente para incitar a lesão de reperfusão, enquanto tempos mais longos danificam o tecido de forma tão grave que é impossível demonstrar a lesão de reperfusão que se segue. Além disso, tempos isquêmicos mais longos acarretam o risco de aumento da mortalidade. Como visto em nosso estudo, 50% (3/6) dos camundongos iniciais submetidos à isquemia de 60 minutos morreram após apenas 90 min de reperfusão. O encurtamento do tempo de isquemia para 45 min reduziu a mortalidade para 20% (1/5) sem alterar os escores de lesão tecidual. Com base em nosso estudo, parece que a janela ideal de dano isquêmico pode ser alcançada pela oclusão da AMS por cerca de 45 min.
Outra variável é o tempo de reperfusão antes da coleta tecidual. Assim como os tempos de isquemia, os tempos de reperfusão variam muito entre os estudos, de 60 min a mais de 24 h. Vários trabalhos relatam que a mucosa intestinal incorre em dano morfológico máximo em 2 a 3 h de reperfusão, com reparo completo alcançado em 24 h 25,26,27. A coleta de tecido antes dessa janela de 2 a 3 h corre o risco de não captar toda a extensão da lesão de reperfusão, enquanto os tecidos colhidos mais perto de 24 h já terão iniciado o processo de reparo. Optou-se, inicialmente, por um tempo de reperfusão de 120 min, mas depois mudou para 90 min em um esforço para diminuir a mortalidade. Essa alteração não alterou os resultados da lesão tecidual, sugerindo que um desvio de 30 min da janela de 2 a 3 h é aceitável.
A concentração de oxigênio também é uma variável importante no desenvolvimento da IRI. Wilding e col. verificaram que, em comparação com camundongos que receberam 21% deO2, aqueles anestesiados com isoflurano administrado com 100% de O2 apresentaram incompatibilidade ventilação-perfusão devido a atelectasias. No mesmo estudo, ratos que receberamO2 a 100% desenvolveram acidose respiratória aguda e pressão arterial média elevada28. Tais alterações fisiológicas devem ser evitadas quando se induz uma lesão como a IRI, na qual uma série de fatores sistêmicos estão envolvidos. Assim, 21% O2 parece ser mais apropriado do que 100% O2 como gás carreador para liberação de isoflurano.
O uso da heparina neste protocolo é passível de debate. Sabe-se que a heparina tem efeitos anticoagulantes e anti-inflamatórios29. Observamos que a mudança de 60 min de isquemia e 120 min de reperfusão para 45 min de isquemia e 90 min de reperfusão com 400 UI/kg de heparina não alterou a lesão intestinal microscópica, mas reduziu a mortalidade. Uma possível explicação é que a heparina preveniu o tromboembolismo fatal para órgãos distantes, como pulmões e cérebro, porém não encontramos evidências disso na necropsia por exame macro ou microscópico dos dois camundongos iniciais que morreram. O uso de tempos de isquemia e reperfusão mais curtos sem heparina pode ser igualmente eficaz na redução da mortalidade. Se fosse esse o caso, seria prudente renunciar ao uso de heparina para minimizar a interferência na IRI. No entanto, a inclusão da heparina no protocolo pode ser apropriada para aqueles que desejam modelar causas cirúrgicas de IRI, uma vez que os pacientes cirúrgicos frequentemente recebem heparina no período perioperatório.
Demonstrou-se que o isoflurano tem efeito protetor tecidual em casos de inflamação intestinal e isquemia, e seu uso pode interferir em um modelo de IRI clinicamente relevante 30,31,32. No entanto, inalantes organoflúores (i.e., isoflurano, sevoflurano) são anestésicos comumente usados em medicina veterinária e humana. Além disso, a duração da anestesia necessária para esse protocolo excede 120 min, e, portanto, um inalante é mais apropriado do que um injetável de ação mais curta, que precisaria ser redosado.
Não havia lesões microscópicas no cólon proximal, fígado ou rim. A ausência de alterações microscópicas talvez se deva ao tempo relativamente curto de reperfusão de 90 a 120 min. Além disso, o cólon proximal tem um suprimento sanguíneo da artéria mesentérica inferior. No entanto, a ausência de danos visíveis não exclui lesão sistêmica. A reação em cadeia da polimerase quantitativa com transcrição reversa (RT-qPCR) é provavelmente uma melhor metodologia para demonstrar lesão sistêmica por meio da medição de citocinas inflamatórias como o TNF-α.
Várias variações deste modelo de IRI intestinal foram desenvolvidas ao longo dos anos. Megison e col., em 1990, demonstraram que a oclusão de vasos colaterais além da AMS produzia uma redução mais consistente do fluxo sanguíneo mesentérico, mas um aumento na taxa de mortalidade33. Um estudo mais recente mostrou que, ao invés de ocluir a AMS em sua base, a ligadura de seus ramos periféricos e colaterais para induzir isquemia no íleo distal produziu lesão reprodutível sem mortalidade34. A oclusão dos ramos arteriais locais garante isquemia máxima e pode resolver a questão das reduções segmentares e multifocais do fluxo sanguíneo observadas com a ligadura da AMS apenas em sua base. Embora este método alternativo de modelagem da IRI intestinal tenha aplicação para a pesquisa dos efeitos teciduais locais da IRI intestinal, não se sabe se ele pode modelar com precisão a inflamação sistêmica e a falência de múltiplos órgãos que podem estar associadas à lesão intestinal.
A oclusão da AMS não é um modelo apropriado para todos os tipos de IRI intestinal. A isquemia mesentérica não-oclusiva, por exemplo, é caracterizada por hipoperfusão esplâncnica decorrente da diminuição do débito cardíaco. Portanto, essa técnica não seria ideal para estudar a IRI intestinal causada por infarto do miocárdio, insuficiência cardíaca congestiva, insuficiência aórtica ou doença renal ouhepática35. relataram que a oclusão da AMS é, no entanto, um modelo clinicamente relevante para IRI intestinal induzida por choque36. Embora menos econômico, o uso de outras espécies, como suínos, pode trazer benefícios sobre os roedores para a modelagem de determinadas condições de lesão intestinal. Uma revisão abrangente realizada por Gonzalez et al., em 2014, descreve modelos animais atualmente em uso para investigação de IRI intestinal9.
Apesar de suas limitações, a técnica de oclusão da AMS em sua base continua sendo um dos modelos de isquemia intestinal mais comumente utilizados em roedores9. Como requer apenas uma pinça vascular e um setup básico, a cirurgia em si é bastante simples. Também produz lesão reprodutível, como evidenciado pelos dados aqui apresentados. A oclusão da AME em roedores pode modelar de forma confiável as causas oclusivas de IRI intestinal e pode ter aplicação prática tanto na medicina veterinária quanto na medicina humana. Como tal, é importante que os procedimentos que aqui delineámos sejam realizados com coerência.
Divulgações
Os autores deste artigo não têm conflitos de interesse a declarar.
Agradecimentos
O financiamento para este projeto foi fornecido pela Divisão de Pesquisa Intramural do Instituto Nacional do Coração, Pulmão e Sangue, Institutos Nacionais de Saúde.
Gostaríamos de agradecer ao Dr. James Hawkins por sua orientação e apoio. Agradecemos também aos Drs. Mihai Oltean e Robert Linford pelo auxílio na localização da artéria mesentérica superior. Gostaríamos de estender nossos agradecimentos aos Drs. Patricia Carvalho Obeid Ellrich, Claudio Correa Natalini e George Howell III por fornecerem sua experiência durante o desenvolvimento deste protocolo. Finalmente, gostaríamos de agradecer a Stephen Wincovitch por sua ajuda na aquisição das belas fotomicrografias apresentadas neste artigo e à Dra. Alicia Olivier por sua ajuda na rotulagem e renderização das figuras finais.
Materiais
| Name | Company | Catalog Number | Comments |
| Adson forceps | Roboz | RS-5236 | Surgical instrument |
| Alm retractor | Roboz | RS-6510 | Surgical instrument |
| Anesthesia machine | Datex-Ohmeda | Aestiva 5 | |
| Anesthesia: isoflurane | Baxter Healthcare Corporation | NDC 10019-360-40 | Dose: 1-4%, INH |
| Angiocath 20 g x 2 | Smiths Medical | 5057 | Flushing intestines with saline and formalin |
| Atraumatic microvascular clip | Teleflex | 065100 | Surgical instrument |
| Buffered formalin 10% | Fisher Scientific | 23-245684 | Tissue fixation |
| Bupivicaine 0.25% | Hospira, Inc. | NDC 0409-1160-18 | Dose: up to 2 mg/kg drop-wise |
| Buprenorphine | Par Pharmaceutical | NDC 42023-179-05 | Dose: 1 mg/kg, SQ |
| Chlorhexidine scrub 2% | Vet One | 510083 | Surgical site prep |
| Circulating water blanket | Cincinnati Sub Zero | Blanketrol 2 | Body temp maintenance |
| Clippers - Wahl BravMini, Purple Hair clippers | Lambert Vet Supply | 008WA-41590-0438 | Surgical site prep |
| Conical tubes 50 ml | Fisher Scientific | 14-432-22 | Tissue fixation and storage |
| Dry ice | N/A | N/A | PCR tissue samples |
| EtOH 200 proof | The Warner-Graham Company | 64-17-5 | Tissue storage |
| Heparin (optional) | Meitheal Pharmaceuticals | NDC 71288-402-11 | Dose: 200-600 IU/kg |
| Induction chamber | VetEquip | 941456 | |
| Indus Instruments THM100 Rodent Monitor | Indus Instruments | N/A | For monitoring rodent body temperature during surgery |
| Isopropyl Alcohol 70% | Humco | NDC 0395-4202-28 | For scrubbing surgical site |
| Microcentrifuge Tubes: 0.6mL | Fisher Scientific | 05-408-121 | PCR tissue samples. 8 per mouse, Terminal bleed collection, serum storage |
| Microsoft Excel | Microsoft | N/A | |
| Nose cone | N/A | N/A | Can be homemade with syringe tube or bubble tubing |
| O2 medical air 21% | Roberts Oxygen | N/A | Rate: 0.5 L/min for each L chamber volume |
| Ophthalmic ointment | Akorn, Inc. | NDC 17478-062-35 | Surgical prep |
| PBS pH 7.4 (1x) | ThermoFisher Scientific | 10010-031 | For tissue rinsing and making 70% EtOH |
| Specimen cups | Cardinal Healthcare | C13005 | For holding tissue cassettes in formalin |
| Sterile Castroviejo Needle Holder | Roboz | RS-6412 | Surgical instrument |
| Sterile cotton swabs | Medline | BXTA50002Z | |
| Sterile gauze | Medline | PRM21423Z | |
| Sterile Micro Dissecting Scissors | Roboz | RS-5980 | Surgical instrument |
| Sterile micro dissecting spring scissors | Roboz | RS-5693 | Surgical instrument |
| Sterile micro forceps | Roboz | RS-5264 | Surgical instrument |
| Sterile saline (0.9%) | Braun | R5201-01 | Must be warmed |
| Sterile scalpel blade #15 | Cardinal Health (Allegiance) | 32295-015 | Surgical instrument |
| Sterile scalpel handle | Roboz | RS-9843 | Surgical instrument |
| Sterile surgical drape | Medline | DYNJSD1092 | |
| Sterile surgical gloves | Medline | MSG2270 | |
| Sterile surgical stapler | Roboz | RS-9260 | Surgical instrument |
| Sterile surgical staples | Roboz | RS-9262 | Abdominal skin closure |
| Sterile suture: Vicryl (polyglactin 910) 6-0, 27" Taper RB-1 Needle | Ethicon | J212G | Closing abdominal muscle |
| Surgical tape | Medline | MMM15271Z | Securing mouse in dorsal recumbancy |
| Syringe 10 ml x 2 | Medline | SYR110010 | Flushing intestines with saline and formalin |
| Tissue cassettes | Fisher Scientific | 22-038-665 | Rolled intestinal segments. 4 per mouse. |
| Towel or drape | Medline | GEM2140 | Water blanket cover |
Referências
- Mallick, I. H., Yang, W., Winslet, M. C., Seifalian, A. M. Ischemia-reperfusion injury of the intestine and protective strategies against injury. Digestive Diseases and Sciences. 49, 1359-1377 (2004).
- Minguet, G., Joris, J., Lamy, M. Preconditioning and protection against ischaemia-reperfusion in non-cardiac organs: a place for volatile anaesthetics. European Journal of Anaesthesiology. 24 (9), 733-745 (2007).
- Cowled, P., Fitridge, R. Pathophysiology of reperfusion injury. Mechanisms of Vascular Disease: A Reference Book for Vascular Specialists. , 331-350 (2011).
- Grootjans, J., et al. Human intestinal ischemia-reperfusion-induced inflammation characterized: Experiences from a new translational model. The American Journal of Pathology. 176 (5), 2283-2291 (2010).
- Sharp, C. R., Rozanski, E. A., Finn, E., Borrego, E. J. The pattern of mortality in dogs with gastric dilatation and volvulus. Journal of Veterinary Emergency and Critical Care. 30 (2), 232-238 (2020).
- Tinker, M. K., et al. Prospective study of equine colic incidence and mortality. Equine Veterinary Journal. 29 (6), 448-453 (1997).
- McMichael, M., Moore, R. M. Ischemia-reperfusion injury pathophysiology, part I. Journal of Veterinary Emergency and Critical Care. 14 (4), 231-241 (2004).
- Kaneene, J. B., Ross, W. A., Miller, R. A. The Michigan equine monitoring system. II. Frequencies and impact of selected health problems. Preventive Veterinary Medicine. 29 (4), 277-292 (1997).
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Animal models of ischemia-reperfusion-induced intestinal injury: Progress and promise for translational research. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (2), 63-75 (2015).
- Kim, M., Park, S. W., Kim, M., D'Agati, V. D., Lee, H. T. Isoflurane post-conditioning protects against intestinal ischemia-reperfusion injury and multiorgan dysfunction via transforming growth factor-β1 generation. Annals of Surgery. 255 (3), 492-503 (2012).
- García, E. M. S. N., Taylor, J. H., Cenizo, N., Vaquero, C. Beneficial effects of intra-arterial and intravenous prostaglandin E1 in intestinal ischaemia-reperfusion injury. Interactive Cardiovascular and Thoracic Surgery. 18 (4), 466-474 (2014).
- Liu, C., et al. Sevoflurane protects against intestinal ischemia-reperfusion injury partly by phosphatidylinositol 3 kinases/Akt pathway in rats. Surgery. 157 (5), 924-933 (2015).
- Shomer, N. H., et al. Review of rodent euthanasia methods. Journal of the American Association for Laboratory Animal Science. 59 (3), 242-253 (2020).
- Diagnostic Necropsy and Tissue Harvest in Rodents. Lab Animal Research. Journal of Visualized Experiments Available from: https://www.jove.com/v/10294/diagnostic-necropsy-and-tissue-harvest (2023)
- Scudamore, C. L. . A Practical Guide to the Histology of the Mouse. , (2014).
- Scicchitano, M. S., et al. Preliminary comparison of quantity, quality, and microarray performance of RNA extracted from formalin-fixed, paraffin-embedded, and unfixed frozen tissue samples. Journal of Histochemistry and Cytochemistry. 54 (11), 1229-1237 (2006).
- Quaedackers, J. S. L. T., et al. An evaluation of methods for grading histologic injury following ischemia/reperfusion of the small bowel. Transplantation Proceedings. 32 (6), 1307-1310 (2000).
- Jablonski, P., et al. An experimental model for assessment of renal recovery from warm ischemia. Transplantation. 35 (3), 198-204 (1983).
- Du, H., et al. Hydrogen-rich saline attenuates acute kidney injury after liver transplantation via activating p53-mediated autophagy. Transplantation. 100 (3), 563-570 (2016).
- Suzuki, S., et al. The beneficial effect of a prostaglandin 12 analog on ischemic rat liver. Transplantation. 52 (6), 978-983 (1991).
- Behrends, M., et al. Acute hyperglycemia worsens hepatic ischemia/reperfusion injury in rats. Journal of Gastrointestinal Surgery. 14 (3), 528-535 (2010).
- Cook, M. J. . The Anatomy of the Laboratory Mouse. , (1965).
- Premen, A. J., et al. Importance of collateral circulation in the vascularly occluded feline intestine. Gastroenterology. 92 (5), 1215-1219 (1987).
- Park, P. O., Haglund, U., Bulkley, G. B., Falt, K. The sequence of development of intestinal tissue injury after strangulation ischemia and reperfusion. Surgery. 107 (5), 574-580 (1990).
- Guzmán-de La Garza, F. J., et al. Different patterns of intestinal response to injury after arterial, venous or arteriovenous occlusion in rats. World Journal of Gastroenterology. 15 (31), 3901-3907 (2009).
- Chang, J. X. Functional and morphological changes of the gut barrier during the restitution process after hemorrhagic shock. World Journal of Gastroenterology. 11 (35), 5485-5491 (2005).
- Illyes, G., Hamar, J. Sequence of morphological alterations in a small intestinal ischaemia/reperfusion model of the anesthetized rat. A light microscopy study. International Journal of Experimental Pathology. 73 (2), 161-172 (1992).
- Wilding, L. A., et al. Benefits of 21% oxygen compared with 100% oxygen for delivery of isoflurane to mice (Mus musculus) and rats (Rattus norvegicus). Journal of the American Association for Laboratory Animal Science. 56 (2), 148-154 (2017).
- Ding, R., Zhao, D., Guo, R., Zhang, Z., Ma, X. Treatment with unfractionated heparin attenuates coagulation and inflammation in endotoxemic mice. Thrombosis Research. 128 (6), 160-165 (2011).
- Hayes, J. K., Havaleshko, D. M., Plachinta, R. V., Rich, G. F. Isoflurane pretreatment supports hemodynamics and leukocyte rolling velocities in rat mesentery during lipopolysaccharide-induced inflammation. Anesthesia and Analgesia. 98 (4), 999-1006 (2004).
- Miller, L. S., et al. Suppression of cytokine-lnduced neutrophil accumulation in rat mesenteric venules in vivo by general anesthesia. International Journal of Microcirculation. 16 (3), 147-154 (1996).
- Kim, M., Park, S. W., Kim, M., D'Agati, V. D., Lee, H. T. Isoflurane activates intestinal sphingosine kinase to protect against bilateral nephrectomy-induced liver and intestine dysfunction. American Journal of Physiology. Renal Physiology. 300 (1), 167-176 (2011).
- Megison, S. M., Horton, J. W., Chao, H., Walker, P. B. A new model for intestinal ischemia in the rat. The Journal of Surgical Research. 49 (2), 168-173 (1990).
- Gubernatorova, E. O., Perez-Chanona, E., Koroleva, E. P., Jobin, C., Tumanov, A. V. Murine model of intestinal ischemia-reperfusion injury. Journal of Visualized Experiments. (111), 53881 (2016).
- Trompeter, M., Brazda, T., Remy, C. T., Vestring, T., Reimer, P. Non-occlusive mesenteric ischemia: Etiology, diagnosis, and interventional therapy. European Radiology. 12 (5), 1179-1187 (2002).
- Kozar, R. A., et al. Superior mesenteric artery occlusion models shock-induced gut ischemia-reperfusion. The Journal of Surgical Research. 116 (1), 145-150 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados