Method Article
Модель ишемически-реперфузионного повреждения кишечника через окклюзию верхней брыжеечной артерии на грызунах
В этой статье
Резюме
Описано, как создать широко используемую хирургическую модель ишемически-реперфузионного повреждения кишечника (ИРИ) у грызунов. Процедура предполагает окклюзию верхней брыжеечной артерии с последующим восстановлением кровотока. Эта модель полезна для исследований, изучающих окклюзионные причины кишечного ИРИ как в ветеринарии, так и в медицине человека.
Аннотация
Ишемически-реперфузионное повреждение кишечника (ИРИ) связано с множеством состояний как в ветеринарии, так и в медицине человека. Кишечные заболевания ИРИ, такие как заворот желудка (ГРВ), заворот брыжейки и колики, наблюдаются у таких животных, как собаки и лошади. Первоначальное прерывание кровотока приводит к ишемизации тканей. Несмотря на то, что это необходимо для спасения жизнеспособной ткани, последующая реперфузия может вызвать дальнейшее повреждение. Основным механизмом, ответственным за ИРИ, является образование свободных радикалов при реперфузии и повторном введении кислорода в поврежденную ткань, но в этом участвует много других компонентов. Возникающие в результате местные и системные эффекты часто дают неблагоприятный прогноз.
Кишечная ИРИ является предметом обширных исследований в течение последних 50 лет. Модель грызуна in vivo , в которой основание верхней брыжеечной артерии (СМА) временно перевязывается, в настоящее время является наиболее распространенным методом, используемым для изучения кишечного ИРИ. В данной работе мы описываем модель кишечного ИРИ с использованием изофлурановой анестезии в медицинском воздухе с содержанием 21%O2 , что приводит к воспроизводимому повреждению, что подтверждается последовательной гистопатологией тонкой кишки. Также оценивали повреждение тканей толстой кишки, печени и почек.
Введение
Ишемия-реперфузионное повреждение (ИРИ) может возникнуть в любом органе и включает в себя два последовательных компонента. Первоначальное прекращение кровотока приводит к ишемизации пораженных тканей, а затем последующая реперфузия вызывает дальнейшее повреждение клеток. Ущерб от реперфузии часто превышает ущерб, вызванный ишемией1. Патофизиология ИРИ включает в себя сложный каскад событий, наиболее заметным из которых является образование свободных радикалов при повторном введении кислорода, которое происходит во время реперфузии2. Активация воспалительных клеток и цитокинов также играет роль2. В случаях кишечного ИРИ бактериальная транслокация в кровоток после повреждения эндотелия может привести к синдрому системной воспалительной реакции2. Если повреждение, вызванное ИРИ, достаточно серьезное, возникающие в результате системные эффекты могут привести к полиорганной недостаточности3.
Случаи кишечного ИРИ ассоциированы с высокой заболеваемостью и смертностью 4,5,6. ИРИ кишечника связана со многими патологическими состояниями и хирургическими процедурами как в ветеринарии, так и в медицине человека. В ветеринарии животные особенно склонны к кишечным заболеваниям ИРИ, таким как заворот желудка (ГРВ), заворот брыжейки и колики 7,8. У людей ИРИ является основной и часто встречающейся проблемой при хирургии аневризмы брюшной аорты, ущемленных грыжах, острой мезентериальной ишемии, завороте, травме, шоке, неонатальном некротизирующем энтероколите и резекции или трансплантации тонкой кишки9.
Большинство исследований кишечного ИРИ in vivo на грызунах включают окклюзию основания верхней брыжеечной артерии (СМА), ветви брюшной аорты, которая снабжает кровью большую часть тонкой кишки и проксимальную часть толстой кишки 10,11,12. Несмотря на широкое применение этой модели и относительную простоту, подробный протокол с использованием ингаляционной анестезии в медицинском воздухе 21%O2 не опубликован. Отсутствие стандартного протокола создает трудности для исследователей, которые не знакомы с процедурой, и препятствует согласованности между исследованиями. Мы демонстрируем шаги, необходимые для проведения хирургической модели кишечной ИРИ у 8-14-недельных самцов и самок швейцарских мышей породы Webster. Эта модель кишечного ИРИ приводит к воспроизводимому повреждению, что подтверждается последовательной гистопатологией.
протокол
Описанные здесь процедуры были одобрены Комитетом по уходу за животными и использованию животных Национального института сердца, легких и крови при Национальных институтах здравоохранения и соответствуют политике, изложенной в Политике Службы общественного здравоохранения в отношении гуманного обращения с лабораторными животными и их использования, Законе о благополучии животных и Руководстве по уходу за лабораторными животными и их использованию.
1. Хирургическая подготовка
- Соблюдайте асептические процедуры. Наденьте маску, чехол для волос и чистый комбинезон/лабораторный халат/хирургические скрабы.
- Подготовьте следующие стерилизованные материалы: хирургические инструменты (см. Таблицу материалов), теплый физиологический раствор, ватные палочки, марлю, хирургические скобы, хирургические простыни и перчатки. Также приобретается хирургическая лента, которую не нужно стерилизовать. Стерилизуйте материалы с помощью методов стерилизации в автоклаве или на основе окиси этилена.
- Положите одеяло с подогревом циркулирующей воды в операционную зону и накройте его стерильным полотенцем или простыней.
- Используйте прецизионный испаритель изофлурана, медицинский воздух под давлением (21%O2) и контур Bain без повторного дыхания с носовым конусом, предназначенный для мышей для обеспечения хирургической анестезии.
2. Подготовка животных
- Обезболивайте мышь в индукционной камере, вводя 2%-4% изофлуран с 21% O2 медицинского воздуха со скоростью 0,5 л/мин на каждый литр объема камеры.
ПРИМЕЧАНИЕ: Предпочтительно использовать медицинский воздух 21%O2 вместо 100%O2 для этой конкретной модели, так как насыщение кровиO2 может помешать IRI. - Извлеките мышь из камеры и переместите ее на чистую поверхность, отделенную от области операции. Установите на него носовой обтекатель, обеспечивающий подачу 1,5% изофлурана с 21% медицинского воздухаO2 .
- Вводят 1 мг/кг бупренорфина подкожно в дорсальную шейно-грудную область.
- Вводят 200-600 МЕ/кг гепарина внутрибрюшинно для предотвращения тромбообразования в период окклюзии.
- Нанесите офтальмологическую мазь на глаза, чтобы предотвратить повреждение роговицы.
- Удалите волосы с брюшной полости с помощью машинок для стрижки.
- Переместите мышь на одеяло с подогревом воды в зоне операции. Опять же, установите на него носовой конус, подавая 1,5% изофлурана с 21% медицинского воздухаO2 , чтобы добиться хирургической плоскости анестезии.
- Расположите мышь в спинном положении лежа и закрепите конечности на столе хирургической лентой.
- Контролируйте температуру тела животного ректально с помощью термометра, предназначенного для грызунов. Поддерживайте температуру тела на уровне 36,5 ± 0,5 °C в течение всего периода операции.
- Продезинфицируйте брюшную полость с помощью стерильной марли, смоченной в скрабе с хлоргексидином или повидон-йодным скрабом с последующим добавлением 70% спирта. Повторите эту последовательность три раза, чередуя скраб и спирт. Каждый раз следует использовать новый набор скрабов и спиртовых марлей.
- Наносите скраб и спирт круговыми движениями, начиная с небольших кругов в центре операционного поля и постепенно двигаясь к краям, увеличивая размер кругов. Выбросьте марлю, как только вы достигнете края операционного поля. Не протирайте назад от края к центру.
- Проведите тест на защемление пальцев ног (педальный рефлекс), чтобы убедиться, что животное полностью обезболино.
- Наденьте стерильные перчатки. Асептически драпируют место операции.
3. Хирургическое вмешательство и ишемия
- Сделайте 3-5-сантиметровый надрез брюшной полости на коже лезвием скальпеля #15, рассеките его от подлежащей мышечной фасции и отразите латерально. Продолжайте разрез через брюшную стенку вдоль linea alba с помощью микроножниц для препарирования или подпружиненных микроножниц и установите ретрактор на место.
- Положите стерильные марлевые салфетки, смоченные теплым стерильным физиологическим раствором, вокруг операционного поля.
- Извлеките тонкую кишку из брюшной полости, переверните ее краниально и влево от животного и положите на увлажненные подушечки. Положите на салфетки еще одну увлажненную марлевую салфетку, чтобы предотвратить высыхание. Периодически капайте теплый стерильный физраствор на марлю, чтобы ткани оставались влажными.
- Изолируют СМА, которая расположена вентрально от нижней полой вены, каудально от чревной артерии и краниально от почечной артерии.
ПРИМЕЧАНИЕ: На рисунке 1 показано расположение СМА в том месте, где она изолирована во время операции. СМА в норме располагается вентрально от нижней полой вены и простирается вправо. Когда кишечник экстериоризируется и переворачивается влево во время операции, СМА находится слева от нижней полой вены. - Установите атравматический микрососудистый зажим поперек основания СМА, где он ответвляется от брюшной аорты, следя за тем, чтобы зажим не перекрывал верхнюю брыжеечную вену.
- Проверьте ишемию тонкой кишки, отметив изменение цвета с розового на бледно-белый и потерю пульсации брыжейки.
- Вернуть внутренние органы в исходное положение внутри брюшной полости на время ишемического периода. Снимите ретрактор и накройте разрез влажной марлей. Периодически добавляйте в марлю теплый стерильный физиологический раствор, чтобы предотвратить пересыхание и поддерживать температуру тела.
- После 45-минутного периода ишемии (начало которого отмечается при первоначальном наложении клипсы) снимите окклюзионный зажим. Проверьте восстановление кровотока, наблюдая пульсацию брыжейки и покрасневший цвет.
- Нанесите теплый стерильный физиологический раствор внутрибрюшинно непосредственно перед окончательным закрытием, чтобы поддерживать надлежащее увлажнение.
- Закройте мышцы живота швом 6-0 полиглактин 910. Вводят бупивакаин (до 2 мг/кг) вдоль линии разреза мышцы для облегчения боли. Закройте кожу хирургическими скобами или зажимами для ран.
4. Восстановление и реперфузия
- Верните мышь в теплую камеру или клетку на одеяло с циркуляцией воды, грелку для рук или другой подходящий источник тепла. Подача 21%O2 при расходе 0,5 л/мин на каждый литр объема камеры. Дайте мышке восстановиться в течение 90 минут. Следите за мышью каждые 5–10 минут на предмет признаков боли или стресса, таких как сгорбленная осанка, косоглазие и нежелание двигаться.
5. Эвтаназия и забор крови
- В конце 90-минутного восстановительного периода верните мышь в индукционную камеру и введите 2%-4% изофлуран с 21%O2 из расчета 0,5 л/мин объема камеры для повторного введения полной анестезии.
- Переместите животное обратно в операционную зону и установите на него носовой конус, доставляющий 2%-4% изофлурана с 21%O2 для достижения глубокой анестезии.
ПРИМЕЧАНИЕ: CO2 не является подходящим методом эвтаназии для этой процедуры, поскольку он вызывает физиологические изменения, которые могут помешать ишемическому повреждению или анализу тканей13. - Снова откройте вентральный разрез по средней линии и выполните терминальное кровотечение, собрав как можно больше крови из полой вены брюшной полости с помощью иглы 23 G и шприца. Ожидается, что будет собрано от 0,3 до 0,5 мл крови (меньше у мышей, перенесших ИРИ, больше у тех, кто перенес фиктивную лапаротомию).
ПРИМЕЧАНИЕ: Целью терминального кровотечения является помощь в гуманной эвтаназии, а также сбор и сохранение крови для будущих исследований (например, биохимический анализ сыворотки, ПЦР, ИФА). - После забора крови брюшная аорта рассекается для полного обескровливания.
- Выполните либо вывих шейного отдела, либо торакотомию в качестве дополнительной меры для обеспечения успешной эвтаназии.
6. Обработка тканей для гистологии
- После эвтаназии соберите нужные ткани. Следите за тем, чтобы обработка тканей производилась своевременно, так как аутолиз начинается сразу после смерти14,15.
- Кишечник: Соберите всю длину тонкой и толстой кишки. Выбросьте слепую кишку.
- Печень: Соберите левую боковую, левую срединную и правую срединные доли.
- Почки: Соберите обе почки. По соглашению левую почку разрезают в продольном направлении, а правую разрезают в поперечном сечении во время вскрытия.
ПРИМЕЧАНИЕ: Толстая кишка, печень и почки могут быть использованы для оценки полиорганной недостаточности или других системных эффектов ИРИ. Тонкая кишка используется для оценки первичного повреждения. Нет необходимости следить за отдельными участками доли печени и почек, так как каждый орган будет анализироваться и оцениваться как единое целое. Сегменты кишечника, однако, следует держать отдельно, а затем маркировать и оценивать по отдельности.
- Разделите кишечник на четыре отдела: двенадцатиперстную кишку, тощую кишку, подвздошную кишку и толстую кишку. Убедитесь, что три сегмента тонкой кишки равны по длине. Сделайте это, сложив тонкую кишку в форме буквы «Z», где верхняя линия — это двенадцатиперстная кишка, средняя линия — тощая кишка, а нижняя линия — подвздошная кишка. Важно следить за проксимальным и дистальным концами.
- Промыть просвет сегментов кишечника физиологическим раствором с помощью шприца объемом 10 мл с ангиокатетером 20 G.
- Перед тем, как делать срезы, положите каждый сегмент кишечника плашмя просветной стороной вверх. С помощью шприца объемом 3 мл, прикрепленного иглой 27 G, обильно нанесите 10% буферный формалин по каплям, чтобы покрыть слизистую оболочку по всей длине. Затем сверните каждый сегмент кишечника по отдельности и поместите в отдельные, помеченные тканевые кассеты.
- Чтобы скатать, положите каждый сегмент плашмя стороной просвета вверх, затем прокатайте по окружности вокруг зубочистки. Проксимальная часть должна составлять внутреннюю часть рулона. Просвет должен быть обращен внутрь/центр. Старайтесь перекатывать как можно аккуратнее, чтобы избежать сдавливания ворсинок.
- В свернутом виде кишечник должен выглядеть как швейцарский рулет. Поместите спираль швейцарского рулета лицевой стороной вверх внутрь кассеты.
- Поместите салфетки в пробирки с этикетками, наполненные 10% буферным формалином, чтобы зафиксировать их при комнатной температуре. Чрезмерная фиксация лучше, чем недостаточная. Флаконы должны быть большими, с большим количеством формалина – по крайней мере, в 20 раз больше фиксатора, чем в ткани.
- Кишечник: Поместите четыре кассеты вместе в чашку для образцов. Фиксация на 24-48 ч.
- Печень: Поместите доли печени вместе в коническую пробирку объемом 50 мл. Фиксация на 24-48 ч.
- Почки: Поместите почки вместе в коническую пробирку объемом 50 мл. Фиксация на 48-72 ч.
ПРИМЕЧАНИЕ: Необрезанные почки восстанавливаются дольше, чем обрезанные почки. Чтобы сократить время фиксации до 24-48 ч, почки могут быть разрезаны вдоль срединной плоскости, продольно (левая почка) и поперечно (правая почка) и помещены в кассеты перед депонированием в формалин.
- После того, как ткани были зафиксированы в формалине в течение указанного времени, их промыть фосфатно-солевым буфером (PBS) или дистиллированной водой и переложить в маркированные флаконы, наполненные 70% EtOH. Ткань может храниться в EtOH неограниченное время при комнатной температуре в ожидании гистологического исследования.
- Кишечник: Поместите четыре кассеты вместе в чашку для образцов.
- Печень: Поместите доли печени вместе в коническую пробирку объемом 50 мл.
- Почки: Поместите почки вместе в коническую пробирку объемом 50 мл.
- Когда ткани будут готовы, обработайте их на предметных стеклах с помощью окрашивания гематоксилином и эозином (H&E). Обрежьте ткани, зафиксированные формалином, а затем погрузите их в парафин. Установите пятимикронные срезы на предметные стекла и окрасьте H&E.
7. Оценка тканей
- Оценка тканей предпочтительно должна выполняться опытным персоналом, который не имеет доступа к группам образцов.
- Ишемия кишечника оценивается по шкале Чиу-Парка17.
- Повреждение почек оценивается по балльной системе Яблонски 18,19.
- Поражение печени оценивается по балльной системе Сузуки20,21.
ПРИМЕЧАНИЕ: В настоящее время существует множество систем оценки, используемых для оценки повреждения тканей в моделях кишечного IRI у грызунов. Балльные системы, использованные в данном исследовании, были выбраны таким образом, чтобы свести к минимуму произвольное оценивание и максимизировать преднамеренную качественную оценку (табл. 1).
Результаты
Мы продемонстрировали модель кишечного ИРИ у мышей, которая дала стабильные и воспроизводимые результаты. Тонкая кишка, проксимальный отдел толстой кишки, почки и печень были разделены и окрашены H&E. Ветеринарный патологоанатом оценивал повреждение тканей с помощью ранее упомянутых систем оценки (Таблица 1). Статистический анализ был проведен с использованием однофакторного дисперсионного анализа (ANOVA) с последующим постфактум сравнением Тьюки с попарными сравнениями, которые определили, была ли существенная разница в данных внутри и между группами. p-значение, меньшее или равное 0,05, считалось пороговым значением для установления статистической значимости. Все статистические тесты и построение графиков выполнялись в программном обеспечении для работы с электронными таблицами (например, Microsoft Excel) с дополнением Real Statistics Resource Pack. Данные представлены в виде среднего значения ± стандартной ошибки среднего значения (SEM).
Микроскопические показатели поражения трех сегментов тонкой кишки (двенадцатиперстной кишки, тощей кишки и подвздошной кишки) были значительно повышены у животных, перенесших ишемически-реперфузионное повреждение кишечника (ИРИ; N = 7) по сравнению с теми, кто перенес симуляцию лапаротомии (Sham; N = 6) (рис. 2 и рис. 3). Стандартная ошибка для этих данных была небольшой, демонстрируя согласованность результатов внутри и между группами. Каждый сегмент кишечника в группе Шама дал точно такой же средний балл по шкале Парка/Чиу — 0,83. SEM для двенадцатиперстной кишки, тощей кишки и подвздошной кишки в группе Sham составил 0,31, 0,40 и 0,31 соответственно. Средние баллы Парка/Чиу для двенадцатиперстной кишки, тощей кишки и подвздошной кишки в группе IRI составили 4,07 ± 0,44, 4,14 ± 0,46 и 5,14 ± 0,40 соответственно.
В этом исследовании 50% (3/6) исходных мышей, которые перенесли 60-минутную ишемию и 120-минутную реперфузию (60/120-я группа), умерли. Две из трех мышей были отправлены на вскрытие. У обеих мышей наблюдался некроз эпителия, застойные явления и кровоизлияние в тонкую кишку. Кроме того, у мышей наблюдался лимфоцитолиз — неспецифическое изменение, связанное с физиологическим стрессом. Ни у одной из мышей не было повреждений сердца, легких, печени или почек. Сокращение времени до 45 мин ишемии и 90 мин реперфузии и добавление 400 МЕ/кг гепарина (группа 45/90/Н) снижало смертность до 20% (1/5) без изменения показателей повреждения кишечника (Рисунок 4). Средний балл по шкале Парка/Чиу для группы 60/120 составил 4,56 ± 0,38 (N = 3), а средний балл для группы 45/90/H составил 4,375 ± 0,38 (N = 4).
Микроскопические данные, указывающие на повреждение проксимального отдела толстой кишки, печени и почек, не наблюдались ни у мышей 60/120, ни у мышей 45/90/H.
Таблица 1: Системы оценки для кишечника, почек и печени. Повреждение кишечника оценивали по системе Чиу/Парка17. Повреждение почек оценивали по шкале Яблонски18,19. Повреждение печени оценивали по балльной системе Сузуки20,21. Эта таблица адаптирована с разрешения систем подсчета баллов, представленных в Quaedackers et al.17, Du et al.19 и Behrends et al.21. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
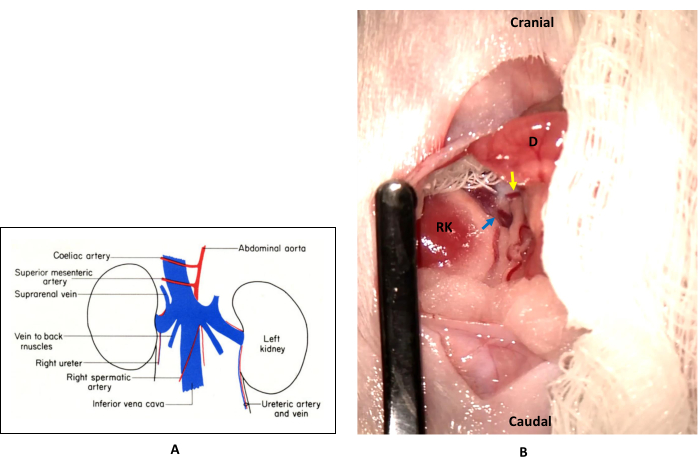
Рисунок 1: Расположение и изоляция верхней брыжеечной артерии (СМА). (А) В норме СМА лежит вентрально от нижней полой вены и простирается вправо от животного. Он расположен между чревной артерией и почечной артерией. Этот рисунок адаптирован с разрешения книги Маргарет Кук «Анатомия лабораторной мыши» (1965)22. (Б) При этой процедуре кишечник экстериоризируется и переворачивается влево (на этом рисунке он покрыт влажной марлей), поэтому СМА (желтая стрелка) находится слева от нижней полой вены (синяя стрелка). Сокращения: РК = правая почка; D = двенадцатиперстная кишка. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
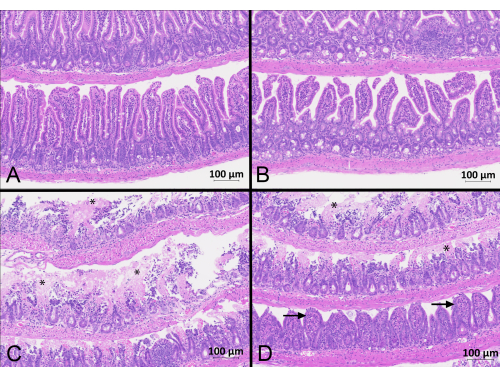
Рисунок 2: Сегменты тонкой кишки, окрашенные гематоксилином и эозином. Срезы тощей кишки (А) и подвздошной кишки (В) мышей из группы Sham имели ворсинки, которые были длинными и тонкими без искажений. На срезах тощей кишки (C) и подвздошной кишки (D) мышей группы IRI были выявлены участки некроза (звездочки) и кровоизлияния с притуплением и искривлением оставшихся ворсинок (стрелки). Фотографии получены от мышей, которые перенесли 45-минутную ишемию и 90-минутную реперфузию и получали 400 МЕ/кг гепарина. Фотографии были сделаны с 20-кратным увеличением и 10% зумом. Масштабная линейка = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Баллы по шкале Парка/Чиу для сегментов тонкой кишки. Микроскопическое повреждение всех трех сегментов кишечника (двенадцатиперстной кишки, тощей кишки и подвздошной кишки) у животных, перенесших ишемически-реперфузионное повреждение кишечника (ИРИ), было значительно выше по сравнению с животными, перенесшими фиктивную лапаротомию (ИРИ). * p < 0,05 для IRI по сравнению с Sham. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
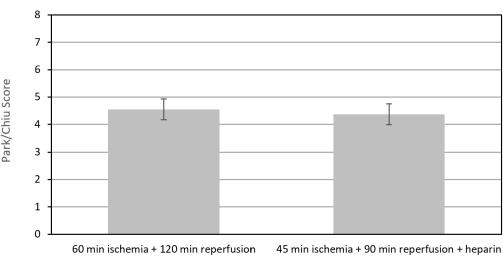
Рисунок 4: Баллы по шкале Парка/Чиу для тонкой кишки, перенесшей 60-минутную ишемию и 120-минутную реперфузию по сравнению с 45-минутной ишемией и 90-минутной реперфузией с 400 МЕ/кг гепарина. Уменьшение времени с 60 мин ишемии и 120 мин реперфузии (60/120) до 45 мин ишемии и 90 мин реперфузии с 400 МЕ/кг гепарина (45/90/ч) не создавало статистически значимой разницы в показателях повреждения тонкой кишки тонкой кишки мышей в группе ИРИ. Тем не менее, это снизило смертность с 50% до 20%. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Обсуждение
Несмотря на широкое распространение этой модели кишечного ИРИ, она не лишена своих ограничений. Например, единственная окклюзия только основания СМА не полностью препятствует притоку крови к кишечнику. Вероятно, это связано с обширной коллатеральной циркуляцией в брыжейке, которая может забирать кровь из соседних ветвей брюшной аорты. В одном исследовании у кошек окклюзия СМА снижала кровоток на 35% в проксимальном отделе двенадцатиперстной кишки, на 61% в дистальном отделе двенадцатиперстной кишки, на 71% в тощей и подвздошной кишках и на 63% в проксимальном отделе толстой кишки. Кровоток не был снижен в средней и дистальной ободочной кишке, которые получают большую часть своего кровообращения из нижней брыжеечной артерии23. У грызунов тощая и подвздошная кишки чаще всего упоминаются в качестве сегментов кишечника, которые подвергаются наиболее значительному повреждению тканей после окклюзии СМА9.
В литературе приводится широкий диапазон времени ишемии после окклюзии СМА, от 1 до 90 мин и более. Разное время ишемии приводит к разным уровням реперфузионного повреждения; Park et al. наблюдали реперфузионное повреждение, когда ишемический интервал составлял от 40 до 60 минут, но не тогда, когда ишемический интервал был короче или длиннее24. Такие результаты свидетельствуют о том, что более короткие промежутки времени не вызывают достаточной ишемии, чтобы спровоцировать реперфузионное повреждение, в то время как более длительные промежутки времени повреждают ткань настолько сильно, что невозможно продемонстрировать последующее реперфузионное повреждение. Кроме того, более длительное время ишемии сопряжено с риском повышенной смертности. Как видно из нашего исследования, 50% (3/6) первоначальных мышей, подвергшихся 60-минутной ишемии, умерли уже после 90-минутной реперфузии. Сокращение времени ишемии до 45 мин снизило смертность до 20% (1/5) без изменения показателей повреждения тканей. Основываясь на нашем исследовании, представляется, что идеальное окно ишемического повреждения может быть достигнуто окклюзией СМА в течение примерно 45 минут.
Другой переменной является время реперфузии до забора ткани. Как и в случае с периодами ишемии, время реперфузии сильно варьируется в зависимости от исследования, от 60 мин до более 24 ч. В нескольких работах сообщалось, что слизистая оболочка кишечника подвергается максимальному морфологическому повреждению через 2-3 ч после реперфузии, а полное восстановление достигается через 24 ч 25,26,27. Забор тканей до этого 2-3-часового окна рискует не охватить всю степень реперфузионного повреждения, в то время как ткани, собранные ближе к 24 часам, уже начнут процесс восстановления. Первоначально мы выбрали время реперфузии 120 минут, но затем перешли на 90 минут, чтобы снизить смертность. Это изменение не повлияло на результаты повреждения тканей, что позволяет предположить, что 30-минутное отклонение от 2-3-часового окна является приемлемым.
Концентрация кислорода также является важной переменной в развитии IRI. Уайлдинг и др. обнаружили, что по сравнению с мышами, получавшими 21%О2, у мышей, получавших анестезию с изофлураном со 100%О2 , наблюдалось несоответствие вентиляции и перфузии из-за ателектаза. В том же исследовании у крыс, получавших 100%О2 , развился острый респираторный ацидоз и повышенное среднее артериальное давление28. Таких физиологических изменений лучше избегать при индуцировании такой травмы, как ИРИ, в которой участвует ряд системных факторов. Таким образом, 21%О2 представляется более подходящим, чем 100%О2 , в качестве газа-носителя для доставки изофлурана.
Использование гепарина в этом протоколе открыто для обсуждения. Известно, что гепарин обладает антикоагуляционным и противовоспалительным действием29. Мы обнаружили, что переход от 60-минутной ишемии и 120-минутной реперфузии к 45-минутной ишемии и 90-минутной реперфузии с гепарином 400 МЕ/кг не изменил микроскопического повреждения кишечника, но снизил смертность. Одно из возможных объяснений заключается в том, что гепарин предотвращал смертельную тромбоэмболию отдаленных органов, таких как легкие и мозг, однако мы не нашли доказательств этого при вскрытии при грубом или микроскопическом исследовании первых двух мышей, которые умерли. Использование более короткого времени ишемии и реперфузии без гепарина может быть столь же эффективным для снижения смертности. Если бы это было так, было бы разумно отказаться от использования гепарина, чтобы свести к минимуму вмешательство в ИРИ. Тем не менее, включение гепарина в протокол может быть целесообразным для тех, кто хочет смоделировать хирургические причины ИРИ, поскольку хирургические пациенты часто получают гепарин периоперационно.
Было показано, что изофлуран оказывает тканезащитное действие в случаях воспаления и ишемии кишечника, и его применение может мешать клинически значимой модели IRI 30,31,32. Тем не менее, фторорганические ингалянты (т.е. изофлуран, севофлуран) являются широко используемыми анестетиками как в ветеринарии, так и в медицине человека. Кроме того, продолжительность анестезии, необходимая для этого протокола, превышает 120 минут, и, таким образом, ингалянт более подходящий, чем инъекционный препарат более короткого действия, который необходимо повторно дозировать.
Микроскопических поражений в проксимальном отделе толстой кишки, печени или почках не было. Отсутствие микроскопических изменений, возможно, было связано с относительно коротким временем реперфузии от 90 до 120 минут. Кроме того, проксимальный отдел толстой кишки имеет кровоснабжение из нижней брыжеечной артерии. Однако отсутствие видимых повреждений не исключает системной травмы. Полимеразная цепная реакция с обратной транскрипцией (ОТ-кПЦР), вероятно, является лучшей методологией для демонстрации системного повреждения путем измерения воспалительных цитокинов, таких как TNF-α.
На протяжении многих лет было разработано несколько вариаций этой модели кишечного ИРИ. В 1990 г. Megison et al. продемонстрировали, что окклюзия коллатеральных сосудов в дополнение к СМА приводит к более последовательному снижению брыжеечного кровотока, ноувеличению смертности. Более позднее исследование показало, что вместо окклюзии СМА в ее основании, перевязка ее периферических и коллатеральных ветвей для индуцирования ишемии в дистальном отделе подвздошной кишки приводила к воспроизводимому повреждениюбез летального исхода. Окклюзия локальных артериальных ветвей обеспечивает максимальную ишемию и может решить проблему мультифокального, сегментарного снижения кровотока, наблюдаемого при перевязке СМА только в ее основании. В то время как этот альтернативный метод моделирования кишечного ИРИ имеет применение для исследования местных тканевых эффектов кишечного ИРИ, неизвестно, может ли он точно смоделировать системное воспаление и полиорганную недостаточность, которые могут быть связаны с повреждением кишечника.
Окклюзия СМА не является подходящей моделью для всех типов кишечного ИРИ. Неокклюзионная мезентериальная ишемия, например, характеризуется спланхнической гипоперфузией, обусловленной снижением сердечного выброса. Таким образом, этот метод не является оптимальным для изучения кишечного ИРИ, вызванного инфарктом миокарда, застойной сердечной недостаточностью, аортальной недостаточностью, заболеваниями почек или печени35. Kozar et al. сообщили, что окклюзия СМА, тем не менее, является клинически значимой моделью для кишечной ИРИ, индуцированной шоком36. Хотя это менее экономично, использование других видов, таких как свиньи, может иметь преимущества перед грызунами для моделирования определенных состояний кишечного повреждения. В комплексном обзоре, проведенном Gonzalez et al. в 2014 году, описаны животные модели, используемые в настоящее время для исследования кишечного IRI9.
Несмотря на свои ограничения, методика окклюзии СМА в ее основе остается одной из наиболее часто используемых моделей ишемии кишечника у грызунов9. Поскольку для этого требуется только один сосудистый зажим и базовая установка, сама операция довольно проста. Это также приводит к воспроизводимым повреждениям, о чем свидетельствуют представленные здесь данные. Окклюзия СМА у грызунов может надежно моделировать окклюзионные причины кишечного ИРИ и может иметь практическое применение как в ветеринарии, так и в медицине человека. В связи с этим важно, чтобы процедуры, которые мы здесь изложили, выполнялись последовательно.
Раскрытие информации
У авторов данной статьи нет конфликта интересов, который они могли бы раскрыть.
Благодарности
Финансирование этого проекта было предоставлено Отделом внутренних исследований Национального института сердца, легких и крови Национальных институтов здравоохранения.
Мы хотели бы поблагодарить доктора Джеймса Хокинса за его наставничество и поддержку. Мы также благодарим докторов Михая Олтеана и Роберта Линфорда за помощь в определении местоположения верхней брыжеечной артерии. Мы хотели бы выразить нашу благодарность докторам Патрисии Карвальо Обейд Эллрих, Клаудио Корреа Наталини и Джорджу Хауэллу III за предоставленный опыт при разработке этого протокола. Наконец, мы хотели бы поблагодарить Стивена Винковича (Stephen Wincovitch) за его помощь в приобретении прекрасных микрофотографий, представленных в этой статье, и доктора Алисию Оливье (Alicia Olivier) за ее помощь в маркировке и отображении окончательных рисунков.
Материалы
| Name | Company | Catalog Number | Comments |
| Adson forceps | Roboz | RS-5236 | Surgical instrument |
| Alm retractor | Roboz | RS-6510 | Surgical instrument |
| Anesthesia machine | Datex-Ohmeda | Aestiva 5 | |
| Anesthesia: isoflurane | Baxter Healthcare Corporation | NDC 10019-360-40 | Dose: 1-4%, INH |
| Angiocath 20 g x 2 | Smiths Medical | 5057 | Flushing intestines with saline and formalin |
| Atraumatic microvascular clip | Teleflex | 065100 | Surgical instrument |
| Buffered formalin 10% | Fisher Scientific | 23-245684 | Tissue fixation |
| Bupivicaine 0.25% | Hospira, Inc. | NDC 0409-1160-18 | Dose: up to 2 mg/kg drop-wise |
| Buprenorphine | Par Pharmaceutical | NDC 42023-179-05 | Dose: 1 mg/kg, SQ |
| Chlorhexidine scrub 2% | Vet One | 510083 | Surgical site prep |
| Circulating water blanket | Cincinnati Sub Zero | Blanketrol 2 | Body temp maintenance |
| Clippers - Wahl BravMini, Purple Hair clippers | Lambert Vet Supply | 008WA-41590-0438 | Surgical site prep |
| Conical tubes 50 ml | Fisher Scientific | 14-432-22 | Tissue fixation and storage |
| Dry ice | N/A | N/A | PCR tissue samples |
| EtOH 200 proof | The Warner-Graham Company | 64-17-5 | Tissue storage |
| Heparin (optional) | Meitheal Pharmaceuticals | NDC 71288-402-11 | Dose: 200-600 IU/kg |
| Induction chamber | VetEquip | 941456 | |
| Indus Instruments THM100 Rodent Monitor | Indus Instruments | N/A | For monitoring rodent body temperature during surgery |
| Isopropyl Alcohol 70% | Humco | NDC 0395-4202-28 | For scrubbing surgical site |
| Microcentrifuge Tubes: 0.6mL | Fisher Scientific | 05-408-121 | PCR tissue samples. 8 per mouse, Terminal bleed collection, serum storage |
| Microsoft Excel | Microsoft | N/A | |
| Nose cone | N/A | N/A | Can be homemade with syringe tube or bubble tubing |
| O2 medical air 21% | Roberts Oxygen | N/A | Rate: 0.5 L/min for each L chamber volume |
| Ophthalmic ointment | Akorn, Inc. | NDC 17478-062-35 | Surgical prep |
| PBS pH 7.4 (1x) | ThermoFisher Scientific | 10010-031 | For tissue rinsing and making 70% EtOH |
| Specimen cups | Cardinal Healthcare | C13005 | For holding tissue cassettes in formalin |
| Sterile Castroviejo Needle Holder | Roboz | RS-6412 | Surgical instrument |
| Sterile cotton swabs | Medline | BXTA50002Z | |
| Sterile gauze | Medline | PRM21423Z | |
| Sterile Micro Dissecting Scissors | Roboz | RS-5980 | Surgical instrument |
| Sterile micro dissecting spring scissors | Roboz | RS-5693 | Surgical instrument |
| Sterile micro forceps | Roboz | RS-5264 | Surgical instrument |
| Sterile saline (0.9%) | Braun | R5201-01 | Must be warmed |
| Sterile scalpel blade #15 | Cardinal Health (Allegiance) | 32295-015 | Surgical instrument |
| Sterile scalpel handle | Roboz | RS-9843 | Surgical instrument |
| Sterile surgical drape | Medline | DYNJSD1092 | |
| Sterile surgical gloves | Medline | MSG2270 | |
| Sterile surgical stapler | Roboz | RS-9260 | Surgical instrument |
| Sterile surgical staples | Roboz | RS-9262 | Abdominal skin closure |
| Sterile suture: Vicryl (polyglactin 910) 6-0, 27" Taper RB-1 Needle | Ethicon | J212G | Closing abdominal muscle |
| Surgical tape | Medline | MMM15271Z | Securing mouse in dorsal recumbancy |
| Syringe 10 ml x 2 | Medline | SYR110010 | Flushing intestines with saline and formalin |
| Tissue cassettes | Fisher Scientific | 22-038-665 | Rolled intestinal segments. 4 per mouse. |
| Towel or drape | Medline | GEM2140 | Water blanket cover |
Ссылки
- Mallick, I. H., Yang, W., Winslet, M. C., Seifalian, A. M. Ischemia-reperfusion injury of the intestine and protective strategies against injury. Digestive Diseases and Sciences. 49, 1359-1377 (2004).
- Minguet, G., Joris, J., Lamy, M. Preconditioning and protection against ischaemia-reperfusion in non-cardiac organs: a place for volatile anaesthetics. European Journal of Anaesthesiology. 24 (9), 733-745 (2007).
- Cowled, P., Fitridge, R. Pathophysiology of reperfusion injury. Mechanisms of Vascular Disease: A Reference Book for Vascular Specialists. , 331-350 (2011).
- Grootjans, J., et al. Human intestinal ischemia-reperfusion-induced inflammation characterized: Experiences from a new translational model. The American Journal of Pathology. 176 (5), 2283-2291 (2010).
- Sharp, C. R., Rozanski, E. A., Finn, E., Borrego, E. J. The pattern of mortality in dogs with gastric dilatation and volvulus. Journal of Veterinary Emergency and Critical Care. 30 (2), 232-238 (2020).
- Tinker, M. K., et al. Prospective study of equine colic incidence and mortality. Equine Veterinary Journal. 29 (6), 448-453 (1997).
- McMichael, M., Moore, R. M. Ischemia-reperfusion injury pathophysiology, part I. Journal of Veterinary Emergency and Critical Care. 14 (4), 231-241 (2004).
- Kaneene, J. B., Ross, W. A., Miller, R. A. The Michigan equine monitoring system. II. Frequencies and impact of selected health problems. Preventive Veterinary Medicine. 29 (4), 277-292 (1997).
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Animal models of ischemia-reperfusion-induced intestinal injury: Progress and promise for translational research. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (2), 63-75 (2015).
- Kim, M., Park, S. W., Kim, M., D'Agati, V. D., Lee, H. T. Isoflurane post-conditioning protects against intestinal ischemia-reperfusion injury and multiorgan dysfunction via transforming growth factor-β1 generation. Annals of Surgery. 255 (3), 492-503 (2012).
- García, E. M. S. N., Taylor, J. H., Cenizo, N., Vaquero, C. Beneficial effects of intra-arterial and intravenous prostaglandin E1 in intestinal ischaemia-reperfusion injury. Interactive Cardiovascular and Thoracic Surgery. 18 (4), 466-474 (2014).
- Liu, C., et al. Sevoflurane protects against intestinal ischemia-reperfusion injury partly by phosphatidylinositol 3 kinases/Akt pathway in rats. Surgery. 157 (5), 924-933 (2015).
- Shomer, N. H., et al. Review of rodent euthanasia methods. Journal of the American Association for Laboratory Animal Science. 59 (3), 242-253 (2020).
- Diagnostic Necropsy and Tissue Harvest in Rodents. Lab Animal Research. Journal of Visualized Experiments Available from: https://www.jove.com/v/10294/diagnostic-necropsy-and-tissue-harvest (2023)
- Scudamore, C. L. . A Practical Guide to the Histology of the Mouse. , (2014).
- Scicchitano, M. S., et al. Preliminary comparison of quantity, quality, and microarray performance of RNA extracted from formalin-fixed, paraffin-embedded, and unfixed frozen tissue samples. Journal of Histochemistry and Cytochemistry. 54 (11), 1229-1237 (2006).
- Quaedackers, J. S. L. T., et al. An evaluation of methods for grading histologic injury following ischemia/reperfusion of the small bowel. Transplantation Proceedings. 32 (6), 1307-1310 (2000).
- Jablonski, P., et al. An experimental model for assessment of renal recovery from warm ischemia. Transplantation. 35 (3), 198-204 (1983).
- Du, H., et al. Hydrogen-rich saline attenuates acute kidney injury after liver transplantation via activating p53-mediated autophagy. Transplantation. 100 (3), 563-570 (2016).
- Suzuki, S., et al. The beneficial effect of a prostaglandin 12 analog on ischemic rat liver. Transplantation. 52 (6), 978-983 (1991).
- Behrends, M., et al. Acute hyperglycemia worsens hepatic ischemia/reperfusion injury in rats. Journal of Gastrointestinal Surgery. 14 (3), 528-535 (2010).
- Cook, M. J. . The Anatomy of the Laboratory Mouse. , (1965).
- Premen, A. J., et al. Importance of collateral circulation in the vascularly occluded feline intestine. Gastroenterology. 92 (5), 1215-1219 (1987).
- Park, P. O., Haglund, U., Bulkley, G. B., Falt, K. The sequence of development of intestinal tissue injury after strangulation ischemia and reperfusion. Surgery. 107 (5), 574-580 (1990).
- Guzmán-de La Garza, F. J., et al. Different patterns of intestinal response to injury after arterial, venous or arteriovenous occlusion in rats. World Journal of Gastroenterology. 15 (31), 3901-3907 (2009).
- Chang, J. X. Functional and morphological changes of the gut barrier during the restitution process after hemorrhagic shock. World Journal of Gastroenterology. 11 (35), 5485-5491 (2005).
- Illyes, G., Hamar, J. Sequence of morphological alterations in a small intestinal ischaemia/reperfusion model of the anesthetized rat. A light microscopy study. International Journal of Experimental Pathology. 73 (2), 161-172 (1992).
- Wilding, L. A., et al. Benefits of 21% oxygen compared with 100% oxygen for delivery of isoflurane to mice (Mus musculus) and rats (Rattus norvegicus). Journal of the American Association for Laboratory Animal Science. 56 (2), 148-154 (2017).
- Ding, R., Zhao, D., Guo, R., Zhang, Z., Ma, X. Treatment with unfractionated heparin attenuates coagulation and inflammation in endotoxemic mice. Thrombosis Research. 128 (6), 160-165 (2011).
- Hayes, J. K., Havaleshko, D. M., Plachinta, R. V., Rich, G. F. Isoflurane pretreatment supports hemodynamics and leukocyte rolling velocities in rat mesentery during lipopolysaccharide-induced inflammation. Anesthesia and Analgesia. 98 (4), 999-1006 (2004).
- Miller, L. S., et al. Suppression of cytokine-lnduced neutrophil accumulation in rat mesenteric venules in vivo by general anesthesia. International Journal of Microcirculation. 16 (3), 147-154 (1996).
- Kim, M., Park, S. W., Kim, M., D'Agati, V. D., Lee, H. T. Isoflurane activates intestinal sphingosine kinase to protect against bilateral nephrectomy-induced liver and intestine dysfunction. American Journal of Physiology. Renal Physiology. 300 (1), 167-176 (2011).
- Megison, S. M., Horton, J. W., Chao, H., Walker, P. B. A new model for intestinal ischemia in the rat. The Journal of Surgical Research. 49 (2), 168-173 (1990).
- Gubernatorova, E. O., Perez-Chanona, E., Koroleva, E. P., Jobin, C., Tumanov, A. V. Murine model of intestinal ischemia-reperfusion injury. Journal of Visualized Experiments. (111), 53881 (2016).
- Trompeter, M., Brazda, T., Remy, C. T., Vestring, T., Reimer, P. Non-occlusive mesenteric ischemia: Etiology, diagnosis, and interventional therapy. European Radiology. 12 (5), 1179-1187 (2002).
- Kozar, R. A., et al. Superior mesenteric artery occlusion models shock-induced gut ischemia-reperfusion. The Journal of Surgical Research. 116 (1), 145-150 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены