Method Article
Configuração de Equipamentos e Remoção de Artefatos para Eletroencefalograma Simultâneo e Ressonância Magnética Funcional para Revisão Clínica em Epilepsia
Neste Artigo
Resumo
Este artigo detalha procedimentos simultâneos de registro de eletroencefalograma e ressonância magnética funcional (EEG-fMRI) que podem ser usados em ambientes clínicos e de pesquisa. Procedimentos de processamento de EEG para remoção de artefatos de imagem para revisão clínica também estão incluídos. Este estudo enfoca o exemplo da epilepsia durante o período interictal.
Resumo
O eletroencefalograma simultâneo e a ressonância magnética funcional (EEG-fMRI) são uma técnica combinada única que fornece sinergia na compreensão e localização do início das crises na epilepsia. No entanto, os protocolos experimentais relatados para registros de EEG-fMRI falham em abordar detalhes sobre a realização de tais procedimentos em pacientes com epilepsia. Além disso, esses protocolos são limitados apenas a ambientes de pesquisa. Para preencher a lacuna entre o monitoramento de pacientes em uma unidade de monitoramento de epilepsia (UEM) e a realização de pesquisas com um paciente com epilepsia, introduzimos um protocolo único de registro de EEG-fMRI de epilepsia durante o período interictal. O uso de um conjunto de eletrodos condicionais de RM, que também pode ser usado na UEM para um EEG do couro cabeludo e gravação de vídeo simultâneos, permite uma transição fácil dos registros de EEG da UEM para a sala de varredura para registros simultâneos de EEG-fMRI. Detalhes sobre os procedimentos de gravação usando este conjunto específico de eletrodos condicionais de RM são fornecidos. Além disso, o estudo explica passo a passo os procedimentos de processamento de EEG para remover os artefatos de imagem, que podem ser usados para revisão clínica. Este protocolo experimental promove uma alteração no registro convencional de EEG-fMRI para maior aplicabilidade em ambientes clínicos (i.e., UEM) e de pesquisa. Além disso, esse protocolo oferece o potencial de expandir essa modalidade para registros pós-ictais de EEG-fMRI no cenário clínico.
Introdução
A epilepsia afeta cerca de 70 milhões de pessoas em todo o mundo1. Uma em cada 150 pessoas com epilepsia mal controlada sucumbe a uma morte súbita inesperada em epilepsia (SUDEP) todos os anos. Além disso, cerca de 30%-40% dos casos de epilepsia são refratários ao tratamento clínico2. O tratamento neurocirúrgico na forma de ressecção, desconexão ou neuromodulação pode ser uma medida que muda e salva vidas para pacientes com epilepsia refratária.
O eletroencefalograma simultâneo e a ressonância magnética funcional (EEG-fMRI) são uma técnica combinada única que mede as atividades cerebrais de forma não invasiva e tem proporcionado benefícios para a compreensão e localização do início das crises na epilepsia3,4,5,6. EEGs do couro cabeludo podem ser usados para lateralizar e localizar zonas de início de crises, mas eles têm resolução espacial relativamente pobre devido às capacidades limitadas com relação à avaliação de fontes epileptogênicas profundas. Embora a RMf tenha boa resolução espacial em todo o cérebro, incluindo regiões profundas, a RMf isoladamente não é específica para convulsões. No entanto, EEGs do couro cabeludo podem informar a interpretação de áreas de ativação ou desativação dependentes do nível de oxigênio no sangue (BOLD) na RMf, produzindo assim uma técnica de RMf específica para epilepsia. Assim, a implementação simultânea de EEG-fMRI pode ser usada para mapear processos espaço-temporais relevantes para localizar tanto o 'onde' quanto o 'quando' de eventos epilépticos.
Explicações sobre como realizar EEG-RMf simultâneas são fornecidas em estudos prévios 7,8,9,10. No entanto, a RMf tem sido subutilizada em epilepsia, especialmente em ambientes clínicos. Existe um estudo que fornece um procedimento geral para registros de EEG-fMRI, antecedentes e exemplos de possíveis análises de EEG7. Além disso, um estudo enfatizando a indução hipnótica juntamente com medidas de temperatura em registros simultâneos de EEG-RMffoi realizado 8. Além disso, um estudo expandido de EEG-fMRI para introduzir um método de imagem de fonte de EEG com restrição de RMf e espaço-temporal foi proposto 9,10. Além disso, o uso de uma alça de fio de carbono para remover efetivamente artefatos do EEG-fMRI tem sido considerado10. No entanto, todos esses estudos falham em abordar os desafios na realização de estudos de EEG-fMRI em um ambiente de pesquisa clínica. Em particular, o uso da tampa do EEG restringe a viabilidade desses protocolos em ambientes clínicos, e detalhes sobre o manejo do paciente também estão faltando. Neste estudo, fornecemos um protocolo de registro de EEG-fMRI que pode ser usado em ambientes clínicos e de pesquisa para pacientes com epilepsia. Este protocolo único permite uma fácil transição do paciente de uma unidade de monitoramento de epilepsia (UEM) para a sala de varredura. Além disso, o protocolo oferece o potencial de expandir sua aplicação para registros do período pós-ictal em pacientes com epilepsia. Para EEG-fMRI, o pós-processamento é uma etapa crucial na remoção de artefatos causados por gradientes de RM e artefatos fisiológicos, como aqueles relacionados aos batimentos cardíacos. Assim, também fornecemos procedimentos passo a passo para remover artefatos de EEG usando um método padrão de remoção degabarito11 para revisão clínica.
Protocolo
Este estudo foi realizado de acordo com o Protocolo #62050, aprovado pelo Comitê de Ética em Pesquisa da Universidade de Kentucky (Reino Unido).
1. Recrutamento de sujeitos
- Critérios de inclusão
Observação : todos os seguintes critérios devem ser atendidos.- Incluir indivíduos diagnosticados com epilepsia focal refratária e elegíveis para avaliação cirúrgica de epilepsia.
- Incluir indivíduos que têm entre 18-60 anos de idade.
- Incluir mulheres com potencial para engravidar se usarem um método contraceptivo. Incluir indivíduos do sexo feminino sem potencial para engravidar (pós-menopausa por pelo menos 2 anos, ooforectomia bilateral ou laqueadura, histerectomia completa).
NOTA: Por padrão de cuidados, um teste de gravidez é realizado para mulheres com potencial para engravidar uma vez admitidas na UEM. - Incluir indivíduos agendados para admissão na UEM com diagnóstico de epilepsia focal refratária ou para caracterização de crises.
- Critérios de exclusão
- Excluir indivíduos que têm claustrofobia grave.
- Excluir indivíduos com dispositivos médicos implantados ou metal embutido que normalmente os desqualificariam de fazer uma ressonância magnética, que é rotineiramente verificada pelo tecnólogo em RM antes de qualquer exame.
- Excluir indivíduos que estão grávidas ou amamentando.
- Excluir indivíduos com qualquer condição médica ou psiquiátrica conhecida que, na opinião do investigador, possa comprometer ou comprometer a capacidade do sujeito de participar deste estudo, ou que prejudique a participação confiável no estudo.
OBS: Uma vez admitido o paciente na UEM, após a concordância do paciente no termo de consentimento livre e esclarecido para participar deste estudo, serão seguidos os seguintes passos.
2. Colocação do eletrodo
- Marque as posições dos eletrodos no couro cabeludo do paciente, com base no sistema 10-20.
NOTA: Figura 1 mostra uma seleção de 32 eletrodos.- Medir e anotar a linha central da cabeça do paciente do couro cabeludo colocando uma fita métrica do násio ao ínion passando pelo centro superior da cabeça (Medida A: plano sagital).
- Marque 50% da Medida A do násio para o ínion. Essa marca indica a localização Cz do eletrodo.
- Marque 10% da Medida A do násio para o Cz indicado. Essa marca indica a localização Fpz do eletrodo.
- Marque 10% da medida A do ínion para o Cz indicado. Esta marca indica a localização Oz do eletrodo.
- Marque 20% da Medida A do Cz indicado para Fpz. Essa marca indica a localização Fz do eletrodo.
- Marque 20% da Medida A do indicado Cz para Oz. Essa marca indica a localização Pz do eletrodo.
- Medir e anotar a cabeça do paciente do ponto pré-auricular esquerdo até o ponto pré-auricular direito, passando pelo centro superior da cabeça (Medida B: plano coronal).
- Marque 50% da Medida B e certifique-se de que esta localização está sobreposta à localização Cz indicada.
- Marque 10% da medida B do ponto pré-auricular esquerdo até Cz. Essa marca indica a localização T3 do eletrodo.
- Marque 10% da Medida B do ponto pré-auricular direito até Cz. Essa marca indica a localização T4 do eletrodo.
- Marque 20% da Medida B do Cz indicado para T3. Essa marca indica a localização C3 do eletrodo.
- Marque 20% da medida B do Cz indicado para T4. Essa marca indica a localização C4 do eletrodo.
- Medir e anotar a circunferência da cabeça do paciente passando pelas marcadas Fpz e Oz (Medida C: plano transversal).
- Marque 10% da Medida C à esquerda e à direita de Fpz. Essas marcas indicam as localizações Fp1 e Fp2 do eletrodo, respectivamente.
- Marque 10% da Medida C à esquerda e à direita de Oz. Essas marcas indicam a localização de O1 e O2 do eletrodo, respectivamente.
- Marque 20% da Medida C à esquerda do Fp1 e à direita do Fp2. Essas marcas indicam as localizações F7 e F8 do eletrodo, respectivamente.
- Medir e anotar a distância de F7 e F8 no plano coronal (Medida D: plano coronal).
- Marque 50% da Medida D e certifique-se de que o Fz indicado anteriormente esteja sobreposto.
- Marque 25% da Medida D de F7 para Fz e de F8 para Fz. Essas marcas indicam as localizações F3 e F4 do eletrodo, respectivamente.
- Meça a distância do násio ao ínion passando por Fp1 e O1. Garantir que 50% da medida se sobreponha ao C3 indicado anteriormente.
- Meça a distância do násio ao ínion passando por Fp2 e O2. Garantir que 50% da medida se sobreponha ao C4 indicado anteriormente.
NOTA: Da mesma forma, as posições dos eletrodos nos lobos temporal e parietal podem ser marcadas, incluindo T5, P3, P4 e T6. Além disso, quaisquer localizações adicionais de eletrodos, como TP9, TP10, FT9 e FT10, podem ser marcadas com base na distância relativa das distribuições de eletrodos do sistema 10-20. O número de eletrodos e suas distribuições podem ser determinados com base na análise prospectiva e foco da pesquisa.
- Limpe o couro cabeludo do paciente usando gel de preparação de pele sobre gaze.
- Coloque a pasta condutora em um copo de eletrodo. Coloque o eletrodo no couro cabeludo do paciente seguindo o nome do canal no cabo do eletrodo.
NOTA: Para o registro simultâneo de EEG-fMRI, é necessário usar eletrodos condicionais de RM, e eletrodos aprovados pela Food and Drug Administration (FDA) são sugeridos na UEM. - Repetir a colocação do gel e dos eletrodos no couro cabeludo do paciente (passo 2.3) para todos os eletrodos (Figura 2A).
NOTA: Os cabos conectados aos eletrodos condicionais de RM são relativamente curtos para a junção de conexão para minimizar os artefatos de RM. Portanto, ao colocar os eletrodos, considere as posições dos eletrodos e coloque-os cuidadosamente para que os cabos possam ser bem organizados. Além disso, certifique-se de que não haja laços nos fios, pois eles podem potencialmente produzir calor e queimaduras dentro do scanner. - Aderir todos os eletrodos ao couro cabeludo do paciente usando cola sobre gaze. Dispor todos os cabos dos eletrodos e colocar a junção do cabo longe do couro cabeludo, colocando compressas de gaze no centro da cabeça do sujeito (Figura 2B, setas vermelhas).
Observação : esta é uma etapa crítica para evitar artefatos de imagem. - Envolva todas as junções do cabo com envoltório de bandagem autoadesivo (ovais azuis na Figura 2B).
Observação : esta etapa é sugerida para proteger as conexões durante a gravação. - Coloque uma tampa elástica na cabeça para prender todos os eletrodos. Conecte o chicote, que está conectado aos eletrodos, ao amplificador. Comece a monitorar seu EEG de forma síncrona com gravações de vídeo.
3. Registro de EEG-fMRI
NOTA: Para o registro de EEG-fMRI, o sistema de registro de EEG condicional de RM é usado juntamente com os eletrodos condicionais de RM colocados no início da admissão da UEM.
- Na sala de monitoramento, conecte o adaptador USB 2 ao kit Triggerbox com um cabo (cabo branco grosso na Figura 3A).
NOTA: O adaptador USB 2 permite fazer a interface de outro hardware com um computador, e o kit Triggerbox é empregado para manipular o sinal de gatilho gerado a partir do scanner a ser detectado no software de gravação de EEG. - Conecte o Syncbox ao adaptador USB 2 com um cabo (cabo preto grosso na Figura 3B).
NOTA: A função do Syncbox é sincronizar os sinais de relógio do amplificador e do sistema de comutação de gradiente do scanner. - Na sala de monitoramento, conecte uma extremidade do cabo de fibra óptica ao Syncbox (Figura 3C à esquerda) e passe outra extremidade por um túnel conectado à sala de digitalização.
- Conecte um cabo de porta USB do adaptador USB 2 ao computador de gravação (marca de estrela na Figura 3B). Conecte um cabo de porta USB do Syncbox ao computador de gravação (marca de estrela na Figura 3C). Conecte um cabo de porta USB do Triggerbox ao computador de gravação (marca de estrela na Figura 3D). Conecte o dongle de licença de software ao computador de gravação.
NOTA: Existem no total quatro portas USB que serão utilizadas. Ter uma porta multi-USB pode ser útil para gerenciar todos eles. - Configure o amplificador de gravação de EEG junto com o kit de trenó MR dentro do scanner.
CUIDADO: Qualquer metal ou componente sensível ao RM deve ser removido dos experimentadores. É necessário que os experimentadores completem o treinamento apropriado para conduzir gravações na sala de varredura de ressonância magnética.
NOTA: Recomenda-se carregar totalmente a bateria do amplificador antes de realizar a gravação. - Conecte a extremidade do cabo de fibra óptica na sala de varredura à parte traseira do amplificador (Figura 4D) e ligue o amplificador.
Observação : a outra extremidade do cabo de fibra óptica está conectada ao Syncbox na sala de monitoramento. - Quando a configuração do equipamento estiver concluída, abra o software de gravação de EEG clicando no ícone do software na tela do computador. Crie um espaço de trabalho no software de gravação clicando no menu Novo Espaço de Trabalho na guia Arquivo no canto superior esquerdo da janela.
- Defina um caminho de pasta onde os novos dados serão armazenados clicando no botão Procurar .
- Insira o nome dos dados em uma caixa em branco para Prefixo e especifique o índice de numeração inserindo um numeral nas caixas pretas para Tamanho Mínimo do Contador [dígitos] e Número Atual.
- Depois de confirmar que o nome do arquivo é exibido corretamente em Próximo Nome do Arquivo Resultante, clique em Avançar.
- Digitalize o amplificador clicando no botão Scan for Amplifier no canto superior esquerdo da janela criada. Estabeleça parâmetros apropriados, incluindo taxas de amostragem e frequências de corte baixas e altas para gravação, selecionando as opções apropriadas listadas para Taxa de amostragem, Corte baixo e Ponto de corte alto (consulte a Figura 5).
NOTA: A taxa de amostragem é definida como 5.000 Hz para obter amostras suficientes dos artefatos de gradiente do scanner. Um Low Cutoff de 10 s é inserido para evitar a saturação de corrente contínua (DC) (a unidade de tempo é usada no software do gravador), e um High Cutoff de 250 Hz é definido para limitar a amplitude do artefato de gradiente antes de entrar no conversor analógico-digital. - Defina os parâmetros do scanner para o fMRI.
NOTA: Uma possível configuração de aquisição BOLD de RMf em estado de repouso é uma sequência ecoplanar (TR/TE = 1360/29 ms, ângulo de inclinação = 65, 54 cortes cobrindo todo o cérebro, campo de visão = 260 mm x 260 mm, resolução = 2,5 mm de voxels isotrópicos). Os detalhes das configurações de RMf podem ser variados dependendo do objetivo da gravação. - Desligue a bomba de hélio do scanner para reduzir ainda mais a introdução de artefatos no sinal de EEG.
NOTA: Desligar a bomba de hélio pode resultar em perda de hélio líquido ou aumento da temperatura do escudo. Assim, é altamente recomendável verificar com o fornecedor do scanner para verificar se desligar o compressor de hélio não é excessivamente prejudicial para seu sistema de varredura de ressonância magnética. - Transfira o paciente para a sala de espera do exame. Explicar o procedimento de gravação ao paciente.
NOTA: Recomenda-se que toda a configuração do equipamento de gravação seja concluída antes da chegada do paciente. - Limpe as costas do paciente, logo abaixo do ombro esquerdo do paciente, onde o eletrocardiograma (ECG) será colocado. Aplique um gel eletrolítico abrasivo no eletrodo do ECG e coloque-o no lado traseiro esquerdo do paciente.
NOTA: O comprimento deste cabo é curto, por isso, ao colocar o eletrodo de ECG, não puxe com força ou coloque-o muito baixo na parte de trás; aproximadamente 5 cm abaixo do ombro é aceitável. O eletrodo do ECG é colocado na parte de trás para minimizar artefatos em movimento. - Aplique fita adesiva ao redor do cabo e do cabo do ECG para minimizar os artefatos de digitalização durante a gravação. Desconecte o chicote de EEG e conecte as junções do cabo de EEG à caixa de interface (Figura 4B).
- Transporte do paciente até a sala de escaneamento. Deite o paciente na mesa de escaneamento com a cabeça na metade inferior aberta da bobina da cabeça.
CUIDADO: Qualquer componente sensível a metal ou RM deve ser removido do sujeito.
OBS: Apoie as costas do paciente quando deitado. - Aplique protetores auriculares para ajudar a reduzir o ruído do scanner. Aplique uma almofada ao redor da cabeça do paciente para minimizar os artefatos de movimento da cabeça.
- Conecte a metade superior da bobina da cabeça para fechar a bobina da "gaiola do pássaro" ao redor da cabeça do paciente. Ajuste a altura da cama. Conecte a caixa de interface ao amplificador (Figura 4C).
NOTA: A fita adesiva também é aplicada aos cabos da caixa de interface para minimizar os artefatos de digitalização (envoltório branco na Figura 4B). - Coloque os sacos de areia seguros para RM ao redor dos cabos para minimizar os artefatos de RM durante a gravação (Figura 4C). Quando todas as configurações na sala de digitalização estiverem concluídas, mova-se para a sala de monitoramento.
- Comunique-se com o paciente através de um microfone na sala de monitoramento, explicando que etapas adicionais para definir as configurações do software estão sendo realizadas.
NOTA: Os experimentadores podem se comunicar por meio de alto-falantes integrados na sala de digitalização e um microfone na sala de monitoramento. - Verifique a impedância dos eletrodos de EEG clicando no botão Verificação de Impedância no canto superior esquerdo da janela do software de gravação aberta no computador. Confirme com o paciente que ele está pronto para a gravação.
NOTA: Durante a gravação, os experimentadores monitoram a condição do paciente através de uma câmera de vídeo na sala de digitalização e se comunicam através do microfone na sala de monitoramento. - Inicie a gravação do EEG clicando no botão Reproduzir no canto superior esquerdo do software de gravação. Execute a varredura de aquisição de fMRI.
CUIDADO: Em qualquer caso, quando o paciente relatar desconforto devido ao ambiente de gravação, incluindo ruído, o experimentador deve interromper o procedimento de gravação.
4. Remoção do artefato de EEG
Observação : as descrições a seguir fornecem etapas detalhadas sobre como remover os artefatos do scanner nos dados de EEG obtidos das gravações simultâneas de EEG-fMRI. A Figura 6 exibe o pipeline de processamento com exemplos representativos.
- Abra o software de análise de EEG.
- Aplicar correção de artefato MR.
- Clique na guia Transformações > Processamento Especial de Sinais > Correção de RM . Quando uma pequena janela for gerada, selecione Usar marcadores, escolha um sinal de gatilho no scanner e clique em Avançar.
Observação : esta etapa indica um sinal de gatilho do scanner e usa-o como uma referência para remover os artefatos MR. - Selecione as opções Intercalado e Baseado no Tempo , insira as informações de tempo do sinal de gatilho e clique em Avançar.
NOTA: Nos dados adquiridos, V1 é o sinal de disparo, e os seguintes valores podem ser inseridos com base nos intervalos de gatilho V1: start [ms]: -2; final [ms]: 1.358; e duração [ms]: 1.360. A etiqueta do sinal de disparo e sua configuração detalhada podem ser variadas, dependendo da configuração do scanner. - Na janela a seguir, marque Habilitar Correção de Linha de Base para Média e desmarque Calcular Linha de Base sobre o Artefato Inteiro. Insira os valores Start [ms] e End [ms]. Selecione Usar cálculo de média deslizante.
Observação : isso permite corrigir a linha de base com base em uma janela deslizante. - Insira o Número Total de Intervalos para Média Deslizante, marque Uso Comum de Todos os Canais para Intervalos Ruins e Correção e clique em Avançar.
NOTA: O número total de intervalos para média deslizante pode ser 21. - Selecione Usar todos os canais para correção e clique em Avançar.
- Marque Do Downsampling e escolha 500 para New Frequency [Hz]. Marque Aplicar filtro passa-baixa e selecione Usar filtro FIR, insira 70 para Frequência de corte [Hz] e clique em Avançar.
- Quando todas as configurações estiverem concluídas, selecione uma opção Armazenar dados corrigidos e clique em Concluir.
Observação : armazenar dados descompactados no arquivo de histórico pode ser selecionado como uma opção armazenar dados corrigidos . Diferentes opções podem ser consideradas, dependendo da finalidade. Depois de clicar em Concluir, uma pequena janela Correção de Artefato do Scanner aparecerá no meio, mostrando o status do processamento. Esse processo de correção da RM pode levar algum tempo para ser concluído, dependendo do tamanho dos dados do EEG.
- Clique na guia Transformações > Processamento Especial de Sinais > Correção de RM . Quando uma pequena janela for gerada, selecione Usar marcadores, escolha um sinal de gatilho no scanner e clique em Avançar.
- Aplique a remoção de CC por um filtro passa-alta. Clique na guia Transformação > Filtragem de Dados > Filtros IIR. Em uma janela recém-gerada, marque Habilitado em Corte baixo. Insira uma Frequência de corte [Hz] de 0,5, escolha o filtro Ordem como 2 e clique em OK.
- Remova artefatos cardiobalísticos.
- Clique na guia Transformações > Processamento Especial de Sinais > Correção CB . Na janela que se abre posteriormente, selecione Usar detecção de pico e marque Modo semiautomático.
- Na seção Modelo de Pulso de Pesquisa, insira Início[s] como 60 e Comprimento[s] como 20. Marque Marcar modelo encontrado e verifique se o canal de ECG apropriado foi escolhido.
- Insira parâmetros adequados para Pulse Rate and Correlation and Amplitude, insira R for Mark Pulses with R-Peak Markers e clique em Next.
NOTA: O valor sugerido para Pulse Rate [ms] é 1000 ± 400 e Pulse Rate [bpm] é um mínimo de 43 e um máximo de 100. Os valores específicos da Frequência de Pulso dependem dos intervalos de ECG do indivíduo. Além disso, o Nível de Gatilho de Correlação pode ser definido como 0,6 e o Nível de Gatilho de Amplitude como um mínimo de 0,3 e um máximo de 1,4. - Marque Usar dados inteiros para calcular o atraso de tempo. Insira o número total de intervalos de pulso usados para a média.
NOTA: O número total de intervalos de pulso usados para média pode ser definido como 21. - Em Corrigir Canais Seguintes, mova todos os canais de EEG para a coluna da direita, exceto o canal de ECG, e clique em Avançar.
- Na próxima página, selecione uma opção Armazenar Dados Corrigidos como preferir. Clique em Concluir.
NOTA: Uma vez que Concluir é clicado, uma janela CB Correction-Interactive Mode aparecerá no lado direito do software. - Deslize sobre o eixo do tempo na parte inferior da Barra de Navegação e verifique onde o ECG do modelo base está realçado com uma caixa sombreada em azul. Confirme se o modelo base do ECG está marcado corretamente.
Observação : clicando duas vezes no nome do canal de ECG, somente o canal de ECG será exibido para revisão. Considere um ajuste manual do pico ou do intervalo, conforme necessário. Na janela CB Correction-Interactive Mode no lado direito do software, ECGs com padrões anormais são listados em ordem sequencial em um formato de tabela. Estes são indicados no traçado do ECG como linhas verticais vermelhas. - Na janela CB Correction-Interactive Mode , verifique cada ECG marcado clicando duas vezes em sua linha correspondente na tabela. Ajuste os locais de pico detectados, conforme necessário, movendo as linhas verticais vermelhas. Depois que todos os ECGs detectados forem revisados, clique em Concluir.
Observação : o canal inicialmente contém apenas marcadores vermelhos e verdes. Os marcadores verdes indicam boas detecções, enquanto os vermelhos indicam picos de pulso potenciais que não atendem a todas as condições exigidas. Os marcadores vermelhos mudam para amarelo depois de modificá-los manualmente. Ao corrigir os ECGs anormais, é importante considerar que cada local de pico e o intervalo de tempo de cada ECG devem ser consistentes.
- Aplique a remoção de ruído da linha elétrica e corrente alternada (CA) por um filtro de entalhe. Clique na guia Transformação > Filtragem de Dados > Filtros IIR. Na janela que se abre, marque Notch Enabled, selecione Frequency [Hz] e clique em OK.
NOTA: Para a seleção de frequência, 50 ou 60 Hz podem ser selecionados dependendo do país onde a gravação é realizada. O filtro de entalhe é aplicado na última etapa para ser benéfico para as detecções de ECG, e essa aplicação de filtro fornece a conveniência da revisão clínica do EEG.
Resultados
Quando um paciente é admitido na UEM, um EEG do couro cabeludo e um vídeo simultâneos são gravados. Um dos objetivos da monitorização do EEG por um neurologista é avaliar a presença de descargas epileptiformes, que podem potencialmente informar a localização do início da crise. Quando a dinâmica extraordinária de canais específicos de EEG é distinguida, a localização dos eletrodos pode ser associada à localização das crises. Durante o período interictal, as descargas epileptiformes interictais (IEDs), incluindo pontas e ondas agudas, são tradicionalmente consideradas como marcadores de áreas de epileptogenicidade. Além disso, os registros obtidos dos dados de EEG-fRMf interictal podem ser vantajosos para entender e localizar as crises. Para validar esse protocolo de registro e processamento de EEG-RMf, avaliamos a qualidade do EEG comparando o EEG pós-processado com o da UEM, e confirmamos que a mesma característica distinguível do EEG é observada em ambos os casos.
A atividade lenta delta focal é tipicamente sugestiva de uma lesão estrutural cerebral subjacente ou uma área onde os neurônios não estão funcionando como esperado, o que é frequentemente observado após derrames, lesões na cabeça, infecções cerebrais ou demência. No entanto, não é incomum que pacientes com epilepsia focal demonstrem atividade delta focal perto ou no local de sua zona epileptogênica. Além disso, embora a atividade delta focal seja menos específica do que os DEIs, ela pode especificar patologia estrutural localizada correspondente ao início de crises epilépticas12. Além disso, ondas lentas interictais focais no EEG correspondem à ativação focal BOLD na RMf que corresponde à área epileptogênica em pacientes com epilepsia parcial13.
É notável que, na epilepsia de início do lobo temporal, um tipo de atividade delta denominada delta rítmico intermitente temporal (TIRDA) às vezes está presente, sendo considerado um equivalente deIED14. Ao contrário, o delta polimórfico intermitente temporal (TIPDA) não é considerado equivalente ao IED15. Nos dados de EEG processados, ondas lentas temporais esquerdas focais claras (TIPDA) estão presentes, o que é observado a partir do EEG registrado na UEM (Figura 7). Embora essa atividade delta não seja equivalente ao IED, ela sugere disfunção neuronal temporal esquerda.
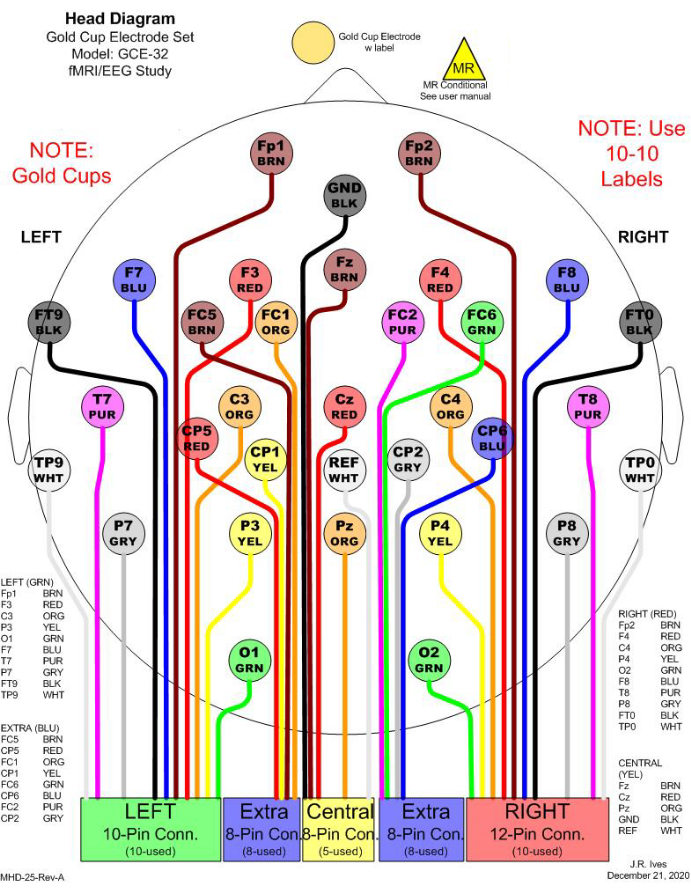
Figura 1: Exemplo de seleções de 32 eletrodos para registro simultâneo de EEG-RMf. Na clínica, 21 canais são comumente considerados para a monitorização do EEG. Para atender a um número mínimo de eletrodos para realizar imagens de fonte de EEG (ESI), 11 canais adicionais são incluídos para cobrir totalmente a cabeça. Todos os eletrodos são copos de ouro para evitar efeitos de RM. Na figura, cores diferentes são usadas para distinguir diferentes eletrodos, e as cores correspondem às cores do cabo físico. Cada caixa retangular na parte inferior indica uma junção a ser conectada a um arnês, que será conectado a um amplificador para gravação. Clique aqui para ver uma versão maior desta figura.
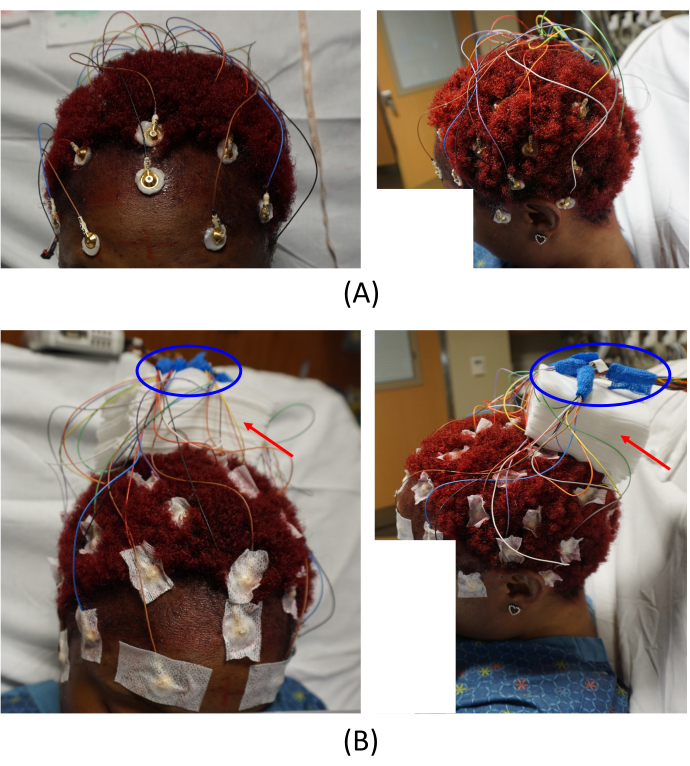
Figura 2: Colocação dos eletrodos. (A) Colocação dos eletrodos no couro cabeludo do paciente e (B) disposição das junções dos cabos. As imagens da esquerda em (A) e (B) fornecem uma visão frontal superior e as imagens da direita fornecem uma visão do lado esquerdo do paciente. As setas vermelhas em (B) indicam a colocação de compressas de gaze. Isso ajuda a evitar artefatos de imagem. As áreas circundadas em azul em (B) mostram como as junções de cabos estão organizadas. Clique aqui para ver uma versão maior desta figura.

Figura 3: Conexão do equipamento na sala de monitoramento . (A) Uma visão geral do adaptador USB 2, Syncbox e conexão Triggerbox. Imagem detalhada de (B) o adaptador USB 2 e as conexões de cabo Syncbox, (C) o Syncbox e a conexão de cabo de fibra óptica e (D) as conexões de cabo no Triggerbox. As marcas de estrela em (B), (C) e (D) mostram a localização dos cabos USB a serem conectados ao PC de gravação. Um diagrama esquemático do sistema de registro do EEG e as conexões necessárias entre o hardware é fornecido na Figura 1 em Mullinger et al.7. Clique aqui para ver uma versão maior desta figura.

Figura 4: Conexão do equipamento na sala de varredura . (A) Uma visão geral da conexão do amplificador de EEG no scanner. (B) Cabos enrolados da caixa de interface para conectar os eletrodos de EEG (o cabo vermelho é para a medida de ECG). (C) Conexão da caixa de interface e do amplificador de EEG e sacos de areia seguros de RM colocados para reduzir artefatos de RM. (D) Conexão do amplificador (parte superior) e da bateria (parte inferior) e conexão do cabo de fibra óptica do Syncbox na sala de monitoramento ao amplificador. Clique aqui para ver uma versão maior desta figura.
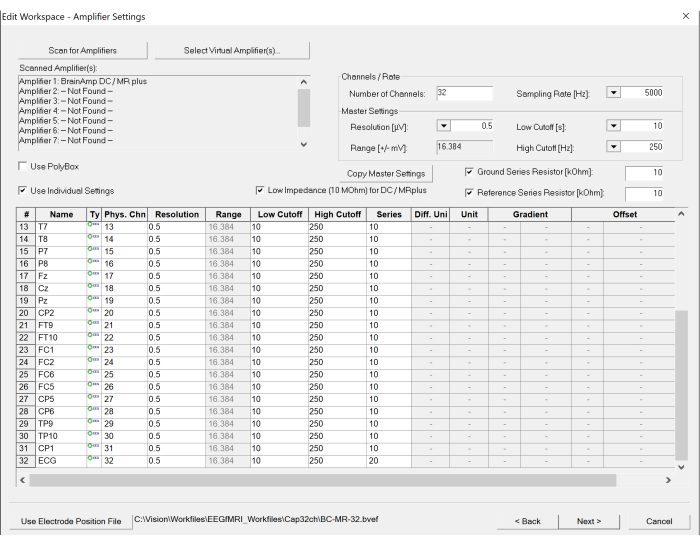
Figura 5: Captura de tela das configurações do espaço de trabalho no software de gravação de EEG. O número de canais e a taxa de amostragem podem ser definidos sob as configurações do amplificador. Além disso, a especificação de cada canal pode ser modificada, se necessário, clicando na tabela na parte inferior. Clique aqui para ver uma versão maior desta figura.
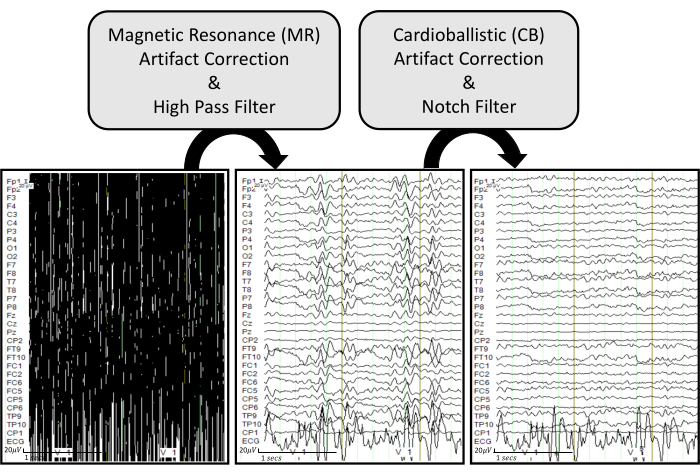
Figura 6: Pipeline de remoção de artefato de EEG com exemplos representativos. Os traços brutos de EEG são exibidos no canto inferior esquerdo. O gráfico do meio inferior mostra os traços do EEG após a aplicação da correção do artefato de RM e um filtro passa-alta de 0,5 Hz no EEG bruto. O gráfico inferior direito exibe traços de EEG após a aplicação da correção de artefato CB e um filtro de entalhe de 60 Hz no EEG processado. Os traços de EEG são exibidos no modo de solo comum para visualizar efetivamente como cada processo influencia cada canal gravado. Clique aqui para ver uma versão maior desta figura.
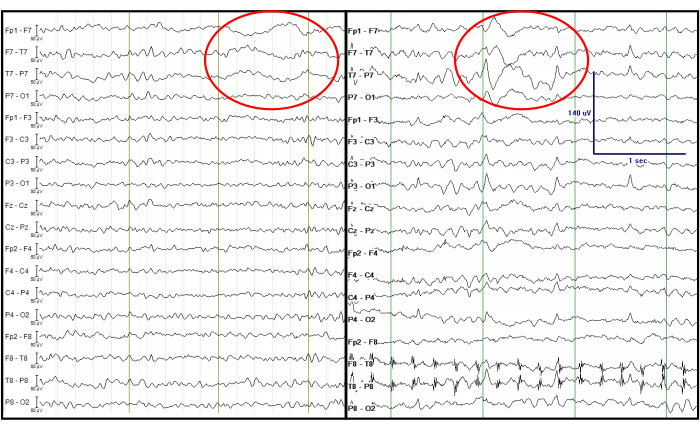
Figura 7: Comparação do EEG processado a partir de um registro simultâneo de EEG-fMRI (esquerda) e um EEG registrado na UEM (direita). O círculo vermelho indica ondas lentas temporais focais esquerdas nos mesmos canais. Os traços de EEG são exibidos em formato de banana dupla, tradicionalmente considerada na clínica. Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo experimental é único em proporcionar uma transição suave de pacientes com epilepsia da UEM para a sala de varredura, permitindo que seja usado em ambientes clínicos e de pesquisa. O uso de eletrodos condicionais de RM aprovados pela FDA é um componente essencial tanto para registros clínicos durante o tempo gasto na UEM quanto para transferência segura para RM sem a necessidade de remover ou trocar os eletrodos do couro cabeludo do paciente. Na UEM, os eletrodos condicionais de RM são conectados a um amplificador para monitoramento simultâneo de vídeo e EEG. Para registros de EEG-fMRI, um amplificador de EEG condicional de RM e um scanner de RM podem ser usados com uma bobina de cabeça de 20 canais, que acomoda o tamanho do conjunto de eletrodos e dos fios de conexão. Deve-se notar que, antes de realizar os registros simultâneos de EEG-fMRI em pacientes com epilepsia, um teste executado com um indivíduo saudável é altamente recomendado para confirmar o funcionamento adequado de todos os equipamentos e familiarizar-se com cada passo necessário.
Além disso, a organização concreta da equipe e a seleção cuidadosa dos pacientes também desempenham um papel significativo nesse protocolo. Para ser viável tanto para o cenário clínico quanto para a pesquisa, é necessário ter uma equipe estruturada de epileptologistas, equipe de enfermagem, tecnólogos em EEG e engenheiros. Para a seleção dos pacientes, os critérios de inclusão e exclusão listados acima devem ser firmemente considerados.
Além disso, é importante abordar que, quando a análise de RMf informada pelo EEG é conduzida, a presença clara das principais características dos EEGs deve existir para orientar as alterações BOLD correspondentes na RMf. Portanto, ao realizar o registro de EEG-fMRI, é importante considerar os pacientes que demonstraram previamente as características alvo do EEG. Durante o período interictal em pacientes com epilepsia, os DEIs, que são anormais e sugerem potencial epileptogênico, são uma característica bem conhecida no EEG para referência às alterações BOLD16, embora o exemplo aqui não inclua este caso. Ao almejar obter DEIs nos registros interictais de EEG-fMRI, os experimentadores devem considerar pacientes com DEIs frequentes (pelo menos três IEDs/hora) observados por um EEG do couro cabeludo, a fim de garantir descargas epileptiformes suficientes durante uma sessão de varredura. O número de DEIs pode ser determinado a partir da monitorização do EEG na UEM, ou a partir da referência à frequência de IEDs observada nos registros prévios de EEG dos indivíduos, se existirem. Os registros obtidos dos dados de EEG-fMRI interictal podem trazer benefícios para a compreensão e potencialmente localização da zona de início das crises17.
Uma vez que um EEG limpo é obtido após o processamento das etapas de remoção do artefato, uma análise adicional do EEG pode ser aplicada. Por exemplo, a imagem da fonte de EEG (ESI) pode ser obtida aplicando-se tomografia eletromagnética cerebral padronizada de baixa resolução (sLORETA)18 para estimar a atividade elétrica correspondente do cérebro na superfície cortical. As fontes estimadas podem ser obtidas invertendo-se a matriz de campo de chumbo computada com base nas camadas da cabeça, crânio externo, crânio interno e córtex criadas a partir da RM do paciente usando o método dos elementos de contorno19. Existem inúmeras caixas de ferramentas disponíveis publicamente para obter imagens de fonte de EEG, e o Brainstorm é uma caixa de ferramentas baseada em MATLAB usada popularmente20.
Quando a ESI é considerada usando o EEG processado, o número total de eletrodos e suas distribuições devem ser cuidadosamente levados em conta para que possam cobrir razoavelmente toda a cabeça. O número mínimo de eletrodos necessários para implementar a ESI é de 32canais21,22, que é maior do que o número padrão de eletrodos usados em ambientes clínicos. Assim, recomenda-se incluir canais extras para cobrir toda a cabeça com espaçamento razoável. A seleção de canais neste estudo inclui 21 canais, que são convencionalmente utilizados na clínica para monitorização eletroencefalográfica, e 11 canais adicionais para cobrir totalmente a cabeça (Figura 1).
Aqui, não incluímos detalhes da análise por RMf, uma vez que esta está fora do escopo de nosso estudo. No entanto, uma possível direção é a análise por RMf informada pelo EEG23. Por exemplo, o tempo de ocorrência dos DEIs pode ser salvo como gatilhos de eventos para se correlacionar com a RMf, o que pode levar a uma análise rotineira de RMf relacionada a eventos. Neste caso, uma análise de modelo linear generalizado pode ser usada para encontrar as regiões cerebrais que mostram alterações no sinal da RMf no momento dos DEIs.
Ressaltamos que um estudo publicado recentemente10 mostrou que é possível utilizar um sistema de malha de fio de carbono quando uma técnica mais robusta de remoção de artefatos é necessária16. No entanto, queremos avaliar que a integração do sistema de malha de fio de carbono em nosso ambiente experimental com o eletrodo condicional de RM ainda não foi investigada.
Embora este estudo se concentre especificamente no período interictal da epilepsia, o protocolo introduzido para EEG-fMRI simultâneo pode ser estendido para o período ictal ou pós-ictal. No entanto, considerações específicas devem ser seguidas quando quaisquer configurações personalizadas são consideradas. Para a fase pós-ictal, uma preocupação importante que conhecemos é que o paciente receba um benzodiazepínico antes do transporte para a RM. Quanto à análise de frequência dos EEGs, tem sido relatado que os benzodiazepínicos não necessariamente alteram as bandas de frequência específicas 24,25 e, no caso de alterações modestas, estas estão confinadas à região somatossório-motora26 ou lobos frontais 27. Além disso, com relação ao EEG-fMRI simultâneo, as correlações delta EEG-BOLD não mostraram alterações após a injeção de benzodiazepínicos em comparação com um controle com injeção de solução salina27. O sinal BOLD estava diminuído apenas nas pequenas áreas do giro de Heschel e área motora suplementar.
Divulgações
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Agradecimentos
Este trabalho foi parcialmente apoiado pela Faculdade de Medicina, pelo Vice-Presidente de Pesquisa, pela UK HealthCare e pela Área Prioritária de Pesquisa da Universidade de Kentucky como parte da Iniciativa da Aliança da Faculdade de Medicina e pelos fundos de Start-Up do Dr. Jihye Bae fornecidos pelo Departamento de Engenharia Elétrica e de Computação da Universidade de Kentucky. Os autores agradecem aos participantes voluntários pela gravação e aos membros da equipe da Epilepsy-Neuroimaging Research Alliance, especialmente ao Dr. Brian Gold por liderar a equipe da aliança, ao Dr. Sridhar Sunderam pela orientação da pesquisa e a Susan V. Hollar e Emily Ashcraft pelo cuidado e gerenciamento do paciente.
Materiais
| Name | Company | Catalog Number | Comments |
| 3T Magnetom Prisma fit MRI scanner | Siemens Healthineers | ||
| Abralyt HiCl, 10 g. | EASYCAP GmbH | Conductive gel for ECG electrode. | |
| BrainAmp MR plus 32-channel | Brain Products GmbH | S-BP-01300 | |
| BrainVision Analyzer Version 2.2.0.7383 | Brain Products GmbH | EEG analysis software. | |
| BrainVision Interface Box 32 inputs | Ives EEG Solutions, LLC | BVI-32 | |
| BrainVision Recorder License with dongle | Brain Products GmbH | S-BP-170-3000 | |
| BrainVision Recorder Version 1.23.0003 | Brain Products GmbH | EEG recording software. | |
| Collodion (non-flexible) | Mavidon | Glue to secure EEG electrodes. | |
| Fiber Optic cable (30m one line) | Brain Products GmbH | S-BP-345-3020 | |
| Gold Cup Electrode set, 32 channel | Ives EEG Solutions, LLC | GCE-32 | 2+ items are recommended when managing multiple subjects with overlapped/close period of Epilepsy Monitoring Unit (EMU) stay. |
| Gold Cup Electrodes | Ives EEG Solutions, LLC | GCE-EKG | |
| Harness, 32 lead, reusable | Ives EEG Solutions, LLC | HAR-32 | 2+ items are recommended when managing multiple subjects with overlapped/close period of Epilepsy Monitoring Unit (EMU) stay. |
| MR-sled kit including 100% and 75% length base plates, low profile (3 cm) block legs for each base plate, ramp, and strap systems as hand configured | Brain Products GmbH | BV-79123-PRISMA SKYRA | |
| Natus NeuroWorks EEG | Natus | Software used for EEG monitoring at the Epilepsy Monitoring Unit (EMU). | |
| Nuprep Skin Prep Gel | Weaver and Co. | ||
| Passive starter set, including consumables (gel, syringes, dispensing tips, adhesive washers, etc.) to facilitate out of the box data acquisition | Brain Products GmbH | S-C-5303 | |
| SyncBox compl. Extension box for phase sync recordings | Brain Products GmbH | S-BP-02675 | Syncbox |
| syngo MR XA30 | Siemens Healthineers | Software used for the MRI scanner. | |
| Ten 20 Conductive Neurodiagnostic Electrode Paste | Weaver and Co. | Conductive gel for EEG electrodes. | |
| TriggerBox Kit for BrainAmp | Brain Products GmbH | S-BP-110-9010 | Triggerbox; This Kit allows to expand the trigger width from the scanner so that the trigger signal can be detected on the BrainVision Recorder properly. This kit may not be required depending on the characteristics of the trigger signal provided by the scanner. |
| Xltek EMU40EX amplifier | Natus | An amplifier used at the Epilepsy Monitoring Unit (EMU). |
Referências
- Ngugi, A. K., Bottomley, C., Kleinschmidt, I., Sander, J. W., Newton, C. R. Estimation of the burden of active and life-time epilepsy: a meta-analytic approach. Epilepsia. 51 (5), 883-890 (2010).
- Kwan, P., Brodie, M. J. Early Identification of refractory epilepsy. The New England Journal of Medicine. 342 (5), 314-319 (2000).
- Menon, V., Crottaz-Herbette, S. Combined EEG and fMRI studies of human brain function. International Review of Neurobiology. 66, 291-321 (2005).
- Gotman, J., Pittau, F. Combining EEG and fMRI in the study of epileptic discharges. Epilepsia. 52, 38-42 (2011).
- Pittau, F., Dubeau, F., Gotman, J. Contribution of EEG/fMRI to the definition of the epileptic focus. Neurology. 78 (19), 1479-1487 (2012).
- Ikemoto, S., von Ellenrieder, N., Gotman, J. Electroencephalography-functional magnetic resonance imaging of epileptiform discharges: Noninvasive investigation of the whole brain. Epilepsia. 63 (11), 2725-2744 (2022).
- Mullinger, K. J., Castellone, P., Bowtell, R. Best current practice for obtaining high quality EEG data during simultaneous fMRI. Journal of Visualized Experiments. (76), e50283 (2013).
- Douglas, P. K., et al. Method for simultaneous fMRI/EEG data collection during a focused attention suggestion for differential thermal sensation. Journal of Visualized Experiments. (83), e3298 (2014).
- Nguyen, T., Potter, T., Karmonik, C., Grossman, R., Zhang, Y. Concurrent EEG and functional MRI recording and integration analysis for dynamic cortical activity imaging. Journal of Visualized Experiments. (136), e56417 (2018).
- Khoo, H. M., et al. Reliable acquisition of electroencephalography data during simultaneous electroencephalography and functional MRI. Journal of Visualized Experiments. (169), e62247 (2021).
- Allen, P. J., Josephs, O., Turner, R. A method for removing imaging artifact from continuous EEG recorded during functional MRI. Neuroimage. 12 (2), 230-239 (2000).
- Smith, S. J. M. EEG in the diagnosis, classification, and management of patients with epilepsy. Journal of Neurology, Neurosurgery, and Psychiatry. 76, 2-7 (2005).
- Manganotti, P., et al. Continuous EEG-fMRI in patients with partial epilepsy and focal interictal slow-wave discharges on EEG. Magnetic Resonance Imaging. 26 (8), 1089-1100 (2008).
- Reiher, J., Beaudry, M., Leduc, C. P. Temporal intermittent rhythmic delta activity (TIRDA) in the diagnosis of complex partial epilepsy: sensitivity, specificity and predictive value. The Canadian Journal of Neurological Sciences. 16 (4), 398-401 (1989).
- Geyer, J. D., Bilir, E., Faught, R. E., Kuzniecky, R., Gilliam, F. Significance of interictal temporal lobe delta activity for localization of the primary epileptogenic region. Neurology. 52 (1), 202-205 (1999).
- Koupparis, A., et al. Association of EEG-fMRI responses and outcome after epilepsy surgery. Neurology. 97 (15), e1523-1536 (2021).
- Gotman, J. Has recording of seizures become obsolete. Revue Neurologique. , 00865 (2023).
- Pascual-Marqui, R. D. Standardized low-resolution brain electromagnetic tomography (sLORETA): technical details. Methods and Findings in Experimental and Clinical Pharmacology. 24, 5-12 (2002).
- Hallez, H., et al. Review on solving the forward problem in EEG source analysis. Journal of Neuroengineering and Rehabilitation. 4, 46 (2007).
- Tadel, F., Baillet, S., Mosher, J. C., Pantazis, D., Leahy, R. M. Brainstorm: a user-friendly application for MEG/EEG analysis. Computational Intelligence and Neuroscience. 2011, 879716 (2011).
- Srinivasan, R., Tucker, D. M., Murias, M. Estimating the spatial Nyquist of the human EEG. Behavior Research Methods, Instruments, & Computers. 30, 8-19 (1998).
- Michel, C. M., et al. EEG source imaging. Clinical Neurophysiology. 115 (10), 2195-2222 (2004).
- Abreu, R., Leal, A., Figueiredo, P. EEG-informed fMRI: A review of data analysis methods. Frontiers in Human Neuroscience. 12, 29 (2018).
- Saletu, B., Anderer, P., Saletu-Zyhlarz, G. M. EEG topography and tomography (LORETA) in the classification and evaluation of the pharmacodynamics of psychotropic drugs. Clinical EEG Neuroscience. 37 (2), 66-80 (2006).
- Windmann, V., et al. Influence of midazolam premedication on intraoperative EEG signatures in elderly patients. Clinical Neurophysiology. 130 (9), 1673-1681 (2019).
- Nishida, M., Zestos, M. M., Asano, E. Spatial-temporal patterns of electrocorticographic spectral changes during midazolam sedation. Clinical Neurophysiology. 127 (2), 1223-1232 (2016).
- Forsyth, A., et al. Comparison of local spectral modulation, and temporal correlation, of simultaneously recorded EEG/fMRI signals during ketamine and midazolam sedation. Psychopharmacology. 235 (12), 3479-3493 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados