Estudando a conversa cruzada de células endoteliais adiposas/adipócitos no tecido adiposo subcutâneo humano
Neste Artigo
Resumo
Aqui, descrevemos um protocolo para isolar, cultivar e fenotipar células endoteliais microvasculares do tecido adiposo subcutâneo humano (hSATMVECs). Além disso, descrevemos um modelo experimental de diafonia hSATMVEC-adipócitos.
Resumo
As células endoteliais microvasculares (MVECs) têm muitos papéis críticos, incluindo controle do tônus vascular, regulação da trombose e angiogênese. A heterogeneidade significativa no genótipo e fenótipo da célula endotelial (CE) depende do leito vascular e do estado da doença do hospedeiro. A capacidade de isolar MVECs de leitos vasculares específicos de tecidos e grupos individuais de pacientes oferece a oportunidade de comparar diretamente a função MVEC em diferentes estados de doença. Aqui, usando tecido adiposo subcutâneo (SAT) tomado no momento da inserção de dispositivos eletrônicos implantáveis cardíacos (CIED), descrevemos um método para o isolamento de uma população pura de tecido adiposo subcutâneo humano funcional MVEC (hSATMVEC) e um modelo experimental de hSATMVEC-diapócitos
Os hSATMVEC foram isolados após digestão enzimática do SAT por incubação com esferas magnéticas revestidas com anticorpo anti-CD31 e passagem por colunas magnéticas. hSATMVEC foram cultivados e passados em placas revestidas de gelatina. Os experimentos usaram células nas passagens 2-4. As células mantiveram características clássicas da morfologia EC até pelo menos a passagem 5. A avaliação por citometria de fluxo mostrou 99,5% de pureza do hSATMVEC isolado, definido como CD31+/CD144+/CD45-. O hSATMVEC isolado de controles teve um tempo de duplicação populacional de aproximadamente 57 h, e a proliferação ativa foi confirmada usando um kit de imagem de proliferação celular. A função isolada do hSATMVEC foi avaliada usando sua resposta à estimulação da insulina e potencial de formação de tubo angiogênico. Em seguida, estabelecemos um modelo de co-cultura de adipócitos subcutâneos hSATMVEC para estudar a diafonia celular e demonstramos um efeito a jusante do hSATMVEC na função dos adipócitos.
O hSATMVEC pode ser isolado do SAT tomado no momento da inserção do CIED e é de pureza suficiente para fenotipar experimentalmente e estudar a conversa cruzada entre hSATMVEC e adipócitos.
Introdução
As células endoteliais (CEs) são células escamosas que revestem a superfície interna da parede do vaso sanguíneo como uma monocamada. Eles têm muitos papéis essenciais, incluindo controle do tônus vascular, regulação da trombose, modulação da resposta inflamatória e contribuição para a angiogênese1. Dada a importância das células endoteliais na fisiologia cardiometabólica, elas são frequentemente usadas experimentalmente para aprofundar a compreensão da fisiopatologia e examinar novos tratamentos farmacológicos para doenças cardiometabólicas.
No entanto, há uma enorme heterogeneidade na morfologia, função, expressão gênica e composição do antígeno das células endoteliais, dependendo da origem de seu leito vascular2. Enquanto as células endoteliais de grandes artérias são mais adequadas para estudos de aterosclerose, as células endoteliais de pequenos vasos, conhecidas como células endoteliais microvasculares (MVECs), são mais adequadas para estudos de angiogênese2. Compreender a base molecular da heterogeneidade endotelial pode fornecer informações valiosas sobre terapias específicas do leito vascular. A função endotelial microvascular também difere significativamente em várias doenças, incluindo diabetes, doenças cardiovasculares e infecção sistêmica 3,4. Portanto, a capacidade de isolar células endoteliais de grupos de pacientes definidos permite a comparação direta de sua função celular endotelial e a conversa cruzada celular5.
Neste artigo, descrevemos um novo método de isolamento de MVECs humanos de tecido adiposo subcutâneo (hSATMVEC) tomado no momento da inserção do dispositivo eletrônico implantável cardíaco (CIED). hSATMVEC isolados após digestão enzimática do tecido adiposo subcutâneo (SAT) foram cultivados e passados em placas revestidas de gelatina. Em seguida, descrevemos uma série de ensaios de fenotipagem que foram aplicados com sucesso a hSATMVECs para validar seu fenótipo e demonstrar o uso em ensaios de células endoteliais de rotina. Finalmente, descrevemos uma aplicação de hSATMVECs em um modelo experimental de hSATMVECs-diaponização de adipócitos.
Protocolo
As amostras de tecido humano utilizadas na técnica descrita foram retiradas de pacientes submetidos à inserção de DCEI indicada por diretrizes de acordo com a prática clínica de rotina no Leeds Teaching Hospitals NHS Trust (Leeds, Reino Unido). O protocolo do estudo, juntamente com toda a outra documentação, foi aprovado pelo comitê de ética local (11/YH/0291) antes da inscrição dos participantes. O estudo foi conduzido em conformidade com os princípios da Declaração de Helsinque.
1. População de pacientes
- Obtenha tecido adiposo subcutâneo fresco (SAT) durante o implante do CIED do SAT sobrejacente ao músculo peitoral maior.
- Isole as amostras de SAT em condições estéreis e manuseie as amostras de tecidos após a coleta em uma capela de fluxo laminar sob condições assépticas estritas para evitar a contaminação bacteriana.
2. Isolamento e cultura de células endoteliais
NOTA: Um esquema para isolamento de hSATMVEC é mostrado na Figura 1.
- Para isolamento de hSATMVEC, use um mínimo de 250 mg de tecido adiposo subcutâneo fresco (SAT) obtido durante o implante de DCEI do SAT sobrejacente ao músculo peitoral maior (ver Figura 1).
NOTA: O uso de grandes quantidades de SAT fresco aumenta o rendimento de hSATMVEC durante o isolamento e tem a maior chance de isolamento bem-sucedido e cultura de hSATMVEC. - Coloque imediatamente o SAT em uma solução de armazenamento de tecido de classificação de células ativadas por magnetismo (MACS) gelada em um tubo de microcentrífuga de 1,5 mL antes de transferir para o laboratório.
NOTA: Para obter a maior chance de isolamento bem-sucedido, o isolamento hSATMVEC deve ser realizado o mais rápido possível. No entanto, o SAT pode ser armazenado por até 24 horas no gelo antes do isolamento, se necessário. - Preparar uma solução de trabalho de colagenase/dispase a 1 mg/ml da seguinte forma.
- Primeiro, reconstitua 500 mg de pó liofilizado de colagenase / dispase em 5 mL de água estéril para formar uma solução estoque de colagenase / dispase com uma concentração de 100 mg / mL.
- Para cada isolamento de hSATMVEC, diluir 100 μL de solução estoque de colagenase / dispase em 10 mL de solução salina balanceada de Hanks fria para obter uma solução de trabalho de 1 mg / mL.
- Em um gabinete de fluxo laminar, use dois bisturis para picar os tecidos em ~ 1 mm3 pedaços em 500 μL de solução de colagenase / dispase a 1 mg / mL na tampa de uma placa de Petri, triturar e transferir para um tubo de centrífuga limpo de 50 mL.
- Lave a tampa da placa de Petri com 4,5 mL de solução fresca de colagenase / dispase 1 mg / mL e adicione ao tubo de centrifugação de 50 mL. Deixar digerir durante 30 min a 37 °C num rotador de tubos a 20 rpm. Pare o processo de digestão adicionando 10 mL de meio de crescimento EC completo MV.
- Triturar a mistura digerida e passá-la por uma peneira de células de 70 μm. Lave a peneira com 10 mL de tampão solução salina e albumina de soro bovino tamponada com fosfato a 0,5% (PBS-BSA). Centrifugar a amostra a 300 x g durante 10 minutos à temperatura ambiente e rejeitar o sobrenadante. Repita esta etapa com mais 5 mL de PBS-BSA a 0,5%.
- Em seguida, remova as células mortas usando um kit de remoção de células mortas. Para fazer isso, incube o pellet celular em 200 μL de grânulos de remoção de células mortas (vórtice antes do uso) por 15 min à temperatura ambiente (RT) em um tubo de microcentrífuga de 1,5 mL.
- Conecte uma coluna LS com um filtro de 30 μm ao ímã separador e coloque um tubo de centrífuga de 15 mL embaixo. Lave a coluna magnética uma vez com 1 mL de tampão de ligação de remoção de células mortas antes de adicionar a suspensão de amostra/grânulo e deixe-a passar passivamente sob gravidade.
- Em seguida, lave a coluna adicionando 0,5 mL de buffer de ligação e deixe-a passar passivamente pela coluna. Repita esta lavagem quatro vezes.
- Colete o eluído como uma fração de células vivas, gire as células a 300 x g em RT por 10 min e, em seguida, lave e ressuspenda o pellet resultante em 400 μL de PBS-BSA a 0,5%.
- Adicione 20 μL de esferas magnéticas revestidas com anti-CD31 às células suspensas e incube por 20 min a 4 ° C. Após a incubação, centrifugar a amostra a 300 x g durante 5 min em RT e rejeitar o sobrenadante. Ressuspenda o pellet celular em 500 μL de PBS-BSA a 0,5%.
- Anexar uma coluna MS com um filtro de 30 μm ao íman separador e colocar um tubo de centrífuga de 15 ml por baixo. Prepare a coluna com 500 μL de 0,5% de PBS-BSA. Repita esta etapa duas vezes.
- Adicione a suspensão de microesferas de células e deixe-a passar sob gravidade. Lave a coluna com 500 μL de PBS-BSA 0,5% três vezes. O fluxo contínuo no tubo de centrífuga sob a coluna contém a fração CD31- .
- Para coletar a fração CD31+ (ou seja, a fração contendo hSATMVECs), remova a coluna MS do ímã separador e coloque-a em um novo tubo de centrífuga de 15 mL. Adicione 1 mL de PBS-BSA a 0,5% e, em uma ação suave, aplique o êmbolo da coluna para liberar os hSATMVECs capturados.
- Centrifugar a amostra a 300 x g durante 5 min à RT e rejeitar o sobrenadante. Ressuspenda o pellet celular em 1 mL de meio de crescimento EC completo MV e divida a solução celular de 1 mL entre um ou dois poços (dependendo do tamanho do pellet) de uma placa de 24 poços revestida com gelatina a 2% (Passagem 0).
NOTA: Não se preocupe se houver poucas células aderentes nos primeiros dias após o isolamento. - Mude de mídia a cada 3 dias. Células de cultura a 37 °C com 5% de CO2. Quando as células isoladas atingirem ~ 80% de confluência (2-4 semanas), passe-as para um único poço de uma placa de seis poços (passagem 1).
NOTA: As passagens subsequentes podem recolocar as células de um poço doador confluente para os poços receptores. Os experimentos foram realizados em células de passagem 2-4 gerações após as células terem demonstrado pureza >99% usando citometria de fluxo (ver seção 3). As células mantiveram a morfologia endotelial típica até pelo menos a passagem 5.
3. Citometria de fluxo
- Antes da citometria de fluxo, verifique visualmente os hSATMVECs para garantir que pareçam confluentes e morfologicamente representativos. Realize a avaliação por citometria de fluxo de hSATMVECs na passagem 2, usando células de um único poço de uma placa de 6 poços.
- Lave as células duas vezes com PBS adicionando 500 μL de PBS bem e aspirando a cada vez. Em seguida, adicione 300 μL / poço de solução quente de tripsina / EDTA (0,25%). Incubar a 37 °C com 5% de CO2 por 2 min.
- Uma vez destacado, neutralize a solução de tripsina / EDTA com 700 μL de meio de crescimento EC completo MV e transfira para um tubo de microcentrífuga de 1,5 mL.
- Centrifugar a suspensão celular a 400 x g durante 8 min a RT. Rejeitar o sobrenadante sem perturbar o sedimento. Em seguida, ressuspenda o pellet celular em tampão MACS de 1 mL e divida entre dois tubos de microcentrífuga de 1,5 mL rotulados como controle não corado e amostra corada (500 μL por poço).
- Adicione mais 500 μL de tampão MACS a cada tubo de microcentrífuga, antes de centrifugar novamente a 400 x g por 8 min em RT.
- Descarte o sobrenadante e ressuspenda o pellet celular em 100 μL de tampão MACS para controle não corado e coquetel de coloração de 100 μL (Tabela Suplementar 1) para a amostra corada. Comine as células com CD45-FITC (o marcador pan-leucocitário), bem como CD144-PE e CD31-PerCP (que são expressos pelas células endoteliais).
- Vortex brevemente as células suspensas por 5 s, depois incube a 4 ° C por 10 min. Em seguida, adicione 1 mL de tampão MACS a cada tubo, centrifugue novamente a 400 x g por 8 min em RT e descarte o sobrenadante.
- Finalmente, ressuspenda o pellet celular em 500 μL de tampão MACS e transfira-o para um novo tubo de microcentrífuga de 1,5 mL. Coloque o tubo rotulado em uma caixa de gelo coberta pronta para análise.
NOTA: Todas as análises de citometria de fluxo incluídas foram realizadas em um sistema de citômetro de fluxo Beckman Coulter Cytoflex de 4 lasers (usando apenas o laser de excitação de 488 nm). - Configure o comprimento de onda máximo de emissão e o filtro para cada fluorocoma da seguinte forma: CD45-FITC - emissão máxima 520 nm, filtro 525/50; CD144-PE - emissão máxima 578 nm, filtro 585/40; CD31-PerCP - emissão máxima 675 nm, filtro 655-730.
- Conforme ilustrado na Figura 2, registre dados para 10.000 células por amostra em uma porta singlete (P2). Verifique se P1 envolve um aglomerado de células principal e se a maioria dessas células cai na porta singlete P2. Certifique-se de que o controle não corado tenha células CD45-CD144 + CD31 + mínimas como % de singletos.
- Registar a percentagem de células CD45-CD144+CD31+ na amostra corada.
4. Tempo de duplicação das células endoteliais e proliferação celular (Figura 3)
- Nas passagens 2 e 3, conte o número de hSATMVECs viáveis para cada amostra usando hemocitometria. Registre a data e a hora de cada contagem de células.
- Calcule o número de duplicações da população entre esses pontos de acordo com a equação: tempo de duplicação = (duração x log(2))/(log (concentração final)-log(concentração inicial)).
NOTA: Uma calculadora online está disponível em https://doubling-time.com/compute.php. - Avalie a proliferação de hSATMVECs usando um kit de imagem de proliferação celular disponível comercialmente. Semeie hSATMVECs a uma densidade de 20.000 células por poço em uma placa de 24 poços e deixe-os durante a noite em meio de crescimento EC completo MV para se recuperar.
- No dia seguinte, adicionar 5-etinil-2'-desoxiuridina (EdU) a cada poço diluído em meio de crescimento EC completo MV a uma concentração final de 10 μM. Incubar a 37 °C (5% CO2) durante 2 h.
- Remova a mídia contendo EdU e lave cada poço duas vezes com PBS. Fixe as células com paraformaldeído a 4% por 15 min em RT. Lave cada poço duas vezes com PBS e adicione 500 μL de Triton X-100 a 0,5% em tampão salino tampão tris-tamponado com solução salina (TBS). Deixe incubar em RT por 20 min.
NOTA: Isso permeabiliza a membrana celular, permitindo a entrada de azida marcada com Alexa fluor 488 na célula. - Prepare o coquetel de azida rotulado com Alexa fluor 488 de acordo com as instruções do fabricante, dependendo do número de poços (consulte6). Lave cada poço duas vezes com PBS antes de adicionar 100 μL de coquetel de azida marcado com Alexa fluor 488 e incube por 30 min em RT protegido da luz.
NOTA: O coquetel de azida rotulado com Alexa fluor 488 reage com o EdU em uma reação de clique. - Remova o coquetel de azida rotulado com Alexa fluor 488 e lave duas vezes com PBS. Adicionar 500 μL de iodeto de propídio por alvéolo e incubar durante 20 min a RT.
NOTA: Esta etapa contrapõe os núcleos (proliferantes e não proliferantes) de vermelho.
Remova o iodeto de propídio, lave duas vezes com PBS e deixe cada poço em 500 μL de PBS para imagem. - Imagem de cada poço em 4 campos de alta potência com ampliação de 10x, com excitação/emissão de 495/519 nm para a azida de 488 nm (ver Figura 3C).
NOTA: As imagens nas figuras foram capturadas usando um sistema de análise de células vivas com ampliação de 10x com tempo de exposição de 800 ms. - Conte o número de células em proliferação (verde) e expresse como uma porcentagem (%) do total de células dentro de cada campo de alta potência (média de 4 regiões por poço).
5. Formação do tubo celular endotelial
- Deixe Matrigel (matriz da membrana basal; BMM) para descongelar durante a noite no gelo. No dia seguinte, com a placa no gelo, adicione 160 μL de BMM a cada poço de uma placa de 24 poços, conforme necessário. Incline a placa para obter cobertura total de cada poço com BMM. Coloque a placa em uma incubadora a 37 °C com 5% de CO2 para endurecer enquanto prepara as células.
- Semeie hSATMVECs a 100.000 células (em 1 mL de meio) por poço. Pipete ao lado do poço e tome cuidado para pipetar lentamente para evitar que a matriz se desprenda. Incubar a placa a 37 °C com 5% de CO2 durante 4 h.
NOTA: Neste ponto, a placa está pronta para ser fotografada. Os resultados e figuras abaixo da imagem de fase no sistema de análise de células vivas com ampliação de 10x foram usados em 5 áreas de poços diferentes (ver Figura 3D). - Conte o número de tubos inteiros em cada campo de alta potência e calcule um valor médio para cada amostra.
6. Estimulação insulínica de hSATMVEC
- Cultive hSATMVEC em uma placa de 6 poços a 37 ° C com 5% de CO2. Uma vez confluente, remova o meio de crescimento de células endoteliais completo MV e lave duas vezes com PBS.
- Adicione 500 μL de meio de fome sérica (meio de crescimento de células endoteliais MV sem suplementos) a cada poço e deixe incubar a 37 ° C com 5% de CO2 por 4 h. Durante este tempo, prepare alíquotas de 500 μL de concentrações crescentes de insulina (0-150 μM) preparadas em meios de fome de soro.
- Depois de ficar sem soro por 4 h, remova o meio dos poços, adicione 1 mL de meio contendo insulina (com concentrações crescentes) a cada poço e incube por 10 min a 37 ° C com 5% de CO2.
- Lave duas vezes com PBS frio antes de adicionar 100 μL de tampão de lise de proteína contendo inibidores de protease e fosfatase para lisar as células para proteína. Quantifique a proteína usando o ensaio BCA.
NOTA: No experimento descrito abaixo, os lisados celulares foram incubados por 30 min em banho de gelo e centrifugados a 20.000 x g por 15 min. Antes da eletroforese, as amostras de proteínas foram fervidas para desnaturar as proteínas a 95 °C por 5 min. As proteínas foram resolvidas em um NuPAGE 4-12% Bis-Tris Gel e transferidas para uma membrana de nitrocelulose. A análise de immunoblot foi realizada de acordo com protocolos padrão usando anticorpos fosfoproteicos relevantes e anticorpos proteicos totais (de acordo com as instruções do fabricante). Um anticorpo secundário Ig/HRP apropriado foi usado para detectar o anticorpo primário (de acordo com as instruções do fabricante). Os níveis de proteína foram quantificados por meio de densitometria com base na intensidade das bandas de cada amostra. A ß-actina foi usada como controle de carga quando apropriado.
7. Configuração de co-cultura de hSATMVEC-adipócitos (Figura 4)
NOTA: Nos resultados abaixo, pré-adipócitos subcutâneos brancos humanos disponíveis comercialmente na passagem 2 de um único doador caucasiano masculino foram usados em todos os ensaios de adipócitos. Os pré-adipócitos foram inicialmente expandidos do frasco fornecido pelo fornecedor (passagem 0) para doze criogeniais contendo meio de congelamento crio-SFM (passagem 1).
- Cada placa de co-cultura de 24 poços requer um criovial de pré-adipócitos (passagem 1). Descongele rapidamente cada frasco e placa em um frasco T75 contendo 12-15 mL de meio PGM-2 quente (contendo 10% de FBS, 30 μg / mL de L-glutamina e 15 ng / mL de GA-1000 SingleQuots). Troque de mídia a cada 3 dias até 90% confluente.
- Uma vez 90% confluente, lave os pré-adipócitos subcutâneos brancos humanos com PBS e adicione 1 mL de solução de tripsina / EDTA (0,25%). Deixe em RT por 2 min e confirme o descolamento com microscopia óptica. Adicione 23 mL de meio PGM-2 para neutralizar a tripsina / EDTA e faça uma solução suspensa de 24 mL de pré-adipócitos.
- Coloque 1 mL de solução subcutânea de pré-adipócitos brancos humanos suspensa em cada poço de uma placa companheira de co-cultura de 24 poços e cresça até a confluência (geralmente 2-3 dias).
- Enquanto cresce até a confluência, prepare meios de diferenciação de pré-adipócitos (PDM). Para preparar o PDM, faça um estoque 2x PDM adicionando uma mistura proprietária de insulina, dexametasona, indometacina e isobutil-metilxantina ao meio de base PGM. Dilua 2x PDM em uma proporção de 1:1 com PGM para fazer 1x PDM.
- Uma vez confluente, diferencie os pré-adipócitos brancos subcutâneos humanos alterando o meio para 1 mL de 1x meio PDM em cada poço (Dia 0). Deixe os pré-adipócitos brancos subcutâneos humanos incubarem a 37 °C 5% CO2 por 10 dias (sem alterações de meio) para se diferenciarem totalmente. Monitore a diferenciação usando microscopia de fase de luz (consulte a Figura 4B).
NOTA: Os adipócitos diferenciados não podem ser passados e podem ser usados para ensaios do dia 10 ao dia 12. A diferenciação de adipócitos pode ser medida pela amplificação de mRNA de leptina, adiponectina e PPAR-γ. - No dia 6 de diferenciação, semeie hSATMVECs a uma densidade de 5 x 104 células por inserção em 500 μL de meio de crescimento EC completo MV em insertos transwell (membrana de 0,4 μM). Coloque as inserções transwell em um poço com 500 μL de meio de crescimento EC completo MV () e cresça até a confluência a 37 ° C em 5% de CO2.
- No dia 10, quando os adipócitos estiverem totalmente diferenciados, remova metade do meio PDM de cada poço e transfira as inserções transwell contendo hSATMVEC confluente em seu próprio meio (ECGM-MV) para cada poço (ver Figura 4A).
- Deixe as células em co-cultura por 24 horas antes de remover as inserções transwell e realize ensaios avaliando a função dos adipócitos.
NOTA: Neste momento, os adipócitos também podem ser lisados para isolamento de proteínas ou RNA, se necessário.
8. Captação de adipócito 2-(N-(7-Nitrobenz-2-oxa-1,3-diazol-4-il)Amino)-2-desoxiglicose (2-NBD)-glicose
- Após 24 h em co-cultura, remova as inserções celulares contendo hSATMVEC. Em seguida, adicione 2-NBD-glicose ao meio em cada poço para atingir uma concentração final de 20 μM. Proteger da luz e incubar por 30 min a 37 ° C com 5% de CO2.
- Lave as células duas vezes em PBS e fixe os adipócitos usando 500 μL de paraformaldeído a 4% (PFA) por 15 min em RT. Lave as células três vezes em PBS antes de deixar em 100 μL de PBS.
NOTA: Neste ponto, os adipócitos estão prontos para serem fotografados. Nas figuras incluídas, a imagem de fase e a luz verde (excitação 440-480 nm / emissão 504-544 nm) foram obtidas no sistema de análise de células vivas com ampliação de 10x em quatro campos de alta potência (ver Figura 4C). - Quantifique o nível de captação de glicose quantificando a porcentagem verde da área total usando o limite no ImageJ (ou qualquer outro pacote de software semelhante).
Resultados Representativos
Pureza e fenótipo hSATMVEC
O hSATMVEC isolado de pacientes controle (ou seja, aquelas pessoas sem história de doença cardiometabólica) foi de 99,5% CD31+CD144+CD45- na citometria de fluxo (Figura 2). O hSATMVEC isolado tinha uma morfologia semelhante a paralelepípedos típica de CEs ( Figura 3A ). Os hSATMVECs tiveram um tempo médio de duplicação da população de 56,6 h ± 8,1 h (média ± SEM, n = 10) (Figura 3B), e a replicação ativa do DNA em hSATMVECs foi confirmada usando um kit de imagem de proliferação celular ( Figura 3C ).
hSATMVEC se comportou como MVECs funcionais e formou tubos em Matrigel (Figura 3D). A expressão relativa das proteínas-chave envolvidas na via de sinalização da insulina Akt-eNOS é mostrada na Figura 3E. Tanto os eNOs quanto a Akt demonstraram aumentos na fosforilação induzida pela insulina, representada como a razão entre proteína fosforilada e proteína total normalizada para ß-actina (Figura 3E).
co-cultura de hSATMVEC-adipócitos
Um modelo ilustrativo de co-cultura de hSATMVEC-adipócitos pode ser visto na Figura 4A. À medida que os pré-adipócitos brancos subcutâneos humanos se tornam mais diferenciados, nota-se o desenvolvimento de vacúolos lipídicos ( Figura 4B ), que pode ser quantificado pela coloração Oil Red O ( Figura 4B ).
O contraste de fase ilustrativo e a imagem de fluorescência (excitação 440-480 nm / emissão 504-544 nm) de adipócitos diferenciados após 30 minutos de incubação com 20 μM de glicose 2-NBD são mostrados na Figura 4C. A captação de glicose pode ser quantificada medindo a área verde como uma porcentagem da área total da célula.
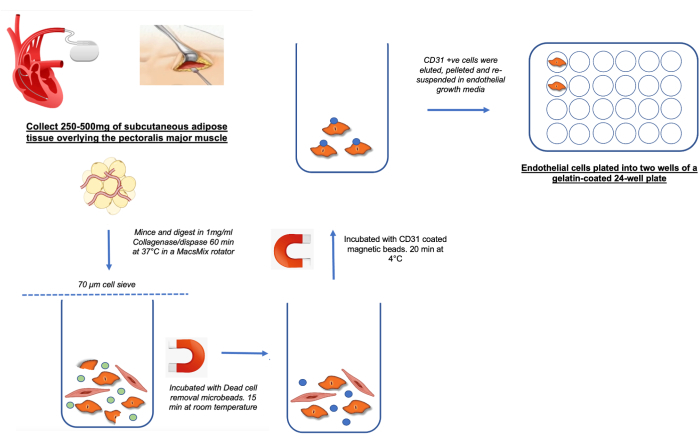
Figura 1: Esquema demonstrando a coleta e processamento de hSATMVECs Clique aqui para ver uma versão maior desta figura.
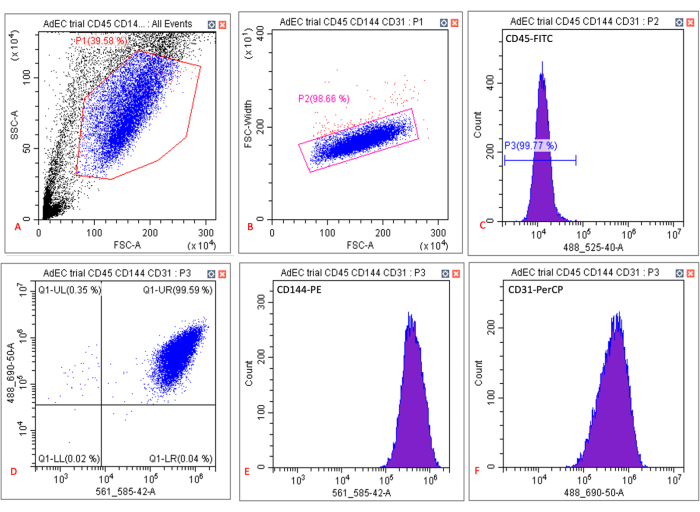
Figura 2: Saída típica da análise de citometria de fluxo de hSATMVECs cultivados. (A) Gráfico de dispersão da área de dispersão lateral (SSC-A) e área de dispersão direta (FSC-A) mostrando gating (caixa vermelha) de hSATMVECs cultivados em torno da densidade populacional de células específicas. (B) Gráfico de dispersão da largura de dispersão direta (FSC-Width) e FSC-A mostrando gating (caixa vermelha) de hSATMVECs cultivados em torno da densidade populacional de células específicas. (C) Histograma mostrando fluorescência de células fechadas para CD45-FITC. (D) Gráfico de dispersão da intensidade de fluorescência de CD144-PE (eixo x) e CD31-PerCP (eixo y). (E) Histograma mostrando fluorescência de células fechadas para CD144-PE. (F) Histograma mostrando fluorescência de células fechadas para CD31-PerCP. Clique aqui para ver uma versão maior desta figura.
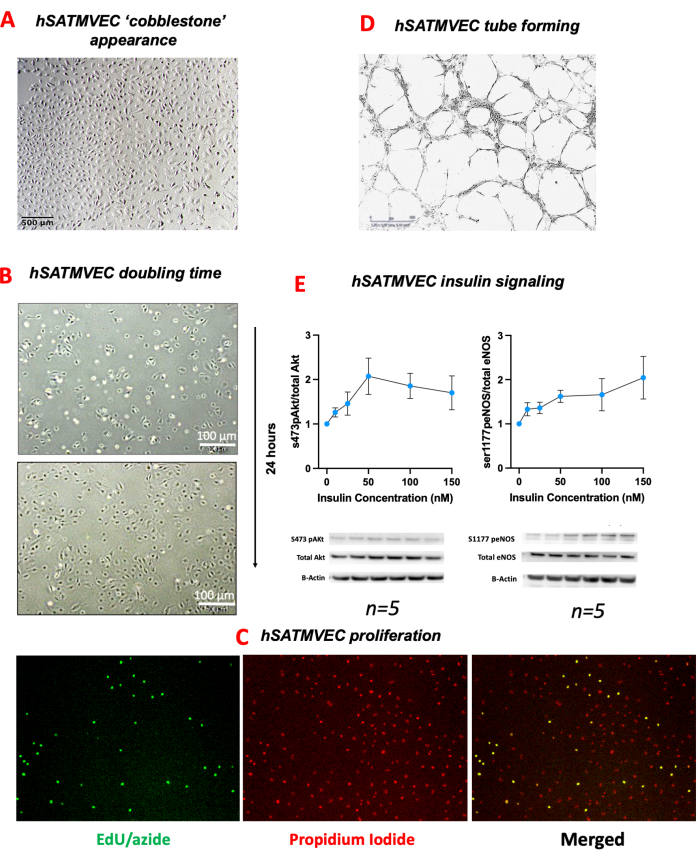
Figura 3: fenótipo hSATMVEC. (A) Imagem de microscopia óptica de hSATMVEC perto da confluência mostrando aparência de paralelepípedo. (B) tempo de duplicação do hSATMVEC - Microscopia de luz do HATEC realizada com 24 h de intervalo, demonstrando a extensão da proliferação celular. (C) proliferação de hSATMVEC. Microscopia de fluorescência de hSATMVEC com iodeto de propídio e EdU/Alexa-fluor 488 de indivíduos controle. (D) Formação de tubo hSATMVEC de indivíduos de controle (imagens tiradas com ampliação de 4x). (E) Estimulação com insulina de HATECs - mostrando expressão relativa de Akt fosforilada (serina 473) para Akt total (painel esquerdo) eNOS fosforilada (serina 1177) para eNOS total (painel direito) em concentrações crescentes de insulina com western blots ilustrativos abaixo padronizado para B-actina. Os dados são mostrados como média ± SEM. Os tamanhos das amostras estão abaixo de cada painel. Abreviaturas: 5-Etinil-2'-desoxiuridina (EdU), células endoteliais microvasculares do tecido adiposo subcutâneo humano (hSATMVEC), erro padrão da média (SEM). Clique aqui para ver uma versão maior desta figura.
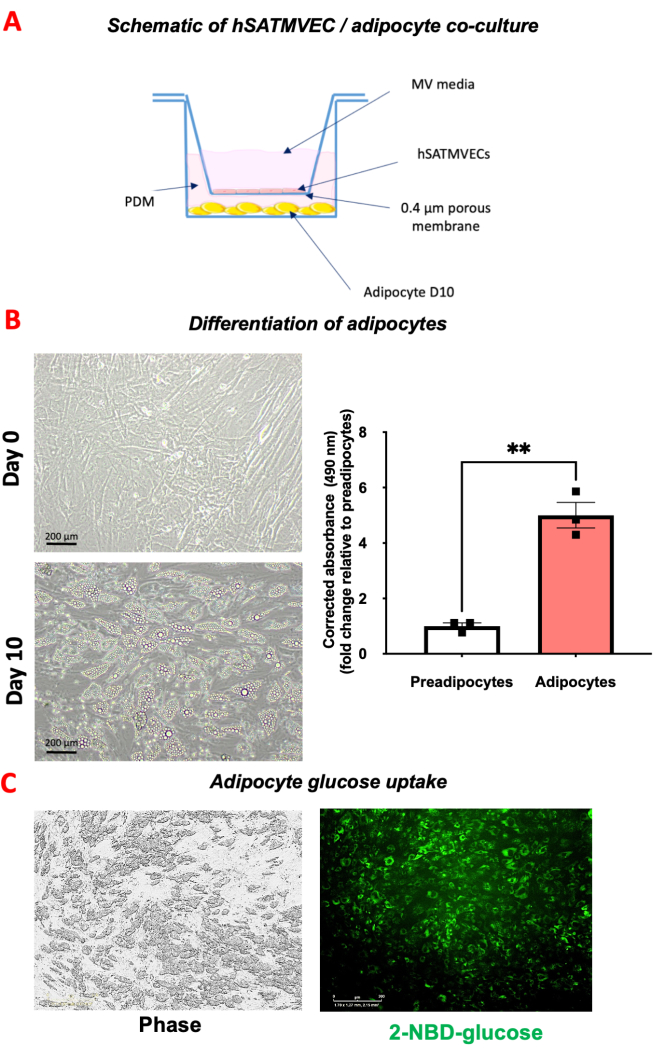
Figura 4: co-cultura de hSATMVEC-adipócitos. (A) Imagem esquemática da co-cultura de hSATMVEC-adipócitos. (B) Diferenciação de adipócitos. O painel esquerdo mostra os pré-adipócitos no dia 0 e o painel direito mostra os adipócitos diferenciados no dia 10 após a adição de PDM. A figura inferior mostra a quantidade de lipídios armazenados em adipócitos e pré-adipócitos corados com Oil Red O. (C) Ensaio de captação de glicose. O painel esquerdo mostra imagens de fase de adipócitos após co-cultura e incubação com 20 μM de glicose 2-NBD por 30 min. O painel direito mostra imagens verdes a partir das quais a captação de glicose (como % verde da área total) pode ser quantificada. Os dados são mostrados como média ± SEM. Abreviaturas: Dia 10 (D10), células endoteliais microvasculares do tecido adiposo subcutâneo humano (hSATMVEC), meios de diferenciação de pré-adipócitos (PDM) Clique aqui para ver uma versão maior desta figura.
Tabela Suplementar 1: Coquetel de coloração para citometria de fluxo. Clique aqui para baixar este arquivo.
Discussão
Este estudo descreve uma técnica de isolamento de hSATMVEC retirado do SAT durante a implantação de rotina de DCEIs. Demonstramos que o isolado hSATMVEC tem alta pureza, expressa proteínas transmembranares específicas para EC CD144 e CD31 e não apresenta expressão significativa do leucócito CD45. Continuamos mostrando que, de maneira reprodutível e confiável, o hSATMVEC isolado prolifera e pode ser usado experimentalmente para estudar a maquinaria intracelular envolvida na sinalização da insulina e na angiogênese. Além de serem capazes de cultivá-los isoladamente, eles também podem ser usados em co-cultura para estudar a diafonia hSATMVEC-adipócito.
As células endoteliais usadas em pesquisas básicas e translacionais são comumente provenientes de grandes vasos, como a aorta e a veia umbilical humana, ou microvasculatura. Essas fontes têm suas respectivas limitações 7,8; As células endoteliais de grandes vasos são de difícil acesso (no caso do tecido aórtico) ou são derivadas de tecido neonatal com fisiologia e exposição ambiental potencialmente diferentes9. O uso de células endoteliais isoladas de tecido retirado durante a implantação do DCEI permite a investigação e experimentação da fisiologia celular em grupos específicos de pacientes do mundo real. Os DCEI são implantados para uma variedade de indicações, inclusive em pacientes com bradiarritmias, insuficiência cardíaca e prevenção primária e secundária de taquiarritmias ventriculares10. Esses pacientes geralmente têm múltiplas comorbidades, incluindo diabetes, obesidade e doença arterial coronariana, que são um dos principais focos globais de pesquisa cardiovascular 11,12,13. Além disso, embora os dados ilustrativos neste artigo se refiram a pacientes de controle, aplicamos essas técnicas para isolar e estudar o SATMVEC de uma variedade de pacientes, incluindo aqueles com insuficiência cardíaca avançada e/ou diabetes mellitus tipo 2.
Não raramente, encontramos problemas com baixos rendimentos de hSATMVEC após a tentativa de isolamento celular. Esse risco pode ser significativamente reduzido usando um volume inicial maior de SAT para isolar hSATMVEC. Além disso, encontramos isso com mais frequência no SAT de pessoas com doença cardiometabólica e, em particular, diabetes.
Uma limitação dessa técnica é que o hSATMVEC isolado só pode sofrer um número limitado de passagens. Em nossa experiência após a passagem 5, independentemente do fenótipo do paciente, a proliferação de hSATMVEC diminui significativamente. Além disso, hSATMVEC isolados usando esta técnica não proliferam bem quando muito escassamente povoados; portanto, recomendamos não passar hSATMVEC em uma proporção maior que 1:6. conforme mencionado na página 1. Descongelamos e reanimamos com sucesso o hSATMVEC armazenado em nitrogênio líquido por até 4 anos e, em nossa experiência, a chance de reanimação é maior quando criopreservado em um número de passagem menor (geralmente criopreservamos hSATMVEC na passagem 2).
O tecido retirado na inserção do DCEI está disponível gratuitamente e pode ser colhido sem prejuízo para o paciente. Portanto, uma fonte de fácil acesso e relativamente não invasiva de células endoteliais desses grupos de pacientes é de grande benefício na realização de pesquisas direcionadas. Embora as imagens representativas neste artigo sejam derivadas de pacientes "controle" (ou seja, pacientes sem diagnóstico de insuficiência cardíaca ou diabetes, embora com indicação de implantação de DCEI), isolamos, cultivamos e co-cultivamos com sucesso SATMVECs de pacientes com insuficiência cardíaca, diabetes e uma combinação dessas patologias. Além disso, essas técnicas também podem ser aplicadas a outros leitos microvasculares, incluindo o músculo esquelético, e atualmente estamos otimizando um modelo de diafonia do músculo esquelético MVEC-miócitos.
Os hSATMVECs podem ser isolados de tecido humano retirado no momento da inserção do DCEI e são de pureza suficiente para serem usados experimentalmente para estudar a disfunção microvascular e a conversa cruzada entre células endoteliais e adipócitos em pessoas com e sem doença cardiometabólica.
Divulgações
A SS recebeu apoio não financeiro, honorários de palestrantes e honorários da AstraZeneca. RC recebeu honorários de palestrante da Janssen Oncology. O OIB recebeu honorários de palestrante da Novartis.
Agradecimentos
Somos muito gratos ao Departamento de Bioimagem da Faculdade de Ciências Biológicas (Universidade de Leeds, Reino Unido) pelo uso da instalação de citometria de fluxo, que foi apoiada pelo financiamento do Conselho de Pesquisa em Biotecnologia e Ciências Biológicas (BBSRC BB / R000352 / 1). O SS foi apoiado por uma bolsa de treinamento em pesquisa clínica da British Heart Foundation (FS / CRTF / 20/24071). CL foi apoiado por uma bolsa de doutorado da British Heart Foundation (FS / 19/59/34896). O LDR foi apoiado pelo prêmio Diabetes UK RD Lawrence Fellowship (16/0005382). A RMC foi apoiada por uma bolsa de pesquisa clínica intermediária da British Heart Foundation (FS / 12/80/29821). MTK é professor de pesquisa cardiovascular e diabetes da British Heart Foundation (CH / 13/1/30086) e possui uma bolsa do programa British Heart Foundation (RG / F / 22 / 110076)
Materiais
| Name | Company | Catalog Number | Comments |
| 170L CO2 Incubator | GS Biotech | 170G-014 | |
| 2-NBDG (2-(N-(7-Nitrobenz-2-oxa-1,3-diazol-4-yl)Amino)-2-Deoxyglucose) | Invitrogen | N13195 | |
| 4% PARAFIX buffered histological fixative | VWR Chemicals | PRC/R/38/1 | |
| Akt (tAkt) Rabbit 1:1000 | Cell Signalling Technology | 9272 | |
| BD Venflon Pro Safety 14 g x 45 mm, Orange, 50/pk | Medisave | 393230 | |
| Bovine Serum Albumin solution, 7.5% | Merck | A8412-100ML | |
| CD144 (VE-Cadherin) Antibody, anti-human, PE, REAfinity | Miltenyi Biotec | 130-118-495 | |
| CD31 Antibody, anti-human, PerCP-Vio 700, REAfinity | Miltenyi Biotec | 130-110-811 | |
| CD31 MicroBead Kit, human, 1 kit | Miltenyi Biotec | 130-091-935 | |
| CD45 Antibody, anti-human, FITC, REAfinity | Miltenyi Biotec | 130-110-769 | |
| Cell Extraction Buffer | Invitrogen | FNN0011 | |
| Centrifuge 5804 R | Eppendorf | 5805000060 | |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 488 dye | Invitrogen | C10337 | Cell proliferation imaging kit |
| Collagenase/Dispase, 500 mg | Roche/Merck | 11097113001 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | Corning | 354230 | Basement Membrane Matrix |
| Corning 100 mm TC-treated Culture Dish | Corning | 430167 | |
| Costar 24-well Clear TC-treated Multiple Well Plates, Individually Wrapped, Sterile | Corning | 3526 | |
| Costar 6-well Clear TC-treated Multiple Well Plates, Individually Wrapped, Sterile | Corning | 3516 | |
| CytoFLEX S – 4 laser flow Cytometer | Beckman | ||
| Dead Cell Removal Kit | Miltenyi Biotec | 130-090-101 | |
| Dulbecco′s Phosphate Buffered Saline | Merck | D8537-500ML | |
| EASYstrainer Cell sieve for 50 mL tubes, 70 µm mesh, Blue, sterile, 50/pk | Greiner Bio-One | 542070 | |
| Endothelial Cell Growth Medium MV | PromoCell | C-22020 | |
| Eppendorf Safe-Lock micro test tubes | Merck | EP0030120094 | |
| Ethylenediaminetetraacetic acid solution | Merck | E8008-100ML | |
| Falcon 24 Well TC-Treated Cell Polystyrene Permeable Support Companion Plate, with Lid, Sterile, 1/Pack, 50/Case | Appleton Woods | CF537 | |
| Falcon Permeable Support for 24 Well Plate with 0.4 µm Transparent PET Membrane, Sterile, 1/Pack, 48/Case | Appleton Woods | CF521 | |
| Freezing Medium Cryo-SFM | PromoCell | C-29912 | |
| Gelatin solution, 2% in water | Merck | G1393-100ML | |
| Gibco Antibiotic-Antimycotic (100x), 100mL | Fisher Scientific | 11570486 | |
| Gibco TrypLE Select Enzyme (1x), no phenol red | Fisher Scientific | 12563029 | |
| Hanks′ Balanced Salt solution | Merck | H6648-500ML | |
| Human Subcutaneous Preadipocyte Cells | Lonza | PT-5020 | |
| Incucyte ZOOM | Essen BioScience | Live-cell analysis system | |
| Insulin solution human | Merck | I9278-5ML | |
| LS Columns, 25/pk | Miltenyi Biotec | 130-042-401 | |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| MACS Tissue Storage Solution | Miltenyi Biotec | 130-100-008 | |
| MACSmix Tube Rotator | Miltenyi Biotec | 130-090-753 | Tube Rotator |
| MS Columns, 25/pk | Miltenyi Biotec | 130-042-201 | |
| NuPAGE 4–12% Bis-Tris Gel | Invitrogen | NP0322BOX | |
| OctoMACS Separator | Miltenyi Biotec | 130-042-109 | |
| PGM-2 Preadipocyte Growth Medium-2 BulletKit | Lonza | PT-8002 | |
| Phospho (Ser1177) eNOS Rabbit 1:1000 | Cell Signalling Technology | 9570 | |
| Phospho-Akt (Ser473) Rabbit 1:1000 | Cell Signalling Technology | 4060 | |
| Pre-Separation Filters 30 µm, 50/pk | Miltenyi Biotec | 130-041-407 | |
| Propidium Iodide (PI)/RNase Staining Solution | Cell Signalling Technology | 4087 | |
| QuadroMACS Separator | Miltenyi Biotec | 130-090-976 | |
| Scalpel Disposable Sterile Style 10 | VWRI | 501 | |
| Screw cap tube, 15 ml, (LxØ): 120 x 17 mm, PP, with print | Sarstetd | 62.554.502 | |
| Screw cap tube, 50 ml, (LxØ): 114 x 28 mm, PP, with print | Sarstedt | 62.547.254 | |
| Screw cap tube, 50 ml, (LxØ): 114 x 28 mm, PP, with print | Sarstetd | 62.547.254 | |
| Total eNOS Mouse 1:1000 | BD Biosciences | 610297 | |
| Triton X-100, BioUltra, for molecular biology | Merck | 93443-500ML | |
| β-Actin (C4) Mouse 1:5000 | Santa Cruz Biotechnology | Sc-47778 |
Referências
- Bierhansl, L., et al. Central role of metabolism in endothelial cell function and vascular disease. Physiology. 32 (2), 126-140 (2017).
- Aird, W. C. Endothelial cell heterogeneity. Cold Spring Harb Perspect Med. 2 (1), a006429 (2012).
- Rajendran, P., et al. The vascular endothelium and human diseases. Int J Biol Sci. 9 (10), 1057-1069 (2013).
- Brown, O. I., Bridge, K., Kearney, M. T. Nicotinamide adenine dinucleotide phosphate oxidases in glucose homeostasis and diabetes-related endothelial cell dysfunction. Cells. 10 (9), 2315 (2021).
- Luk, C., Haywood, N. J., Bridge, K. I., Kearney, M. T. Paracrine role of the endothelium in metabolic homeostasis in health and nutrient excess. Front Cardiovasc Med. 26 (9), 882923 (2022).
- . Click-iT EdU Imaging Kits Available from: https://www.thermofisher.com/document-connect/document-connect.html?url=https://assets.thermofisher.com/TFS-Assets%2FLSG%2Fmanuals%2Fmp10338.pdf (2024)
- Bouïs, D., et al. Endothelium in vitro: A review of human vascular endothelial cell lines for blood vessel-related research. Angiogenesis. 4 (2), 91-102 (2001).
- Ades, E. W., et al. HMEC-1: establishment of an immortalized human microvascular endothelial cell line. J Invest Dermatol. 99 (6), 683-690 (1992).
- Chi, J. T., et al. Endothelial cell diversity revealed by global expression profiling. Proc Natl Acad Sci U S A. 100 (19), 10623-10628 (2003).
- Brignole, M., et al. 213 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. Eur Heart J. 34 (29), 2281-2329 (2013).
- Greenspon, A. J., et al. Trends in permanent pacemaker implantation in the United States from 1993 to 2009: Increasing complexity of patients and procedures. J Am Coll Cardiol. 60 (16), 1540-1545 (2012).
- Mendis, S. A., Alwan, A. . Prioritized Research Agenda for Prevention and Control of Noncommunicable Diseases. , (2011).
- Brown, O. I., et al. Relationship among diabetes, obesity, and cardiovascular disease phenotypes: A UK biobank cohort study. Diabetes Care. 46 (8), 1531-1540 (2023).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados