Eletroforese Capilar (CE)
Visão Geral
Fonte: Laboratório da Dra.B. Jill Venton - Universidade da Virgínia
A eletroforese capilar (CE) é uma técnica de separação que separa moléculas em um campo elétrico de acordo com o tamanho e a carga. Ce é realizado em um pequeno tubo de vidro chamado capilar que é preenchido com uma solução de eletrólitos. Os analitos são separados devido a diferenças na mobilidade eletroforética, que varia de acordo com carga, viscosidade solvente e tamanho. A eletroforese tradicional em géis é limitada na quantidade de tensão que pode ser aplicada porque os efeitos de aquecimento de Joule arruinarão o gel e a separação. Os capilares têm uma grande relação superfície-área-volume e, assim, dissipam melhor o calor. Portanto, as tensões aplicadas para um experimento de eletroforese capilar são bastante grandes, muitas vezes de 10.000 a 20.000 V.
A eletroforese capilar é útil para separações de alto desempenho. Em comparação com a cromatografia líquida, as separações ce são muitas vezes mais rápidas e eficientes. No entanto, a eletroforese capilar funciona melhor para separar moléculas carregadas, o que não é uma limitação da cromatografia líquida. A CE tem uma capacidade máxima maior do que a cromatografia líquida de alto desempenho (HPLC), o que significa que as separações são mais eficientes e mais picos podem ser detectados. A instrumentação pode ser muito simples. No entanto, o HPLC é mais versátil e muitas fases estacionárias e móveis foram desenvolvidas para diferentes tipos de moléculas.
Princípios
A eletroforese capilar separa moléculas devido às suas mobilidades eletroforéticas. A mobilidade eletroforética de uma molécula depende de sua carga e do quanto ela é atraída ou repelida pela tensão, bem como pela força de arrasto de atrito que resiste ao movimento. O atrito é proporcional ao raio da molécula. Assim, a mobilidade eletroforética é baseada no tamanho e na carga. A velocidade que uma molécula carregada viaja por um capilar é o produto de sua mobilidade eletroforética e do campo elétrico aplicado. Tensões mais altas, portanto, levam a velocidades mais rápidas e separações mais rápidas.
A maioria dos instrumentos de eletroforese capilar são configurados com a tensão negativa na extremidade do detector e a tensão positiva na entrada. Isso significa que moléculas carregadas positivamente migram para o cátodo no final, enquanto moléculas carregadas negativamente migram para o outro lado. Todas as moléculas são vistas no detector, no entanto, porque há um fluxo de fluido a granel chamado fluxo eletroosmótico. A ordem de migração é, portanto, positivamente carregada, neutra e, em seguida, moléculas carregadas negativamente.
O fluxo eletroosmótico é causado pela aplicação de uma alta tensão a um pequeno capilar de vidro cheio de uma solução de sal. Os íons carregados positivamente na solução de sal formam uma camada dupla com os grupos de silanol carregados negativamente nas paredes do vidro. Quando uma tensão negativa é aplicada na extremidade do capilar, ela puxa os cáations da camada dupla, que também puxa a solução ao seu redor devido às forças de atrito. Este tipo de fluxo é em forma de plug-in e leva a menos ampliação de banda do que os plugues de fluxo em forma de parabólica do HPLC.
Moléculas neutras fluem na mesma velocidade do fluxo eletroosmótico. No entanto, uma fase pseudo-estacionária pode ser adicionada ao buffer de execução para formar micelas que as moléculas podem dividir dentro e fora. Uma fase pseudo-estacionária típica é o dodecylsulfato de sódio. As micelas são carregadas negativamente do lado de fora, então elas têm uma mobilidade eletroforética, então o tempo gasto na micela determina o tempo de migração. Esta forma de eletroforese capilar é chamada de cromatografia eletrocinética micelar (MEKC).
A detecção em CE é semelhante à do HPLC. UV-Vis é geral e não requer marcação enquanto a molécula tiver uma ligação dupla. No entanto, a absorvância depende do comprimento do caminho, que é pequeno para um capilar de 50 μm. Uma célula bolha ou célula z aumentará o comprimento do caminho. Fluorescência induzida por laser é um método de detecção mais sensível. Um laser é brilhado através de uma janela na capilaridade e fluorescência do produto medido. Embora a fluorescência forneça sensibilidade muito alta, geralmente requer que as moléculas sejam marcadas porque a maioria não é fluorescente. Detecção eletroquímica e detecção de espectrometria de massa eletrospray estão ganhando popularidade. O problema com qualquer um desses detectores é que a alta tensão da separação deve ser levada ao solo antes da detecção, pois eletroquímica e eletrospray requerem a aplicação de uma tensão e a tensão CE pode interferir. Novos métodos de desacoplamento da tensão CE, utilizando eletrodos para drenar a corrente ou uma pequena rachadura no capilar, estão superando esses desafios.
Procedimento
1. Configuração de instrumentação CE
- Ligue o instrumento CE e o computador. Usando o software do computador, ligue a fonte de luz para análise UV para permitir que ele se aqueça. Alguns softwares têm um indicador quando a lâmpada está pronta para uso (o ícone da lâmpada vira cor).
- Faça um arquivo de métodos. Defina os parâmetros importantes para a execução do CE. Nesta análise, as temperaturas do cartucho e do armazenamento da amostra são de 35 °C. O comprimento de onda para detecção de UV é de 214 nm.
- Escreva um programa de tempo. O programa geralmente consiste em passos de lavagem (para limpar o capilar antes da análise), passos de injeção e, em seguida, um passo de eletroforese. Para a etapa de lavagem, realize 2 enxágües por 1 min usando 20 psi de pressão. A primeira lavagem é com NaOH, que ajuda a garantir que os grupos de silanol na parede capilar sejam desprodoados. A segunda lavagem é com buffer de execução (tampão de 0,025 M de borate aqui) para garantir que o capilar seja deixado equilibrado com buffer.
- Para a injeção, a injeção de pressão é usada a 0,5 psi para 5 s.
- Para o passo da eletroforese, as condições são tensão de separação: 20 kV, tempo: 5 min, polaridade normal. Para cada etapa, indique também qual frasco é a entrada e qual frasco é a saída. Salve o arquivo de métodos depois que todos os parâmetros forem inseridos.
2. Preparação das Normas e Amostras de Refrigerante
- Faça soluções de estoque de 500 ppm de aspartame, cafeína e ácido benzoico na água. Faça 50 mL de cada um, usando um frasco volumoso.
- Faça uma solução padrão de 150 ppm aspartame, 150 ppm de cafeína e 100 ppm de ácido benzoico em um frasco volumoso de 10 mL.
- Faça soluções padrão de cafeína de 50 ppm, 100 ppm, 150 ppm e 200 ppm em frascos volumosos de 10 mL.
3. Execute as amostras no CE
- Coloque os frascos contendo normas ou amostras de refrigerante no porta-frascos de amostra. Certifique-se de anotar qual amostra está em qual slot. Dois slots têm o buffer de execução de borate e a solução de enxaguante NaOH de 0,1 M.
- No arquivo do método, entrada que slot o primeiro frasco de amostra está dentro
- Adquira uma única execução, certificando-se de inserir todas as informações de dados que o programa solicita.
- Continue a adquirir dados, alterando o frasco de entrada para cada amostra. Execute o padrão de combinação, as 3 concentrações de cafeína, e uma amostra pepsi e pepsi diet.
- Insira o alvo no instrumento e escolha o instrumento apropriado.
- Analise os dados no computador. Calcule as áreas de pico e os padrões de sobreposição e amostras reais para ajudar a identificar picos. Faça uma curva de calibração para os dados da cafeína.
Resultados
Eletroferogramas coletados para amostras diet pepsi e pepsi são mostrados nas Figuras 1 e 2, respectivamente. Os três picos de cafeína, aspartame e ácido benzoico são observados na Pepsi diet e têm tempos de migração semelhantes aos padrões. Para a Pepsi normal, o pico da cafeína está presente, mas não os picos de aspartame e ácido benzoico. A análise ce é rápida, pois os tempos de migração são de apenas 3 a 4 minutos.
A curva de calibração para cafeína é mostrada na Figura 3. Esta curva pode ser usada para calcular a concentração de cafeína em cada amostra.
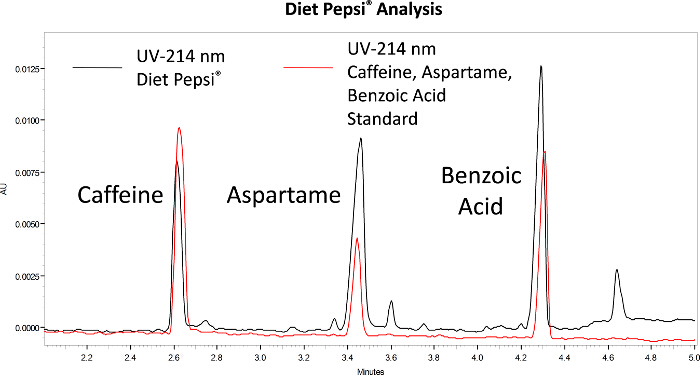
Figura 1. Análise CE da Diet Pepsi. O vermelho são padrões de cafeína, aspartame e ácido benzoico. O preto é uma amostra diet pepsi. Clique aqui para ver uma versão maior desta figura.
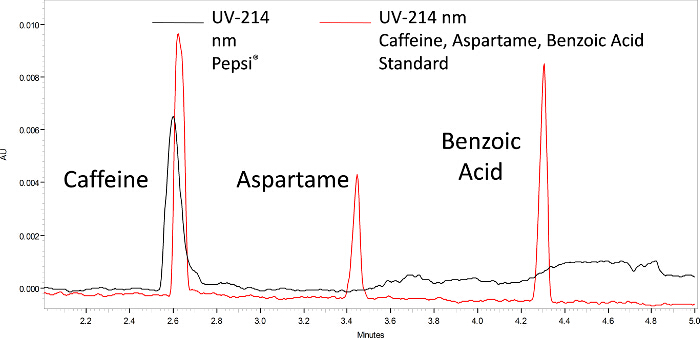
Figura 2. Análise CE da Pepsi. O preto é uma amostra de Pepsi, enquanto o vermelho é uma amostra de padrões de cafeína, aspartame e ácido benzoico. Não há aspartame ou ácido benzoico, indicando que o refrigerante não é dieta. Clique aqui para ver uma versão maior desta figura.
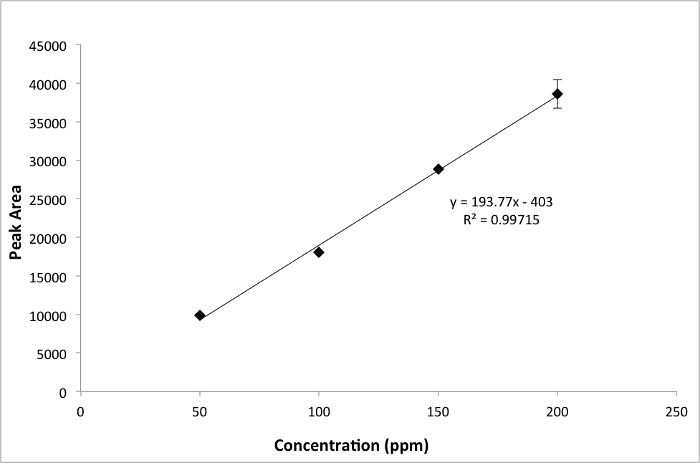
Figura 3. Gráfico de calibração da cafeína com CE. Um parcela da área de pico versus concentração para padrões de cafeína medidos com CE. Clique aqui para ver uma versão maior desta figura.
Aplicação e Resumo
A eletroforese capilar é usada para muitas separações especiais. Por exemplo, é usado na indústria farmacêutica para testes de qualidade, para se certificar de que não há produtos laterais ou interferentes. Ce é particularmente útil para separar drogas com um grupo de amino básico, pois as paredes do capilar podem ser neutras com um pH ácido e, portanto, a droga não vai grudar no capilar.
Um modo de CE também foi usado para sequenciar o genoma humano e separar o DNA. Este modo de CE é eletroforese de gel capilar e para essas separações, um polímero é injetado no capilar ce. O polímero dá um modo adicional de separação com base no tamanho, já que os fragmentos menores podem viajar mais rápido através do gel. Isso é chamado de peneira, e junto com a separação eletroforética, tem 1 resolução de par de base para análise de DNA.
Pular para...
Vídeos desta coleção:

Now Playing
Eletroforese Capilar (CE)
Analytical Chemistry
94.2K Visualizações

Preparação da Amostra para Caracterização Analítica
Analytical Chemistry
85.1K Visualizações

Normas Internas
Analytical Chemistry
205.2K Visualizações

Método de adição de padrão
Analytical Chemistry
320.5K Visualizações

Curvas de calibração
Analytical Chemistry
798.2K Visualizações

Espectroscopia ultravioleta-visível (UV-Vis)
Analytical Chemistry
624.7K Visualizações

Espectroscopia raman para análise química
Analytical Chemistry
51.4K Visualizações

Fluorescência de raios X (XRF)
Analytical Chemistry
25.8K Visualizações

Cromatografia gasosa (GC) com detecção por ionização em chama
Analytical Chemistry
282.7K Visualizações

Cromatografia Líquida de Alta Eficiência (HPLC)
Analytical Chemistry
385.5K Visualizações

Cromatografia de troca iônica
Analytical Chemistry
264.8K Visualizações

Introdução à Espectrometria de Massa
Analytical Chemistry
112.6K Visualizações

Microscopia Eletrônica de Varredura (MEV)
Analytical Chemistry
87.3K Visualizações

Medições eletroquímicas de catalisadores suportados usando um potenciostato/galvanostato
Analytical Chemistry
51.7K Visualizações

Voltametria Cíclica (CV)
Analytical Chemistry
125.7K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados