Espectroscopia infravermelha
Visão Geral
Fonte: Vy M. Dong e Zhiwei Chen, Departamento de Química da Universidade da Califórnia, Irvine, CA
Este experimento demonstrará o uso de espectroscopia infravermelha (IR) (também conhecida como espectroscopia vibracional) para elucidar a identidade de um composto desconhecido identificando o(s) grupo funcional presente. Os espectros de RI serão obtidos em um espectrômetro de RI utilizando a técnica de amostragem total atenuada (ATR) com uma amostra pura do desconhecido.
Princípios
Uma ligação covalente entre dois átomos pode ser pensada como dois objetos com massas m1 e m2 que estão conectados com uma mola. Naturalmente, este vínculo se estende e comprime com uma certa frequência vibracional. Esta frequência 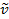 é dada pela Equação 1,onde k é a constante de força da mola, c é a velocidade da luz, e μ é a massa reduzida(Equação 2). A frequência é tipicamente medida em números de ondas, que são expressas em centímetros inversos (cm-1).
é dada pela Equação 1,onde k é a constante de força da mola, c é a velocidade da luz, e μ é a massa reduzida(Equação 2). A frequência é tipicamente medida em números de ondas, que são expressas em centímetros inversos (cm-1).
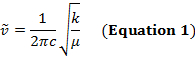
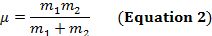
Da Equação 1,a frequência é proporcional à força da mola e inversamente proporcional às massas dos objetos. Assim, as ligações C-H, N-H e O-H têm frequências de alongamento mais altas do que as ligações C-C e C-O, já que o hidrogênio é um átomo de luz. Títulos duplos e triplos podem ser considerados como molas mais fortes, de modo que um vínculo duplo C-O tem uma frequência de alongamento maior do que um vínculo único C-O. A luz infravermelha é radiação eletromagnética com comprimentos de onda que variam de 700 nm a 1 mm, o que é consistente com as forças relativas da ligação. Quando uma molécula absorve a luz infravermelha com uma frequência que equivale à frequência vibracional natural de uma ligação covalente, a energia da radiação produz um aumento na amplitude da vibração da ligação. Se as eletronegatividades (a tendência de atrair elétrons) dos dois átomos em uma ligação covalente são muito diferentes, ocorre uma separação de carga que resulta em um momento dipolo. Por exemplo, em uma ligação dupla C-O (um grupo carbonyl), os elétrons passam mais tempo em torno do átomo de oxigênio do que o átomo de carbono porque o oxigênio é mais eletronegativo do que o carbono. Portanto, há um momento de dipolo líquido resultando em uma carga negativa parcial sobre o oxigênio e uma carga positiva parcial sobre o carbono. Por outro lado, uma alkyne simétrica não tem um momento de dipolo líquido porque os dois momentos individuais de dipolo de cada lado se cancelam. A intensidade da absorção infravermelha é proporcional à mudança no momento do dipolo quando a ligação se estende ou comprime. Assim, um trecho de grupo carbonyl mostrará uma faixa intensa no IR, e uma alkyne interna simétrica mostrará uma pequena, se não invisível, banda para alongamento da ligação tripla C-C(Figura 1). A Tabela 1 mostra algumas frequências de absorção características. A Figura 2 mostra o espectro ir de um éster Hantzsch. Observe o pico em 3.343 cm-1 para a ligação única N-H e o pico em 1.695 cm-1 para os grupos carbonyl. Neste experimento, é utilizada a técnica de amostragem ATR, onde a luz infravermelha reflete a amostra que está em contato com um cristal ATR várias vezes. Normalmente, são utilizados materiais com alto índice de refração, como germânio e selenida de zinco. Este método permite examinar diretamente analitos sólidos ou líquidos sem maiores preparações.
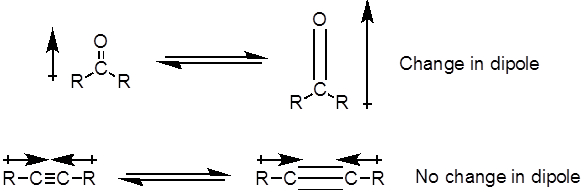
Figura 1. Diagrama mostrando C-O duplo eC-Ctriplo laços ea mudança resultante no momento do dipolo.
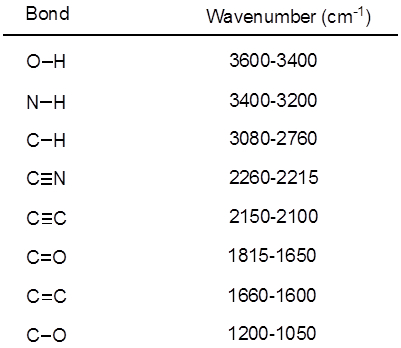
Mesa 1. Frequências de IR características de ligações covalentes presentes em moléculas orgânicas.
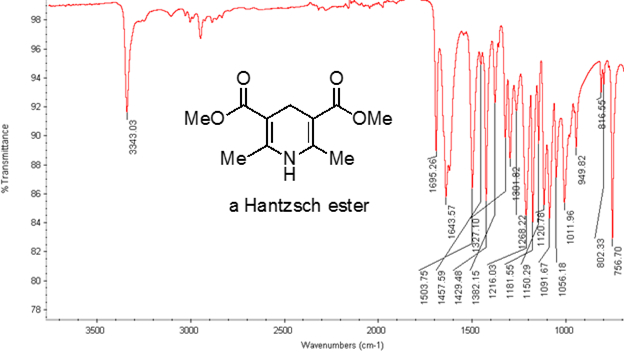
Figura 2. Espectro ir de um éster Hantzsch.
Procedimento
- Ligue o espectrômetro ir e deixe-o aquecer.
- Obtenha uma amostra desconhecida do instrutor e regise a letra e aparência da amostra.
- Colete um espectro de fundo.
- Usando uma espátula metálica, coloque uma pequena quantidade de amostra sob a sonda.
- Torça a sonda até que ela se esixe no lugar.
- Regisso espectro ir da amostra desconhecida.
- Repita se necessário para obter um espectro de boa qualidade.
- Regissão de absorção indicativa dos grupos funcionais presentes.
- Limpe a sonda com acetona.
- Desligue o espectrômetro.
- Analise o espectro obtido. A Figura 3 mostra os possíveis candidatos à amostra desconhecida. Adseou a provável identificação da amostra desconhecida.

Figura 3. Diagrama mostrando as possíveis identidades do desconhecido.
Resultados
Tabela 2: Aparência e frequências de RI observadas dos compostos listados na Figura 3.
| Número composto | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Aparência | líquido claro | branco sólido | líquido claro | líquido claro | líquido claro | líquido claro | líquido amarelo | branco sólido | branco sólido | líquido claro |
| Frequências observadas (cm-1) | 1691, 1601, 1450, 1368, 1266 |
2773, 2730, 1713, 1591, 1576 |
2940, 2867, 1717, 1422, 1347 |
3026, 2948, 2920, 1605, 1496 |
2928, 2853, 1450, 904, 852 |
3926, 3315, 2959, 2120, 1461 |
3623, 3429, 3354, 2904, 1601 |
3408, 3384, 3087, 1596, 1496 |
3226, 2966, 1598, 1474, 1238 |
3340, 2959, 2861, 1468, 1460 |
Aplicação e Resumo
Neste experimento, demonstramos como identificar uma amostra desconhecida com base em seu espectro de RI característico. Diferentes grupos funcionais dão diferentes frequências de alongamento, que permitem a identificação dos grupos funcionais presentes.
Como mostrado neste experimento, a espectroscopia ir é uma ferramenta útil para o químico orgânico identificar e caracterizar uma molécula. Além da química orgânica, a espectroscopia de IR tem aplicações úteis em outras áreas. Na indústria farmacêutica, essa técnica é utilizada para análise quantitativa e qualitativa de medicamentos. Na ciência dos alimentos, a espectroscopia ir é usada para estudar gorduras e óleos. Por fim, a espectroscopia de RI é utilizada para medir a composição de gases de efeito estufa, ou seja,CO2,CO, CH4e N2O em esforços para compreender as mudanças climáticas globais.
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados