17.5 : Стандартное изменение энтропии для реакции
Энтропия является функцией состояния, поэтому стандартное изменение энтропии для химической реакции (ΔS°rxn) может быть рассчитано на основе разницы в стандартной энтропии между продуктами и реагенты.
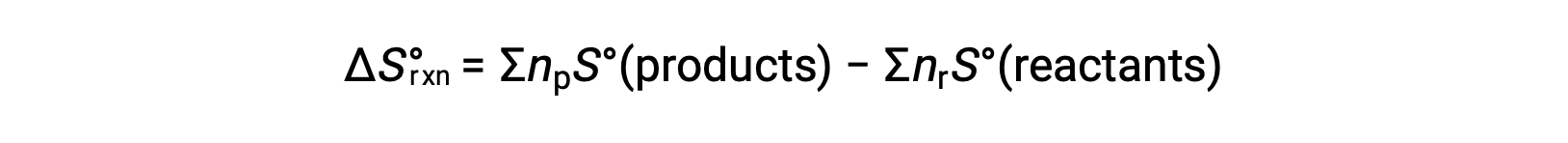
где np и nr представляют стехиометрические коэффициенты в сбалансированном уравнении продуктов и реагенты соответственно.
Например, ΔS°rxn для следующей реакции при комнатной температуре
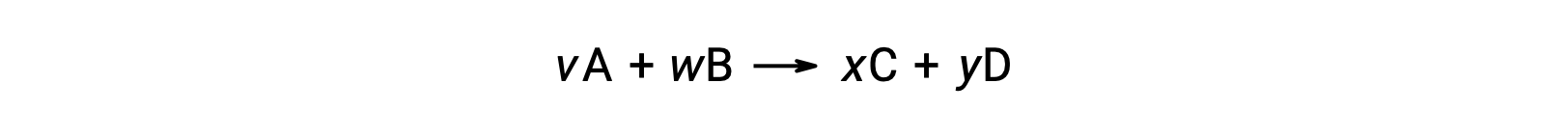
рассчитывается следующим образом:
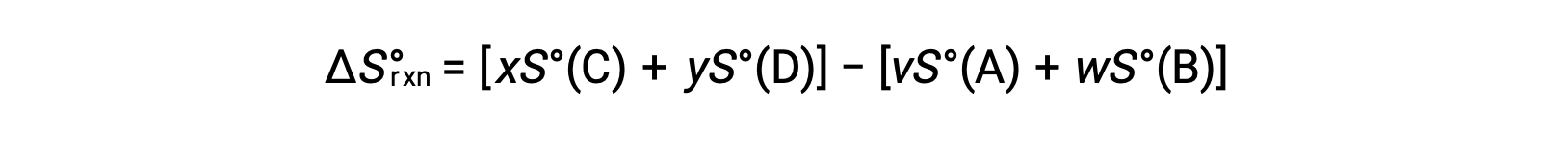
В таблице приведен частичный список стандартных энтропий.
| Вещества | S° (ДЖ/МОЛЬ·K) |
| C (s, графит) | 5.740 |
| C (s, ромб) | 2.38 |
| CO (г) | 197.7 |
| CO2 (г) | 213.8 |
| CH4 (г) | 186.3 |
| C2H4 (g) | 219.5 |
| C2H6 (г) | 229.5 |
| CH3OH (л) | 126.8 |
| C2H5OH (l) | 160.7 |
| H2 (г) | 130.57 |
| H (г) | 114.6 |
| H2O (г) | 188.71 |
| H2O (л) | 69.91 |
| HCI (г) | 186.8 |
| H2S (г) | 205.7 |
| O2 (г) | 205.03 |
Определение ΔS°
Рассмотрим конденсацию воды, при которой 1 моль газообразной H2O превращается в 1 моль жидкости H2O.
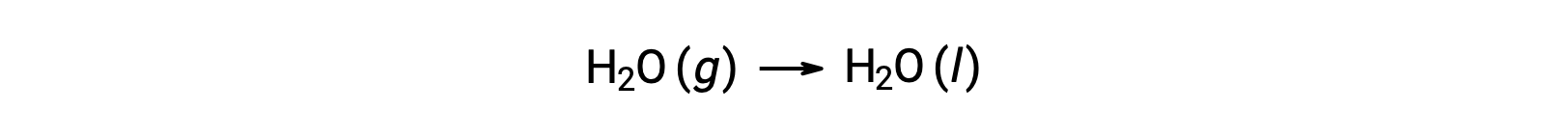
Стандартные изменения энтропии для реакции, ΔS°rxn рассчитываются с использованием стандартных молярных энтропий и стехиометрических коэффициентов.
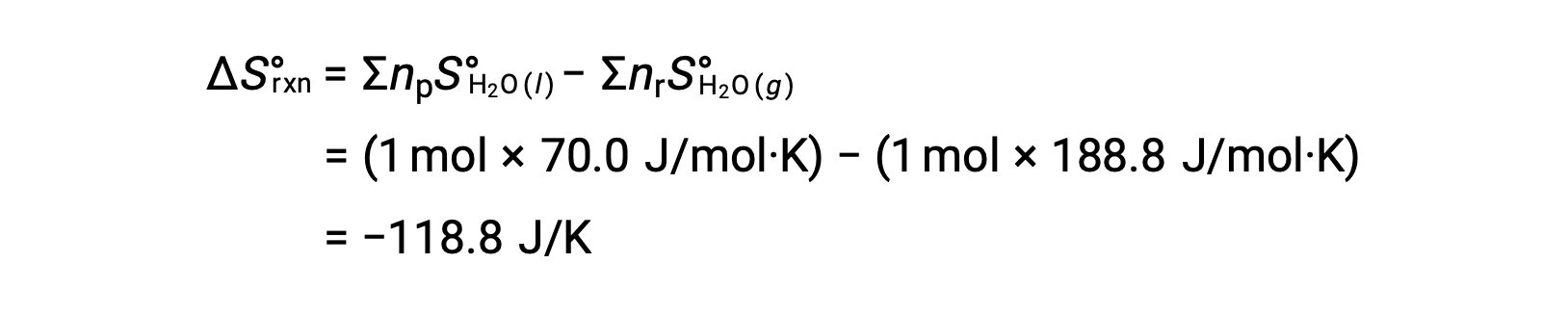
Значение для ΔS°rxn отрицательное, как ожидается для этого фазового перехода (конденсации).
В качестве второго примера рассмотрим сгорание метанола CH3OH:
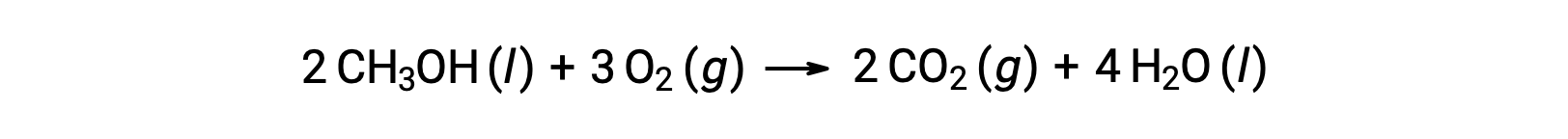
Эта же процедура используется для расчетастандартной энтропии изменения реакции:
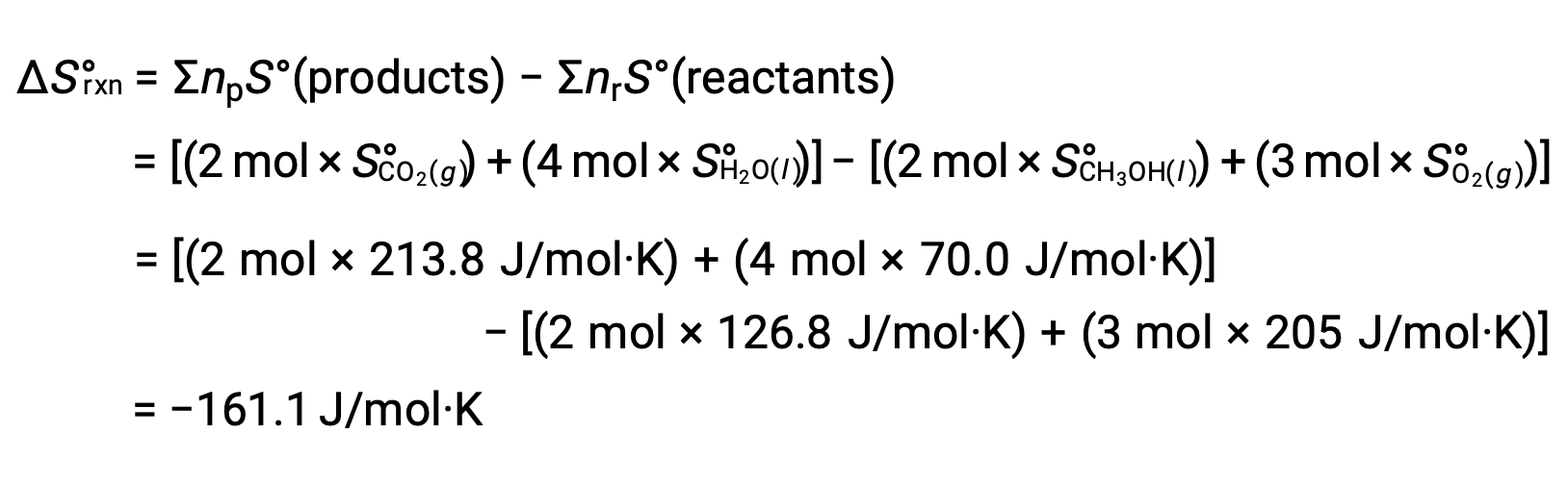
Этот текст адаптирован к Openstax, Химия 2е изд., Глава 16.2: Второй и третий Закон термодинамики.
Авторские права © 2025 MyJoVE Corporation. Все права защищены
