Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Опробование Способность к диффузии сигнальных молекул переориентировать Эмбриональные спинного спаечный Аксоны
Резюме
Этот тест оценивает способность сигнальной молекулы, здесь костные морфогенетические белки 7 (BMP7), переориентировать спаечный аксонов. Эксплантов эмбриональной спинной спинного мозга выращиваются прилегающих к совокупности COS клетки, секретирующие факторы роста кандидата. Переориентация спаечный аксонов, растущее внутри эксплантатов визуализируются по иммуногистохимии.
Аннотация
Спинной спаечный аксонов в спинном мозге позвоночных 1 были неоценимую системы модель, в которой для выявления сигналов аксонов руководства. Здесь мы описываем в пробирке анализ ", переориентация анализа", который широко используется для изучения влияния внешних и внутренних сигналов от ориентации спаечный аксонов 2. Этот анализ был разработан многочисленный народ в лабораториях Джейн Додд, Томас Jessell и Эндрю Ламсден (см. благодарность за более подробной информацией) и версии данного анализа были использованы для демонстрации переориентации деятельности ключевых молекул, руководство аксонов, в том числе БМП chemorepellent в потолочной панелью 3,4 и chemoattractive деятельности Netrin1 5 и Еж Соник (SHH) 6 в пол пластины в спинном мозге.
Эксплантов включающий 2-3 сегментов спинного две трети спинного мозга расчлененное из эмбриональных день (E) 11 крыс и культивировали в трехмерном гели коллагена 7. E11 спинной спинного эксплантов содержать новорожденного спаечный нейронов, которые могут быть идентифицированы по их аксонального выражение гликопротеин, Tag1 8. В течение 30-40 часов в культуре, спаечный траектории аксона воспроизводятся в этих спинной эксплантов со временем конечно же, увидеть в естественных условиях. Это аксонального траектория может быть обжаловано путем размещения либо тест ткани или совокупности COS ячейки выражения кандидата сигнальной молекулы в контакте с одной из боковых краев спинной эксплантов. Спаечный аксонов расширения в непосредственной близости от добавляется ткань будет расти под влиянием как эндогенных пластины крыши и сигналы от внематочной боковой ткани. Степень, в которой спаечный аксоны переориентированы в этих условиях могут быть определены количественно. С помощью этого теста, можно и рассмотреть достаточность определенный сигнал для переориентации спаечный аксонов 3,4, а также необходимость для этого сигнала, чтобы направить спаечный траектории 9.
протокол
Часть 1: Подготовка агрегатов трансфицированных клеток COS использованием висячие капли
- Семенной COS-7 (COS) клеток в 35 блюдах культуры. Когда они достигают 80% слияния, трансфекции 1 мкг выражения плазмиды в клетки с помощью Lipofectamine2000 в соответствии с протоколом производителя с.
- Для подготовки висят капли, аспирация трансфекции средних и промыть трансфицированных клеток COS с 1 мл 1 раз фосфатным буферным раствор (PBS). Лечить клеток с 0,5 мл фермента без клеточной диссоциации среду в течение 15 минут. Добавить 1 мл раствора Opti-MEM + 1x пенициллина / стрептомицина / Глютамин (P / S / G) + 10% эмбриональной телячьей сыворотки (FBS), чтобы остановить реакцию.
- Измельченного в порошок клетки, чтобы удалить их с поверхности культуры блюдо и передачи в 15 мл коническую трубку. Спиновые в течение 2 минут при 2000K для осаждения клеток. Удалить супернатант и ресуспендируют осадок в 100 мкл Opti-MEM + 1x P / S / G + 10% FBS.
- Пятно несколько капель 20 мкл на внутренней стороне крышки 35 мм блюдо культуры, инвертировать крышку и положите сверху дно тарелки и оставьте в 37 ° C инкубаторе в течение нескольких часов, пока клетки совокупности.
Часть 2: Подготовка Спинной спинного эксплантов шнура
- Рассеките эмбрионов E11 крысы из матки матери и держать на льду в среду L15 пока нет необходимости.
- С заостренными вольфрамовой иглой, удалить 4-6 сегмента участке от ствола каждого эмбриона, из области непосредственно под почка передней конечности. Использование пластиковой пипеткой, собирают ткань штук в одной скважине 4-а Nunc блюдо и держать на льду.
- Когда все сегменты эмбриона были рассеченные, использовать пластиковые пипетки для передачи части в решении 1мл L15 + 1 мг dispase во второй яме Nunc блюдо. Инкубируйте при комнатной температуре в течение не более 5 минут. Не более инкубировать ткани куски dispase.
- Во время инкубации, добавить 0,5 мл тепла инактивированной нормальной сыворотки козьего (HIGS) до примерно 10 мл L15 в чашку Петри и водоворот перемешать. Передача 1 мл этого раствора в третьей скважины из Nunc блюдо и передачи части ткани в этот раствор при инкубации закончился. Держите на льду. Примечание: последующие вскрытие будет легче, если ткань частей разрешено "отдохнуть" на льду в течение часа.
Часть 3: Грунтовка Коллаген
- Добавить 40μl 10x Минимальная Основные среднего до 360μl коллаген, смесь быстро и тщательно, щелкая или кратко вортексе трубки. Спином вниз быстро picofuge. Решение будет желтый. Держите на льду как можно больше.
- Добавьте достаточно 0.8M бикарбоната натрия (NaHCO 3), чтобы включить раствора коллагена слегка оранжевым (см. примечание ниже). Опять же, смесь быстро и тщательно, щелкая, и со спином вниз кратко в picofuge. Если раствор остается розовым после смешивания, вы добавили слишком много NaHCO 3 и придется начать снова с новой трубки коллагена.
- На данный момент коллагена решение загрунтовать. Он будет оставаться жидкой на льду, но будет способствовать укреплению в течение примерно 5 минут (розовеющие), когда довести до комнатной температуры.
- Пятно 20 мкл коллагена в каждую лунку 4-а Nunc блюдо. Использование кончиком пипетки, раскинувшийся коллагена для формирования малых "площадку". Пусть коллагена набора при комнатной температуре.
Примечание: точное количество NaHCO 3 необходимо титровать для каждой партии коллагена. Начните с маленьких (11μl), а затем добавить 1 мкл 0,5-ступенчатый пока раствор не станет легким оттенком оранжевого цвета. "Правильный" размер, как правило, 1UL меньше, чем наименьшее количество NaHCO 3, который превратил бы коллагена розовый. Количество NaHCO 3 не масштабируется линейно вверх или вниз.
Часть 4: Препарирование Спинной спинного мозга и эксплантов Позиционирование из них с COS клеточных агрегатов в коллагеновой матрице
- Использование свежей заостренные иглы вольфрама и пару тонких щипцов (# 5 и # 55), удалите мезодермы окружающие спинной мозг.
- Резка параллельно полу тарелку с вольфрамовой иглой, осторожно удалите вентральной пятая часть спинного мозга.
- Делить пополам спинной спинного эксплантов, убедившись, что ребра, как чисто сократить, насколько возможно. Повторно обрежьте края, если это необходимо. Передача каждого спинной спинного эксплантов на отдельные колодки коллагена использованием рот пипеткой оснащены стеклянной капиллярной трубке вытащил прим. 0,5 мм в диаметре.
- Сокращение совокупного трансфицированных клеток COS на квадраты примерно такой же ширины, как и боковые края спинной спинного эксплантов.
- Трансфер одного из этих квадратов на коллагеновой пластины с спинной спинного эксплантов, используя рот пипеткой.
- С рот пипеткой, аспирация лишнюю жидкость использованием рот пипеткой. Не более аспирации.
- Применить 4μl загрунтованных коллагена на площадку, и, используя вольфрамовой иглы, Перемещать коллагена за эксплантов без прямого касания ткани. Перемещая вольфрамовой иглой в коллаген окружающих эксплантов, ориентироваться эксплантов, так что совокупный COS клеток, прилегающих к боковой кромке спинной спинного эксплантов.
- После коллагена установил, повторите применение 4μl коллагена для того, чтобы эксплантов полностью заключен в коллаген.
- В капотом культуры ткани, добавить 0,5 мл Opti-MEM + 1xP/S/G и культуры в течение 30-40 часов.
- Fix эксплантатов в течение 45 минут с 0,5 мл 4% параформальдегида в 1xPBS, держа пластину на льду.
- Промыть два раза с 0,5 мл блокирование решения 1xPBS + 0,1% Triton-X100 +1% HIGS (PBTN). Блок на 4 ° С, по крайней мере пару часов, ночной инкубации является предпочтительным, а затем процесс иммуногистохимии.
Часть 5: Визуализация спаечный Аксоны по Immunohistochemistry
- После блокировки в PBTN, вырезать эксплантов из 4-луночный планшет с щипцами и место в 48-луночного блюдо.
- Добавить 200 мкл первичных антител в каждую лунку и оставить на ночь при 4 ° C. Для визуализации спаечный аксонов, используйте 1:06 решением мыши анти-Tag1 антител. Чтобы определить, трансфекции была успешной, также включают первичные антитела против любой сигнальной молекулы проходят испытания, или соответствующие эпитопа если сигнальная молекула была эпитопа помечены.
- Вымойте каждый образец в течение 5 х 1 час в PBTN при 4 ° C.
- Добавить 200 мкл вторичных антител в каждую лунку и оставить на ночь при 4 ° C. Если анти-Tag1 антитела были использованы в качестве первичного антитела, используйте козьи антитела IgM мыши вторичные антитела связаны либо FITC или Cy3. При использовании светочувствительных вторичные антитела связаны с FITC или Cy3, держать 48-луночного блюдо покрыты фольгой с этого момента.
- Вымойте каждого образца 5 х 1 час каждый в PBTN при 4 ° C.
- Передача эксплантов на 3-и депрессии слайд, удалить лишнюю жидкость, смонтировать в Vectashield средних и покровное. Хранить в свет сейф на любой 4 ° С или -20 ° C.
Часть 6: Представитель Изображения эксплантов
В успешный эксперимент, эксплантов и COS совокупности останутся рядом друг с другом, а не отдаляться друг от друга, как коллаген множеств. Там будут минимальными разрастание аксонов; значительное аксонального разрастание означает, что спинной спинного эксплантов культивировали слишком долго. Там не будет пузырьков, растущих из эксплантов; blebbing происходит, если ткань вступает в непосредственный контакт с питательной среды.
Способность сигнальной молекулы переориентировать аксонов оценивается с помощью конфокальной микроскопии. Степень аксон переориентация может быть определена количественно путем измерения средний угол переориентации аксонов ближе всего к совокупности COS ячейка 3. Как показано на рисунке 1, COS клеток, экспрессирующих Myc с метками BMP7 (синий) переориентировать Tag1 + спаечный аксонов (зеленый) от источника BMP7 (рис. 1В) подобно тому, которым эксплантов крыши пластины отталкивает спаечный аксонов (рис. 1А). COS клеток, экспрессирующих борьбе с переносчиками не влияют на ориентацию спаечный аксонов 3,4. Эти эксплантов были помечены антитела против фактора транскрипции Isl1 / 2 (красный), который украшает моторных нейронов спинного и интернейронов. Этот результат был первый признак того, что член семьи посредником BMP деятельности потолочной панели chemorepellent 3.
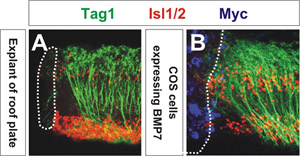
Рисунок 1: Пожалуйста, нажмите здесь , чтобы видеть большую версию рисунке 1.
Обсуждение
Критические факторы, которые определяют успех в выполнении этого теста во-первых, ткань не следует относиться с dispase слишком длительного периода, такое лечение может привести к ткань становится очень липким и снизившись жизнеспособность. Два, коллагена должны быть идеально загрунтова...
Благодарности
Этот протокол был разработан в лабораториях Джейн Додд, Томас Jessell и Эндрю Ламсден. Многие люди, в том числе Конрад Basler, Энн Calof, Томас Эдлунд, Фил Гамильтон, Домна Karagogeos, Ариэль Руис я Altaba и Toshiya Ямада определяется как культура эксплантов спинного мозга в коллагене. Марыся Плачека и Марк Тессье-Лавинь впервые методика использования аксон рост в пробирке из эксплантов в качестве средства идентификации молекул аксон руководства. Работа в Батлер лаборатории поддержана грантами марте Dimes и R01 NS063999 из NIH / NINDS.
Материалы

Ссылки
- Altman, J., Bayer, S. A. . The development of the rat spinal cord. , (1984).
- Placzek, M. Tissue recombinations in collagen gels. Methods in molecular biology. , 325-335 (2008).
- Augsburger, A., Schuchardt, A. BMPs as mediators of roof plate repulsion of commissural neurons. Neuron. 24, 127-141 (1999).
- Butler, S. J., Dodd, J. A role for BMP heterodimers in roof plate-mediated repulsion of commissural axons. Neuron. 38, 389-401 (2003).
- Kennedy, T. E., Serafini, T. Netrins are diffusible chemotropic factors for commissural axons in the embryonic spinal cord. Cell. 78, 425-435 (1994).
- Charron, F., Stein, E. The morphogen sonic hedgehog is an axonal chemoattractant that collaborates with netrin-1 in midline axon guidance. Cell. 113, 11-23 (2003).
- Lumsden, A. G., Davies, A. M. Chemotropic effect of specific target epithelium in the developing mammalian nervous system. Nature. 323, 538-539 (1986).
- Dodd, J., Morton, S. B. Spatial regulation of axonal glycoprotein expression on subsets of embryonic spinal neurons. Neuron. 1, 105-116 (1988).
- Yamauchi, K., Phan, K. D., Butler, S. J. BMP type I receptor complexes have distinct activities mediating cell fate and axon guidance decisions. Development. 135, 1119-1128 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены