Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Создание первичных культурах фибробластов взрослых от грызунов
В этой статье
Резюме
В этой статье описывается протокол для изоляции и обслуживание первичных культурах фибробластов из кожи и ткани легких диких грызунов.
Аннотация
Важность использования первичных элементов, а не линии раковых клеток, для биологических исследований становится широкое признание. Первичные элементы являются предпочтительными при исследовании клеточного цикла управления, апоптоза и репарации ДНК, как раковые клетки нести мутации в генах, участвующих в этих процессах. Первичные элементы не могут быть культурными бесконечно из-за наступления старения репликативной или aneuploidization. Таким образом, новые культуры должны быть созданы на регулярной основе. Процедура выделения грызунов эмбриональных фибробластов хорошо известна, но изоляция взрослых культур фибробластов часто представляет проблему. Взрослых фибробластов грызунов изолированы от мышиных моделях болезни человека может быть предпочтительным контроль при сравнении их от человеческих фибробластов пациентов. Кроме того, взрослые фибробласты только материал при работе с дикими грызунами, где беременные самки не могут быть легко получены. Здесь мы предлагаем протокол для изоляции и культуры взрослых фибробластов из кожи грызунов и легких. Мы использовали эту процедуру успешно изолировать фибробластов из более чем двадцати видов грызунов от лабораторных мышей и крыс диких грызунов, таких как бобр, дикобраз, и белки.
протокол
1. Перед началом работы
- Стерилизовать ножницы и пинцет с 70% этанола.
- Место малой магнитной мешалкой внутри 30 мл стакан, залить двумя слоями фольги, и автоклав.
- Подготовка 28 Вунш ЕД / мл исходного раствора Liberase Blendzyme 3 в стерильной воде. Сделать 0,5 мл аликвоты и замораживают при температуре -20 ° C. Оттепель новых аликвоту перед каждым использованием. Решение может появиться облачно после размораживания. Vortex решение пока не станет ясно.
- Разминка СМИ культуре клеток.
2. Подготовка животных Пример
Внимание: дикие животные могут содержаться патогенные микроорганизмы, такие как вирус бешенства. Всегда быть в курсе открытых острых предметов.
- Усыпить животное и место каркаса при 4 ° C. Лучше всего использовать туши сразу же, однако, если это невозможно, таких как, если животные собираются в поле, туши может быть использован в течение 24 часов. После 24 часов снижается ячейки доходности.
- Рассеките животное в хирургическом люкс или в капот химические (не в ткани капот культуры).
- Подмышками область удобный сайт для сбора образцов кожи, как подмышки кожа тоньше, содержит меньше жира и меха менее плотной. Чистый разрез сайта с 70% этанола. Убедитесь, что мех пропитывается этанолом.
- Бритье меха вокруг разреза с острым скальпелем. Бритье большую площадь, чем желаемый разреза. Постарайтесь свести к минимуму сокращения к коже. Спрей области с 70% этанола и дайте ему высохнуть.
- Для сбора акцизного образец кожи фрагмент примерно на 1 см 2. Pinch кожи с тканью щипцы, и вырезать ножницами. Постарайтесь, чтобы не порезать жировой слой с кожи, а жир мешает коллагеназы пищеварения. Для сбора образцов легких, мыть области груди на 70% этанола, и открыть кожи на груди с помощью ножниц, сделав Т-образный разрез и потянув за исключением полы кожи. Вымойте открыл мышц области с 70% этанола и дайте высохнуть. Вырезать грудной клетки стерильные щипцы и ножницы (используйте кость фрезы для крупных животных). Используйте стерильные методы, чтобы избежать загрязнения внутренних органов. Не прикасайтесь к внутренним органам с инструментами, которые затрагивали шерсть животных. Вырезать легких фрагментов примерно 1 см 2, используя стерильные щипцы и ножницы.
- Место фрагментов ткани в 50 мл стерильного труб с PBS, чтобы избежать высыхания.
- Мойте за пределами 50 мл трубки с фрагментами тканей с этанолом, и взять их на капот культуры ткани.
- Правильно распоряжаться туши животного.
3. Извлечение Клетки
- Передача фрагментов тканей в 10 см культуре ткани блюдо использованием стерильного скальпеля. Не передавайте слишком много PBS с образцом.
- Вырезать ткани в ~ 1 мм части, используя два скальпеля. Используйте два лезвия использованием ножниц, начиная от центра и вытягивать друг от друга. Держите ткани сжатой вверх, не режут по частям. Когда резки достаточно кожи напоминает замазку, он не будет разделяться на куски, но будет растягиваться тонкий. Легочной ткани легче резать, и он будет разделиться на мелкие кусочки.
- Использование скальпеля, передача вырезать ткань в стерильные 30 мл стакан с стерильных мешалкой. Промыть пластины используются для резки ткани с 10 мл DMEM/F12 СМИ с 0,14 единиц Вунш / мл Liberase Blendzyme 3 и 1X антибиотик / противогрибковым и добавить решение в стакан 30 мл с фрагментов тканей.
- Обложка стакан с стерильную пленку, и инкубировать при 37 ° С, помешивая, в течение 30 до 90 минут. Длина инкубации зависит от типа и вида ткани. Будьте осторожны, не за-дайджест ткани. Лучшая урожайность достигается при фрагментов тканей по-прежнему присутствуют в конце пищеварения. Кожа занимает больше времени, чтобы переварить, чем легких. Кожа из крупных животных требуется больше времени, чтобы переварить. Проверьте пищеварения через 30 минут, а затем каждые 10 мин. Когда кожа пищеварения завершения СМИ мутнеет и кожицы отделены друг от друга, а по краям фигур становятся "нечеткой". Легкое пищеварение должно быть прекращено, когда легкие фрагменты меняют цвет от красного до белого, и приступить к формированию липкие волокна.
- Внесите раствор, содержащий фрагменты ткани вверх и вниз, разорвать сгустки. Перенесите раствор в стерильные 50 мл трубки. Если фрагменты легко перемещаться через 10 мл пипетки резки и пищеварение было сделано хорошо. Промыть стакан 3 раза по 10 мл теплой DMEM/F12 средств массовой информации с 15% FBS, 1X антибиотик / противогрибковым и добавить информации к 50 мл трубки с фрагментами тканей. Закрыть 50 мл трубки и смешать обращением несколько раз. FBS в СМИ остановится Liberase пищеварения.
- Спиновые на 524 г в размахивая ведром культуре ткани центрифуги в течение 5 мин. Удалить супернатант. Ресуспендируют гранул в 10 мл теплой DMEM/F12 средств массовой информации с 15% FBS, 1X антибиотик / противогрибковым. Внесите подвеска смаксимальное усилие на разрыв ткани штук.
- Добавьте еще 30 мл DMEM/F12 средств массовой информации с 15% FBS, 1X антибиотик / противогрибковым, перемешать и центрифуге при 524 г в размахивая ведром культуре ткани центрифуги в течение 5 мин. Повторите еще раз, чтобы удалить следы Liberase.
- Ресуспендируют гранул в 10 мл DMEM/F12 средств массовой информации с 15% FBS, 1X антибиотик / противогрибковым и трансфер в 10 см ткани блюдо культуры и место в культуре ткани инкубаторе при температуре 37 ° C, 5% СО 2, 3% O 2 .
- Проверьте пластины каждый день в течение фибробластов и СМИ цвета. Если изоляция была успешной, фибробласты выползать из фрагментов тканей и приложить к пластинке (рис. 1). Фибробласты начинают выхода фрагментов тканей в течение 2-5 дней.
- Если цвет средства массовой информации изменения в желтый, это указывает на возможное загрязнение или переполненных клетках. Изучить плит под микроскопом при большом увеличении. Если бактерии, грибки, глисты или присутствуют отклонения пластин (это редко проблема с лабораторными животными, однако может возникнуть, когда образцы собираются от диких). Если нет загрязнение присутствует, но СМИ изменили цвет, это вызвано либо слишком много клеток, или слишком много фрагментов тканей, расположенных в одной тарелки. Если более 60% пластина покрыта прилагается фибробластов, изменение средств массовой информации на пластине и передачи фрагментов тканей с новой пластинки с новыми медиа. Если это не так много фибробластов прикреплены к пластине, изменение средств массовой информации и разделить ткани куски 2-4 пластины.
- Через 7 дней, если средства массовой информации не были изменены ранее, изменение средств массовой информации и передачи фрагментов тканей с новой пластинкой с новыми средствами массовой информации.
- Инкубируйте клетки и ткани фрагментов для дополнительных 7 дней. К 14-й день всех жизнеспособных фибробластов вышли из фрагментов тканей.
- Через 14 дней от начала изолятор, отбросить старые средства массовой информации и фрагментов тканей, урожай клеток и пластины их на новую пластинку в 5х10 5 клеток / пластину EMEM с 15% FBS, 1X Пенициллин / стрептомицин, без незаменимых аминокислот и пирувата натрия. EMEM СМИ будут поддерживать рост фибробластов только и другие типы клеток умрет или остановки пролиферации.
- После клетки достигает 80-90% слияния, заморозить аликвоту клеток для использования в будущем.
- Продолжить культивирования клетки путем разделения их на 5х10 5 клеток / пластину, когда клетки достигают 80-90% слияния.
4. Представитель Результаты
Нормальные фибробласты крупные клетки с крупными выступами (lamellipodia) (рис. 2). Фибробласты растут в монослой. Здоровый растущий культура содержит 1-10% в клетках этапе М, признан окружены клетками возвышается над поверхностью пластины, но не отделена от пластины (рис. 3). Как правило, 10 см блюдо с присадками 5х10 5 клеток становится вырожденной в течение 3-4 дней. Время удвоения сильно зависит от вида и может быть больше, для некоторых долгоживущих видов грызунов 1. Когда клетки заполняют пластину они арестовывают распространения в стадии G1. Типичные сливной пластины фибробластов содержит плотно слой клеток (рис. 4). Когда клетки достигают 90% слияния они готовы к расщеплению. При желании, клетки могут быть сохранены на арестованы сливной пластине в течение длительного периода времени с регулярными изменениями среды (один или два раза в неделю).
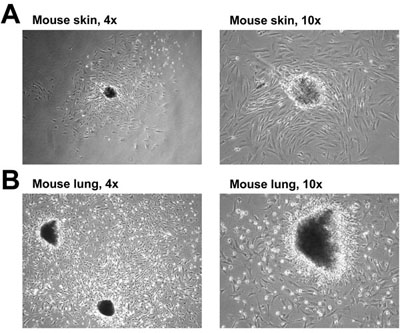
Рисунок 1. Фибробластов мыши изоляции от кожи () и легких (B). СМИ была изменена, чтобы удалить одиноких клеток и мусора до принятия картины на 7 день.

Рисунок 2. Фибробластов мыши легких.
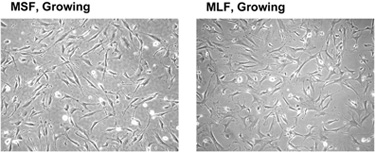
Рисунок 3. Области мышиных фибробластов, содержащих клетки в М-сцены, снятых в 10-кратным увеличением.

Рисунок 4. Сливной пластины фибробластов мыши, сфотографировали на 10-кратным увеличением.
Обсуждение
Нормальная первичных фибробластов обеспечивают прекрасную альтернативу установленном раковых клеток линий в биологических исследованиях. Важным преимуществом является то, что фибробласты, они не несут мутации онкогенов и опухолевых супрессоров и сохранить нетронутым контрольно-п?...
Раскрытие информации
Благодарности
Мы благодарим д-р Стивен Austad за предоставление первой версии этого протокола. Эта работа была поддержана грантами NIH и Эллисон Медицинский фонд В. Г. и А. С.
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM/F12 media | Invitrogen | 11330-032 | |
| Fetal Bovine Serum (FBS), Qualified | Invitrogen | 01437-036 | The Qualified serum had been pre-tested to provide good growth support for primary fibroblasts. |
| Antibiotic/Antimycotic | Invitrogen | 15420-096 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| Liberase TM Research Grade | Roche | 05401127001 | Replacement enzyme. |
| A note from the authors: Since Roche discontinued Liberase Blendzyme 3 (11814184001), they recommend using Liberase TM Research Grade medium Thermolysin (Cat. no. 05401119001 - 10 mg, Cat. no. 05401127001 - 100mg) instead. We have switched to this enzyme successfully with no issues. | |||
| EMEM media | ATCC | 30-203 | The EMEM media from ATCC already contains nonessential amino acids and sodium pyruvate. |
| Feathered #21 disposable, sterile scalpel | Multiple suppliers | ||
| Three Gas Control incubator | Forma or Heraeus | ||
Ссылки
- Seluanov, A. Distinct tumor suppressor mechanisms evolve in rodent species that differ in size and lifespan. Aging . Cell. 7, 813-823 (2008).
- Parrinello, S. Oxygen sensitivity severely limits the replicative lifespan of murine fibroblasts. Nat Cell Biol. 5, 741-747 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены