Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Экспериментальные метастазы и CTL Приемные Передача Иммунотерапия мышиной модели
* Эти авторы внесли равный вклад
В этой статье
Резюме
Экспериментальные метастазы легких и CTL модель мыши иммунотерапии для анализа опухолевых клеток-Т-клеток взаимодействия В естественных условиях.
Аннотация
Экспериментальная модель мыши метастазов является простой, но физиологически соответствующих метастазы модели. Опухолевые клетки вводят внутривенно (IV) в вены хвоста мыши и колонизировать в легкие, тем самым, напоминающие последних этапах опухолевой клетки спонтанного метастазирования: выживание в обращении, экстравазации и колонизации в дистальных отделах органов. С терапевтической точки зрения, экспериментальная модель метастазов является самым простым и идеальной модели с целью лечения часто конечная точка метастазы: созданы метастатической опухоли в дистальных отделах органа. В этой модели, опухолевые клетки вводятся IV в вены хвоста мыши и позволил, чтобы колонизировать и расти в легких. Опухоль конкретных ЦТЛ затем вводят в IV метастазы несущих мыши. Количество и размеры метастазов в легких может контролироваться количество опухолевых клеток, который будет введен и время роста опухоли. Таким образом, различные стадии метастазирования, от минимального к обширным метастазированием метастазы, могут быть смоделированы. Метастазов в легких анализируются инфляции с чернилами, что позволяет легче визуального наблюдения и количественной оценки.
протокол
1. Экспериментальная модель мыши метастазы
- За день до инъекции опухоли клетки, семена один T75 колбе до 1 х 10 7 CMS4-Met клеток в 10 мл RPMI среде, содержащей 10% сыворотки, чтобы получить быстрорастущие опухолевые клетки. Выдержите в течение ночи при температуре 37 ° C.
- В день инъекции, удалять средние и промыть клетки сразу с PBS, то урожай опухолевых клеток с 0,05% трипсина-EDTA при 37 ° С в течение 5 минут. Остановить реакцию с 10 мл RPMI среде, содержащей 10% сыворотки. Передача клетки конической трубе.
- Спином вниз клетки при 1300 оборотов в минуту в центрифуге Sorvall Легенда RT в течение 3 минут при комнатной температуре. Удалить супернатант. Ресуспендируют клеток в 10 мл свежего 1X HBSS мыть, то спином вниз снова и ресуспендируют в том же порядке.
- Граф опухолевых клеток на гемоцитометра. Развести клеток в HBSS, так что клетки, необходимые для каждой инъекции ресуспендируют в общем объеме 100 мкл.
- Теплый 6-8 недельных BALB / с мышами в стакан погружен в теплую воду, чтобы расширить хвостовую вену. Место мыши на фиксатор хвостовую вену на скамейке запасных. Используйте микрошприца вводить по 100 мкл опухолевые клетки в боковых хвостовую вену. Используйте асептики, чтобы избежать инфекции. После инъекции применяются небольшое давление на месте инъекции до остановки кровотечения.
- Вернуться мыши к клетке, и позволяют опухоль вырастет до желаемой стадии.
2. Цитотоксических Т-лимфоцитов (CTL) Приемные Иммунотерапия Трансфер
- В день передачи, пипетки вверх и вниз для ресуспендирования очищенной цитотоксических Т-лимфоцитов, или CTL, приготовленного, как описано в тексте. Передача всех клеток из одной пластины на 15 мл коническую трубку, не дав объем превышать более чем 2 / 3 от трубки.
- Вставьте стерильной пипетки Пастера в коническую трубку и лег лимфоцитов Средний разделения или LSM, в клетках, пока общий объем приближается 14 мл.
- Будьте осторожны, чтобы не нарушать слоев. Центрифуга при 2000 оборотов в минуту в течение 20 минут при комнатной температуре. Не используйте тормоз для замедления ротора после спиннинг.
- Передача ЦТЛ на новые 15 мл коническую трубку. Добавить HBSS до объема приблизительно 10 мл до мытья.
- Граф клеток. Спином вниз при 1300 оборотов в минуту в течение 5 минут при комнатной температуре. Ресуспендируют в HBSS до требуемой плотности клеток для инъекций, сохраняя общий объем на инъекцию в 100 мкл.
- Используйте ту же технику инъекции хвост, как показано выше в этом видео, чтобы придать ЦТЛ в опухоли мышей.
- Вернуться мыши к клетке, и позволяют ЦТЛ взаимодействовать с опухолью. Мыши, как правило, приносится в жертву анализа 14-21 дней после CTL лечения.
3. Визуализация метастазов в легких
- Для визуализации метастазов в легких, место пожертвовал мыши на спину на доску из пенопласта. Pin ноги обеспечить беспрепятственный доступ к трахее. Спрей брюшной стороне с 70% этанола.
- Начиная с середины живота, используйте ножницы, чтобы разрезать вдоль средней линии, через грудную клетку, а вверх, к слюнных желез. Expose трахеи. Используйте пинцет для удаления тканей, окружающих трахею.
- Тема 200 мкл кончиком пипетки под трахеи. Холдинг наконечник с одной стороны, осторожно поднимите трахеи вверх и в сторону от тела.
- Поворот платформы на 180 °. Используйте 50 мл шприца для введения тушь в легкие через трахею. Полностью раздувать легкие с чернилами, пока не почувствуете сильное сопротивление.
- Используйте ножницы, чтобы вырезать трахеи. Слайд пару щипцов при легких и избавить их от мыши. Промыть легких кратко в 1L стакан воды.
- В химический вытяжной шкаф, передача легких стеклянный пузырек сцинтилляционных, содержащий 5 мл раствора Фекете. Опухолевой ткани будет выступать как белый узелки на черном легких после нескольких минут. Опухоли могут теперь быть подсчитаны и хранятся в растворе Фекете на неопределенный срок.
4. Представитель Метастазы в легкие Визуализированные
- Здесь, легкие от мышей, которые были введены с молочной 4T1 рак линии показывают белых пятен указывает опухолей. Мыши, которые были введены с 4T1 клеток, трансфицированных IRF8 доминантно-негативного мутанта K79E показать расширенной метастатический потенциал опухолевых клеток.
- Эти изображения показывают гистологический анализ эффективности CTL приемных иммунотерапии передачи. Опухоли мышей вводили физиологический раствор показала множественные опухоли 6 дней спустя, указывает желтая стрелка (). Мышам вводили опухолеспецифические Т-клетки, с другой стороны, показал сокращение опухоли (B).
- В этом же эксперименте, тушь лечение дает более простой способ измерить эффективность CTL приемных передачи. Здесь, белый узелки опухоли на опухоль легких четко отличать от легких, которые успешно прошли CTL приемных передачи, и подсчет узелки позволяет степениколичественного не представляется возможным с гистологии.
5. Представитель Результаты
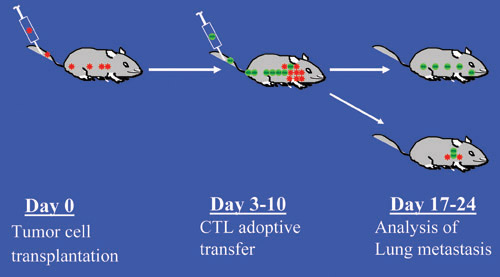
Рисунок 1. Экспериментальная схема экспериментальной опухоли метастазы и CTL передачи адаптивной иммунотерапии мышиной модели. Красными точками отмечены опухолевые клетки и зеленые точки указывают ЦТЛ.
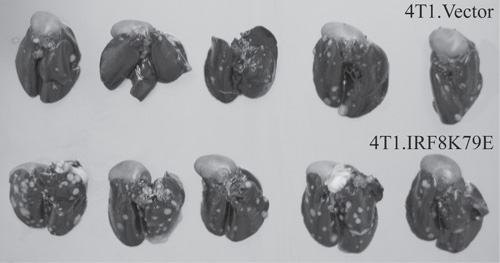
Рисунок 2. Нарушение IRF8 функции расширенной метастатический потенциал опухолевых клеток. Мышь молочной 4T1 рак линия стабильно трансфицированных вектором (4T1.Vector) или векторном выразил IRF8 доминантно-негативного мутанта K79E (4T1.IRF8K79E) (15, 16). Опухолевые клетки вводили в IV мыши боковыми жилками хвост. Опухолями легких были раздуты тушью для визуализации опухоли узелков. Опухоль узелки, как легко видеть, как белые пятна на черном фоне легочной ткани.
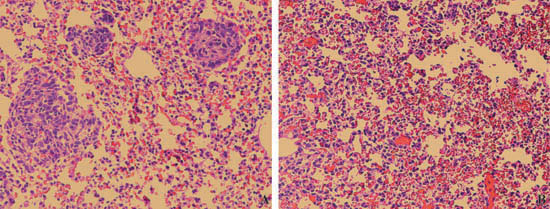
Рисунок 3. Гистологический анализ эффективности CTL приемных иммунотерапии передачи. Мышь саркомы клеточной линии CMS4-Met вводили в IV мыши боковыми жилками хвост. Три дня спустя, физиологический раствор () или опухоль-специфических Т клеток (B) вводили в опухоли мышей. Легкие были проанализированы шесть дней после CTL лечению обычными H & E гистологического окрашивания. Опухоль узелки указаны стрелками.

Рисунок 4. Визуализация опухоли узелки инфляцией тушью. Мышь саркомы клеточной линии CMS4-Met вводили в IV мыши боковыми жилками хвост. Три дня спустя, физиологический раствор (контроль) или опухоль-специфических Т клеток (+ CTL) вводили в опухоли мышей. Легкие были проанализированы четырнадцать дней после CTL лечения. Белые пятна, которые являются опухоли узелки, позволяют легко количественная эффективность CTL лечения.
Раскрытие информации
Мыши были приобретены у Национального института рака (Friderick, MD) и размещены в медицинском колледже объекта животного Грузии. Эксперименты и уход / благосостояния согласуются с федеральными нормами и утвержденного протокола по Медицинского колледжа Джорджии IACUC комитета.
Благодарности
Поддержке грантов от Национального института здоровья (CA133085 в КЛ) и Американского онкологического общества (RSG-09-209-01-ТБГ в КЛ).
Материалы
Решения:
Тушь Решение (17):
- Залить 150 мл дистиллированной воды в 250 мл колбу.
- Добавить 4 капли гидроксида аммония в дистиллированной воде.
- Добавить 30 мл тушь акций (т.е. Sanford Black Magic Водонепроницаемый рисунок тушью 4465 Пункт 44 011) к смеси аммиака и воды.
- Топ с дистиллированной водой до объема 200 мл. Решение готово для инъекций.
Фекете Решение (17):
Решение Фекете используется для отбеливания тушь раздутых с опухолями легких отличить белое узелки опухоли черном фоне нормальных тканей.
- Добавить 350 мл 95% этанола на 1 л стеклянную бутылку.
- Добавить 150 мл дистиллированной воды
- Добавить 50 мл формальдегида
- Добавить 25 мл кислого ледникового кислоты
Ссылки
- Ryan, M. H., Bristol, J. A., McDuffie, E., Abrams, S. I. Regression of extensive pulmonary metastases in mice by adoptive transfer of antigen-specific CD8(+) CTL reactive against tumor cells expressing a naturally occurring rejection epitope. J Immunol. 167 (8), 4286-4292 (2001).
- Caldwell, S. A., Ryan, M. H., McDuffie, E., Abrams, S. I. The Fas/Fas ligand pathway is important for optimal tumor regression in a mouse model of CTL adoptive immunotherapy of experimental CMS4 lung metastases. J Immunol. 171 (5), 2402-2412 (2003).
- Liu, K., Caldwell, S. A., Greeneltch, K. M., Yang, D., Abrams, S. I. CTL Adoptive Immunotherapy Concurrently Mediates Tumor Regression and Tumor Escape. J Immunol. 176 (6), 3374-3382 (2006).
- Yang, D., Stewart, T. J., Smith, K. K., Georgi, D., Abrams, S. I., Liu, K. Downregulation of IFN-gammaR in association with loss of Fas function is linked to tumor progression. International journal of cancer. 122 (2), 350-362 (2008).
- Pages, F., Berger, A., Camus, M. Effector memory T cells, early metastasis, and survival in colorectal cancer. N Engl J Med. 353 (25), 2654-2666 (2005).
- Galon, J., Costes, A., Sanchez-Cabo, F. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science. 313 (5795), 1960-194 (2006).
- Strater, J., Hinz, U., Hasel, C. Impaired CD95 expression predisposes for recurrence in curatively resected colon carcinoma: clinical evidence for immunoselection and CD95L mediated control of minimal residual disease. Gut. 54 (5), 661-665 (2005).
- Camus, M., Tosolini, M., Mlecnik, B. Coordination of intratumoral immune reaction and human colorectal cancer recurrence. Cancer research. 69 (6), 2685-2693 (2009).
- Dudley, M. E., Wunderlich, J. R., Yang, J. C. Adoptive cell transfer therapy following non-myeloablative but lymphodepleting chemotherapy for the treatment of patients with refractory metastatic melanoma. J Clin Oncol. 23 (10), 2346-2357 (2005).
- Srivastava, M. K., Sinha, P., Clements, V. K., Rodriguez, P., Ostrand-Rosenberg, S. Myeloid-derived suppressor cells inhibit T-cell activation by depleting cystine and cysteine. Cancer research. 70 (1), 68-77 (2010).
- Nagaraj, S., Gabrilovich, D. I. Tumor escape mechanism governed by myeloid-derived suppressor cells. Cancer research. 68 (8), 2561-2563 (2008).
- Nguyen, D. X., Bos, P. D., Massague, J. Metastasis: from dissemination to organ-specific colonization. Nature reviews. 9 (4), 274-284 (2009).
- Heijstek, M. W., Kranenburg, O., Rinkes, B. o. r. e. l., H, I. Mouse models of colorectal cancer and liver metastases. Digestive surgery. 22 (1-2), 1-2 (2005).
- Yang, D., Ud Din, N., Browning, D. D., Abrams, S. I., Liu, K. Targeting lymphotoxin beta receptor with tumor-specific T lymphocytes for tumor regression. Clin Cancer Res. 13 (17), 5202-5210 (2007).
- Yang, D., Thangaraju, M., Browning, D. D. IFN Regulatory Factor 8 Mediates Apoptosis in Nonhemopoietic Tumor Cells via Regulation of Fas Expression. J Immunol. 179 (7), 4775-4782 (2007).
- Yang, D., Thangaraju, M., Greeneltch, K. Repression of IFN regulatory factor 8 by DNA methylation is a molecular determinant of apoptotic resistance and metastatic phenotype in metastatic tumor cells. Cancer research. 67 (7), 3301-3309 (2007).
- Wexler, H. Accurate identification of experimental pulmonary metastases. Journal of the National Cancer Institute. 36 (4), 641-645 (1966).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены