Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Инъекции инсулина и гемолимфы добычи для измерения чувствительности к инсулину у взрослых Дрозофилы
В этой статье
Резюме
Консервативные сигнализации инсулина пути найдены в плодовой мушки Дрозофилы Сделайте этот организм потенциального инструмента для моделирования метаболических расстройств, включая сахарный диабет II типа. В связи с этим, очень важно установить физиологические тесты для эффективного измерения системного действия инсулина в периферической глюкозы в распоряжении взрослых летать.
Аннотация
Консервативные питательных зондирования механизмы существуют между млекопитающими и плодовой мушки, где пептиды напоминающие млекопитающих инсулина и глюкагона, соответственно функция для поддержания гомеостаза глюкозы во время развития личиночной 1,2 этапов. Исследования в основном на пост-митотического мухи взрослых показали возмущения гомеостаза глюкозы в результате генетических абляции инсулин-подобный пептид (ЦЛП) продуцирующих клеток (IPC) 3. Таким образом, взрослые мухи весьма перспективны в качестве подходящей модели генетической системы для метаболических заболеваний, включая диабет второго типа. В целях дальнейшего развития системы плодовой мушки, сравнимый физиологические тесты, используемые для измерения толерантности к глюкозе и чувствительность к инсулину у млекопитающих должны быть установлены. С этой целью мы недавно описал роман методика измерения устный ответ на толерантность к глюкозе у взрослого человека летать и продемонстрировали важность для взрослых IPCs в поддержании гомеостаза глюкозы 4,5. Здесь мы изменили ранее описанной процедуры для инъекций инсулина 6 и соединил его с нового метода добычи гемолимфы для измерения периферической чувствительности к инсулину у взрослого человека летать. Уникально, наш протокол позволяет прямого физиологического измерения способности взрослой мухи распоряжаться периферических нагрузки глюкозой на инсулинотерапии, методологию, которая делает возможным охарактеризовать инсулина мутантов и возможных мер, влияющих на толерантность к глюкозе и чувствительность к инсулину у взрослой мухи.
протокол
1. Подготовка Инсулин решения
- Подготовка свежих бычьих решение инсулина путем растворения инсулина в ФБР для достижения концентрации 0,01 мг / мл. Оба инсулина / PBS и контроля PBS решения должны быть на льду всей инъекции процедуры. Эти решения должны быть подготовлены с 0,5% (объем / объем) FD & C Blue нет. 1 пищевой краситель.
2. Подготовка игл и инъекций Настройка
- Подготовка капиллярных игл стекла с использованием микропипетки puller.The следующие съемник настройки дают иглы достаточно высокого качества для инъекций: Тепло, 345; Pull, 210; Скорость, 100; Время, 200 (100 мс). Только что вытащил иглы должны быть притуплены путем нажатия кончиком через Kimwipe ткани. Это притупление процесс удаляет удлиненные высоким сопротивлением кончика и производит поплотнее наконечник с большим диаметром пор.
- Место притупляются иглы откидные в микроцентрифужных трубки, содержащей инсулин / PBS PBS растворе или в одиночку. Капиллярное действие приводит к спине заполнения каждой иглы. Обратите внимание на кончике иглы под стереомикроскопа обеспечить, чтобы ни мусора или воздушные пузырьки появляются на конце. Не использовать иглы, которые не заполняют чисто.
- Вставьте заполнен иглы в ручной иглы microinjector держателя и положение иглодержателя с микроманипулятора так, чтобы кончик иглы виден через стереомикроскопа. Применение положительного давления на столб жидкости в иглу, поворачивая ручной микрометра microinjector ручку прилагается к поршень шприца на microinjector.
- Убедитесь, что достаточное давление для перемещения жидкости был применен, касаясь Kimwipe до кончика иглы и подтверждающие жидкости.
- Как только игла была подготовлена для инъекций, прикрепите калибровочный график в иглу вал с четкими ленты, и принести иглы в центр внимания благодаря стереомикроскопа под 20-кратным увеличением.
3. Подготовка Fly
- Десять-дневных самок используются для инъекций экспериментов. Сбор мух в течение 24 ч eclosion. Обезболить мух увлажненный CO 2 на газ площадки, разобраться самцов и самок место в флаконах, содержащих стандартное лечение или диету. Поддерживать самок на экспериментальных диеты в течение 10 дней.
- На десятый день после eclosion и разделение на экспериментальные диеты, передача мух от пищи содержащей флаконах по флаконах, содержащих по 5 мл вилку 2% агара и голодать им в течение 12-16 ч.
- Трансфер от голода летит в флаконах, содержащих 10% раствора глюкозы пропитанные фильтры для 1 час до инъекции инсулина.
- Кратко обезболить мух увлажненной 2 CO глюкозы после кормления, а затем холодной иммобилизации их на льду.
4. Процедура инъекции
- Аккуратно понять холодной иммобилизованных летать с парой тонких щипцов и удерживать его рядом с кончика иглы так, чтобы кончик примыкает к передней части с левой стороны грудной клетки мухи. Принесите как кончик иглы и грудной клетки мухи в центре внимания при стереомикроскопа.
- Аккуратно переместите летать на кончике иглы так, чтобы кончик иглы прикасается центре выступ левой области грудной клетки prescutum мухи (рис. 1). Как только летать правильно ориентированным и приведены в соответствие с кончика иглы, продолжают продвигать летать на иглу так, чтобы игла пронзает центре prescutum.
- Применение положительного давления по мере необходимости, выдвигая поршень шприца с микроманипулятора ручку microinjector, пока 0,1 мкл жидкости была введена в лету. Потока жидкости в hemocoel мухи придаст синий цвет левой части передней грудной клетки. Иногда надо убираться и заранее несколько раз, чтобы выбить любые блокировки кончика иглы и позволяют жидкости.
- Разрешить вводят мухи восстанавливаться в 2% агара флаконы для назначенных моментов времени, прежде чем гемолимфы добычи.
5. Коллекция гемолимфы
- Кратко обезболить мух увлажненный CO 2 на желаемом после инъекции временные точки и положение каждой летать спинной стороне вниз на двухсторонней ленты прикреплены к поверхности площадки CO 2. Упорядочить мухи ровными рядами с головой капсулы выровнены. Можно использовать отделаны деревянными аппликатора для прессы свои крылья в скотча и обеспечить иммобилизацию.
- Как только мухи крепятся к ленте, держитесь хоботок каждой мухи с мелкими пинцетом и слегка потяните его в направлении вентральной и задней части летать так, что перед головной капсулы виден через стерео микроскопа.
- Другой рукой и, удерживая хоботок в положении, прокалывать центре головной капсулы чуть выше ptilinal шва использованием острой иглой вольфрама (рис. 2). Надо быть осторожным, чтобы не вставить иглу слишком далеко, как это легко пробить кончике иглы через другой стороне головной капсулы, а затем потерять сКОНТРОЛЯ гемолимфы потока. Прокол все летит в инъекции группы до сбора гемолимфы.
- Как только головной капсулы был проколот, используйте отделаны деревянными аппликатора осторожно надавите на живот мухи. Это может быть полезно, чтобы бросить летать над тем, что она опирается на вентральной стороне, как вы применить давление. Эта процедура будет производить капли гемолимфы от места прокола капсулы голову.
- Сенсорный один конец 1 мкл микрокапиллярных трубки гемолимфы капли выходящих из места прокола капсулы голову. Гемолимфы войдет через трубку капиллярного действия. Определить и записать количество гемолимфы собраны, проверяя столба жидкости в трубке микрокапиллярных против окончил объем графике.
6. Определение гемолимфы Глюкоза
- Извлечь гемолимфы образцов в лунки микропланшета, содержащую 100 мкл реагента Глюкоза Infinity. Храните пластины на льду во время загрузки гемолимфы образцов.
- Создание стандартной кривой путем загрузки отдельно 1 мкл каждого из решений глюкозы акций на 50 мм, 25 мм, 12,5 мм, 6.25mM и 3.125mM.
- Инкубируйте образцы при температуре 37 ° С в течение 10 минут.
- Определение оптической плотности при длине волны 340 нм.
- Счет для гемолимфы объем собранных образцов и определить концентрацию глюкозы на основе стандартной кривой с известной концентрацией глюкозы.
7. Представитель Результаты
Типичный ответ терпимость инсулина обнаружен в инсулин вводят мухи, где падение циркулирующие уровни глюкозы обнаружено 15 минут после инъекции. С другой стороны, такой ответ не видели в ФБР вводили мух (рис. 3). Этот ответ в периферической распоряжении глюкозы продолжается в инсулин вводят взлетает до 30 минут после инъекции. Мы регулярно экстракта 0,2-0,5 мкл гемолимфы в 4-5 летит в каждой инъекции группы. Три группы инъекций включены в каждом эксперименте.

Рисунок 1. Левая сторона грудной клетки дрозофилы показывает иглы сайта (с изменениями по Оетегес, 1950) 7. Вставьте иглу через центр prescutum на передней, спинной области левой стороны грудной клетки.
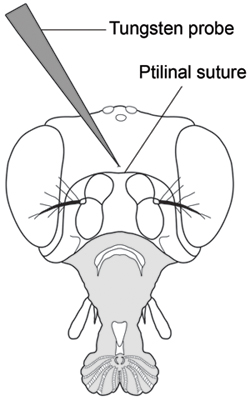
Рисунок 2. Вид спереди дрозофилы головы показывает место для прокола гемолимфы добычи (с изменениями по Оетегес, 1950) 7. Прокол головной капсулы с тонко заостренными вольфрама зонд в центре головной капсулы чуть выше ptilinal шва.
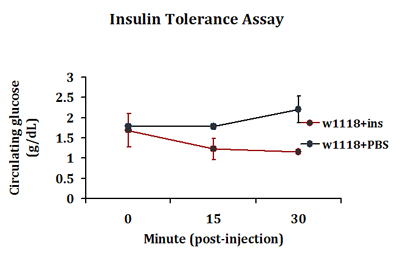
Рисунок 3. Типичный ответ терпимость инсулина обнаружен в управление взрослых мух. Управление W 1118 мухи вводили бычьего инсулина (1 нг в PBS) или только PBS. Летает в репликации групп были затем позволило восстановить в течение 0, 15 или 30 минут и циркулирующие уровни глюкозы были измерены.
Обсуждение
Методике, описанной в настоящем докладе, потенциально полезны в любых исследований, которые исследует физиологические процессы, в результате чего обнаруживаются изменения в состав гемолимфы дрозофилы. Объединив впрыска и гемолимфы коллекции таким образом, можно установить непо...
Раскрытие информации
Благодарности
Эта работа была поддержана грантами НИА к YW.CF (AG21068, AG31086).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента / оборудование | Компания | Номер в каталоге | |
|---|---|---|---|
| Бычьего инсулина | Сигма | I5500 | |
| Бесконечность Глюкоза реагент | Thermo Electron Corporation | TR1541 | |
| Руководство microinjector | Саттер Инструмент | ||
| Р-87 Flamming / коричневый микропипетки съемник | Саттер Инструмент | ||
| Одноместный баррель боросиликатного стекла капиллярной | Системы AM | 626000 | |
| FD & C Blue № 1 | McCormick & компании | ||
| 1 мкл микрокапиллярных труб | Драммонд | ||
| Три оси микроманипулятора ручной и базы | Инструменты Всемирного Precision |
Ссылки
- Rulifson, E. J., Kim, S. K., Nusse, R. Ablation of insulin-producing neurons in flies: growth and diabetic phenotypes. Science. 296, 1118-1118 (2002).
- Kim, S. K., Rulifson, E. J. Conserved mechanisms of glucose sensing and regulation by Drosophila corpora cardiaca cells. Nature. 431, 316-316 (2004).
- Broughton, S. J. Longer lifespan, altered metabolism, and stress resistance in Drosophila from ablation of cells making insulin-like ligands. Proc Natl Acad Sci U S A. 102, 3105-3105 (2005).
- Haselton, A. Partial ablation of adult Drosophila insulin-producing neurons modulates glucose homeostasis and extends life span without insulin resistance. Cell Cycle. 9, 3063-3063 (2010).
- Haselton, A. T., Fridell, Y. W. Adult Drosophila melanogaster as a model for the study of glucose homeostasis. Aging (Albany NY). 2, 523-523 (2010).
- Belgacem, Y. H., Martin, J. R. Disruption of insulin pathways alters trehalose level and abolishes sexual dimorphism in locomotor activity in Drosophila. J Neurobiol. 66, 19-19 (2006).
- Demerec, M. . Biology of Drosophila. , (1950).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены