Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Катетеризации из Мышь подчелюстные слюнные железы через Канальные Уортон
В этой статье
Резюме
Протокол для катетеризации из мыши подчелюстной слюнной железы через проток Уортон описано. Для этого эксперимента, решение трипанового синего используется как краситель, чтобы продемонстрировать, как эта техника эффективно обеспечивает вливаний в целевых железы, и предложить надежность этого нового подхода, как потенциальные клинические наркотиков / клеточной терапии для регенерации слюнных желез.
Аннотация
Тяжелые слюнные железы гипофункция часто встречается у пациентов с синдромом Шегрена и те, кто получают терапевтическое облучение в их головы и шеи регионов для лечения рака. Обе группы пациентов испытывают такие симптомы, как сухость во рту (сухость во рту), дисфагия (нарушение жевания и глотания), тяжелая кариес зубов, изменения вкуса, орально-глоточной инфекции (кандидоз), мукозит, боль и дискомфорт.
Один инновационный подход регенеративной медицины для лечения слюнной железы гипо-функция спекуляций в RS Редман, E Mezey и др. 2009:. Стволовые клетки могут быть напрямую, сданный на хранение катетеризации в железе как мощный метод в возрождении функции нарушенной органа. Можно предположить, что миграция иностранных стволовых клеток дифференцироваться в железистых клеток функционировать как часть хост слюнные железы. Кроме того, эта техника катетеризации целесообразным и эффективным способ доставки для клинического применения переноса генов.
Здесь мы проиллюстрируем этапы выполнения катетеризации процедуру на мышь подчелюстной слюнной железы через проток Уортон (рис. 1). C3H мышей (Charles River, Монреаль, Квебек, Канада) используются для этого эксперимента, которые были сохранены в чистых обычных условиях в Университете Макгилла ресурсного центра животного. Все эксперименты были одобрены Комитетом Уход животных университета и были в соответствии с руководящими принципами Канадского совета по уходу за животными.
Для этого эксперимента трипанового синего решение вливаются в железы через открытие канала Wharton, используя инсулиновый шприц с 29-иглы заключенная внутри полиэтиленовой трубы. Впоследствии мышь расчлененный показать, что вливания мигрировали в железе успешно.
протокол
1. Процедурные Описание
- Подкожно вводят 1 мкл / г массы тела на 0,5 мг / мл моногидрата сульфата атропина (Cat # 11330, Fluka, США) в каждую мышь, чтобы предотвратить слюнных выделений из нарушая движение вливаний.
- Обезболить каждой мыши с 1 мкл / г веса тела 100 мг / мл кетамина и 20 мг / мл ксилазина (Phoenix Научные, Арканзас, США) раствор вводят внутри-перитонеального (IP)
- Место мыши на заказ пластиковой платформе в вентральной позиции: верхнечелюстных резцов заблокированы на металлической проволоки, и нижней челюсти резцы подсел на упругой нити, чтобы держать открытым ртом.
- Использование инсулина шприц с 29-иглы (Cat # 600145, Tyco Healthcare, Массачусетс, США), помещенный внутрь 0,58 мм диаметр полиэтиленовых труб (Cat # 427410, Becton Dickinson, штат Мэриленд, США, рис 2). Полиэтиленовых труб вставляется 5 мм за кончик 29-иглы. Иглы используется в качестве жесткой руководство для перемещения полиэтиленовых труб в канал Уортон. Полиэтиленовых труб вставляют 3-5 мм внутрь канала. Отметим, что только полиэтиленовых труб входит слюнных протоков железы в то время как игла остается вне канала. Inject 50ul с фильтром на 0,4% трипанового синевы решение (Cat # 15250, Gibco, США) в подчелюстной железы через проток Уортон, которая расположена прямо под язык. Инфузии поставляется стабильно с положительным давлением на поршень шприца; палец остается на поршень даже после всех настой был доставлен в железе, с целью предотвращения обратного потока внутри вливания в устной форме. Решение трипанового синий используется в видео в качестве красителя для демонстрации техники.
- осле введения решение трипанового синий, мыши был подвергнут эвтаназии до вскрытия. Слюнной железы хирургическим подвергается для того, чтобы определить, сколько из вливаний, фактически остался в железе.
2. Представитель Результаты:
После инфузии вводили, мышь расчлененный к хирургическим выставить пост-канюлированные слюнные железы. Как показано на Изображение-2, темная окраска протока Wharton предоставляет доказательства того, что решение трипанового синего вводили успешно.
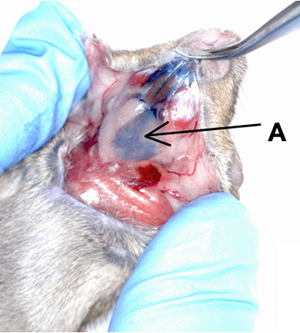
Рисунок 1. Катетеризации мыши железы подчелюстные.
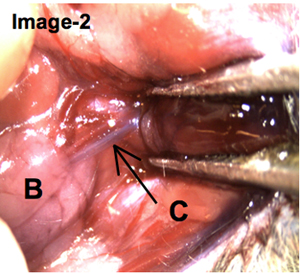
Рисунок 2. Полиэтиленовая трубка заключена вокруг головки 29-иглы. Иглу шприца используется в качестве жесткой руководство для перемещения полиэтиленовых труб в канал Уортон. Полиэтиленовых труб вставляется (канюлю) 3-5 мм внутрь канала. Отметим, что только полиэтиленовых труб входит слюнных протоков железы в то время как игла остается вне канала.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Затруднения при использовании этого метода катетеризации является предотвращение обратного потока вводят раствор. Даже если трипанового синий раствор временно перекочевал в слюнной железы успешно, слюны секреции могут помешать настои и вызывать обратный поток трипанового синий ра?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Благодарности
Авторы выражают благодарность доктору Ана Cotrim для технических консультаций и доктору Monzur Муршед для оборудования. Эта работа была частично финансируется Канадским института исследований в области здравоохранения.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments | |
| Название реагента | Тип | Компания | Номер в каталоге | Комментарии (необязательно) |
| Атропин | Наркотик | Fluka | 11330 | Для подавления секреции слюны |
| Кетамин | Наркотик | Феникс Научные | Успокоение | |
| Ксилазин | Наркотик | Феникс Научные | ||
| Полиэтиленовые трубы (0,58 мм в диаметре) | Трубка | Intramedic ПЭ-10, Becton Dickinson диагностических систем | 427410 | Для вставки на кончике иглы, чтобы избежать повреждения тканей во время введения в проток Уортон. |
| Ультра Комфорт шприц инсулина (с 29G иглы) | Шприц | Tyco Healthcare | 600145 | |
| 4% трипанового синий | Пятно | Гибко | 15250 |
Ссылки
- Fox, P. C. Acquired salivary dysfunction. Drugs and radiation. Ann N Y Acad Sci. 842, 132-137 (1998).
- Bhide, S. A., Miah, A. B., Harrington, K. J., Newbold, K. L., Nutting, C. M. Radiation-induced xerostomia: pathophysiology, prevention and treatment. Clin Oncol (R Coll Radiol). 21, 737-744 (2009).
- Redman, R. S., Ball, W. D., Mezey, E., Key, S. Dispersed donor salivary gland cells are widely distributed in the recipient gland when infused up the ductal tree. Biotech Histochem. 84, 253-260 (2009).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены