Method Article
Запись Крупномасштабные нейронных ансамблей с кремниевых зондов в наркозом крыса
В этой статье
Резюме
Внеклеточный записи нейронной активности с использованием кремниевых зондов в анестезии крыс будут описаны. Эта техника позволяет получать информацию в нескольких областях мозга из более чем 100 нейронов одновременно. В нем содержится информация с одной резолюции клетка о нейронных ансамблей в динамике нескольких локальных схем.
Аннотация
Крупномасштабные электрофизиологических записей из нейронных ансамблей дают возможность исследовать, как мозг организует широкий спектр поведения от пики активности его нейронов. Одним из наиболее эффективных методов контроля пики активности большого числа нейронов в нескольких локальных нейронных схем одновременно является использование кремния электрод массивы 1-3.
Потенциалы действия производят большое трансмембранного изменения напряжения в непосредственной близости от ячейки somata. Эти выходные сигналы могут быть измерены путем размещения проводника в непосредственной близости от нейрона. Если Есть много активных (пики) нейронов в непосредственной близости от наконечника, электродов записи объединенный сигнал от каждого из них, где вклад одного нейрона взвешивается по его "электрическое расстояние. Кремний зонды идеальны электроды записи для прослушивания множества нейронов, из-за большого количества сайтов записи (+64) и небольшого объема. Furthermoре, несколько сайтов могут быть расположены на расстоянии миллиметров, что позволяет обеспечить одновременную запись нейронной активности в различных слоях коры или в нескольких корковых колонн (рис. 1). Важно отметить, что геометрически точное распределение записи сайтов и позволяет для определения пространственных отношений изолированном 4 нейронов. Здесь мы описываем острых, крупных нейронов записи с левой и правой передней лапы соматосенсорной коры одновременно в анестезии крыс с кремнием зондов (рис. 2).
протокол
1. Хирургия Подготовка
- Обезболить крысы с соответствующего типа и дозы анестетиков. Здесь мы используем уретана (1,5 г / кг, Sigma-Aldrich Ко, Санкт-Луис, Миссури) - готовят 20%-ного раствора путем разбавления 20 г уретана в 100 мл фосфатного буферного раствора (PBS), то есть животное получит 7,5 мл / кг уретана решение intraperitonealy (IP). Из-за своей кривой доза-реакция, общая доза уретана делится на четыре приложения, отделенных друг от друга примерно на 30 минут. До первых двух применений уретана, животное под наркозом с изофлуран вводят в концентрации 3-4% (кислород на 2 литра в минуту) и поддерживается на уровне 2% (кислород со скоростью до 2 литров в минуту), чтобы предотвратить животное от получение подчеркнул в виде инъекций. Во время операции, дополнительные администрации isofluorane (2%-ной концентрации в течение 2 минут) могут быть использованы в случае необходимости.
- Бритье мех вдоль разреза (спинной стороне головы), чтобы обеспечитьмех не будет загрязнять рану и достаточной площади можно дезинфицировать вокруг разреза.
- Подготовка места операции стерильно использованием органического йода или хлоргексидина мыла и антисептиков (этанол).
- Подготовка кремниевых зондов (NeuroNexus технологий, Ann Arbor, MI). Зонды необходимо продезинфицировать, 70% этанолом с последующей промывкой дистиллированной водой. При необходимости датчики могут быть окрашены флуоресцентным маркером подготовлены стерильно (например, краска I, Invitrogen °), к более позднему выявить положение зонда в гистологического анализа. Для этого мы используем небольшой и очень мягкой кистью и деликатно прикоснуться к задней кремния зонда с красителем. Эта процедура всегда должна быть сделана за микроскопом, чтобы убедиться, что зонд не прогнуться. Всегда проверяйте, чтобы убедиться, что краска не блокирует любой из каналов. Любые остаточные краситель остается на зонд может быть позже удалены с алкоголем, с последующей промывкой водой.
- Кремний электродэс ухода: из-за их небольшого размера, кремний зонды тонкий и чрезвычайно лопаются даже при использовании его с большой осторожностью. Таким образом, мы рекомендуем мониторинга потенциальных опасностей во все времена, такие как: (я) Держите зонды в соответствующим образом назначенных коробке; (II) не допускать сбоя или падения зонда при обращении с ними; (III) Убедитесь, что стереотаксическая манипуляторы, хорошо фиксированная для предотвращения несчастных случаев; (IV) при записи, окружающие ткани и / или крови можно прикрепить к зондов. Поэтому важно быть также осторожны при извлечении зонда после записи. Использование постоянного потока решение PBS или физиологический раствор, настоятельно рекомендуется; (у) Всегда чистым зондов после записи. Для очистки зондов, настоятельно рекомендуется погружать их в жидкость ферментативной чистых (Бостон, Bausch & Lomb) в течение нескольких минут. Всегда промыть зондов с дистиллированной водой и вернуть их в посвященных коробки. По нашему опыту, адекватный уход из кремниевых зондов обеспечиваетхорошее качество записи более 10 экспериментов. Если канала появляется шум во время использования, должны быть исключены из последующего анализа. Мы обнаружили, что перекрестные помехи между каналами минимальна, поэтому шумные канала обычно имеет очень слабое влияние на сигнал в другие каналы.
2. Хирургия
- Применять мазь для глаз на глаз поверхность перед любой операции манипуляции.
- Администрирование дексаметазон 5 мг / мл подкожно уменьшить воспаление мозга.
- Fix животное в стереотаксической системы координат для хирургии.
- Администрирование Лидокаин HCl 2% с адреналином (2-4 мг / кг разбавляют до 0,5% раствора) подкожно в область разреза до надрез, чтобы уменьшить потенциальный риск кровотечения и раны для местной анестезии.
- Сделайте 2 см разрез через кожу головы средней линии и вытесняют кожу с боков, чтобы разоблачить поверхности черепа.
- Очистить кожу головы от спинной фасции от тупой диссекции и контролякровотечение microcautery или с помощью костного воска.
- Сделать два отверстия бурения приложить небольшие винты в затылочной кости черепа для заземления животных и ссылки. Ссылка винт должен быть в контакте с твердой мозговой оболочки. В целях снижения электрических шумов во время записи, рекомендуется держать винты мокрой во все времена. Для этого небольшие акриловые барьер окружающих винты могут быть построены или винты могут быть покрыты агара.
- Сделайте 1-2 мм в диаметре трепанации черепа в координатах, соответствующих корковых и / или подкорковой области (ы), имеющие отношение 5. Использование сжатого воздуха для удаления остатков костной ткани по мере необходимости во время трепанации черепа (сверление отверстий). Предотвращение черепа разогреться от бурения с применением капель PBS. Сделать второй трепанации черепа, если это необходимо, чтобы вставить второй зонд. В этом видео мы представляем запись с двух областях коры одновременно, поэтому два craniotomies сделаны.
- Построить небольшой барьер акриловой смолы (например: Lang СтоматологическаяПроизводство, завод, ОАО, Wheeting, IL), окружающие два craniotomies того, чтобы сохранить PBS в верхней части подвергаются оболочки, предотвращая ее от высыхания. Применить PBS постоянно в течение всего эксперимента.
- Открытый вопрос оболочки обоих craniotomies. Две иглы (30 ½ избыточное давление) согнутых на концах (формирование крючок), могут быть использованы для этой манипуляции.
- Присоединить разъем кремниевых зондов для стереотаксической manipulatiors. Разъемы крепятся к столбу, чтобы иметь черенки зондов прекрасно параллельно стереотаксического манипулятора. Это имеет решающее значение для поддержания стабильной записи и избежать повреждения датчика.
- Подключите ссылкой винт ссылкой контактный датчик кремния. Для снижения электрического шума земле винта должны быть подключены к: я) земли зонда, вилка II) шасси почву из-записывающее устройство, и III) стереотаксической рамы.
- Место кончик кремниевых зондов просто в контакте с Пиа.
- Медленно ввести йэлектронных кремниевых зондов и убедитесь, что черенки кремниевых зондов (рис. 1 и 2) может быть вставлен в мозг без сопротивления или изгиба.
- Осторожно опустите зондов до достижения желаемой области записи. Если необходимо, добавьте капли PBS на вершине craniotomies, чтобы избежать высыхания ткани.
- Потому что уретановые анестезии следует использовать только для терминальных процедур, животное усыпляют по IP-инъекции, по крайней мере 200mg/kg натрия пентобарбитал разбавлен до концентрации не более 60 мг / мл. Это сопровождается обезглавливание животных.
3. Представитель Результаты:
Представитель записи локальных потенциалов поля и пики активности показаны на рисунке 3А. После выполнения шип сортировки (дискриминация шипы, идущих от разных нейронов; рис 3B, C, 6, 7, 8) кремния зонд записи дают возможность исследовать нейронной активности населения вовлечены в, А. М.Онг друга, следующие процессы: память и принятие решений 9, пластичности 10, стимулом кодирования 11, спонтанной активности 12 и воздействия различных наркотиков 13.
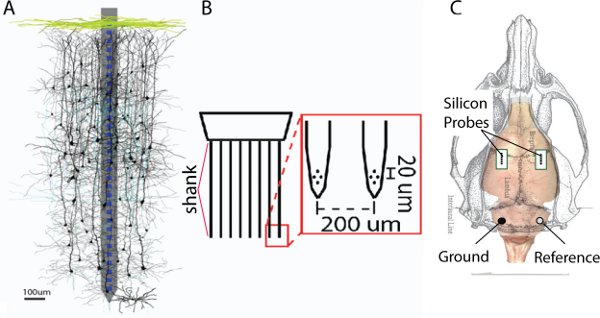
Рисунок 1. А. Пример кремния зонд с одним хвостовиком накладывается на монтаж реконструированы нейронов (любезность С. Саката 14). Б. Пример зонд с тетрод конфигурации на каждом из 8 черенков. C. Схема Крыса черепа. Зеленые прямоугольники представляют степень трепанация черепа над правой и левой соматосенсорной коры головного мозга.
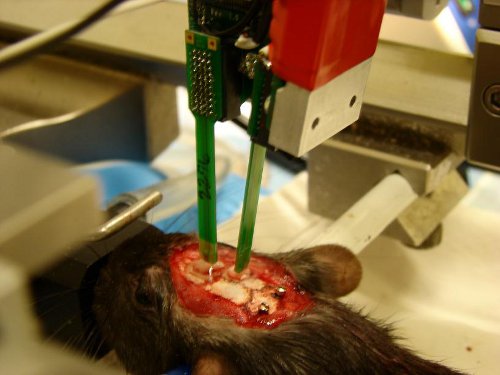
Рисунок 2. Пример эксперимента с кремнием зонды вставляются в префронтальной коре и гиппокампе. Капли PBS покрытие трепанация черепа для защиты подвергаются брайн от высыхания. Два винта, расположенные над мозжечком будет подключен к земле и ссылки, соответственно.
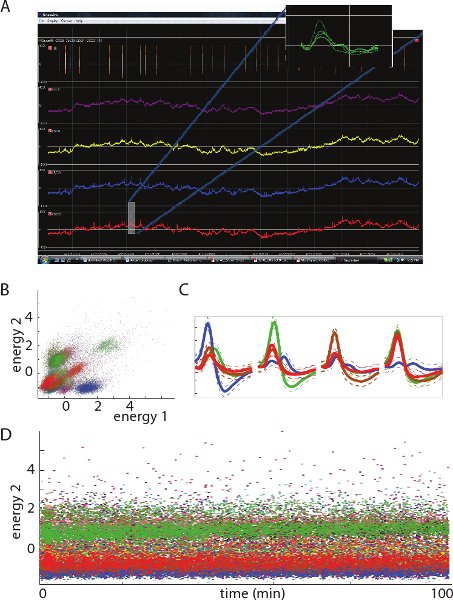
Рисунок 3. А. На рисунке показано 500 мс представителя электрофизиологические записи местных потенциальном поле (LFP) с одного тетрод (примечание: отрицательное напряжение отложено на оси ординат). Вставьте шоу - сигнал о шип В. Двумерные видом блок кластеров в пространстве признаков от 1 тетрод.. Каждый кластер представляет шипы из одной единицы (нейрон). C. Средняя шип сигналы от представительной единицы (цветом) на каждом из четырех участков записи из одной тетрод. D. Сигнал энергии (связанной с амплитудой) зарегистрированных шипы с течением времени . Примечание относительно постоянными значениями энергии для каждой единицы, что свидетельствует стабильный записи в течение срока действия отображается период.
Обсуждение
Эта статья демонстрирует, как использовать массивы кремниевых электродов для записи с большой популяции нейронов (> 100) в нескольких областях коры одновременно. Для того, чтобы быть успешным в хирургии и записи, следующие вопросы должны быть рассмотрены:
- Внедрение зондов для нужной области: При установке датчиков в мозговой ткани, то можно нанести значительный ущерб. Это может привести к низким качеством записанного единиц. Чтобы избежать этой проблемы, мы рекомендуем следующее: (я) введение зонда под определенным углом степени (рекомендуется использовать 10 углов степени). Делая это, дендритные повреждения записанных нейронов может быть уменьшен; (II) После зонды вставляются в мозговой ткани, они изначально снижена более быстрыми темпами (примерно от 50 до 100 микрон в 10-30 сек), пока они не ближе к нужной области записи. Когда зонды около 200 микрон от целевой области, положение регулируется более медленно (примерномерно 10 мкм, каждые 2 или 3 минуты).
- Стабилизация записи: Когда зонды в назначенное место и значительные обнаружении активности (отличительные спайки в большинстве каналов), то рекомендуется подождать около 30 минут до начала записи. Это позволит тканей мозга к механической стабилизации после установки датчиков и обеспечить более стабильную запись.
- Мозг пульсацию: Время от времени можно увидеть пульсацию мозга, которые могут значительно ухудшить качество записи. Небольшой краниотомии (достаточно пространства, чтобы соответствовать зонд) может уменьшить мозга пульсация в области записи. Если необходимо, цистерны Magna может быть проколот. Это уменьшает давление спинномозговой жидкости и уменьшает отек и пульсации.
- Кремний зонд конфигурации: Силиконовая зонды могут иметь разнообразные формы и конфигурации записи сайта. Например, они могут различаться по числу голени, длина и толщина хвостовика, а врасположение записи сайтов (например, тетрод против линейной конфигурации, см.: www.neuronexustech.com). Выбор датчика, используемого в конкретной конфигурации зависит от того, научный вопрос необходимости дать ответ. Например, если цель заключается в записи популяций нейронов в нескольких местах, в одном конкретном слое (как представлено в этих записей), лучшим выбором является использование зонда с восемью черенками и тетрод конфигурации. Это дает возможность записи нескольких отдельных единиц на каждом тетрод и отбора проб из восьми местах по всей 1.4мм службы. В другом случае, если кто-то хотел бы учиться деятельности propagations через корковые слои, лучшим выбором будет использование зонда с одним хвостовиком с равномерно распределенными записи сайтов по этой хвостовиком который позволяет записывать в несколько слоев коры одновременно 14.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана NSERC & AHFMR. Авторы выражают благодарность Мариам Alaverdashvili и Аманда Mauthe-Kaddoura замечания по рукописи и Hiroe Ямазаки за помощью в подготовке операции.
Материалы
| Name | Company | Catalog Number | Comments |
| Имя | Компания | Номер по каталогу | |
| Уретан | Sigma-Aldrich | ||
| Фосфатный буфер солевом растворе (PBS) | |||
| Изофлюрана | Бенсон | 02241315 | |
| Кремний зондов | NeuroNexus Технологии | 4 X 2 - Тет - 5 мм - 150 - 200 - 312 | |
| Dye I (DiIC 18 (3)) | Invitrogen Ко | 617830 | |
| Дексаметазон 5 | Vetoquinol | 0A0640B | |
| Глазная мазь | Vetoquinol | 005165414 | |
| Лидокаин HCl 2% с адреналином | Bimeda-MTC | 00141984 | |
| Стереотаксической Frame | KOPF инструменты | 1430-B | |
| Манипулятор электродов и держатель | KOPF инструменты | 960 | |
| Крыса ухо-бары | KOPF инструменты | 1955 | |
| Крыса адаптер | KOPF инструменты | 920 | |
| Анестезия маски | KOPF инструменты | 906 | |
| Скальпель | Roboz Хирургические инструменты | RS-9843 | |
| Скальпель лезвия | Парагон | 0086 | |
| Micro рассекает ножницами | Roboz Хирургические инструменты | RS-5910 | |
| Винты | Гулд Pasteners ограниченной | 14084701 | |
| Гемостатические щипцы | Грабитьунция Хирургические инструменты | RS-7130 RS-7211 | |
| 30 ½ иглы | Becton Dickinson- | 305115 | |
| Микромотор контроль | Foredom | HP4-917 | |
| Препаровальный пинцет | Roboz Хирургические инструменты | RS-5237 | |
| Кость воска | Lukens | M263500 | |
| Сжатый воздух бутылку | Сокол безопасности продукции, Inc | 50-10521C | |
| Ферментативный очиститель | Бостон, Bausch & Lomb | BAUSCH497628 | |
| Дистиллированная вода | |||
| Стоматологическая акриловая пудра | Ланг Стоматологическая | 1220 | |
| Стоматологическая акриловая жидкость | Ланг Стоматологическая | 1404 | |
| Цифровые системы Lynx SX | Neuralynx ООО | 4SX-Z400 | |
| Cheeta Softwere | Neuralynx ООО | ||
| Аллигатор кабелей |
Ссылки
- Buzsaki, G. Large-scale recording of neuronal ensembles. Nat. Neurosci. 7, 446-451 (2004).
- Kipke, D. R. Advanced neurotechnologies for chronic neural interfaces: new horizons and clinical opportunities. J. Neurosci. 28, 11830-11838 (2008).
- Csicsvari, J. Massively parallel recording of unit and local field potentials with silicon-based electrodes. J. Neurophysiol. 90, 1314-1323 (2003).
- Bartho, P. Characterization of neocortical principal cells and interneurons by network interactions and extracellular features. J. Neurophysiol. 92, 600-608 (2004).
- Paxinos, G., Watson, C. . The rat brain: in stereotaxic coordinates. , (1998).
- Lewicki, M. S. A review of methods for spike sorting: the detection and classification of neural action potentials. Network. 9, R53-R78 (1998).
- Harris, K. D., Henze, D. A., Csicsvari, J., Hirase, H., Buzsaki, G. Accuracy of tetrode spike separation as determined by simultaneous intracellular and extracellular measurements. J. Neurophysiol. 84, 401-414 (2000).
- Luczak, A., Narayanan, N. S. Spectral representation--analyzing single-unit activity in extracellularly recorded neuronal data without spike sorting. J. Neurosci. Methods. 144, 53-61 (2005).
- Pastalkova, E., Itskov, V., Amarasingham, A., Buzsaki, G. Internally generated cell assembly sequences in the rat hippocampus. Science. 321, 1322-1327 (2008).
- Fujisawa, S., Amarasingham, A., Harrison, M. T., Buzsaki, G. Behavior-dependent short-term assembly dynamics in the medial prefrontal cortex. Nat Neurosci. 11, 823-833 (2008).
- Harris, K. D. How do neurons work together? Lessons from auditory cortex. Hear. Res. 271, 37-53 (2011).
- Luczak, A., Bartho, P., Marguet, S. L., Buzsaki, G., Harris, K. D. Sequential structure of neocortical spontaneous activity in vivo. Proc. Natl. Acad. Sci. U.S.A. 104, 347-352 (2007).
- Robbe, D. Cannabinoids reveal importance of spike timing coordination in hippocampal function. Nat. Neurosci. 9, 1526-1533 (2006).
- Sakata, S., Harris, K. D. Laminar structure of spontaneous and sensory-evoked population activity in auditory cortex. Neuron. 64, 404-418 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены