Method Article
Registrazione Ensembles neuronali su larga scala con sonde di silicio sotto Rat anestetizzati
In questo articolo
Riepilogo
Registrazioni extracellulari di attività neuronale con sonde silicio nel ratto anestetizzato saranno descritti. Questa tecnica permette di ottenere informazioni attraverso aree cerebrali multiple da più di 100 neuroni contemporaneamente. Esso fornisce informazioni sulla risoluzione singola cellula neuronale dinamiche ensemble in più circuiti locali.
Abstract
Grande scala registrazioni elettrofisiologiche da complessi neuronali offrono l'opportunità di studiare come il cervello orchestra la grande varietà di comportamenti dall'attività incurvamento del suoi neuroni. Uno dei metodi più efficaci per monitorare l'attività spiking da un gran numero di neuroni in diversi circuiti neuronali locale è allo stesso tempo mediante matrici di elettrodi 1-3 silicio.
Potenziali d'azione produrre grandi cambiamenti transmembrana tensione in prossimità di somata cellulare. Questi segnali di uscita può essere misurata mettendo un conduttore in prossimità di un neurone. Se ci sono molti attivi (spike) i neuroni in prossimità della punta, l'elettrodo record segnale combinato da tutti loro, in cui è pesata contributo di un singolo neurone per la sua 'distanza elettrica'. Sonde di silicio sono elettrodi di registrazione ideale per controllare i neuroni più a causa di un gran numero di siti di registrazione (+64) e un piccolo volume. Furthermore, più siti possono essere organizzati su una distanza di millimetri, permettendo così per le registrazioni simultanea di attività neuronale nei vari strati corticali o più colonne corticali (Fig. 1). È importante sottolineare che la distribuzione geometricamente precisa i siti di registrazione consente anche per la determinazione del rapporto spaziale dei isolato 4 singoli neuroni. Qui, descriviamo un acuto, su larga scala registrazione neuronale da sinistra e destra della corteccia somatosensoriale arti anteriori simultaneamente in un ratto anestetizzato con sonde di silicio (Fig. 2).
Protocollo
1. Chirurgia Preparazione
- Anestetizzare il topo con il tipo appropriato e la dose di anestetici. Qui usiamo uretano (1,5 g / kg, Sigma-Aldrich, S. Luis, MO) - preparato come soluzione al 20% diluendo 20 g di uretano in 100 ml di tampone fosfato (PBS), cioè l'animale riceverà 7,5 ml / kg di uretano soluzione intraperitonealy (IP). A causa della sua curva dose-risposta, la dose totale di uretano è diviso in quattro applicazioni, ciascuno separato da circa 30 minuti. Prima che le prime due domande di uretano, animale viene anestetizzato con isoflurano somministrato ad una concentrazione del 3-4% (ossigeno a 2 litri al minuto) e mantenuta a 2% (ossigeno fino a 2 litri al minuto) per evitare un animale da stressarsi per iniezione. Durante l'intervento, una somministrazione aggiuntiva di isofluorane (2% di concentrazione per 2 minuti) può essere utilizzato se necessario.
- Accorciare il pelo lungo il sito di incisione (lato dorsale della testa) per garantire chela pelliccia non contaminare la ferita e che una superficie sufficiente può essere disinfettato tutto il sito di incisione.
- Preparare sito chirurgico antisettico con iodio organico o sapone clorexidina e antisettici (etanolo).
- Preparare le sonde di silicio (Tecnologie NeuroNexus, Ann Arbor, MI). Sonde possono essere disinfettati con etanolo al 70% seguito da risciacquo con acqua distillata. Se necessario, le sonde possono essere verniciati con un marcatore fluorescente preparato antisettico (es. coloranti I, Invitrogen Co.), per rivelare poi la posizione della sonda per l'analisi istologica. Per fare questo si usa un pennello piccolo e molto morbida e delicatamente toccare il retro della sonda silicio con il colorante. Questa procedura deve essere sempre fatto nel corso di un microscopio per assicurarsi che la sonda non viene danneggiato o piegato. Sempre assicurarsi che il colore non sta bloccando uno qualsiasi dei canali. Qualsiasi colorante residuo lasciato sulla sonda può essere successivamente rimossa con l'alcol, seguito da risciacquo con acqua.
- Elettrodo di siliciocura es: a causa delle loro piccole dimensioni, le sonde in silicone sono delicati ed estremamente suscettibili alla rottura, anche quando lo si utilizza con notevole attenzione. Quindi, si consiglia di monitorare potenziali pericoli in ogni momento, quali: (i) Tenere le sonde in una scatola opportunamente designato, (ii) prevenire crash o far cadere sonde quando loro trattamento; (iii) Assicurarsi che i manipolatori stereotassica sono ben fissati per prevenire eventuali incidenti, (iv) Durante la registrazione, tessuto circostante e / o sangue possibile allegare alle sonde. Pertanto, è importante essere attenti anche durante la rimozione della sonda dopo la registrazione. Utilizzando un flusso costante di soluzione salina o PBS è fortemente raccomandato, (v) Pulire sempre le sonde dopo la registrazione. Per pulire le sonde, si consiglia di immergere in un liquido detergente enzimatico (Boston, Bausch & Lomb) per qualche minuto. Sciacquare sempre le sonde con acqua distillata e restituirli alla loro casella dedicata. Nella nostra esperienza, la cura adeguata delle sonde silicio assicuraregistrazioni di buona qualità per più di 10 esperimenti. Se un canale 'diventa rumoroso' durante l'uso, dovrebbe essere escluso dalle analisi successive. Abbiamo scoperto che cross-talk tra i canali è minimo, quindi un canale rumoroso di solito ha ben poco effetto su un segnale in altri canali.
2. Chirurgia
- Applicare un occhio-unguento sulla superficie oculare prima di qualsiasi manipolazione chirurgica.
- Somministrare Desametasone 5 mg / ml per via sottocutanea per ridurre l'infiammazione del cervello.
- Fissare il telaio stereotassico animale in tutta la chirurgia.
- Somministrare lidocaina HCl 2% con epinefrina (2-4 mg / kg diluita allo 0,5% soluzione) per via sottocutanea al sito di incisione, prima l'incisione è fatto per ridurre il potenziale rischio di sanguinamento della ferita e per l'anestesia locale.
- Eseguire un'incisione 2 centimetri attraverso la linea mediana del cuoio capelluto e spostare la pelle lateralmente per esporre la superficie del cranio.
- Cancella il cuoio capelluto dalla fascia dorsale per via smussa e controllol'emorragia da microcautery o utilizzando cera ossea.
- Fare due fori per fissare piccole viti nell'osso occipitale del cranio per terra animale e di riferimento. La vite di riferimento deve essere in contatto con dura. Al fine di ridurre il rumore elettrico durante le registrazioni, si consiglia di mantenere le viti bagnati in ogni momento. Per fare questo, una piccola barriera che circonda le viti in acrilico può essere costruita o le viti possono essere coperti con agar.
- Fai una craniotomia 1-2 mm di diametro in coordinate corrispondenti alla zona corticale e / o sottocorticali (s) di interesse 5. Utilizzare l'aria compressa per rimuovere la polvere di ossa, se necessario durante la craniotomia (foratura). Prevenire cranio riscaldamento da perforazione mediante l'applicazione di gocce di PBS. Fai una craniotomia secondo se necessario per inserire la seconda sonda. In questo video, vi presentiamo una registrazione di due aree corticali contemporaneamente, quindi due craniotomie sono fatti.
- Costruire una piccola barriera di resina acrilica (ad esempio: Lang DentalManufacturing, Co., Inc., Wheeting, IL) che circondano i due craniotomie al fine di mantenere PBS in cima dura esposta, impedendo che si secchi. Applicare PBS costantemente durante l'intero esperimento.
- Aprire la dura madre di entrambi craniotomie. Due aghi (30 ½ gauge) piegato sulle punte (formando un gancio), possono essere utilizzati per questa manipolazione.
- Collegare il connettore delle sonde di silicio per il manipulatiors stereotassica. I connettori sono attaccato ad un palo in modo da avere il gambo delle sonde perfettamente parallelo al manipolatore stereotassico. Ciò è fondamentale per mantenere le registrazioni stabili e di evitare danni sonda.
- Collegare la vite di riferimento per il perno di riferimento sonda silicio. Per ridurre il rumore elettrico le viti di terra devono essere collegati a: i) la terra della spina della sonda, ii) la massa del telaio dal dispositivo di registrazione, e iii) il telaio stereotassico.
- Posizionare la punta delle sonde silicio appena a contatto con la pia.
- Lentamente introdurre °sonde di silicio e e assicurarsi che il gambo delle sonde di silicio (Fig. 1 e 2) può essere inserito nel cervello senza resistenza o piegarsi.
- Abbassare delicatamente le sonde fino a raggiungere un'area di registrazione desiderata. Se necessario, aggiungere qualche goccia di PBS sulla cima del craniotomie per evitare l'essiccamento del tessuto.
- Poiché l'anestesia uretano deve essere utilizzato solo per le procedure di terminale, l'animale è eutanasia da una iniezione ip di almeno 200mg/kg di sodio pentobarbital diluito ad una concentrazione non superiore a 60 mg / ml. Questa è seguita dalla decapitazione dell'animale.
3. Rappresentante dei risultati:
Registrazioni rappresentativo dei potenziali locali di campo e l'attività spiking sono illustrati nella Figura 3A. Dopo aver eseguito l'ordinamento picco (picchi discriminante provenienti da neuroni diversi; Fig. 3B, C, 6, 7, 8) in silicone registrazioni sonda offrono la possibilità di indagare l'attività neuronale popolazione coinvolta in, sonoaltre ong, i seguenti processi: la memoria e il processo decisionale 9, plasticità 10, stimolo di codifica 11, 12 e attività spontanea effetti delle varie droghe 13.
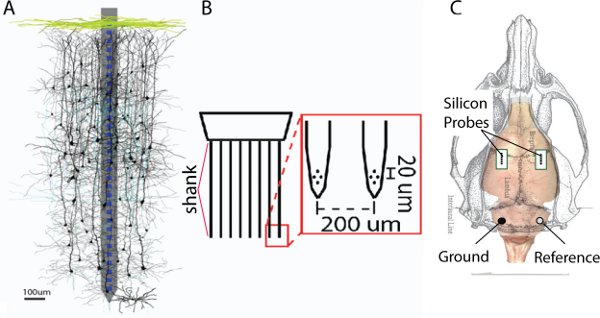
Figura 1. A. Esempio di una sonda di silicio con un gambo singolo viene sovrapposto un montaggio di neuroni ricostruito (per gentile concessione di S. Sakata 14). B. Esempio di una sonda con una configurazione a tetrodo a ognuno degli 8 stinchi. C. schematica di un ratto cranio. Le caselle verdi rappresentano la misura della craniotomia oltre la corteccia somatosensoriale destra e sinistra.
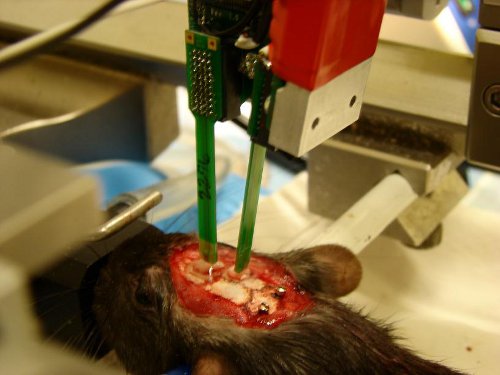
Figura 2. Esempio di esperimenti con sonde di silicone inserito nella corteccia prefrontale e l'ippocampo. Gocce di PBS coprire la craniotomia per proteggere la vista brain si secchino. Due viti posizionate sopra il cervelletto sarà collegato a terra e di riferimento, rispettivamente.
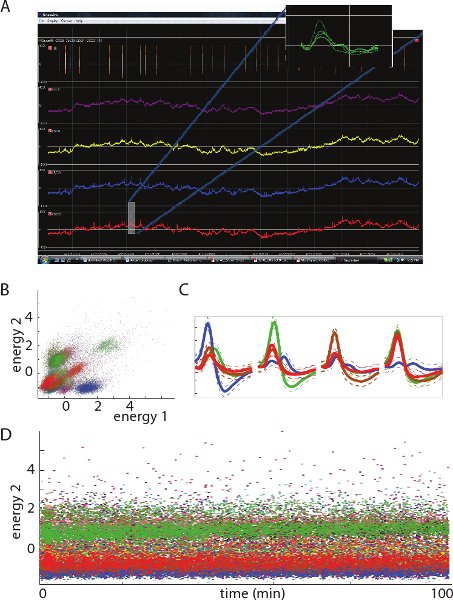
Figura 3. Immagine A. mostra 500ms di una registrazione elettrofisiologica rappresentante del potenziale campo locale (LFP) da un tetrodo (nota: tensione negativa è tracciata sul ordinata). Mostra inserire - una forma d'onda di un picco B. bidimensionali viste di cluster unità in funzione di spazio da 1 tetrodo.. Ogni cluster rappresenta picchi da una singola unità (neuroni). C. forme d'onda media picco dalle unità di rappresentanza (codice colore) a ciascuno dei quattro siti di registrazione da un tetrodo singolo. D. forma d'onda di energia (in relazione alla ampiezza) di picchi registrati nel corso del tempo . Notare i valori di energia relativamente costante per ogni unità, questo indica una registrazione stabile per tutta la durata del periodo visualizzato.
Discussione
Questo documento viene illustrato come utilizzare le matrici di silicio elettrodo per la registrazione da grande popolazione di neuroni (> 100) in molteplici aree corticali contemporaneamente. Per avere successo in chirurgia e la registrazione, i seguenti aspetti devono essere considerati:
- L'introduzione delle sonde ad una zona desiderata: Quando si inserisce la sonda nel tessuto cerebrale, è possibile causare danni considerevoli. Questo può comportare una scarsa qualità di unità registrate. Per evitare questo problema si consiglia quanto segue: (i) Introdurre le sonde con un angolo di certo (raccomandato l'uso di un angolo di 10 gradi). In questo modo, i danni dendritiche dei neuroni registrati possono essere ridotte, (ii) Dopo le sonde sono inserite nel tessuto cerebrale, che inizialmente sono abbassati ad un ritmo più veloce (circa 50 a 100 micron per 10-30 sec) fino a quando non ottiene più vicino alla zona desiderata della registrazione. Quando le sonde sono circa 200 micron dalla zona di destinazione, la posizione è regolata più lentamente (circacarta di circa 10 micron ogni 2 o 3 minuti).
- Stabilizzazione delle registrazioni: quando le sonde sono nella zona e l'attività viene rilevata una notevole (picchi distintivo nella maggior parte dei canali), si consiglia di attendere circa 30 minuti prima di iniziare una registrazione. Questo permetterà tessuto cerebrale per stabilizzare meccanicamente dopo l'inserimento di sonde e di garantire una registrazione più stabile.
- Pulsazione cervello: A volte è possibile vedere la pulsazione del cervello che può ridurre significativamente la qualità di una registrazione. Una piccola craniotomia (spazio appena sufficiente per adattarsi alla sonda) può ridurre la pulsazione del cervello in una zona di registrazione. Se necessario, la cisterna magna può essere forato. Questo riduce la pressione del liquido cerebrospinale e riduce il gonfiore e pulsazione.
- Silicon configurazione della sonda: sonde di silicio può avere una varietà di forme e configurazioni di siti di registrazione. Per esempio, possono variare nel numero di denti, la lunghezza e lo spessore del gambo, e inla disposizione dei siti di registrazione (ad esempio tetrodo configurazione vs lineare, vedi: www.neuronexustech.com). La scelta di sonda utilizzata, con una configurazione specifica dipende dalla questione scientifica che necessitano di una risposta. Per esempio, se l'obiettivo è di registrare popolazioni di neuroni in più posizioni in uno strato specifico (come presentato in queste registrazioni), la scelta migliore è quella di utilizzare una sonda con otto zampe e una configurazione a tetrodo. Questo permette di registrazioni di più unità ad ogni singolo tetrodo e campionamento di otto sedi in un arco di 1,4 mm. In un altro esempio, se qualcuno vuole studiare propagazioni attività attraverso strati corticali, la scelta migliore sarebbe quella di utilizzare una sonda con un gambo con i siti di registrazione regolarmente distribuiti lungo quel gambo, che permette di registrare in diversi strati corticali contemporaneamente 14.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo lavoro è stato supportato da NSERC & AHFMR. Gli autori ringraziano Mariam Alaverdashvili e Amanda Mauthe-Kaddoura per commenti sul manoscritto e Hiroe Yamazaki per un aiuto sulla preparazione intervento chirurgico.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome | Azienda | Numero di catalogo | |
| Uretano | Sigma-Aldrich | ||
| Phosphate Buffer Saline (PBS) | |||
| Isoflurano | Benson | 02241315 | |
| Silicon sonde | NeuroNexus Technologies | A 4 X 2 - Tet - 5mm - 150 - 200-312 | |
| Dye I (DiIC 18 (3)) | Invitrogen Co. | 617830 | |
| Desametasone 5 | Vétoquinol | 0A0640B | |
| Occhio unguento | Vétoquinol | 005165414 | |
| Lidocaina cloridrato 2% con epinefrina | Bimeda-MTC | 00141984 | |
| Stereotassica frame | KOPF Instruments | 1430-B | |
| Elettrodo manipolatore e titolare | KOPF Instruments | 960 | |
| Rat orecchio-bar | KOPF Instruments | 1955 | |
| Rat adattatore | KOPF Instruments | 920 | |
| Anestesia maschera | KOPF Instruments | 906 | |
| Bisturi | Strumenti chirurgici Roboz | RS-9843 | |
| Lame di bisturi | Paragone | 0086 | |
| Micro forbici dissezione | Strumenti chirurgici Roboz | RS-5910 | |
| Viti | Pasteners Gould limitata | 14084701 | |
| Pinze emostatiche | DerubareStrumenti chirurgici oz | RS-7130 RS-7211 | |
| 30 ½ aghi di calibro | Becton, Dickinson | 305115 | |
| Controllo micromotore | Foredom | HP4-917 | |
| Dissettore | Strumenti chirurgici Roboz | RS-5237 | |
| Osso di cera | Lukens | M263500 | |
| L'aria compressa bottiglia | Falcon sicurezza dei prodotti, Inc. | 50-10521C | |
| Detergente enzimatico | Boston, Bausch & Lomb | BAUSCH497628 | |
| Acqua distillata | |||
| Dental polvere acrilica | Lang Dental | 1220 | |
| Dentale liquido acrilico | Lang Dental | 1404 | |
| Sistema digitale Lynx SX | Neuralynx Inc. | 4SX-Z400 | |
| Cheeta Softwere | Neuralynx Inc. | ||
| Alligator cavi |
Riferimenti
- Buzsaki, G. Large-scale recording of neuronal ensembles. Nat. Neurosci. 7, 446-451 (2004).
- Kipke, D. R. Advanced neurotechnologies for chronic neural interfaces: new horizons and clinical opportunities. J. Neurosci. 28, 11830-11838 (2008).
- Csicsvari, J. Massively parallel recording of unit and local field potentials with silicon-based electrodes. J. Neurophysiol. 90, 1314-1323 (2003).
- Bartho, P. Characterization of neocortical principal cells and interneurons by network interactions and extracellular features. J. Neurophysiol. 92, 600-608 (2004).
- Paxinos, G., Watson, C. . The rat brain: in stereotaxic coordinates. , (1998).
- Lewicki, M. S. A review of methods for spike sorting: the detection and classification of neural action potentials. Network. 9, R53-R78 (1998).
- Harris, K. D., Henze, D. A., Csicsvari, J., Hirase, H., Buzsaki, G. Accuracy of tetrode spike separation as determined by simultaneous intracellular and extracellular measurements. J. Neurophysiol. 84, 401-414 (2000).
- Luczak, A., Narayanan, N. S. Spectral representation--analyzing single-unit activity in extracellularly recorded neuronal data without spike sorting. J. Neurosci. Methods. 144, 53-61 (2005).
- Pastalkova, E., Itskov, V., Amarasingham, A., Buzsaki, G. Internally generated cell assembly sequences in the rat hippocampus. Science. 321, 1322-1327 (2008).
- Fujisawa, S., Amarasingham, A., Harrison, M. T., Buzsaki, G. Behavior-dependent short-term assembly dynamics in the medial prefrontal cortex. Nat Neurosci. 11, 823-833 (2008).
- Harris, K. D. How do neurons work together? Lessons from auditory cortex. Hear. Res. 271, 37-53 (2011).
- Luczak, A., Bartho, P., Marguet, S. L., Buzsaki, G., Harris, K. D. Sequential structure of neocortical spontaneous activity in vivo. Proc. Natl. Acad. Sci. U.S.A. 104, 347-352 (2007).
- Robbe, D. Cannabinoids reveal importance of spike timing coordination in hippocampal function. Nat. Neurosci. 9, 1526-1533 (2006).
- Sakata, S., Harris, K. D. Laminar structure of spontaneous and sensory-evoked population activity in auditory cortex. Neuron. 64, 404-418 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon