Method Article
Субстрат поколения для эндонуклеаз CRISPR / Cas системы
В этой статье
Резюме
CRISPR / Cas системы промежуточного адаптивного иммунитета у бактерий и архей. Многие белки Cas предлагается в качестве endoribonucleases, действующих на прекурсоров crRNA различной длины. Здесь мы проиллюстрируем три различных подхода для получения предварительного crRNA субстраты для биохимического анализа деятельности эндонуклеазы Cas.
Аннотация
The interaction of viruses and their prokaryotic hosts shaped the evolution of bacterial and archaeal life. Prokaryotes developed several strategies to evade viral attacks that include restriction modification, abortive infection and CRISPR/Cas systems. These adaptive immune systems found in many Bacteria and most Archaea consist of clustered regularly interspaced short palindromic repeat (CRISPR) sequences and a number of CRISPR associated (Cas) genes (Fig. 1) 1-3. Different sets of Cas proteins and repeats define at least three major divergent types of CRISPR/Cas systems 4. The universal proteins Cas1 and Cas2 are proposed to be involved in the uptake of viral DNA that will generate a new spacer element between two repeats at the 5' terminus of an extending CRISPR cluster 5. The entire cluster is transcribed into a precursor-crRNA containing all spacer and repeat sequences and is subsequently processed by an enzyme of the diverse Cas6 family into smaller crRNAs 6-8. These crRNAs consist of the spacer sequence flanked by a 5' terminal (8 nucleotides) and a 3' terminal tag derived from the repeat sequence 9. A repeated infection of the virus can now be blocked as the new crRNA will be directed by a Cas protein complex (Cascade) to the viral DNA and identify it as such via base complementarity10. Finally, for CRISPR/Cas type 1 systems, the nuclease Cas3 will destroy the detected invader DNA 11,12 .
These processes define CRISPR/Cas as an adaptive immune system of prokaryotes and opened a fascinating research field for the study of the involved Cas proteins. The function of many Cas proteins is still elusive and the causes for the apparent diversity of the CRISPR/Cas systems remain to be illuminated. Potential activities of most Cas proteins were predicted via detailed computational analyses. A major fraction of Cas proteins are either shown or proposed to function as endonucleases 4.
Here, we present methods to generate crRNAs and precursor-cRNAs for the study of Cas endoribonucleases. Different endonuclease assays require either short repeat sequences that can directly be synthesized as RNA oligonucleotides or longer crRNA and pre-crRNA sequences that are generated via in vitro T7 RNA polymerase run-off transcription. This methodology allows the incorporation of radioactive nucleotides for the generation of internally labeled endonuclease substrates and the creation of synthetic or mutant crRNAs. Cas6 endonuclease activity is utilized to mature pre-crRNAs into crRNAs with 5'-hydroxyl and a 2',3'-cyclic phosphate termini.
протокол
1. Генерация долго предварительной crRNA подложках методом ПЦР
- Дизайн ПЦР-праймеров ориентации прокладки регионов кластера CRISPR. Добавить РНК-полимеразы Т7 (T7RNAP) промотора (5 '-taatacgactcactata-3') для прямого праймера и сайты рестрикции для клонирования продуктов ПЦР в вектор, как праймеров (например, BamHI и Hind III для pUC19, рис. 2А) .
Примечание: T7RNAP требует остатков гуанидина для правильной инициации транскрипции. - Усиление вашей предварительной crRNA интерес последовательность из геномной ДНК с помощью ПЦР.
- Отделить продуктов ПЦР с помощью электрофореза в агарозном геле и гель извлечения нужной группы. Дайджест продуктов ПЦР с ограничением ферменты, чтобы создать липкими концами (например, BamHI и HindIII, рис. 2А). Очистить свой продукт ПЦР с ПЦР-комплект очистки для устранения расщепления продуктов.
- Настройка реакции лигирования, который содержит ДНК-лигазы Т4, Т4 ДНК-лигазы буфера исо счетом 3:1 молярное отношение дрова продуктов ПЦР и дефосфорилированный линейного PUC вектор с соответствующими липкими концами. Выдержите эту смесь при температуре 16 ° С в течение ночи. Преобразование лигирования смеси в компетентные кишечной палочки DH5α клеток стандартных протоколов и использовать синий белый скрининга для выявления успешных труб.
- Изолировать плазмиды из белых колоний с использованием плазмиды комплектом подготовки. Определите положительные клоны плазмиды последовательности. Кроме того, ПЦР колоний могут быть использованы для скрининга.
2. Поколение промежуточные предварительные crRNA подложки с помощью отжига ДНК-олигонуклеотидов
- Дизайн вперед и назад олигонуклеотиды с желаемой CRISPR повтор / прокладка последовательности. Олигонуклеотиды содержат последовательность промотора Т7 РНКП, а также терминал сайты рестрикции (например, BamHI и Hind III для pUC19). Завершить олигонуклеотиды, чтобы липкие концы форму после отжига (см. рис. 2B ).
- 5'-фосфорилировать 1 нмоль каждого олигонуклеотида в отдельный 20 мкл реакционной смеси, содержащей 5 мкл T4 полинуклеотидкиназы (ПНК), 2 мкл T4 PNK 10x буфера, 2 мкл АТФ (10 мМ). Инкубируйте каждого образца в течение 1 часа при 37 ° C.
- Гибридизации двух фосфорилированных олигонуклеотидов. Объедините 1 мкл фосфорилированного вперед смесь олиго (от 2,2)., 1 мкл фосфорилированных обратном олиго смеси (с версии 2.2.), 1 мкл T4 ДНК-лигазы 10х буфера в 10 мкл реакции. Инкубируйте образцы в течение 5 мин при 95 ° С на нагревательный блок или в кипящей воде, выключить источник тепла и дайте смеси остыть до комнатной температуры (~ 2-3 часов).
Примечание: В этот критический шаг, медленный процесс охлаждения способствует отжига двух олигонуклеотидов по сравнению с формированием структуры в рамках каждого отдельного олигонуклеотида. - Лигируют 4 мкл гибридизации смеси, 1 мкл переваренной и дефосфорилирован вектор PUC (0,1 мкг /мкл) с T4 ДНК-лигазы, T4 ДНК-лигазы 10х буфера и 10 мМ АТР в 20 мкл смеси лигирования. Инкубируйте образца при 16 ° C в течение ночи.
- Преобразование лигированную плазмид в компетентные кишечной палочки DH5α клеток стандартных протоколов и использовать сине-белый скрининга. Изолировать плазмид и выявления положительных клонов пищеварения (на экране для вставки нужного размера) и последующего секвенирования плазмид.
3. Генерация коротких РНК Cas субстратов через собственный синтез РНК олигонуклеотидов
Дизайн короткого Cas РНК-субстратов (например, одной последовательности повторяем, рис. 2C) и использовать пользовательские объекты олигонуклеотида синтез РНК.
Примечание: включение дезоксирибонуклеотид в указанное положение олигонуклеотида РНК (рис. 2) могут быть использованы, чтобы точно определить место расщепления РНК.
4. Экстракорпоральное T7 транскрипции РНК-полимеразой
- Изолировать плазмид с вашим разработана конструкция (с 1,9. Или 2,7.) С помощью плазмиды maxiprep комплект очистки.
- Линеаризации плазмиды с ограничением фермента, который расщепляет вниз по течению от клонированного фрагмента (например, HindIII). Обеспечить полную пищеварения.
Примечание: Если расходящиеся определены 3 'концом РНК-транскрипта желательно, предназначенные конструкции должны содержаться дополнительные конкретные ограничения для сайта "стоки" транскрипции выше последовательности HindIII. - Очищают линеаризованной плазмидной фенол: хлороформ (1:1) добыча и осаждением этанолом. Восстановление нуклеиновых кислот ресуспендирования осадка в DEPC обработанной стерильной водой.
- Установить в пробирке Т7 РНКП бежать транскрипции смесь, содержащую 40 мМ Hepes / KOH (рН 8), 22 мМ MgCl 2, 5 мМ ДТТ, 1 мМ спермидин, 4 мМ каждого нуклеозид трифосфат (ATP, CTP, GTP, UTP ), 40-100 мкг / мл перевареннойплазмиды и 0,1 мг / мл Т7 РНКП в DEPC очищенной воды. Выдержите в течение 3 часов при 37 ° C.
- Анализ полученной РНК-транскрипты на денатурирующих 8 М мочевины 12% полиакриламидном геле (рис. 3А). РНК-транскрипты может быть очищен с помощью Mono Q анионообменной хроматографии 13 и выделяют осаждением этанолом из фракций РНК и ресуспендирования осадка в DEPC рассматриваться стерильной водой. Для дальнейшего использования, хранения РНК при температуре -80 ° C.
5. Cas6 эндонуклеазы анализа
- Настройка 20 мкл в пробирке Т7 РНКП бежать транскрипции смеси (см. 4.4), которая содержит пониженное количество 2 мМ АТФ и дополняется с 2,5 мкл α-[32 P]-ATP (10 мКи / мл, 5000 Ки / ммоль). Очищают продуктов реакции с помощью гель-экстракции из денатурирующих 8 М мочевины 12% полиакриламидном геле. Визуализируйте полос авторадиографии.
- Производим и очистить желаемую рекомбинантных белков Cas. В данном примере CAS6 из Clostridium thermocellum очищали с помощью тепла и осадков Ni-NTA хроматографии.
- Настройка реакции эндонуклеазы анализа (например, Clostridium thermocellum Cas6, реакционная смесь содержит 20 мМ Hepes (KOH pH 8), 250 мМ KCl, 2 мМ MgCl 2, 1 мМ DTT, 12.000 копий в минуту РНК-субстрата и 1 мкМ фермента и инкубировали при 37 ° С в течение 30 мин).
- Загрузите 5 мкл реакционной смеси (+ 10 мкл РНК загрузки буфера, содержащего 95% формамид) на 8 М мочевины 12% полиакриламидном геле. Визуализируйте продукты расщепления после электрофореза с помощью авторадиографии.
6. Представитель Результаты
Например РНК-субстратов для анализа деятельности эндонуклеазы Cas показано на рисунке 3А. Аликвоту 5 мкл аналитического 100 мкл в реакцию транскрипции пробирке были загружены. Обратите внимание, что эффективность производства РНК колеблется между различными конструкциями. Некоторые факторы тшляпы были обнаружены влиять на размер полученной РНК (I) исходная последовательность следующих +1 G необходимые для инициации транскрипции, (II) возможность формирования структуры РНК при транскрипции и (III) выбор ограничение сайт для поколения в стоках расщепления положение.
Исследование активности эндонуклеазы РНК требует как высокой степени очистки рекомбинантных белков Cas (рис. 3В) и надлежащего отрицательного контроля. В идеале, эта отрицательная контрольная проба отличается как можно меньше из исследованных реакций эндонуклеазы Cas. Это может быть достигнуто путем инкубации РНК с буфером реакции и клеточных лизатов без Cas выражение (и в соответствии с идентичной процедуре очистки). Идеальный отрицательного контроля является добавление дезоксирибонуклеотид в предполагаемом месте расщепления. На рисунке 3C, расщепление 5 'Терминал помечены повторить последовательность показана для Clostridium thermocellum Cas6. Под одинаковых условиях, это повтор не является субстратом больше, когда дезоксирибонуклеотид вводится в положение -9. Этот метод также предоставляет информацию о сайте расщепления. Наконец, давно внутренне помечены предварительно crRNA расщепляется Cas6 и два фрагмента расщепления не наблюдается.
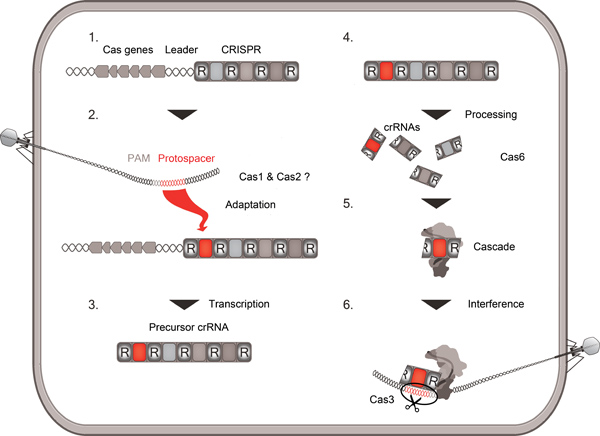
Рисунок 1. Схематический обзор CRISPR / Cas деятельности. Обзор следует включение вирусной ДНК-последовательности (protospacer) в кластере CRISPR (адаптация), транскрипции и обработки CRISPR массива в небольшом crRNAs по Cas6 эндонуклеазы, поглощение crRNAs в каскад сложных и вмешательство повторяется вирусной атаки на основе взаимодополняемости между crRNA и protospacer. Protospacer соседние мотивы (PAM) знак вирусных последовательностей protospacer.
Рисунок 2 "SRC =" / files/ftp_upload/4277/4277fig2.jpg "/>
Рисунок 2. Генерация РНК-субстратов для Cas белков. На схеме показаны рабочего процесса для создания (A) долгое предварительно crRNA субстратов, (B) промежуточные предварительные crRNA субстратов и (C) короткие РНК Cas подложки для предварительного crRNA производства. Пример последовательности представлены для CRISPR массив Clostridium thermocellum. Нажмите, чтобы увеличить показатель .

Рисунок 3. Cas6 эндонуклеазы анализа. A.) Toluidine синие окрашенные в полиакриламидном геле из специально разработанных РНК олигонуклеотидов (250 пмоль) и два в пробирке РНК-транскрипты (5 мкл 100 мкл типичная реакция). Б) SDS-PAGE гель Cas6 подготовки (80 пмоль) из Clostridium thermocellum после термическойосадков при температуре 50 ° С в течение 1 часа и Ni-NTA хроматографии. C.) Обнаружение endonucleolytic Cas6 деятельности для 5 'Терминал помечены повторяющихся последовательностей и предварительно crRNA в транскриптов пробирке. Введение дНТФ в положении -9 отменяет Cas6 расщепления в течение короткого Cas РНК-субстрата (S, рис. 2С). 5 'Терминал 8 NT теги также создается для crRNA созревания от долгой предварительной crRNA субстратов (L, рис. 2А). Полосы разделены на денатурирующих 8 М мочевины 12% полиакриламидном геле и визуализировали с помощью авторадиографии.
Обсуждение
Представленные методы позволяют поколения Cas субстратов эндонуклеазы различных диапазонов размеров и с различной последовательности свободы в дизайне. Наиболее прямым подходом для создания синтетических олигонуклеотидных субстратов РНК ограничено коротким конструкций РНК в связи с ростом затрат и технических ограничений в создании больше РНК олигомеров. В то время как успешный синтез РНК сообщалось немодифицированных олигомеров РНК длиной более 100 нуклеотидов, практичный и экономичный максимальная для пользовательского синтеза РНК лежит ниже 40 нуклеотидов. Однако любой заданной последовательности могут быть синтезированы и целевых введения модифицированные нуклеотиды (например, дезоксирибонуклеотиды) могут быть использованы для анализа сайтов расщепления в деталях. Более предварительно cRNAs должен быть сформирован через в пробирке транскрипции.
Отжига олигонуклеотидов, которые содержат РНК-полимеразы Т7 промотора позволяет для производства промежуточной длины предварительно crRNКак. Максимальная длина регулярно и экономически синтезировали ДНК-олигонуклеотидов чуть выше 150 нуклеотидов и представляет собой максимальное синтетических предварительно crRNAs с помощью этого метода. Сборка из нескольких отожженной ДНК олигонуклеотида пар, которые образуют липкие концы друг с другом может продлить этот максимальной длины, но требует увеличения проблем в клонировании конструкции. Основным преимуществом этого метода является возможность генерировать предварительно crRNA конструкции (и, следовательно, Cas эндонуклеазы субстратов) с любой желаемой последовательности. Это позволяет испытания синтетических конструкций crRNA.
Наконец, большие предварительного crRNAs может быть получен из amplificates ПЦР всей геномной CRISPR элементов или их фракций. Внесены изменения в пробирке транскрипции шаблон плазмиды могут быть введены с помощью сайт-направленного мутагенеза для создания предварительного crRNA вариантов. Эти конструкции могут быть использованы для анализа глобальных endonucleolytic картина расщепления в течение всейпредварительно crRNA.
Пионерские работы по производству немодифицированных РНК с помощью РНК-полимеразы T7 в пробирке транскрипции был основан на передаче 14 и РНК вируса мозаики костра РНК 15. Консенсус T7 РНК-полимеразы промоутер состоит из признания домена (-17 через -5) и инициирование области (-4 через +6) с инициации транскрипции при существенной гуанозин +1 16. Позиции ниже +1 может быть изменена, которая позволяет транскрипции практически любой желаемой последовательности РНК. Представленные методы генерации в пробирке стоки шаблоны транскрипции позволяет в пробирке синтеза полного предварительного crRNAs, которые соответствуют геномных регионов CRISPR или синтетические предварительно crRNA вариантов. Транскрипты, созданные с 5'-трифосфат терминала настоящему, если транскрипция реакции загрунтовать GMP для получения 5 'монофосфат концы 14. Такие концы необходимо, если стенограммы должны быть помеченыТ4 полинуклеотидкиназы и γ-[32 P]-ATP. Расщепление деятельности Cas6 и Cas6-подобных ферментов создает crRNA, которые содержат 5'-гидроксил и 2 ', 3'-концах циклического фосфата. Эти РНК могут быть проанализированы для признания Каскад комплекс.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить Jeanette Schermuly для получения рекомбинантных РНК-полимеразы Т7 и Норман Ebelt за помощь в подготовке рисунке 1. Эта работа финансировалась за счет средств от Deutsche Forschungsgemeinschaft (DFG FOR1680) и Общества Макса Планка.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии (по желанию) |
| Антарктический фосфатазы | NEB | M0289L | |
| в пробирке транскрипции класса Ultrapure нуклеотидных трифосфатов | Иена Bioscience | NU-1010 - NU-1013 | |
| Жидкостной хроматографии, ktapurifier 100 | GE Healthcare | ||
| ДНК-олигонуклеотидов | MWG Operon | ||
| РНК олигонуклеотидов | MWG Operon | ||
| Gel Extraction Kit | QIAGEN | 28704 | |
| ПЦР-очистки Kit | QIAGEN | 28104 | |
| Спин Miniprep Kit | QIAGEN | 27106 | |
| Плазмида Kit Maxi | QIAGEN | 12163 | |
| BamHI | NEB | R0136L | |
| HindIII | NEB | R0104L | |
| T4 ДНК-лигазы | NEB | M0202S | |
| T4 полинуклеотидкиназы | Ambion | AM2310 | |
| T7 РНК-полимеразы | собственного приготовления | ||
| Дезоксинуклеотид Mix решение | NEB | N0447L | |
| Мини-PROTEAN Tetra электрофорез системы | Bio-Rad | 165-8001 | |
| Буря Scanner 840 | GE Healthcare | 163723 | |
| Хранение Phosphorscreen | Молекулярная динамика | 63-0034-81 | |
| Mono Q 5/50 GL | GE Healthcare | 17-5166-01 | |
| Phusion High-Fidelity ДНК-полимеразы | NEB | M0530L | использовать буфер GC |
| Толуидиновым синим | Сигма | T3260 | |
| pUC19 | NEB | N3041S | |
| γ-[32 P]-ATP, α-[32 P] ATP- | Hartmann аналитического | SRP-401, SRP-307 |
Ссылки
- Barrangou, R. CRISPR provides acquired resistance against viruses in prokaryotes. Science. 315, 1709-1712 (2007).
- Makarova, K. S., Grishin, N. V., Shabalina, S. A., Wolf, Y. I., Koonin, E. V. A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action. Biol. Direct. 1, 7 (2006).
- Lillestøl, R. K., Redder, P., Garrett, R. A., Brugger, K. A putative viral defence mechanism in archaeal cells. Archaea. 2, 59-72 (2006).
- Makarova, K. S. Evolution and classification of the CRISPR-Cas systems. Nat. Rev. Microbiol. 9, 467-477 (2011).
- Brouns, S. J. Small CRISPR RNAs guide antiviral defense in prokaryotes. Science. 321, 960-964 (2008).
- Carte, J., Pfister, N. T., Compton, M. M., Terns, R. M., Terns, M. P. Binding and cleavage of CRISPR RNA by Cas6. RNA. 16, 2181-2188 (2010).
- Haurwitz, R. E., Jinek, M., Wiedenheft, B., Zhou, K., Doudna, J. A. Sequence- and structure-specific RNA processing by a CRISPR endonuclease. Science. 329, 1355-1358 (2010).
- Gesner, E. M., Schellenberg, M. J., Garside, E. L., George, M. M., Macmillan, A. M. Recognition and maturation of effector RNAs in a CRISPR interference pathway. Nat. Struct. Mol. Biol. 18, 688-692 (2011).
- Carte, J., Wang, R., Li, H., Terns, R. M., Terns, M. P. Cas6 is an endoribonuclease that generates guide RNAs for invader defense in prokaryotes. Genes Dev. 22, 3489-3496 (2008).
- Wiedenheft, B. Structures of the RNA-guided surveillance complex from a bacterial immune system. Nature. 477, 486-489 (2011).
- Garneau, J. E. The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA. Nature. 468, 67-71 (2010).
- Sinkunas, T. Cas3 is a single-stranded DNA nuclease and ATP-dependent helicase in the CRISPR/Cas immune system. EMBO J. 30, 1335-1342 (2011).
- Jahn, M. J., Jahn, D., Kumar, A. M., Söll, D. Mono Q chromatography permits recycling of DNA template and purification of RNA transcripts after T7 RNA polymerase reaction. Nucleic Acids Res. 19, 2786-2787 (1991).
- Sampson, J. R., Uhlenbeck, O. C. Biochemical and physical characterization of an unmodified yeast phenylalanine transfer RNA transcribed in vitro. Proc. Natl. Acad. Sci. USA. 85, 1033-1037 (1988).
- Dreher, T. W., Bujarski, J. J., Hall, T. C. Mutant viral RNAs synthesized in vitro show altered aminoacylation and replicase template activities. Nature. 311, 171-175 (1984).
- McGinness, K. E., Joyce, G. F. Substitution of ribonucleotides in the T7 RNA polymerase promoter element. J. Biol. Chem. 277, 2987-2991 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены