Method Article
Безметалловая Синтез Ynones от ацилхлориды и калия Alkynyltrifluoroborate солей
В этой статье
Резюме
The goal of this manuscript is to demonstrate a straightforward method for the preparation of ynones from acyl chloride and potassium alkynyltrifluoroborate salt starting materials. The one-pot reaction proceeds rapidly in the presence of boron trichloride without exclusion of air and moisture.
Аннотация
Ynones are a valuable functional group and building block in organic synthesis. Ynones serve as a precursor to many important organic functional groups and scaffolds. Traditional methods for the preparation of ynones are associated with drawbacks including harsh conditions, multiple purification steps, and the presence of unwanted byproducts. An alternative method for the straightforward preparation of ynones from acyl chlorides and potassium alkynyltrifluoroborate salts is described herein. The adoption of organotrifluoroborate salts as an alternative to organometallic reagents for the formation of new carbon-carbon bonds has a number of advantages. Potassium organotrifluoroborate salts are shelf stable, have good functional group tolerance, low toxicity, and a wide variety are straightforward to prepare. The title reaction proceeds rapidly at ambient temperature in the presence of a Lewis acid without the exclusion of air and moisture. Fair to excellent yields may be obtained via reaction of various aryl and alkyl acid chlorides with alkynyltrifluoroborate salts in the presence of boron trichloride.
Введение
The intention of this video is to demonstrate a straightforward approach for the preparation of compounds containing an ynone functional group from convenient starting materials. Ynones are valuable building blocks in organic chemistry that have been shown to have biomedical and material significance. Ynones are precursors to valuable organic functional groups including pyrimidines,1,2 quinolones,3 furans,4 pyrazoles,5,6 flavones,7 oximes,8 and chiral propargylic alcohols.9-11 A more convenient method for the preparation of ynones has been sought as a result of the drawbacks of traditional methods including poor functional group tolerance and tedious synthetic routes.
The reaction of metal12,13 and metalloid14 acetylides with acyl chlorides is one common route for the preparation of ynones. Alternatively, the synthesis of ynones from acyl chloride can be achieved via two-step procedures using Weinreb amides and organolithium or Grignard reagents.15 Another prevalent approach includes the addition of organolithium or Grignard reagents to an aldehyde, which is followed by the oxidation of a secondary alcohol to the corresponding ketone.16-19 Poor functional group tolerance of metal acetylides and the need to purify synthetic intermediates after each step are main deficiencies of the aforementioned methods. Transition-metal-catalyzed carbonylative couplings have recently emerged as an alternative approach for the preparation of ynones.20-22 Unfortunately, in addition to cost and toxicity associated with transition metals, metal-catalyzed carbonylative reactions often require elevated CO pressures and suffer from the presence of an undesired Sonogashira coupling byproduct. Given their utility in organic synthesis as well as the drawbacks associated with traditional synthetic methods, the development of a more straightforward method for the preparation of ynones is appealing.
Potassium organotrifluoroborate salts have recently emerged as versatile reagents in organic synthesis. Advantages including ease of preparation,23 inherent stability, low toxicity, and good functional group tolerance have made organotrifluoroborate salts attractive synthetic reagents.24-27 Organotrifluoroborate salts have been used primarily as a bench-stable equivalent of boronic acids for palladium-catalyzed Suzuki-Miyaura coupling.26 Recently, following a seminal work by Matteson and co-workers,28 Bode, Molander and others have highlighted the utility of organotrifluoroborates as reagents in non-metal catalyzed reactions.29-33 The field of transition-metal-free reactions of trifluoroborates is still in its infancy stage. Given the great potential for use of organotrifluoroborate salts in non-metal catalyzed organic synthesis, we sought to develop a novel method for the preparation of ynones from acyl chlorides and alkynyltrifluoroborate salts.
протокол
1. Синтез Ynone
- Использование аналитических весов, вес 0,15 ммоль alkynyltrifluoroborate соли желательно кали (1,5 эквивалента) и добавить в чистый сосуд, снабженный магнитной мешалкой.
- Использование стеклянным плунжером шприца, снабженного иглой, добавить 0,5 мл безводного DCM в пробирку, чтобы позволить себе 0,3 М раствор trifluoroborate.
ПРИМЕЧАНИЕ: Так как это новая методология, реакции были проведены для доказательства концепции. Для того, чтобы уменьшить количество отходов, они были выполнены в небольшом масштабе. Реакцию можно масштабировать до получения больших урожаев по мере необходимости. - Использование стекл нный шприц, добавляют 0,15 ммоль 1,0 М раствора трихлорида бора (1,5 экв, 150 мкл) по капл м в реакционный сосуд при температуре окружающей среды (20 ° C) при перемешивании. Замените крышку. Удержание или зажим колпачком реакционный сосуд таким образом, что реакционный раствор ниже ватерлинии в ультразвуком. Разрушать ультразвуком раствор в течение 30 сек при 20 ° С и частоты OF 40 кГц.
- Перемешивают реакционного раствора при комнатной температуре (20 ° С) в течение еще 20 мин. В зависимости от природы исходного материала alkynyltrifluoroborate, наблюдать изменение цвета. Изменение цвета от белого до желто-коричневого или темно-коричневого, красного или фиолетового является распространенным явлением.
- Добавить 0,1 ммоль желаемой ацильной хлорида (1,0 эквивалента) в ампуле при комнатной температуре (20 ° С) при перемешивании. С другой стороны, передавать содержимое реакционного сосуда в колбу, загруженную с помощью магнитной мешалки и 0,1 ммоль хлорангидрида. Замените крышку. Перемешивают реакционного раствора при комнатной температуре (20 ° С) в течение 30 мин.
Примечание: Как правило, изменение в очень темный цвет является показателем того, что реакция происходит. - Использование тонкослойной хроматографии (ТСХ) 34 следить за ходом реакции по сравнению с соответствующим стандарту хлорангидрида.
Примечание: В зависимости от природы исходных материалов, реакция может не перейти к завершению.цил хлорида исходного материала наблюдалось в более высоком рабочем месте, чем в конечном продукте для всех ynones, полученных на сегодняшний день с помощью этого метода.- Подготовка стандарта ацилхлорид путем разбавления приблизительно 10 мг хлорангидрида исходного материала с 1 мл этилацетата в небольшой ампуле.
- Использование TLC корректировщик, месте реакционного раствора и стандарт на стартовой линии ТСХ пластины. Совместно местом как с реакционным раствором и стандарта может быть полезным, чтобы определить, есть ли еще исходного вещества, присутствующего в реакционном растворе.
- Определить подходящий TLC подвижной фазы методом проб и ошибок. Для приготовления продукта 1а, подвижной фазы, состоящей из 1:30 этилацетат: гексан приводит к R F значений приблизительно 0,5 и 0,8 для ynone продукта и бензоилхлорида исходного материала, соответственно.
- Визуализация развитой TLC пластинку под УФ-светом. Используйте карандаш, чтобы отметить какие-либо видимые пятна.
2. водной обработки
- Гасят реакцию, добавив 1 мл холодной воды (приблизительно 5 ° C) в реакционный сосуд. С помощью пипетки Пастера перенести решение на чистую делительную воронку. Кроме того разбавить содержимое в делительную воронку с 10 мл холодной воды и экстрагируют продукт сразу в 15 мл этилацетата.
- Отменить нижнюю водную фазу и промывают органический слой один дополнительный раз с 10 мл воды и один раз 10 мл солевого раствора. Собирают органический слой в чистую колбу Эрленмейера и сухим сульфатом магния. Фильтр раствор в чистую круглодонную колбу с помощью силы тяжести фильтрации.
3. Очистка Ynone
- Использование тонкослойной хроматографии, определить подходящий подвижной фазы для очистки флэш-хроматографии продукта. Коэффициент удержания (R F) приблизительно 0,5, как правило, достаточно, чтобы отделить продукт от любого оставшегося началачисле материальные и побочных продуктов.
Примечание: В случае плохого разделения, менее пол рный система растворителей могут быть использованы таким образом, что продукт имеет более низкое значение с п л. В зависимости от полярности исходных материалов, A, гексан: этилацетат смеси в диапазоне от 30: 1 до 5: 1, как правило, пригодны. - Подготовка колонки, содержащей диоксид кремния влажного с соответствующей подвижной фазы. Добавьте слой песка в верхней части колонны с тем, чтобы не мешать кремнезем при добавлении продукта и элюента.
- Упаривают обработкой раствора с помощью роторного испарителя с температурой бани при температуре 40 ° С и поворота установлен на 120 оборотов в минуту. Растворить содержимое колбы в течение 2 мл подвижной фазы и тщательно загрузки раствора равномерно на колонке. Убедитесь, что диоксид кремния является влажным, но линия растворителя не превышает высоту кремнезема. Разрешить некоторые растворителя для элюирования таким образом, что продукт на диоксиде кремния. Добавить небольшое количество подвижной фазы и повторяют.
- Заполните колУМН подвижной фазой, определяемой в шаге 3.1; в случае продукта 1а, 30: 1, гексан: этилацетат уместно. Сбор фракций в пробирках с помощью флэш-хроматографии, чтобы ускорить процесс очистки. Просто подключите адаптер со шлангом к розетке воздуха. Регулировка давления воздуха таким образом, что элюент протекает через колонку при подход щей скорости.
- Пятно каждой из фракций с колонки на ТСХ пластине. Дополнительно, место стандарт ацилхлорид в качестве эталона. Разработка ТСХ с использованием подвижной фазы будет сочтено целесообразным в шаге 1.8. Отметить все пятна, видимые в УФ-свете, отметив, что продукт, как ожидается, имеют более низкий R F по сравнению со стандартной ацилхлорид.
- Соберите все фракции, содержащие видимые пятна в большой круглой колбе. Если более чем одно место с более низкой R F, чем в исходном материале присутствует, собирают их в отдельные колбы. Растворитель выпаривают с использованием роторного испарителя и сухой материал, собранный недеформированнойг высоком вакууме в течение двух часов.
- При необходимости, выполнить пентан мыть на небольшой колонке с целью дальнейшей очистки в ynone продукт, полученный из электронного плохой хлорангидрида исходного материала. На небольшом масштабе, то это может быть выполнено с использованием пипетки Пастера в качестве колонки.
- Растворить продукт в минимальном количестве хлороформа, дихлорметана, или диэтиловый эфир и нагрузки на колонке с силикагелем влажной пентаном. Элюировать 1-2 длин столбцов пентана через колонку и собирают в стакан с отходами.
- Элюции чистый ynone продукт из колонки с использованием пентана диэтиловый эфир или этилацетат. Собирают элюент В отдельной колбе, испаряется, и поместить в высоком вакууме в течение не менее двух часов. Получение приблизительно 10 мг продукта для характеристики ЯМР-спектроскопией.
4. Характеристика Ynone
- Охарактеризовать и оценить чистоту конечного продукта с использованием 1 H и 13 С ЯМР-спектроскопии. 34Как правило, химический сдвиг карбонильной углерода появляется около 177 частей на миллион по спектре 13 С ЯМР. Два SP атомами углерода содержащей ynone функциональной группы представлены характерные пики возле 87 и 93 частей на миллион.
- Используйте инфракрасной спектроскопии 34, чтобы определить характерный карбонильную пик ynone продукта. Делокализации электрона из соседней тройной связи, как правило, вызывает пик карбонил появляться между 1600 и 1650 см -1, в зависимости от электронных характеристик соединения.
- Определение молекулярной массы продукта и дополнительно проверить идентичность с помощью масс-спектрометрии высокого разрешения. 34
Результаты
Первоначальные усилия были сосредоточены вокруг подготовки ynone 1а от фенилацетилен trifluoroborate S1 и хлористого бензоила (рисунок 1). Таблица 1 иллюстрирует шаги Оптимизация работы в том числе скрининга различных кислот Льюиса, растворителей, а также экспертизы влияния воды на реакции , Далее, масштабы реакции была изучена путем подачи фенилацетилена trifluoroborate к оптимизированных условиях в присутствии различных ацил хлоридов (рисунок 2). Modest отличным выходом может быть получен в зависимости от природы подложки хлорангидрида. Объем реакции Кроме того, было оценено путем подготовки нескольких дополнительных примеров alkynyltrifluoroborate солей. Рисунок 3 иллюстрирует некоторые примеры других alkynyltrifluoroborate солей, которые могут быть использованы при подготовке ynones под развитых условиях. Производные Пэнylacetylene trifluoroborate электрон подшипника донорные заместители, получают соответствующие продукты ynone хорошего до превосходного выходами, а алифатические производные солей alkynyltrifluoroborate оказались несколько менее химически активные получая скромные выходы.
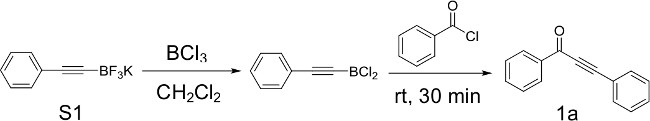
Рисунок 1: Получение Ynone 1а из фенилацетилен trifluoroborate S1 и бензоилхлорид схеме, иллюстрирующей условия для получения ynone 1а в том числе формирования реактивной dichloroborane промежуточного продукта..
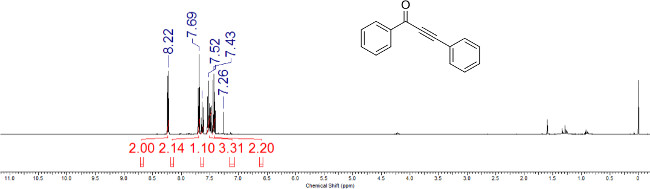
Рисунок 2:. 1 представитель H ЯМР-спектр ynone 1а Химические сдвиги и относительные интеграции характерных протонов помечены.
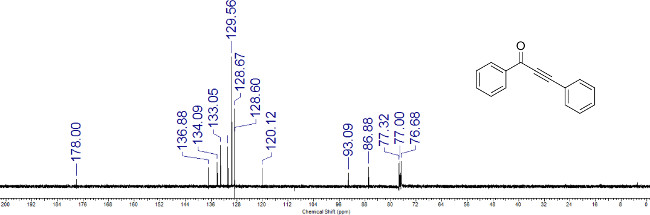
Рисунок 3:. Представитель 13 С ЯМР-спектр ynone 1а Химические сдвиги характеристических атомов углерода помечены.
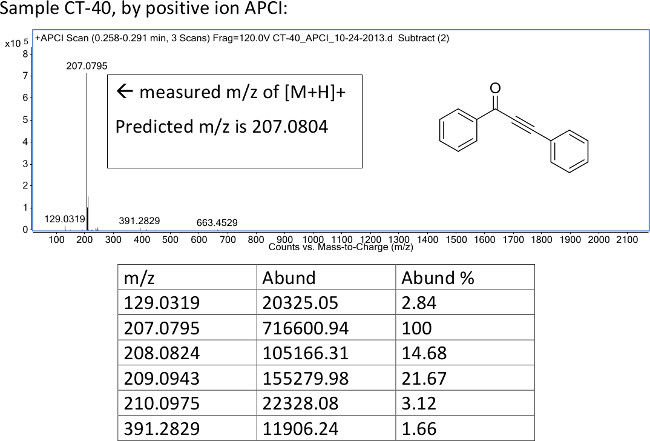
Рисунок 4:. Представитель HRMS спектр ynone 1а, полученного с помощью химического атмосферного давления ионизацией Измеренное значение м / з от [M + H] + ион сообщалось.
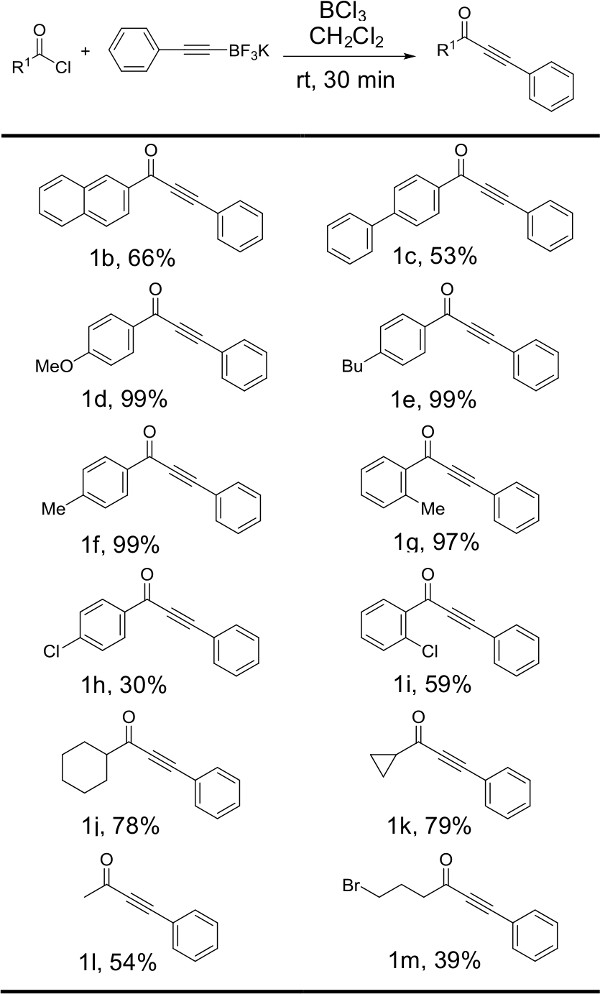
Рисунок 5: Реакции phenylacetylenetrifluoroborate соли S1 с ацилхлоридами структуры и выходы для продукции, произведенной за счет изменения личности.ацильной хлорида исходного материала проиллюстрированы. Реакции проводили с 1 экв хлорида ацил, 1,5 экв phenylacetylenetrifluoroborate калия S1 и 1,5 экв трихлорида бора.
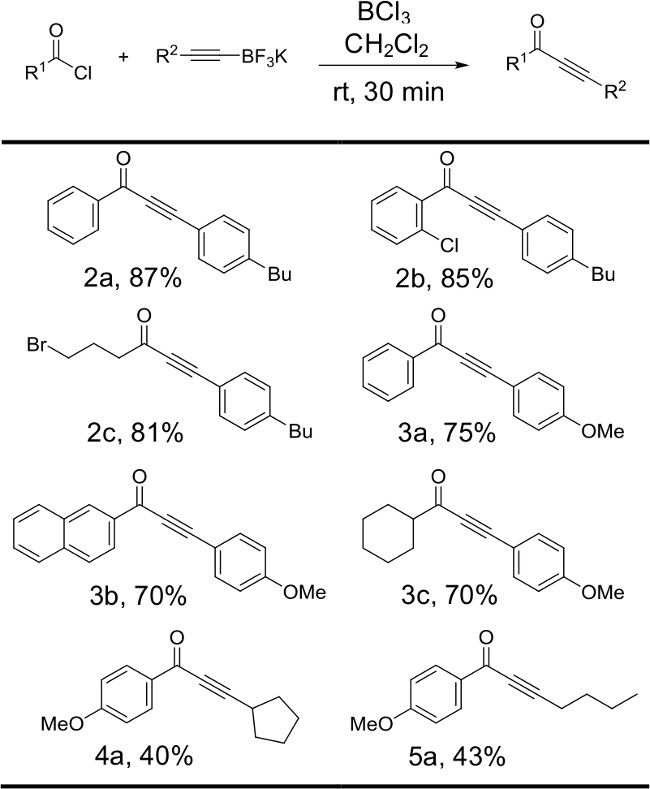
Рисунок 6:. Реакции различных alkynyltrifluoroborates с хлорангидридами структуры и выходы для продуктов, полученных путем изменения личности alkynyltrifluoroborate исходного материала проиллюстрированы. Реакции проводили с 1 экв ацилхлоридом, 2,5 organotrifluoroborate соли экв калия и 2,5 экв трихлорида бора.
| Запись | Кислоты Льюиса | Кислоты Льюиса (экв) | Обстановка | Уступать (%) |
| 1 б </ SUP> | SiO 2 | 16,5 | CH 2 Cl 2 | 0 |
| 2 | SiCl 4 | 1 | CH 2 Cl 2 | след |
| 3 | BF 3 · OEt 2 | 1 | CH 2 Cl 2 | след |
| 4 б | FeCl 3 | 1 | CH 2 Cl 2 | 24 |
| 5 с | AlCl 3 | 1 | CH 2 Cl 2 | 62 |
| 6 d | AlCl 3 | 1 | CH 2 Cl 2 | 66 |
| 7 е | AlCl 3 | 1 | CH 2 Cl 2 | 60 |
| 8 | AlCl 3 | 1 | ТГФ | след |
| 9 | AlCl 3 | 1 | толуол | след |
| 10 | AlCl 3 | 2 | ClCH 2 CH 2 Cl | 33 |
| 11 | AlCl 3 | 1 | ДМСО | след |
| 12 | AlCl 3 | 2 | ацетонитрил | след |
| 13 | AlCl 3 · 6H 2 O | 1 | CH 2 Cl 2 | 0 |
| 14 б | BCl 3 | 1,5 | CH 2 Cl 2 | 67 |
| 15 | BBr 3 | 1 | CH 2 Cl 2 | 20 |
Таблица 1:. Оптимизация условий для подготовки ynone 1а выходом продукта 1a при изменении условий реакции и катализатора кислоты Льюиса. Через Реакции проводили с 1 экв бензоилхлорида и 1 экв phenylacetylenetrifluoroborate калия S1. B 1.5 экв S1. Гр безводных условиях. Д Реакционную было сделано в не-сушат на воздухе стеклянной посуды. Е безводных условиях + 1 мкл воды.
Обсуждение
Таблица 1 иллюстрирует шаги по оптимизации условий для реакции фенилацетилена trifluoroborate с бензоилхлорида с получением соответствующего ynone продукт. Первоначально были испытаны катализаторы, известные, чтобы преобразовать organotrifluoroborates чтобы organodifluoroboranes. К сожалению, силикагель, 35 тетрахлорид кремния, 36 и трифторид бора 31,32 не способствуют образованию желаемой ynone (таблица 1, данные 1-3). Использование хлорированных катализаторов кислот Льюиса оказались более успешными. Низкий выход целевого ynone 1а было получено в присутствии железа (III) хлорида катализатора (таблица 1, вход 4). Далее, хлорид алюминия (III), была исследована в результате его хорошо налаженной способности содействовать образованию ионов oxocarbenium в Фриделя-Крафтса ацилирования. 37-39 Требуемый продукт получают с выходом 62% при алюминий (III), хлорид катализатора был эмиloyed.
Дальнейшая оптимизация показали, что воздух и влага мало влияют на выход реакции (табл 1, записи 5-7). В результате последующие реакции проводили в не высушенной стеклянной посуды в присутствии воздуха. Попытки оптимизации растворитель показали, что дихлорметан (ДХМ), в частности, хорошо подходит для реакции (таблица 1, записи 8-12). Расхождения в результатах реакций, катализируемых хлорид алюминия (III) побудили изучение альтернативных катализаторов. Коммерчески доступный алюминия (III) гексагидрата хлорида был полностью неактивен в условиях реакции (таблица 1, вход 13). Это является хорошим показателем, что образование гидрата хлорида алюминия (III) ингибирует реакцию. Бора, трихлорид было найдено, чтобы произвести подобные выходы с лучшей консистенции (таблица 1, вход 14).
При взаимодействии с alkynyltriflu калияoroborate с трихлорида бора, а более активные формы organodichloroborane формируется. 40 Этот начальный этап является критическим для реакции с ацилхлоридом и формирования ynone, чтобы продолжить. Поскольку organotrifluoroborate соли не растворимы в ДХМ, реакция протекает в гетерогенной смеси. После добавления трихлорида бора, раствор обрабатывают ультразвуком, чтобы облегчить образование активных форм dichloroborane путем увеличения площади поверхности trifluoroborate соли доступную для реакции. Применение ультразвуковых волн к реакционной смеси вызывает механическое воздействие посредством генерации кавитационных пузырьков. Во время обработки ультразвуком, схлопывании кавитационных пузырьков в результатах жидкости в локализованных областях высоких температурах и давлениях. 41 ударные волны, которые создают микроскопические турбулентности, выражающееся в увеличении кинетической энергии твердых солей trifluoroborate. Увеличение энергии системы во время обработки ультразвуком промоTES фрагментация trifluoroborate соли полученное увеличена площадь поверхности для взаимодействия с трихлорида бора. Ультразвуком реакционной смеси перед добавлением в ацилхлорид исходного материала обеспечивает эффективное образование реакционноспособных видов alkynyldichloroborane без необходимости дополнительной вынуждающих условий или более длительного времени реакции.
Фиг.2 иллюстрирует результаты, полученные при фенилацетилен trifluoroborate подвергали взаимодействию с различными хлорангидридами под оптимизированных условий реакции. Обычный ароматические (1b, 1с) и алифатические (1j-L) ацилхлориды предоставить соответствующие ynones в синтетически полезных выходами. Эти ацилхлориды подшипников донором электронов Группы (1к-г) обеспечивают прекрасные урожаи, а электронные снятия группы в результате сравнительно скромных доходности (1Н, 1i, 1M). Интереstingly, когда электрон снятия группа находится в орто-положении (1i, 59%), значительное увеличение текучести наблюдается по сравнению с аналогичным п замещенного хлорангидрида (1H, 30%). Стерических взаимодействие заместителем в орто-положении может заставить карбонильную функциональную группу из плоскости, тем самым компенсируя электроноакцепторную характер ароматическом кольце. Стоит отметить, что хлорид 4-bromobutyryl взаимодействию с получением желаемого 1m продукт с выходом 39%. Насколько нам известно, это первый протокол для синтеза ynones терпеть функциональную группу алкилбромида. Иногда, когда ацил хлоридом исходного материала является нейтральным или электронно недостаточно, алифатические примеси появляются на протонного ЯМР. Это может потребовать пентан мыть с целью дальнейшего очистки продукта. В то время как возможно, что это не экономично, чтобы выполнить пентан мыть в течение первого этапа очистки сИнс пентана дорогостоящим по сравнению с гексаном. Завершение вторичной очистки отдельно и в меньшем масштабе, таких как колонны пипетки Пастера значительно уменьшает количество пентана требуется.
Рисунок 3 иллюстрирует влияние личности alkynyltrifluoroborate соли на выход реакции. В общем, производные фенилацетилена trifluoroborate соли несущих донорных заместителей в ароматическом кольце в реакцию с ароматических и алифатических ацильных хлоридов для получения желаемых ynones хорошего до превосходного выходами (2а-с, 3а-с). Алифатические alkynyltrifluoroborate соли оказались менее реакционноспособные субстраты. Скромные выходы были получены при hexynyl- и cyclopentylethynyltrifluoroborate соли подвергают взаимодействию с электронно-богатых производных бензоилхлорид (4а, 5а).
В заключение, нового способа подготовки OF был разработан ynones из ацилхлоридами и alkynyltrifluoroborate калийных солей. Полученные для синтеза ynones этого диапазона метода от умеренных до превосходного в зависимости от характера хлорангидрида выходы и trifluoroborate исходных материалов. В общем эти исходные материалы, имеющие электронные донорные заместители претерпевают реакцию легче, чем исходных материалов, имеющих нейтральные и электроноакцепторных функциональных групп. Значение этого подхода состоит в простоту эксплуатации и функциональной группы допуска метода. Это просто, реакционную один горшок протекает быстро при температуре окружающей среды в присутствии трихлорида бора без доступа воздуха и влаги. Это удобный способ может быть использован при подготовке ynones в скромной отличным выходом из различных ацильных хлоридов и alkynyltrifluoroborate солей.
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
This work was supported by the UOIT start-up fund. We thank Mr. Matthew Baxter (UOIT) for his assistance in the laboratory.
Материалы
| Name | Company | Catalog Number | Comments |
| Sonicator | VGT | 1860QT | Ultrasonic cleaner. Similar sonication devices may be used. |
| Dichloromethane | Sigma | 270997 | Anhydrous |
| Boron trichloride solution | Sigma | 178934 | 1 M solution in DCM |
| Acyl chloride | Sigma | Various | Acyl chlorides from other suppliers such as Alfa Aesar may be used. Caution: refer to MSDS for safety information. |
| Potassium alkynyltrifluoroborate salt | N/A | N/A | Synthesized23 from terminal alkyne |
| Ethyl acetate | ACP | E-2000 | ACS grade |
| Hexanes | ACP | H-3500 | ACS grade |
| Pentane | Sigma | 236705 | Anhydrous |
| Magnesium sulfate | Sigma | M7506 | |
| Filter paper | Whatman | 1093 126 | Student grade. This speceific variety is not necessary. |
| Silica Gel 60 | EMD | 1.11567.9026 | Particle size 0.040-0.063 |
Ссылки
- Bannwarth, P., Valleix, A., Grée, D., Grée, R. Flexible Synthesis of Pyrimidines with Chiral Monofluorinated and Difluoromethyl Side Chains. J. Org. Chem. 74, 4646-4649 (2009).
- Karpov, A. S., Merkul, E., Rominger, F., Müller, T. J. Concise Syntheses of Meridianins by Carbonylative Alkynylation and a Four‐Component Pyrimidine Synthesis. Angew. Chem. Int. Ed. 44, 6951-6956 (2005).
- Arcadi, A., Aschi, M., Marinelli, F., Verdecchia, M. Pd-catalyzed regioselective hydroarylation of α-(2-aminoaryl)-α, β-ynones with organoboron derivatives as a tool for the synthesis of quinolines: experimental evidence and quantum-chemical calculations. Tetrahedron. 64, 5354-5361 (2008).
- Lee, C. G., Lee, K. Y., Lee, S., Kim, J. N. Chemical transformation of Baylis–Hillman adducts: the reaction of methyl 3-arylamino-2-methylene-3-phenylpropanoates in polyphosphoric acid. Tetrahedron. 61, 1493-1499 (2005).
- Kirkham, J. D., Edeson, S. J., Stokes, S., Harrity, J. P. Synthesis of Ynone Trifluoroborates toward Functionalized Pyrazoles. Org. Lett. 14, 5354-5357 (2012).
- Mohamed Ahmed, M. S., Kobayashi, K., Mori, A. One-pot construction of pyrazoles and isoxazoles with palladium-catalyzed four-component coupling. Org. Lett. 7, 4487-4489 (2005).
- Awuah, E., Capretta, A. Access to Flavones via a Microwave-Assisted, One-Pot Sonogashira− Carbonylation− Annulation Reaction. Org. Lett. 11, 3210-3213 (2009).
- She, Z., et al. Synthesis of Trisubstituted Isoxazoles by Palladium (II)-Catalyzed Cascade Cyclization–Alkenylation of 2-Alkyn-1-one O-Methyl Oximes. J. Org. Chem. 77, 3627-3633 (2012).
- Corey, E., Helal, C. J. Novel electronic effects of remote substituents on the oxazaborolidine-catalyzed enantioselective reduction of ketones. Tetrahedron Lett. 36, 9153-9156 (1995).
- Matsumura, K., Hashiguchi, S., Ikariya, T., Noyori, R. Asymmetric transfer hydrogenation of α, β-acetylenic ketones. J. Am. Chem. Soc. 119, 8738-8739 (1997).
- Midland, M. M., McDowell, D. C., Hatch, R. L., Tramontano, A. Reduction of. alpha.,. beta.-acetylenic ketones with B-3-pinanyl-9-borabicyclo [3.3. 1] nonane. High asymmetric induction in aliphatic systems. J. Am. Chem. Soc. 102, 867-869 (1980).
- Logue, M. W., Moore, G. L. Cuprous trimethylsilylacetylide. Preparation and reaction with acid chlorides. J. Org. Chem. 40, 131-132 (1975).
- Normant, J. Organocopper (I) Compounds and Organocuprates in Synthesis. Synthesis. , 63-80 (1972).
- Logue, M. W., Teng, K. Palladium-catalyzed reactions of acyl chlorides with (1-alkynyl) tributylstannanes. A convenient synthesis for 1-alkynyl ketones. J. Org. Chem. 47, 2549-2553 (1982).
- Nahm, S., Weinreb, S. M. N-Methoxy-N-methylamides as effective acylating agents. Tetrahedron Lett. 22, 3815-3818 (1981).
- Baba, T., Kizuka, H., Handa, H., Ono, Y. Reaction of ketones or aldehydes with 1-alkynes over solid-base catalysts. Appl. Catal., A. 194, 203-211 (2000).
- Brown, H. C., Garg, C. P. A simple procedure for the chromic acid oxidation of alcohols to ketones of high purity. J. Am. Chem. Soc. 83, 2952-2953 (1961).
- Nishimura, T., Onoue, T., Ohe, K., Uemura, S. Palladium (II)-catalyzed oxidation of alcohols to aldehydes and ketones by molecular oxygen. J. Org. Chem. 64, 6750-6755 (1999).
- Pu, L. Asymmetric alkynylzinc additions to aldehydes and ketones. Tetrahedron. 59, 9873-9886 (2003).
- Kim, W., Park, K., Park, A., Choe, J., Lee, S. Pd-Catalyzed Selective Carbonylative and Non-carbonylative Couplings of Propiolic Acid: One-Pot Synthesis of Diarylalkynones. Org. Lett. 15, 1654-1657 (2013).
- Kobayashi, T., Tanaka, M., Sakakura, T. Palladium(ii) Complex-catalysed Formation of a-Keto Acids via Double Carbonylation of Organic. Halides J. Chem. Soc., Chem. Commun. , 837-838 (1985).
- Mohamed Ahmed, M. S., Mori, A. Carbonylative Sonogashira coupling of terminal alkynes with aqueous ammonia. Org. Lett. 5, 3057-3060 (2003).
- Vieira, A. S., et al. Nucleophilic Addition of Potassium Alkynyltrifluoroborates to d-Glucal Mediated by BF3· OEt2: Highly Stereoselective Synthesis of α-C-glycosides. Org. Lett. 10, 5215-5218 (2008).
- Darses, S., Genet, J. -. P. Potassium organotrifluoroborates: new perspectives in organic synthesis. Chem. Rev. 108, 288-325 (2008).
- Darses, S., Genet, J. P. Potassium trifluoro (organo) borates: new perspectives in organic chemistry. Eur. J. Org. Chem. 2003, 4313-4327 (2003).
- Molander, G. A., Ellis, N. Organotrifluoroborates: Protected Boronic Acids That Expand the Versatility of the Suzuki Coupling Reaction. Acc. Chem. Res. 40, 275-286 (2007).
- Stefani, H. A., Cella, R., Vieira, A. S. Recent advances in organotrifluoroborates chemistry. Tetrahedron. 63, 3623-3658 (2007).
- Matteson, D. S., Kim, G. Y. Asymmetric alkyldifluoroboranes and their use in secondary amine synthesis. Org. Lett. 4, 2153-2155 (2002).
- Dumas, A. M., Bode, J. W. . Synthesis of Acyltrifluoroborates. Org. Lett. 14, 2138-2141 (2012).
- Dumas, A. M., Molander, G. A., Bode, J. W. Amide‐Forming Ligation of Acyltrifluoroborates and Hydroxylamines in Water. Angew. Chem. Int. Ed. 51, 5683-5686 (2012).
- Mitchell, T. A., Bode, J. W. Synthesis of Dialkyl Ethers from Organotrifluoroborates and Acetals. J. Am. Chem. Soc. 131, 18057-18059 (2009).
- Vo, C. -. V. T., Mitchell, T. A., Bode, J. W. Expanded substrate scope and improved reactivity of ether-forming cross-coupling reactions of organotrifluoroborates and acetals. J. Am. Chem. Soc. 133, 14082-14089 (2011).
- Zeng, J., Vedachalam, S., Xiang, S., Liu, X. -. W. Direct C-Glycosylation of Organotrifluoroborates with Glycosyl Fluorides and Its Application to the Total Synthesis of (+)-Varitriol. Org. Lett. 13, 42-45 (2010).
- Lehman, J. W. The student's lab companion: laboratory techniques for organic chemistry: standard scale and microscale. Pearson College Div. , (2008).
- Molander, G. A., Cavalcanti, L. N., Canturk, B., Pan, P. -. S., Kennedy, L. E. Efficient Hydrolysis of Organotrifluoroborates via Silica Gel and Water. 74, 7364-7369 (2009).
- Molander, G. A., Ellis, N. Organotrifluoroborates: protected boronic acids that expand the versatility of the Suzuki coupling reaction. Acc. Chem. Res. 40, 275-286 (2007).
- Calloway, N. The Friedel-Crafts Syntheses. Chem. Rev. 17, 327-392 (1935).
- Gore, P. The Friedel-Crafts acylation reaction and its application to polycyclic aromatic hydrocarbons. Chem. Rev. 55, 229-281 (1955).
- Groves, J. The Friedel–Crafts acylation of alkenes. Chem. Soc. Rev. 1, 73-97 (1972).
- Kim, B. J., Matteson, D. S. Conversion of alkyltrifluoroborates into alkyldichloroboranes with tetrachlorosilane in coordinating solvents. Angew. Chem. 116, 3118-3120 (2004).
- Thompson, L., Doraiswamy, L. Sonochemistry: science and engineering. Ind. Eng. Chem. Res. 38, 1215-1249 (1999).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены