Method Article
Temporal Упорядочение динамических данных выражений из конкретных пространственных Expression Maps
В этой статье
Резюме
The segmentation clock drives oscillatory gene expression across the pre-somitic mesoderm (PSM). Dynamic Notch activity is key to this process. We use imaging and computational analyses to extract temporal dynamics from spatial expression data to demonstrate that Delta ligand and Notch receptor expression oscillate in the vertebrate PSM.
Аннотация
During somitogenesis, pairs of epithelial somites form in a progressive manner, budding off from the anterior end of the pre-somitic mesoderm (PSM) with a strict species-specific periodicity. The periodicity of the process is regulated by a molecular oscillator, known as the "segmentation clock," acting in the PSM cells. This clock drives the oscillatory patterns of gene expression across the PSM in a posterior-anterior direction. These so-called clock genes are key components of three signaling pathways: Wnt, Notch, and fibroblast growth factor (FGF). In addition, Notch signaling is essential for synchronizing intracellular oscillations in neighboring cells. We recently gained insight into how this may be mechanistically regulated. Upon ligand activation, the Notch receptor is cleaved, releasing the intracellular domain (NICD), which moves to the nucleus and regulates gene expression. NICD is highly labile, and its phosphorylation-dependent turnover acts to restrict Notch signaling. The profile of NICD production (and degradation) in the PSM is known to be oscillatory and to resemble that of a clock gene. We recently reported that both the Notch receptor and the Delta ligand, which mediate intercellular coupling, themselves exhibit dynamic expression at both the mRNA and protein levels. In this article, we describe the sensitive detection methods and detailed image analysis tools that we used, in combination with the computational modeling that we designed, to extract and overlay expression data from distinct points in the expression cycle. This allowed us to construct a spatio-temporal picture of the dynamic expression profile for the receptor, the ligand, and the Notch target clock genes throughout an oscillation cycle. Here, we describe the protocols used to generate and culture the PSM explants, as well as the procedure to stain for the mRNA or protein. We also explain how the confocal images were subsequently analyzed and temporally ordered computationally to generate ordered sequences of clock expression snapshots, hereafter defined as "kymographs," for the visualization of the spatiotemporal expression of Delta-like1 (Dll1) and Notch1 throughout the PSM.
Введение
Сомиты первые сегменты, образованные в удлинении оси тела в развивающихся видов позвоночных и являются предшественниками позвоночника, ребер, и ткани дермы, а также мышц и эндотелиальных клеток. Во время сомитогенеза, эпителиальные сомиты образуются из несегментированной пресомитной мезодерме (PSM) (обзор в ссылке 1). Этот процесс регулируется «Дробление часов», состоящую из сети колебательные генов и белков, в основном, принадлежащие к сигнальной Паз пути. Сегментация часов состоит из различных негативных петель обратной связи, которые позволяют производить пульсирующую активности Notch в пределах одной ячейки 2 (обзор в ссылках 3 - 6). В то время как внутриклеточный метод колебаний хорошо характеризуется, она до сих пор в значительной степени неизвестно, каким образом эти колебания координируются через ПСМ ткани. Недавно было показано, с помощью экспериментальных и теоретических исследований, что эти колебания являются эссенциял в процессе сомитогенезе и что пути Notch играет решающую роль в процессе сегментации как и колебательный экспрессии гена 7, 8. Тем не менее, он был широко сообщалось , что рецептор Notch 1 (Notch1) и дельта-подобный лиганд (Dll) -1 имеют статические градиенты в PSM 9, 10, 11.
Мы предположили, что Notch-зависимые колебания сегментации ПСМ часов зависят от периодической активации основного рецептора затрагивающего пути Notch и лиганда, Notch1 и Dll1, соответственно, через ПСМ мыши. Выводы предыдущих исследований, которые сообщили статический ростральной-каудальном градиент этих белков были обусловлены, мы предсказываем, к отсутствию чувствительности в технике иммуноокрашивания. Поэтому они не в состоянии обнаружить колебания низкого уровня Dll1 и Notch1 в хвостовом PSM.
Мы ВГАе разработал метод более тщательно изучить эти факторы, сочетая экспериментальные данные с математическим моделированием для прогнозирования механизм , посредством которого колебания белков тактовых компонентов координируются через PSM 12.
Общая цель этого метода заключается в выявлении и количественной оценки низкого уровня, динамическую экспрессию белка в PSM и сопоставить профили экспрессии белков , представляющих интерес , по выражению известного гена часов, Lunatic Fringe (Lfng). Поскольку один цикл сегментации часов у эмбрионов мышей занимает 2 часа , чтобы закончить, различные образцы необходимы для построения полного пространственно - временной профиль экспрессии белка Dll1 и Notch1 в течение одного Lfng колебаний в PSM. Таким образом, мы разработали этот протокол, чтобы для обнаружения с высокой пропускной способностью экспрессии белка низкого уровня в целом монтажа, контрлатеральных эксплантов PSM. Тем не менее, этот метод также может быть полезным для исследований тшлем целью охарактеризовать динамику белка низкого уровня в любой эмбриональной ткани, которые можно разделить на контралатеральной половины.
протокол
Все эксперименты проводились в рамках проекта лицензии № 6004219 в строгом соответствии с животными (научные процедуры) Закона 1986 года и коды Великобритании Home Office, Практическое руководство по использованию животных в научных процедур.
1. PSM эксплантата Вскрытие
- Получить хвост ткани из эмбрионов , полученных в заданное время спаривания дикого типа (CD1) мышей 13. Если коротко, то на эмбриональный день (E) 10,5, усыпить беременной мыши доноров в камере диоксида углерода. Урожай рог матки и поместить его в раствор стерильно 1x забуференный фосфатом физиологический раствор (PBS) в соответствии с процедурами лицензирования Министерства внутренних дел или эквивалентных местных правил. Передача рога матки к культуре блюдо ткани, содержащей свежие, стерильные PBS. Выполнить все последующие шаги рассечение в этом растворе.
- Под стереомикроскопа, перерезать толстую мышечную оболочку рога матки с помощью изогнутых ножниц и извлечения каждого эмбриона тщательно с использованием тонких щипцов. Береги себячтобы гарантировать, что хвостовой ткани не повреждается в этом процессе. Используя изогнутые ножницы и тонких щипцов, отсечь амниотической мешок из каждого эмбриона, следя за тем, чтобы не повредить зародыш.
- Используйте либо хирургические иглы или изогнутые ножницы, чтобы собрать хвост ткани каждого эмбриона путем разрезания эмбриона кзади задних зачатки конечностей.
- Баланс хвоста ткани вентральной стороной вниз с использованием как пинцет и иглу. Генерация пары PSM эксплантов из каждого эмбрионального хвоста путем рассечения хвоста ткани на две половины вдоль средней линии; выполнить легкое качательное движение с помощью иглы. Убедитесь в том, что нервная трубка, хорда и ПСМ ткани делятся поровну между двумя эксплантов.
- Пипетировать каждый контралатеральной PSM эксплантов на нижней стороне пластика культуральную чашку крышкой 35 мм в небольшом объеме предварительно нагретом (37 ° С) культуральной среды (DMEM-F12 + 0,1% L-глутамина, заменителем, дополненной 10% фетальной сыворотки теленка , 10 нМ человеческого Bfgf, и 1% пенициллина / стрептомицина).
- Поместите блюдо на верхней части крышки и быстро переверните его так, чтобы ткань PSM подвешен крышки в "висячей капли" среды. Культура эксплантов ПСМ в увлажненной камере при 37 ° С в течение 1 - 2 ч.
- Передача пар PSM эксплантов на отдельные лунки 24-луночного планшета для культуры ткани с. Выдержите в 4% параформальдегид в PBS в течение 1 ч при комнатной температуре (RT) или 4 & deg; C в течение ночи (O / N). ВНИМАНИЕ: параформальдегид является токсичным, а также надлежащие меры предосторожности должны быть приняты при работе с этим решением.
Примечание: Выполнить все последующей промывкой и инкубацию шаги в 24-луночный планшет для тканевых культур с. - Отмывки образца скважин в PBS при комнатной температуре на качающейся платформе, с помощью тонкой пластиковой пипетки Пастера для обмена раствора PBS на образцах свежей PBS 3 - 4 раза. Процесс один PSM эксплантов из каждой пары с помощью иммуногистохимии (этап 2) , а другой с помощью флуоресцентной гибридизация для гена известны часы в (улер 3).
2. Иммуногистохимия PSM эксплантов
- Промыть один PSM эксплантов из каждой пары эмбрионального сгенерированного на шаге 1, в 2% Тритон Х-100 в PBS в течение 1 ч при комнатной температуре на ротационном платформе, а затем промыть образцы на короткое время в PBS. Заменить PBS на образцах с блокирующим раствором (2% бычьего сывороточного альбумина (БСА) и 10% сыворотки нормальной козьей (NGS) в PBS + 0,1% твин-20) и инкубировать O / N при 4 ° С на качающейся платформе.
Примечание: Все последующие промывает и стадии инкубации в этой секции должны быть выполнены при комнатной температуре на ротационном платформе, если не указано иное. растворы для промывки могут быть легко изменены с помощью остроконечного пластика или стекла пипетки Пастера. - Развести желаемых первичных антител / антитела в рабочем буфере (0,1% BSA, 0,3% NGS, и 0,2% Тритон Х-100 в PBS). В этом примере, разбавленные антитела Dll1 и Notch1 1:25 в рабочем буфере.
Примечание: Оптимизация потребуется для определения соответствующего коэффициента разбавления требуется в This шаг, если используются альтернативные антитела. - Выдержите эксплантов в раствор антител в течение 3 - 5 дней при температуре 4 ° С на качающейся платформе. Не забудьте включить некоторые образцы с рабочим буфером, не содержащий первичное антитело, чтобы действовать в качестве контроля вторичных антител.
- Восстановление раствора первичного антитела в трубке хранения 1,5 мл с помощью пипетки и хранить его при температуре 4 ° С.
Примечание: Восстановленные первичное антитело может быть использовано несколько раз, в зависимости от используемого антитела. - Выполните 2 промывками образцов в течение 5 - 10 мин каждый в PBS, а затем 3 промывок в течение 10 мин каждый в 2% Тритон Х-100 в PBS при комнатной температуре на ротационном платформе.
- Развести флуоресцентно меченого вторичного антитела / антитела (эпитоп соответствием с первичным антителом / использовали антитела) в рабочем буфере. При желании можно добавить 20 мкг / мл Hoechst 33342 к этому раствору, чтобы контрастное ядер.
Примечание: Оптимизация может потребоваться, чтобы определить соответствующий коэффициент разбавления, необходимое на этом этапе. В этом еXample, коэффициент разбавления 1: был обычно используется 400. - Центрифуга раствор вторичного антитела в течение 10 мин при 16 XG, чтобы предотвратить образование агрегатов антител. Добавить 250 - 500 мкл вторичного раствора антител к каждому образцу скважины, следя за тем, чтобы не использовать последние несколько микролитров раствора, который может содержать агрегаты антител.
- Накройте образец пластины с фольгой, чтобы свести к минимуму воздействия света и инкубировать образцов в растворе вторичного антитела в течение 3 - 5 дней при температуре 4 ° С в темноте.
- До крепления образца мыть образцы дважды в течение 10 мин каждый раз в 0,1% Tween-20 в PBS (PBST) и один раз в течение 5 мин в PBS при комнатной температуре на ротационном платформе (этап 4).
3. Флуоресцентные В гибридизация (FISH) ПСМ эксплантов
- При хранении в альтернативном судне, передавать оставшиеся контралатеральной эксплантов PSM на отдельные лунки 24-луночного планшета для культуры ткани с.
- Вымойте образцы для10 мин в 50% этанола в PBST, а затем выполняют 2 промывок в течение 10 минут каждый в 100% этанола на качающейся платформе при комнатной температуре обезвоживает ткани.
Примечание: Все последующие промывает и стадии инкубации в этой секции должны быть выполнены при комнатной температуре на ротационном платформе, если не указано иное. - Увлажняет ткани путем промывки в течение 10 мин в 50% этаноле в PBST, с последующей промывкой дважды в течение 5 мин каждый в PBST.
Примечание: Шаги 3.2 и 3.3 необходимые шаги, необходимые для фиксации этого протокола и не могут быть опущены. - Инкубируйте образцы с 10 мкг / мл протеиназы К в 0,1% Tween-20 в PBS (PBST) в течение 5 мин без перемешивания. Быстро удалить протеиназы К и прополоскать образцы кратко с PBST перед тем после фиксации ткани в течение 30 мин в 4% раствор формальдегида + 0,1% глутарового альдегида в PBST. ВНИМАНИЕ: Оба формальдегид и глутаральдегид являются токсичными, а также надлежащие меры предосторожности должны быть приняты при работе с этими решениями.
Примечание: Следующая стиральнаяи стадии инкубации с участием 50% и 100% гибридизационных смеси (шаги 3.6 - 3.9) следует проводить без перемешивания. - После промывки образцов в два раза в течение 10 мин каждый раз в PBST, мыть образцы один раз в 50% смеси гибридизация (подходит для интронных зондов: 50% формамида, 5x цитрат физиологическим раствором натрия (ССК), 5 мМ ЭДТА, 50 мкг / мл т-РНК, 0,2% твина-20, 0,1% SDS и 100 мкг / мл гепарина) в PBST готовили при комнатной температуре. Инкубируйте образцы в этом растворе в течение 10 мин при 65 ° С без перемешивания.
- Промыть образцы дважды с предварительно нагретом (65 ° C) гибридизация смеси до инкубации образцов в гибридизационных смеси в течение ≥ 2 ч (до 48 ч) при 65 ° С (более длительное время инкубации улучшить результирующий сигнал-шум, контраст) , Удалите гибридизационная смесь из предыдущего шага, и заменить его на 0,25 - 0,5 мл подогретого (65 ° C) гибридизация смеси содержащей дигоксигенином (DIG) меченных анти-смысловой РНК-зонда против известного компонента сегментации часов.
НЕЕ: Например, интронного лунатиков (Lfng (I)) зонд был использован в концентрации 20 мкл / мл , чтобы обнаружить возникающую мРНК LFNG. Разбавление используемое на этой стадии является зонд-зависимый и потребует оптимизации. - Уплотнение пластины с использованием липкой лентой для предотвращения испарения и инкубировать образцов в растворе зонда в течение двух суток при температуре 65 ° C.
- С помощью остроконечного пластиковую пипетку Пастера, восстановить зонд для повторного использования и хранить его при температуре 20 ° С. Промыть образцы дважды с предварительно нагретом (65 ° С) после гибридизация смеси (50% формамид, 0,2% твин-20, и 1x SSC) перед стиркой образцов еще два раза в течение 20 минут каждый при 65 ° С в предварительно нагревают после гибридизации смеси.
- Промыть образцов в течение 15 мин при температуре 65 ° С в предварительно нагретый 50% смеси гибридизационного в 0,1% твина-20 в Трис-солевом буферном растворе (TBST). Промыть образцы дважды TBST перед стиркой в течение 30 мин при комнатной температуре в TBST на качающейся платформе.
- Предварительно инкубировать эксплантов в БлоCking раствор (TBST + 2% блокирующим буферным раствором реагента (BBR) + 20% термообработанного козьей сывороткой) в течение как минимум 2 ч. Заменить этот раствор свежим блокирующим раствором, содержащим 1: 200 разбавление с пероксидазой хрена (HRP) анти-дигоксигенином антитела. Инкубируйте образцы O / N при температуре 4 ° С.
- После инкубации антитела, ополоснуть образцов 3 раза TBST при комнатной температуре и передавать их на отдельные лунки нового 24-луночного планшета для культуры ткани. Промыть эксплантов с TBST 3 раза в течение 1 ч каждый.
- На данный момент, передать образцы в 0,5 мл пробирки для хранения или отдельные лунки 48-луночного планшета для культуры ткани с, чтобы уменьшить необходимый объем реагентов для обнаружения сигнала усиления Tyramide (TSA) в следующих шагах.
- Инкубируйте образцы в АСП амплификации буфере (список реагентов) при комнатной температуре в течение 1 мин без перемешивания с использованием в качестве небольшого объема, как это возможно, убедившись, что образцы полностью погружены в раствор.
- Добавьте реагент TSA (смСписок реагентов) в буфер амплификации образца в разведении 1:50. Быстро перемешать раствор до тех пор пока реагент АСП не распределяется равномерно, покрывают пластины или трубы в оловянной фольги, и инкубировать образцов в течение 60 - 90 мин в темноте.
- Удалите раствор амплификации TSA и мыть образцы в TBST 3 раза в течение 5 минут каждый. Передача эксплантов обратно в 24-луночного планшета для культуры ткани в увеличивать объем стирки и инкубировать образцов в 1% -ной перекиси водорода в TBST в течение 1 ч. Промыть образцы с TBST 3 раза в течение 5 мин каждый раз, а затем два раза в течение 5 мин каждый с PBST до крепления образца (этап 4).
4. Подготовка образцов для обработки изображений
- Подготовьте один заряженный адгезию предметное стекло для каждой пары эксплантов путем добавления толстых распорки изображений 0,12-мм, которые предотвращают образцы от раздавливания путем добавления покровным. Удалите клейкую полоску с одной поверхности прокладки и поместить его клейкой стороной вниз на предметное стекло, нажав Firmly для герметизации распорки на слайде.
Примечание: Для остальных шагов, стремиться сохранить образцы в условиях низкой освещенности или в темноте, чтобы избежать фотообесцвечивания. Пипетка пары эксплантов на подготовленных слайд с помощью стеклянной пипетки Пастера в центре обработки спейсера, гарантируя, что расчлененный сторона эксплантов сталкивается с горкой. Устройте контралатеральной пары эксплантов бок о бок. - Удалить как можно больше жидкости, как это возможно из слайда с помощью стеклянной пипетки Пастера и фитиль от любой остаточной влажности окружающего образцы, используя кусок сложенной бумаги ткани низкого ворса.
- Разрешить образцы придерживаться слайда в течение 45 - 60 секунд, пока ткань не начинает казаться липким и прозрачным. В течение этого времени, удалите остатки клея вкладыш из распорки с помощью щипцов. Не позволяйте образцы высохнуть.
- Добавьте большую каплю бифункциональных mountant и клирингового раствора (0,5% п-фенилендиамина и 20 мМ Трис, рН 8,8, в 90% глицерина) к образцам в центрепроставки. Примечание: Это решение становится коричневым / черным, когда разрешено окисляется.
- Осторожно поместите круглую покровное (нет. 1.5) по образцам, гарантируя, что mountant распределяется равномерно и что все ребра покровного стекла в контакт с прокладкой. Поместите крышку-просочился слайд вниз головой на некоторую папиросную бумагу низкого ворса.
- С небольшим усилием надавите, чтобы гарантировать, что покровное полностью придерживается проставки и что любой избыток mountant удаляется. Повторяйте, пока не более mountant кляксами бумагу.
- Чистый и маркировать слайд (ы) надлежащим образом, а не хранить их в темноте до формирования изображения, краткосрочные при -20 ° С или долгосрочной перспективе, при -80 ° С. После удаления слайды из хранения, позволяют им полностью разморозить, прежде чем визуализации.
- Изображение смонтированные образцы с помощью конфокальной микроскопии с плиточным приобретением и высокой цели увеличения. Изображение пары эксплантов с использованием объектива масла погружения 40X на 4-мкм Z-интервалов с использованием 488 нм, 568 нм и 647-нм лазер Liуказанные в другом месте , чтобы возбудить зеленый, красный, и дальнего красного флуорофоров, соответственно, используемые для обнаружения белка и мРНК в этом исследовании 12.
ПРИМЕЧАНИЕ: Плиточные изображения были сшиты после приобретения для формирования единого изображения для анализа.
5. После сбора анализа изображений
- С помощью программного обеспечения для анализа изображений для определения области, представляющей интерес в PSM каждого экспериментального образца.
- Для количественной оценки уровней экспрессии, вычитать фон и пороговые изображения на уровне процедуры отсутствия первичного контрольного образца, перед последующим квантификации. Определить происхождение, ось, и единицы длины для каждого образца.
- Рассчитать интенсивность флуоресценции в зависимости от положения вдоль нормированного ростро-каудальной оси для каждой из М выборок 12. После нормализации графики интенсивности, поместите сторону профилей интенсивности бок и получить матрицу интенсивности F (I, J) , который описывает интенсивность в I й пространственной позиции в J - й пробы.
6. Временная Заказ образцов
- Для того, чтобы вывести временную упорядоченность известного компонента часов, определить ее матрицу интенсивности. Затем переставить столбцы матрицы интенсивности, с тем, чтобы получить временно периодический шаблон. Для этого определим функцию
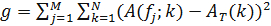
где А (е J; к) представляет собой автокорреляционную функцию J - го столбца Г и Т является функцией целевой автокорреляции, выбирается для обеспечения временной периодичности рисунка, задается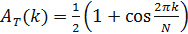
- Используйте Метрополиса-Гастингса (или другой алгоритм минимизации) 12 , чтобы определить порядок образцов , которые сводят к минимуму функции г. Таким образом, определяют порядок изM образцы, которые максимизирует временную периодичность известного компонента часов.
- Использование INFERRED временного упорядочения М выборок, построить упорядоченную кимографе для паттерна экспрессии в Partnered канале 12.
Результаты
Этот протокол позволяет визуализировать пространственно - временного профиля интересующего белка наряду с транскрипцией генов часов в PSM мыши 12. Например, Dll1 (рис 1A-C) и экспрессия белка Notch1 (рис 1D-F) показаны вибрировать из синхронности с зарождающейся транскрипции Notch-регулируемых генов сегментации часы Lfng. Количественное Dll1, Notch1 и Lfng (I) интенсивность сигнала по отношению к оси переднезадней (AP) на PSM (рис 1G) показывает четкой динамики колебательные выражение для этих целей (рис 1H-J). Пространственно-временной профиль экспрессии белка Dll1 и Notch1 на протяжении всего цикла часов четко визуализировать и количественно, используя этот протокол на основе анализа изображений после приобретения данных изображения с высокой разрешающей способностью фиксированных тканей.
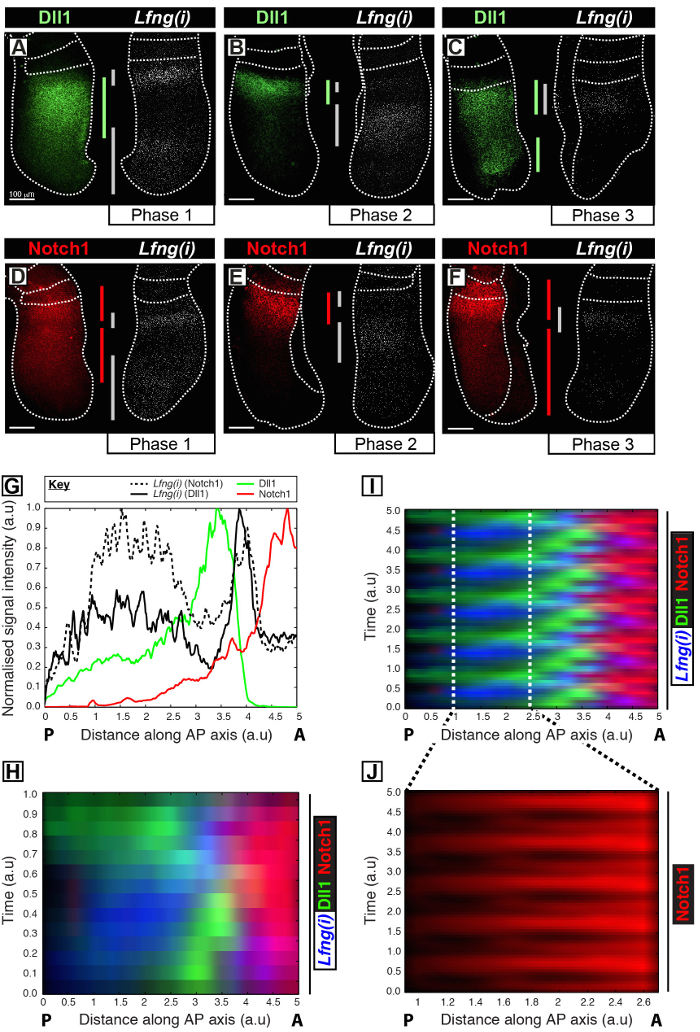
Рисунок 1: Пространственно-временной визуализации и Количественное Dll1 и Notch1 экспрессии белка Dynamics. (AF) Пары эксплантов из шести E10.5 эмбрионов (AF) , показывающие пространственное распределение белка Dll1 (AC) или белка Notch1 (DF) в одной половине наряду с обнаружением Lfng пре-мРНК (Lfng (I)) в соответствующий контралатеральной половину каждой пары. Панели расположены в соответствии с этапа 1 (А и D), фаза 2 (В и Е), и этап 3 (C и F) цикла сегментации часов, как определено пространственным профилем (I) выражение LFNG. Степень экспрессии доменов для Dll1 (зеленый), Notch1 (красный), и Lfng (I) (серый) вдоль передне-задней оси ПСМ имеют Ьееп разграничены полосы, кодированные цветом. Пунктирные линии разграничить позиции совсем недавно сформированного сомитов (ами), внешними краями ПСМ и прилегающей нервной ткани (С и Е). Шкала баров (слева внизу каждой панели, AF) представляют 100 мкм. (G) Пример интенсивности участок изображающие осевое изменение интенсивности сигнала через ПСМ. Данные нанесены из двух эксплантов пар , показывающих LFNG пре-мРНК (черный хешированная линия) в одном эксплантов по сравнению с белком Notch1 (красного цвета) в контралатеральной эксплантов (Embryo 1), а также LFNG пре-мРНК (черная сплошная линия) в другой эксплантов по сравнению с белком Dll1 (зеленый) в контралатеральной эксплантов (Эмбрион 2). Измеренная интенсивность сигнала (ось у) представлен в зависимости от осевого положения (оси х; передняя PSM [A] к правой и задней PSM [P] слева). (Н) кимографе показывающая пространственное распределение Dll1, Notch1 и Lfng (I) помногочисленные PSMS. Каждая строка кимографе представляет интенсивность сигнала отдельного PSM эксплантов. Ряды расположены во временной последовательности в соответствии с пространственно - временного распределения Lfng пре-мРНК (I) пространственно - временного распределения Dll1, Notch1 и Lfng (I) через нескольких колебаний тактовых имитируется периодическим продолжением данных , представленных в (H) , выделяя колебательный характер динамики экспрессии Dll1 и Notch1. Экспрессия белка (J) Пульсирующие Notch1 в каудальной части PSM подсвечивается увеличением области разграничены в виртуальном кимограф , показанном на (I). Модифицированный из ссылки 12. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
 Рисунок 2: Количественный анализ пространственно-временной динамики Dll1 и Notch1 экспрессии белка. (А) Пример интенсивности участок изображает осевое изменение в интенсивности сигнала через ПСМ. Данные , представленные из двух эксплантов пар показывая LFNG пре-мРНК (черный хешированная линия) в одном эксплантов по сравнению с белком Notch1 (красного цвета) в контралатеральной эксплантов половину, а также LFNG пре-мРНК (черная сплошная линия) в полупространстве эксплантов от а второй хвост по сравнению с белком Dll1 (зеленый) в контралатеральной эксплантов половине второго хвоста. Измеренные интенсивности (ось у) нанесены на график осевого положения (оси х; ростральной [A] справа и хвостового [P] слева). (BH) Kymographs показать пространственное распределение Notch1, Dll1, NICD и Lfng (I) через многочисленные PSMS. (В и С) НИИБ (В) и Dll1 (С) экспрессии в разделах PSM; (D и E) Lfng (I) (D) и Dll1 (<сильный> E) в контралатеральной эксплантов половинок; (F и G) , Lfng (I) (F) , и Notch1 (G) , в контралатеральной эксплантов половинок. Из Reference 12. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Рисунок 2: Количественный анализ пространственно-временной динамики Dll1 и Notch1 экспрессии белка. (А) Пример интенсивности участок изображает осевое изменение в интенсивности сигнала через ПСМ. Данные , представленные из двух эксплантов пар показывая LFNG пре-мРНК (черный хешированная линия) в одном эксплантов по сравнению с белком Notch1 (красного цвета) в контралатеральной эксплантов половину, а также LFNG пре-мРНК (черная сплошная линия) в полупространстве эксплантов от а второй хвост по сравнению с белком Dll1 (зеленый) в контралатеральной эксплантов половине второго хвоста. Измеренные интенсивности (ось у) нанесены на график осевого положения (оси х; ростральной [A] справа и хвостового [P] слева). (BH) Kymographs показать пространственное распределение Notch1, Dll1, NICD и Lfng (I) через многочисленные PSMS. (В и С) НИИБ (В) и Dll1 (С) экспрессии в разделах PSM; (D и E) Lfng (I) (D) и Dll1 (<сильный> E) в контралатеральной эксплантов половинок; (F и G) , Lfng (I) (F) , и Notch1 (G) , в контралатеральной эксплантов половинок. Из Reference 12. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Критические шаги в рамках Протокола
Настоящий протокол описывает чувствительный метод для выполнения количественного анализа экспрессии белка и колебательной динамики низкоуровневых в E10.5 мыши PSM эксплантов. Надежный протокол для обоих иммуногистохимии и флуоресцентной гибридизация (FISH) в сопровождается высоким разрешением целом монтажа конфокальной микроскопии, а затем с помощью анализа изображений и временной сегментации kymographs для генерации пространственно - временную карту экспрессии белка через ПСМ. Высокое отношение сигнал-шум в белка и мРНК обнаружения имеет важное значение для обеспечения успеха этой техники. Необходимо соблюдать осторожность, чтобы тщательно обмениваться все решения эффективно в течение стадий промывки и поддерживать температуру C стирок 65 ° в соответствующих стадиях шага 3. Это наиболее выгодно взять время, чтобы источником эффективных антител и РНК-зондов, направленными против объектами интереса и проверить эти реагентыТщательно на целом монтажа образцов перед началом этого протокола.
Модификации и устранение неисправностей
Основные вопросы, с которыми можно столкнуться при выполнении этого протокола возникают из-за плохой прочности обнаружения сигнала и качества. Это во многом зависит от эффективности антител или РНК-зондов, используемых для иммуногистохимии или FISH шагов в протоколе, соответственно. Ряд различных этапов может потребовать оптимизации перед тем, адекватного обнаружения сигнала достигается. Одной из распространенных причин для плохого обнаружения сигнала является неправильное крепление; крайне важно, чтобы либо свежей PFA или PFA хранят при температуре 4 ° С в течение не более чем за одну неделю используется для фиксации образцов. Длина записи, может также требуют оптимизации, в зависимости от зонда антитела или РНК, используемую. Для получения антител, рекомендуется следовать инструкциям производителя, где это возможно, а для РНК-зондов, мы рекомендуем консультацию опубликованной литературы.
В этом исследовании мы использовали РНК - зонд , который специфически обнаруживает пре-мРНК гена Lfng часов. Из - за относительного отсутствия изобилия, обнаружение LFNG пре-мРНК требует длительного периода инкубации с зондом гибридизации смеси , содержащей 5x цитрат натрия-солевой раствор (SSC) для хорошего обнаружения сигнала. Те же самые условия могут применяться к другим зондами , которые обнаруживают слабо выраженные мРНК, но в нашем опыте, обнаружение более стабильных мРНК мишеней может потребоваться более короткий шаг гибридизации зонда и более низкие концентрации SSC в гибридизация смеси (например, 1.3x SSC). Для обоих иммуногистохимии и FISH, протокол сначала должен быть оптимизирован на целых эмбрионов, а также оптимальная концентрация антитела или зонда должны быть определены эмпирически.
Ограничения техники
Как уже упоминалось выше, успех этого метода сильно зависит от качества белка и обнаружение мРНК. Wе наметили несколько предложений относительно того, как белок и обнаружение мРНК может быть улучшена, но при отсутствии сигнала обнаружения флуоресцентного высокого качества, нет никакого способа, эксперимент может продолжиться. Число белковых мишеней, которые могут быть проанализированы в каждом образце ткани ограничена спектральным разрешением конфокальной микроскопии и эпитопов антител, используемых. В данном исследовании мы смогли использовать до трех эпитопов для обнаружения белка наряду с красителем ДНК на каждом образце 12. Этот протокол позволяет только обнаружение одной мРНК - мишени, хотя в настоящее время альтернативные методы могут быть использованы для увеличения это до трех мишеней 14.
Значимость техники в отношении существующих / альтернативных методов
Описанный здесь метод обеспечивает чувствительный метод для обнаружения колебаний белка низкого уровня в целом монтажа эксплантов PSM. Количественное этой динамикивозможно путем проведения FISH для известного гена часы в соответствующих контралатеральной эксплантов. Библиотека kymographs генерируется, что может быть организовано по одному сегментация тактовый цикл, выделяя пространственно-временные динамики экспрессии мишени интерес в течение этого времени. Основное различие в этой технике над другими является использование вычислительной автоматизации для заказа во времени больших массивов данных, что позволяет пространственно-временные динамику экспрессии новых компонентов тактовыми, подлежащих анализу беспристрастно. Например, этот метод при условии, понимание того, как Dll1 и Notch1 белки и их колебания совместно регулируются по всей PSM. Альтернативные методы в этом контексте также полагаться на иммунное окрашивание, но они не обнаружили небольшие колебания уровней белка Dll1 и Notch1 в хвостовом PSM, которые были очевидны с использованием этого метода. Вместо этого, они сообщили , устойчивый градиент выражения , что является самым сильным в ростральной области 9 , 10, 11. Это может быть связано с тем, что этот протокол имеет более длительный первичный гуморальный инкубационный период (3 - 5 дней, в противоположность в течение ночи), которая может потребоваться для обнаружения более низкие уровни белка. По мере того как уровни Dll1 и экспрессии Notch1 являются относительно высокими в ростральной PSM, это, возможно, повлияли на авторов к изображению образцов при более низкой настройки экспозиции, чем было бы необходимо, чтобы обнаружить хвостового экспрессию белка. Еще одно потенциальное несоответствие возникает из - за использования нефиксированной ткани в исследовании Чапмен и соавт. , В которой преходящего выражение Dll1 и Notch1 в каудальной части PSM , возможно, были менее хорошо сохранившееся 9.
Будущие приложения или направления после овладения техникой
После того, как этот протокол был освоен, анализ экспрессии с высокой пропускной способностью может быть выполнена для любого интересующего белка в PSM.PSM эксплантов, сгенерированные из нескольких пометов мыши могут быть обработаны сразу для создания номера высокого проб, необходимого для проведения анализа. Хотя мы использовали только эмбрионов дикого типа в этих исследованиях, можно провести такой анализ с использованием генетически модифицированных эмбрионов с целью оценки важности одного или нескольких факторов на динамику экспрессии белка. Помимо ПСМ, этот протокол может быть адаптирован к другим системам, которые состоят из двух половинок контралатеральной и могут быть использованы для обнаружения чувствительно экспрессии белка и колебательные Микродинамику. Одним из примеров , для которых этот протокол может быть адаптирован является исследование динамической экспрессии белка в мышиной нервной трубки, так как половинки контралатеральные может быть сгенерирован и культивируют, и активность Паз было показано, что оба присутствуют и важны для формирования паттерна 15. Мы призываем другие группы, чтобы адаптировать этот протокол к другим системам и обеспечить обратную связь для дальнейшего совершенствования.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Эта работа была поддержана студенчества MRC на RAB-регулирование, с студенчества MRC к CSLB, и гранта WT проекта до JKD (WT089357MA). Работа была также поддержана Welcome Trust стратегического премии (097945 / Z / 11 / Z). Мы благодарим д - ра Е. Kremmer за любезное дар антитела Dll1 и д - р О. Pourquie для зонда Lfng РНК.
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM-F12 | Gibco (ThermoFisher Scientific) | 11320033 | |
| GlutaMAX™-1 (100x) | Gibco (ThermoFisher Scientific) | 35050 | |
| Fetal Bovine Serum, qualified, E.U.-approved, South America origin | Gibco (ThermoFisher Scientific) | 10270106 | |
| Recombinant Human FGF-basic (154 a.a.) | Peprotech | 100-18B | |
| Penicillin/Streptomycin | Gibco (ThermoFisher Scientific) | 15140122 | |
| anti-mouse monoclonal Notch1 antibody^ | BD Pharmingen | 552466 | |
| anti-rat polyclonal Dll1 antibody^* | N/A | N/A | |
| Lfng intronic anti-sense RNA probe^* | N/A | N/A | |
| 16% paraformaldehyde | Pierce (ThermoFischer Scientific) | PI28908 | |
| Proteinase K, recombinant, PCR grade | Roche (Sigma-Aldrich) | 31158 | |
| Phosphate buffered saline (PBS), pH 7.4 | Made in house | N/A | |
| Triton-X 100 | Sigma-Aldrich | T8787 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich | 5470 | |
| Normal goat serum (NGS) (heat-treated) | Gibco (ThermoFisher Scientific) | 16210072 | |
| Hoechst 33342 | ThermoFischer Scientific | H3570 | |
| Tween-20 | Sigma-Aldrich | P9416 | |
| Ethanol | Sigma-Aldrich | 46139 | |
| Glutaraldehyde | Sigma-Aldrich | 340855 | |
| Formamide | Sigma-Aldrich | F9037 | |
| Saline-sodium citrate (SSC) | Sigma-Aldrich | 93017 | |
| EDTA | Sigma-Aldrich | 798681 | |
| tRNA | Roche (Sigma-Aldrich) | 101095 | |
| Heparin | Sigma-Aldrich | H3149 | |
| Tris-buffered saline (TBS) | Made in house | N/A | |
| Blocking Buffer Reagent | Roche (Sigma-Aldrich) | 11096176001 | |
| anti-DIG horseradish peroxidase (HRP) conjugated antibody | Roche (Sigma-Aldrich) | 11207733910 | |
| Tyramide signal amplification (TSA) kit | Perkin Elmer | NEL744001KT | |
| *The Dll1 antibody and RNA probe used in this study are not commercially available. Please see acknowledgements for sources. | |||
| ^Antibodies/RNA probes should be sourced which are applicable to the research interests of the reader. | |||
Ссылки
- Oates, A. C., Morelli, L. G., Ares, S. Patterning embryos with oscillations: structure, function and dynamics of the vertebrate segmentation clock. Development. 139 (4), 625-639 (2012).
- Krol, A. J., Roellig, D., et al. Evolutionary plasticity of segmentation clock networks. Development. 138 (13), 2783-2792 (2011).
- Dequéant, M. -. L., Ahnert, S., et al. Comparison of Pattern Detection Methods in Microarray Time Series of the Segmentation Clock. PLoS ONE. 3 (8), 2856 (2008).
- Bailey, C., Dale, K. . Somitogenesis in Vertebrate Development. , 1-15 (2015).
- Maroto, M., Bone, R. A., Somitogenesis Dale, J. K. Somitogenesis. Development. 139 (14), 2453-2456 (2012).
- Kageyama, R., Masamizu, Y., Niwa, Y. Oscillator mechanism of notch pathway in the segmentation clock. Developmental Dynamics. 236 (6), 1403-1409 (2007).
- Ferjentsik, Z., Hayashi, S., et al. Notch Is a Critical Component of the Mouse Somitogenesis Oscillator and Is Essential for the Formation of the Somites. PLoS Genetics. 5 (9), 1000662 (2009).
- Wiedermann, G., Bone, R. A., Silva, J. C., Bjorklund, M., Murray, P. J., Dale, J. K. A balance of positive and negative regulators determines the pace of the segmentation clock. eLife. 4, 05842 (2015).
- Chapman, G., Sparrow, D. B., Kremmer, E., Dunwoodie, S. L. Notch inhibition by the ligand DELTA-LIKE 3 defines the mechanism of abnormal vertebral segmentation in spondylocostal dysostosis. Human Molecular Genetics. 20 (5), 905-916 (2011).
- Sparrow, D. B., Chapman, G., et al. A Mechanism for Gene-Environment Interaction in the Etiology of Congenital Scoliosis. Cell. 149 (2), 295-306 (2012).
- Okubo, Y., Sugawara, T., Abe-Koduka, N., Kanno, J., Kimura, A., Saga, Y. Lfng regulates the synchronized oscillation of the mouse segmentation clock via trans-repression of Notch signalling. Nature communications. 3, 1141 (2012).
- Bone, R. A., Bailey, C. S. L., et al. Spatiotemporal oscillations of Notch1, Dll1 and NICD are coordinated across the mouse PSM. Development. 141 (24), 4806-4816 (2014).
- Shea, K., Geijsen, N. Dissection of 6.5 dpc mouse embryos. Journal of Visualized Experiments. (2), 160 (2007).
- Denkers, N., García-Villalba, P., Rodesch, C. K., Nielson, K. R., Mauch, T. J. FISHing for chick genes: Triple-label whole-mount fluorescence in situ hybridization detects simultaneous and overlapping gene expression in avian embryos. Developmental Dynamics. 229 (3), 651-657 (2004).
- Stasiulewicz, M., Gray, S. D., et al. A conserved role for Notch signaling in priming the cellular response to Shh through ciliary localisation of the key Shh transducer Smo. Development. 142 (13), 2291-2303 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены