Method Article
Метод липидной экстракции и анализа для характеристики микробов почвы в экспериментах со многими образцами
В этой статье
Резюме
В статье описывается метод, который увеличивает пропускную способность при балансировании усилий и точности для извлечения липидов из клеточных мембран микроорганизмов для использования в характеристике как общих липидов, так и относительной численности индикаторных липидов для определения структуры микробного сообщества почвы в исследованиях со многими образцами.
Аннотация
Микробные сообщества являются важными факторами и регуляторами экосистемных процессов. Чтобы понять, как управление экосистемами может влиять на микробные сообщества, относительно точный, но усердный метод анализа состава микробного сообщества представляет собой анализ фосфолипидной жирной кислоты (PLFA). PLFA был разработан для анализа биомаркеров фосфолипидов, которые могут использоваться в качестве индикаторов микробной биомассы и состава широких функциональных групп грибов и бактерий. Он обычно используется для сравнения почв с альтернативными растительными сообществами, экологией и режимами управления. Было показано, что метод PLFA чувствителен к обнаружению сдвигов в составе микробного сообщества.
Альтернативный метод экстракции и анализа метилового эфира жирных кислот (MIDI-FA) был разработан для быстрого извлечения тотальных липидов без выделения фракции фосфолипидов из чистых культур в качестве метода микробиологической идентификации. Этот методБыстрый, но менее подходит для образцов почвы, поскольку он не имеет начального этапа разделения частиц почвы и вместо этого начинает реакцию омыления, которая, вероятно, производит артефакты из фонового органического вещества в почве.
В этой статье описывается метод, который увеличивает пропускную способность при балансировании усилий и точности для извлечения липидов из клеточных мембран микроорганизмов для использования в характеристике как общих липидов, так и относительного обилия индикаторных липидов для определения структуры микробного сообщества почвы в исследованиях со многими образцами. Метод сочетает в себе точность, достигаемую посредством профилирования PLFA, путем извлечения и концентрирования липидов почвы в качестве первого шага, а также уменьшения усилий путем омыления органического материала, извлеченного и обработанного с помощью метода MIDI-FA, в качестве второго шага.
Введение
Учитывая ключевую роль микроорганизмов в циклировании питательных веществ 1 , изменение состава растительного сообщества 2 , регулирование продуктивности растений 3 и разложение органического вещества 4 , понимание почвенных микробных сообществ является жизненно важным для понимания наземных экосистем.
Из-за их относительно высокого содержания в почве и их химической подписи липидные биомаркеры могут использоваться для профилирования доминирующих экологических групп, включающих микробные сообщества почв. 5 . Путем количественного определения биомаркеров липидов, которые характерны для разных микробных групп, мы можем оценить общие липиды, а затем отделить эти липиды в экологически значимых группах, таких как грамположительные (Gm +) и грамотрицательные (Gm-) бактерии, arbuscular mycorrhizal (AM) и сапротрофные Грибы и актиномицеты 5 , Ss = "xref"> 6 , 7 , 8 .
Существует много методов для характеристики аспектов микробных сообществ. Метод PLFA обычно используется для понимания структуры основного микробного сообщества. Это эффективный способ оценки относительной численности микробных групп, а также общей микробной биомассы. Из-за быстрого липидного оборота профилирование PLFA также позволяет относительно быстро обнаруживать изменения в микробном сообществе почвы и дает информацию, которая позволяет сравнить функцию экосистемы, например, грибковые: бактериальные отношения для оценки скорости циклирования питательных веществ 1 , 9 , 10 . Однако, хотя метод извлечения PLFA является почетным и уважаемым по времени, он также требует много времени и не поддается изучению в масштабе экосистемы, для которого требуется большое количество образцов из реплик полевой шкалыF "> 11 , 12 .
Напротив, способ экстракции метилового эфира жирной кислоты (MIDI-FA) может обеспечить быструю пропускную способность. В этом методе образцы омыляются, преобразуются в FAME, извлекаются, а затем анализируются. Метод MIDI-FA является быстрым, но менее различимым, чем PLFA, который сочетает в себе извлечение липидов с разделением различных классов липидов 13 (фосфолипиды, нейтральные липиды и гликолипиды).
В этом протоколе мы описываем метод, который объединяет элементы как PLFA, так и профилирования липидов MIDI-FA. Он использует экстракцию липидов, используя начальные стадии извлечения хлороформа модифицированного метода Блай и Дайера, а затем омыление и превращение в FAME. Это обеспечивает надежный способ обнаружения структуры микробного сообщества, исключая большую часть фонового шума из немикробного материала 5 , 14 . Этот метод был разработан для достижения баланса между протоколами PLFA и MIDI-FA, т. Е. Сохранял большую часть точности и увеличивал пропускную способность, чтобы сделать его логически и экономически целесообразным для анализа липидов из крупномасштабных исследований со многими образцами 15 . Выполняя первоначальное извлечение и выделение органических растворимых компонентов ( например, липидов) перед выполнением MIDI-FA, и завершая это с помощью этапа очистки, протокол обеспечивает баланс между скоростью и точностью.
протокол
ПРИМЕЧАНИЕ. Всегда используйте соответствующие средства индивидуальной защиты (СИЗ) на протяжении всей процедуры. Чтобы избежать потенциального загрязнения образца, не прикасайтесь к стеклянной посуде голыми руками. При использовании протоколов, требующих обращения с хлороформом, надевайте соответствующие перчатки.
1. Препараты (2 дня для ~ 40 образцов)
- Соберите почву в стерильные мешки и транспортируйте с поля в кулер, содержащий лед. Если невозможно просеять свежую почву и немедленно замораживать, храните образцы в морозильнике -80 ° C до готовности для начала анализа.
- Подготовьте почву путем гомогенизации. Удалите корни и камни и сломайте комки грубым просеиванием ( например, 2 мм).
- Подготовьте для сушки вымораживанием, помещая подвыборки в соответствующий контейнер в соответствии с инструкциями руководства по замораживанию для сушки и как можно скорее замораживайте сухим. После того как почвы высушиваются сублимацией, храните в герметичном контейнере с осушителем до экстракции. Лучше всего sЗамораживают высушенную почву при температуре минимум -20 ° С, но предпочтительно при -80 ° С.
- При подготовке к экстракции удаляют высушенные сублимированные почвы из хранилища и измельчают до мукообразной консистенции. Способы измельчения включают шаровую мельницу, шаровой мусор и ступку и пестик. После измельчения почвы храните в морозильной камере (см. 1.3).
ПРИМЕЧАНИЕ. Количество образца, используемого для экстракции, зависит от его содержания органического вещества. Общее правило состоит в том, чтобы использовать от 0,5 до 1 г почвы, которая составляет от 12 до 18% углерода по весу, и от 3 до 5 г для почвы от 1 до 3% углерода по весу. - Предварительно промыть 30 мл центрифужные пробирки с помощью гексана. Добавьте примерно 2 - 3 мл гексана в пробирки и вихрь в течение 5 секунд. Слейте гексан в другую трубку и вихрь. Гексан (от 2 до 3 мл) можно использовать для периодического полоскания шести трубок. Храните гексан-промытые трубы, перевернутые в вытяжном шкафу, и утилизируйте использованный гексан в соответствующем контейнере для отходов.
- Оберните стеклянную посуду в 2-3 слоя алюминиевой фольги и поместите в муфельную печь. Выпекать(Муфельной) посуды при 450 ° C в течение 4,5 часов.
- Подготовьте реагенты.
- Для используемого количества почвы добавьте химикаты в объемном соотношении 0,8: 1: 2 для фосфатного буфера (P-буфер): CHCl 3 : MeOH.
- Подготовьте раствор P-буфера: фосфат-буфер: 0,1 M, pH 7,0.
- Добавить 61 мл 1M K 2 HPO 4 , стерильный (химикат должен быть сертифицирован по стандартам ACS или лучше). Добавьте 39 мл 1 M KH 2 PO 4 , стерильный (химикат должен быть сертифицирован по стандартам ACS или лучше). Заполните 1000 мл водой типа 1. Отрегулируйте pH до 7,0 с помощью NaOH или HCl. Храните неиспользованное решение на срок до 7 дней при температуре окружающей среды или 30 дней в холодильнике.
- Альтернативно, взвешивают 10,62 г K 2 HPO 4 и 5,31 г KH 2 PO 4 ; Разбавить до 1 л водой типа 1. Проверьте pH, при необходимости отрегулируйте.
- Подготовьте реагент 1, реагент омыления.
- Внесите 300 мл воды типа 1.Добавить 300 мл CH 3 OH (класс ВЭЖХ или выше). Добавить 90,00 г NaOH (сертифицированный ACS или лучше). Добавляют гранулы NaOH к раствору при перемешивании. Перемешать до тех пор, пока гранулы не растворятся. Рекомендуется хранить это решение не более 30 дней.
- Подготовьте реагент 2, реагент метилирования.
- Внесите 275 мл CH 3 OH (класс ВЭЖХ или выше). Добавить 325 мл сертифицированного 6,00 N HCL при перемешивании. Рекомендуется хранить это решение не более 30 дней.
- Подготовить реагент 3, реагент экстракции: 50% C 6 H 14 (гексан), 50% C 5 H 12 O (MTBE).
- В вытяжном шкафу объединить 200 мл C 6 H 14 (класс ВЭЖХ или выше) и 200 мл C 5 H 12 O (степень ВЭЖХ или выше). Хорошо перемешать; Колпачок плотно. Хранить в огнеопасном шкафу или вытяжном шкафу не более 1 года.
- Подготовьте реагент 4, реагент для базовой мойки.
- Распределение 900Мл воды типа 1 в химический стакан. Добавить при перемешивании 10,80 г NaOH (сертифицированный ACS или лучше). Перемешать до тех пор, пока гранулы не растворятся. Рекомендуется хранить это решение не более 30 дней.
- Подготовьте исходный раствор внутреннего стандарта.
- Взвесьте 100 мг стандарта EE 19: 0. Добавьте 50 мл промытой гексаном мерной колбы. Добавьте ~ 15 мл раствора гексана-МТБЭ (реагент 3) в колбу, закрутите для растворения. Доводят до 50 мл раствором гексана-МТБЭ (реагент 3). Колпачок и вихрь для смешивания. Перенесите в стеклянные трубки, обработанные гексаном, покрытыми ПТФЭ колпачками и храните при -20 ° C.
2. ДЕНЬ 1 - Экстракция жирных кислот из почвы (от 4 до 5 ч для ~ 40 образцов)
- Подготовьте три отсасывающие пипетки объемом от 5 до 10 мл для P-буфера, хлороформа и метанола.
ПРИМЕЧАНИЕ. В качестве экстрагентов были предложены менее опасные альтернативы хлороформу. Это может привести к эквивалентным коэффициентам извлечения липидов 16 , 17 , но не оцениваются в этом протоколе. - Взвешивают лиофилизированные почвы в 30 мл центрифужные пробирки и регистрируют массу почвы.
- Сделайте две заготовки и включите стандарт проверки (почва, которая была извлечена ранее).
- В вытяжном шкафу добавьте реагенты в почву в пробирке центрифуги в следующем порядке: P-буфер, CHCl 3 и MeOH (таблица 1). Дайте почвенному времени мочить после добавления P-буфера перед добавлением CHCl 3 . Закройте пробирки центрифуги плотно и накройте для защиты от света.
- Поместите их на шейкер горизонтально, убедившись, что они хорошо защищены. При установке скорости на 280 об / мин, встряхните в течение 1 часа 18 .
- Подготовьте две стеклянные трубки диаметром 16 мм х 150 мм для каждого образца следующим образом: нанесите на трубку и добавьте тот же объем CHCl 3 и равный объем P-буфера.
- Удалите центрифужные пробирки из шейкера и центрифуги в течение 10 мин при 1430Xg и 25 ° C. Фазовое разделение должно быть видимым в стеклянной трубке.
- В вытяжном шкафу декантируйте супернатант из центрифужной трубки в одну из труб, приготовленных на этапе 2.6. Повторите шаги с 2,4 по 2,5 и декантируйте супернатант во вторую трубку.
- Надежно закройте все стеклянные трубки размером 16 мм × 150 мм с крышками из ПТФЭ и переверните 10 х для смешивания.
- Позвольте образцам стоять без помех в течение ночи, чтобы завершить разделение двух фаз. Для этого держите образцы в темном шкафу / пространстве или покрыты алюминиевой фольгой при комнатной температуре. Допускается, чтобы выдержки отделялись в течение выходных.
- В качестве альтернативы, если кто-то хочет перейти непосредственно к следующему этапу или если на следующий день образцы будут нарушены, пробы центрифуги в течение 10 мин при 1000 xg и 25 ° C.
ПРИМЕЧАНИЕ. Соблюдайте все образцы в группе сравнения с тем же временем разделения фаз.
- В качестве альтернативы, если кто-то хочет перейти непосредственно к следующему этапу или если на следующий день образцы будут нарушены, пробы центрифуги в течение 10 мин при 1000 xg и 25 ° C.
3 ДНЯ2 - выделение липидов (от 3 до 4 ч для ~ 40 образцов)
- Включите испарительный аппарат и растворитель. Установите испарительный аппарат на 33 ° C и предварительно разогрейте.
- Настройте вакуумный аспиратор в вытяжном шкафу: колбу с боковым клапаном, подключенную к вакуумному насосу, трубку с высокой чистотой и стеклянную пипетку.
- Аспирируйте верхний слой и интерфейс (примерно на 2/3 пути вниз) двух стеклянных трубок, удерживая водный слой. Повторите процесс, используя чистую пипетку для каждого образца.
- Объедините водные слои экстракта из второй трубки с тем, что в первой трубе, тщательно декантируя. Убедитесь, что декантирующая трубка не содержит царапин или трещин.
- После того, как экстракты CHCl 3 объединены, проверьте жидкость - она должна быть прозрачной. Если не добавить MeOH до тех пор, пока не станет ясно.
- Высушите все образцы, используя вакуумное испарительное устройство. Начните с настроек температуры 33 ° C, скорости вихря 26% и давления 400 мбар.
- пЗакрутите образцы в испарительной системе и через 10 мин медленно опустите давление до 350 мбар.
- Следите за ходом процесса, и когда уровень жидкости в трубе достиг уровня нагревательного блока, уменьшите давление до 300 мбар.
- Продолжайте следить за высотой оставшейся жидкости и, когда она имеет глубину примерно 1 см, уменьшите давление до 200 мбар.
- После того, как образцы высушены, удалите образцы и запустите насос на 10 дополнительных минут для очистки паров.
- Плотно закройте трубки и храните липиды в морозильной камере при температуре -80 ° C.
- Утилизируйте аспирированную жидкость в соответствии с действующими правилами химической безопасности.
4. ДЕНЬ 3 - омыление и метилирование (от 6 до 7 ч для ~ 40 образцов)
- Включите водяные бани. Установите ванну от 1 до 95 ° C и ванну от 2 до 80 ° C.
- Установите диспенсеры для пипеток и убедитесь, что они выдают правильный объем.
Реагент 1: 1 мл на образец
Реагент 2: 2 мл на образец
Реагент 3: 1,25 мл на образец
Реагент 4: 3 мл на образец
ПРИМЕЧАНИЕ. Процесс нагрева будет создавать давление в трубке. Не используйте царапины, трещины или сколы. - Используя дозатор пипетки, добавьте 1,0 мл реагента 1 к высушенным липидам. Нагреть плотно, вихрь в течение 5 с и поместить в стойку.
- Поместите стойку пробирки для проб в водяную баню с температурой 95 ° C в течение 5 минут. Удалите стойку из ванны с ванны и проверьте пробирки на наличие утечек, обозначенных пузырьками, поднимающимися в трубке. Затяните или замените колпачки просачивающихся трубок и снова проверьте наличие трещин или стружки. Продолжайте нагревать трубки в водяной бане еще на 10 мин.
- Удалите образцы из ванны 1 и поместите в ванну 2 (80 ° C) и продолжайте инкубацию еще на 15 минут.
- Удалите трубки и охладите образцы, поместив стойку в сковородку водопроводной воды для охлаждения.
- Добавьте 2 мл реагента 2 к каждому образцу. Крышка плотно и вихрь на 5-10 секунд.
- Поместите стойку в водяную баню с температурой 80 ° C и инкубируйте в течение 10 мин.
- Извлеките стойку труб из водяной бани и поставьте в кастрюлю водопроводной воды для охлаждения. Агитируйте стойку труб, чтобы ускорить процесс охлаждения.
ПРИМЕЧАНИЕ. Не превышайте время и температуру. Слишком большое нагревание может ухудшить FAME. - Используя дозатор пипетки, добавьте 1,25 мл реагента 3 в каждую пробирку для отбора метиловых эфиров жирных кислот. Плотно закройте и поместите трубки в шейкер в течение 10 минут.
- После встряхивания позвольте стойке трубок сидеть в течение 10 минут для разделения фаз. Перенесите органическую фазу (верхний слой) в стеклянную пробирку диаметром 16 мм × 100 мм с помощью стеклянной пипетки.
- Повторите экстракцию, снова добавляя реагент 3, встряхивая, позволяя фазам отделяться и переносить верхнюю фазу.
ПРИМЕЧАНИЕ Не переносите ни одну из нижних фаз. Прекрасно оставлять небольшое количество верхней фазы в трубке. - Используя дозатор пипетки, добавьте 3 мл реагента 4 вЕ трубы диаметром 16 мм х 100 мм.
- Закройте пробирки плотно и вихри в течение 20-30 с.
- После встряхивания центрифугируют в течение 3 мин при 1000 × g.
- Используя чистую стеклянную пипетку, аспирируйте верхнюю органическую фазу и перенесите в аммиачный флакон емкостью 4 мл.
- Включите испарительный аппарат и растворитель. Установите испарительное устройство на 30 ° C, скорость вихря до 26%, вакуум до 200 мбар и нажмите предварительный нагрев.
- Контролируйте прогресс. После того, как образцы высушены, удалите образцы и запустите насос на 10 дополнительных минут для очистки паров.
- Удалите пипетку из бутылок 1 и 4 реагента и прокачайте через некоторую разбавленную кислоту ( например, 1% HCl), а затем воду DI. Промойте пипетку, используемую для реагента 2, путем прокачки через воду DI. В капот слейте растворитель из пипетки, используемой для реагента 3, в соответствующий контейнер и держите его в капоте до тех пор, пока остатки растворителя не испарятся.
- Храните пипетки перевернутыми, при этом поршни удаляются, чтобы предотвратить прилипаниеГ обратных клапанов.
- Используйте стеклянные пипетки один раз, а затем утилизируйте в соответствующем контейнере.
- В вытяжном шкафу, чтобы растворимые остатки на стеклянной посуде испарялись.
- Промойте посуду чистой водой и детергентным раствором.
5. ДЕНЬ 4 - Подготовка рабочего раствора и перенос FAME на флаконы GC (2-3 часа для ~ 40 образцов)
- Собирают материалы: флаконы янтаря емкостью 4 мл с высушенными образцами; Амбер 2 мл GC флаконов; 400 мкл плоских нижних стеклянных вставок и колпачков; 500 мкл стеклянного шприца; 50 мл мерную колбу; Исходный раствор - этил-нонадеканоат (внутренний стандарт 19: 0 EE) в 50/50 гексане / MTBE (реагент 3).
- Используя стеклянный шприц, добавьте 500 мкл исходного раствора нонадеканоата (19: 0 EE) в мерную колбу на 50 мл.
- Заполните колбу до объемного счета реагентом 3.
- Колпачок и инвертировать 5х для смешивания.
- Перенесите 3 мл в чистый флакон объемом 4 мл для резервуара рабочего раствора.
- ИспользованиеE стеклянный шприц, добавьте 300 мкл рабочего раствора в каждый из 4 мл флаконов, содержащих высушенные жирные кислоты метиловые эфиры и колпачок.
- Вверните образец в течение 15 с и отложите в течение 15 мин.
- Используя стеклянную пипетку Pasteur, осторожно переносите метиловые эфиры взвешенных жирных кислот в 2 мл GC-флакон, содержащий вставку 400 мкл.
- Перед анализом храните герметичные флаконы GC в морозильнике -20 ° C.
- Представить образцы для анализа GC.
ПРИМЕЧАНИЕ. Анализ должен проводиться с использованием конкретной колонки GC и условий, описанных в дополнительном файле S1 . Лучше всего, чтобы анализ GC был завершен в течение 2 недель после метилирования.
Результаты
Таблицы данных из отчетов можно сопоставить в электронную таблицу или базу данных. После корректировки коэффициента отклика (поправочного коэффициента, который нормализует ответ для разных длин цепей) площади пиков можно сравнить с площадью пика внешних или внутренних стандартов, чтобы достичь концентрации в экстракте. Делясь на массу извлеченной почвы, данные могут быть выражены как масса FAME на грамм почвы или, используя молекулярную массу каждой FAME, более часто сообщаемый нмоль на грамм почвы. Сумма микробных FAME указывает на общую микробную биомассу и может сравниваться между обработками ( рис. 1 ). Определенные FAME также могут быть связаны с конкретными микробными группами, такими как грамположительные или грамотрицательные бактерии, актиномицеты, арбускулярные микоризные грибы и сапротрофные грибы 19 , 20 , 21 , 22 , 23 , 24 . Соотношения массы конкретных биомаркеров могут отражать относительную численность этих групп ( рис. 2 ). В целом, уровни распространенности FAME создают отпечатки пальцев на уровне сообщества, которые позволяют сравнивать различия микробного сообщества с помощью многомерных методов, таких как ординация ( рисунок 3 ). В отличие от большинства основанных на ДНК подходов данные липидов на уровне сообщества могут быть проанализированы как относительные, так и абсолютные. Если общая биомасса существенно отличается между образцами, эти два подхода дадут очень разные результаты; Экологические вопросы, лежащие в основе эксперимента, должны определять, какой подход используется.
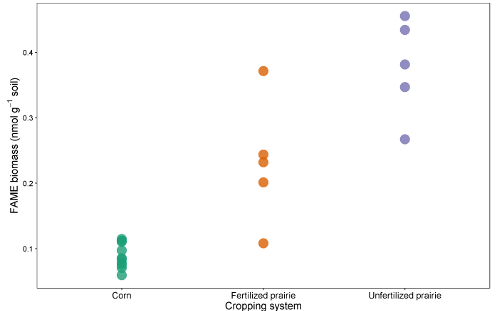
F Рисунок 1 : Общая биомасса FAME. Сравнение общей биомассы биомарма FAME (nmol g -1 ) от непрерывной кукурузы, оплодотворенной прерии и неоплодотворенных прерий. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
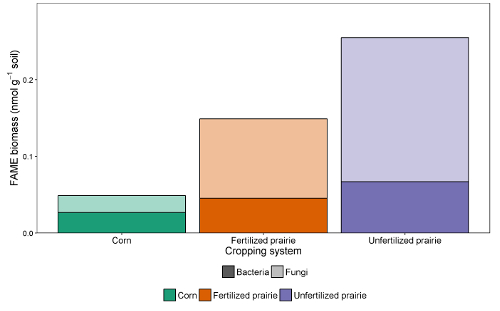
Рисунок 2 : Биомасса FAME бактерий и грибов. Сравнение лечения бактериальной и грибковой биомастеры FAME биомассы (нмоль г- 1 почвы) из непрерывной кукурузы, оплодотворенной прерии и неоплодотворенных прерий. Фундальная и бактериальная масса из абсолютного изобилия. Среднее (сумма f / сумма b). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
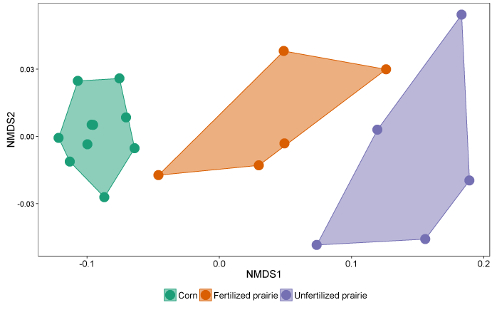
Рисунок 3 : Неметрическое размерное масштабирование биомарок липидов FAME. Сравнение общего микробного сообщества с использованием профилей абсолютного изобилия всех микробных липовых биомаркеров FAME. В этом примере сплошные кукурузные и неоплодотворенные сообщества прерий отделены друг от друга и очень далеки друг от друга, в то время как некоторые оплодотворенные образцы прерий имеют микробные сообщества, которые напоминают культуры из кукурузы, а другие напоминают неоплодотворенную прерию. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
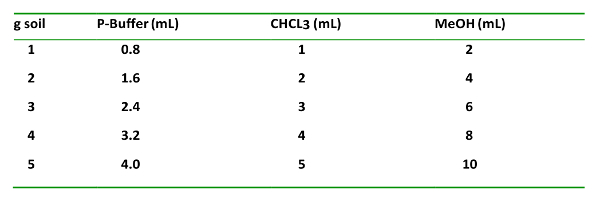
Таблица 1: T h e soл VEN типа т, PROPOR ти от з добавляет г -1 почву, в т д ч EIR Orde г о т о ити добавить п. Это важно для правильной экстракции и разделения органической и водной фаз.
Обсуждение
Для исследования нескольких образцов из экспериментов со многими репликатами и / или экспериментальными единицами исследователи могут обнаружить, что фосфолипидный жирнокислотный анализ (PLFA) является запретительным с точки зрения времени и материалов 25 . С помощью метода PLFA фосфолипиды клеточных мембран экстрагируют, очищают и идентифицируют с использованием модифицированной двухфазной водно-органической экстракции Bligh и Dyer 26 . Затем следует твердофазная хроматография на силикагеле для разделения липидов по полярности и щелочное метилирование фосфолипидных жирных кислот в метиловые эфиры жирных кислот. В PLFA профилирование выхода липидов может быть низким, но очень высокой чистотой. Микробный идентификатор вводили альтернативный метод, способ метилового эфира жирной кислоты (MIDI-FA). В методе MIDI-FA все липиды экстрагируются непосредственно из чистых культур или образцов почв / осадков 11 , 12 , 27 черезомыления. Этот метод имеет более низкие потери липидов и является быстрым, поскольку он не имеет ни стадии концентрирования, ни очистки, ни метода PLFA. Однако, хотя метод MIDI-FA является быстрым и менее дорогостоящим, поскольку он был первоначально разработан для идентификации организмов в чистой культуре, начальных этапов удаления или очистки не существует. Таким образом, он может включать липидоподобные соединения, совместно экстрагированные из органического вещества почвы, которые искажают подпись сообщества 27 , 28 , 29 . Поскольку это включение также может искажать меры биомассы, MIDI-FA обычно используется только для грубо качественного описания липидов почвы 13 .
В описанной здесь процедуре сочетаются лучшие из двух отдельных процедур экстракции: 1) экстракция и концентрация липидов с использованием модифицированного метода Блай и Дайера 26 и 2) метиловый эфир жирной кислоты saПонижение, метилирование, экстракция и базовая промывка. Этот метод был разработан для достижения преимуществ обоих этих протоколов при минимизации недостатков 15 . Выполняя первоначальное извлечение и выделение органических растворимых компонентов ( например, липидов) перед выполнением MIDI-FA, и завершая это с помощью этапа очистки, этот протокол обеспечивает баланс между скоростью и точностью. Хотя этот метод может оказаться неприемлемым, когда требуется высокая степень чистоты ( т. Е. При анализе 13 C PLFA) или при анализе фосфолипидов и нейтральных липидов по отдельности, во многих случаях он позволяет выявлять реакции микробного сообщества на условия окружающей среды с большей чувствительностью, чем на основе ДНК Методы 30 , 31 , 32 , 33 . Мембранные липиды быстро разлагаются после смерти клеток, что позволяет имОтражают живое микробное сообщество во время выборки 5 , 7 , в отличие от ДНК окружающей среды, в которой большая часть информации поступает из мертвых или неактивных организмов 34 . Учитывая высокий уровень покоя, наблюдаемый среди почвенных микроорганизмов 35 , характеристика живой биомассы может быть использована для понимания временных взаимодействий растительного микроорганизма в относительно точной временной шкале, а биомаркеры липидов могут быть использованы для анализа физиологического статуса микробного сообщества 7 . Было показано, что для оценки микробного ответа в больших настройках поля 25 требуются методы с высокой пропускной способностью, и хотя метод, который мы предлагаем здесь, не реплицирует точность профилирования биомаркеров PLFA, он увеличивает пропускную способность и минимизирует изменчивость, реализованную с помощью MIDI-FA процедура. Этот метод оказался эффективным инструментом решенияВопросы, связанные с динамикой микробного сообщества на широком спектре почв в крупномасштабных сельскохозяйственных и экосистемных исследованиях 36 , 37 , 38 , 42 , 43 , 44 , 45 , 46 , 47 , 48 , 49 , 50 .
Классы липидов сочетаются с этим методом, и может быть потеря информации, содержащейся в этих отдельных классах 22 , 39 , но объединение классов липидов может усилить способность обнаруживать арбускулярное микоризное происхождение грибов 16: 1 ω5c из обоих фосфоритов - и нейтральные липиды 40 . Кроме того, в то время как tЕго количество неизвестных жирных кислот (которое может быть получено из неживого органического вещества) может быть выше с помощью этого метода, было показано, что оно ниже, чем у MIDI-FA, и позволяет проводить сравнительное сравнение профилей липидов с исследованиями со многими образцами, где образец Пропускная способность является проблемой 15 . Обычно считается, что нейтральная фракция происходит главным образом от хранения липидов, продуцируемых грибами, хотя может быть и небольшой вклад от фауны почвы 41 . В свете этого описанный здесь способ может дать результаты, демонстрирующие больший вклад грибковых липидов 18: 2 ω 6,9c и 18: 1 ω 9c, чем PLFA. Другие липиды, которые, как правило, обнаруживаются в нейтральной фракции, включают некоторые из насыщенных жирных кислот, например 16: 0, 18: 0, 20: 0.
Существуют различные способы, в которых липидные данные могут быть выражены и проанализированы. Наиболее распространенными представлениями являются обилие (нмоль г- 1 почва), моль-фракциолN (нмол индивидуальный липид нмоль -1 общий липид) и мол.% (Мольная доля * 100). Нормализованные по общим липидам в образце, мольная доля и мольный процент являются показателями относительной численности данного липида. После соответствующего преобразования, например , квадратного корня арксина, мольная доля подходит для использования в анализе с помощью основных компонентов или управления орбит избыточности. Изобилие - это абсолютное количество выделенного липида на грамм почвы. Поскольку количество липидов на клетку является достаточно постоянным, а экстракция липидов является высокоэффективной и всеобъемлющей, общая изобилие является хорошей оценкой общих липидов, а обилие ключевых показателей отражает биомассу экологической группы, которой она представляет 17 . Наконец, хороший способ взглянуть на состав микробного сообщества - использовать методы многомерного анализа 16 , например , методы координации, такие как неметрическое многомерное масштабирование (NMDS -Которая не нуждается в преобразовании данных) или анализ основных компонентов (PCA), может быть полезна для сравнения относительного обилия всех биомаркеров липидов.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была частично профинансирована Исследовательским центром биотехнологии DOE Great Lakes (DOE BER Office of Science DE-FC02-07ER64494) и Управлением энергоэффективности и возобновляемой энергии DOE OBP (DE-AC05-76RL01830). Авторы хотели бы отметить Андерса Гурду за его пациента и умелый вклад в видеографию и редактирование.
Материалы
| Name | Company | Catalog Number | Comments |
| RapidVap | Labconco | 7900000 | Evaporative system |
| RapidVap | Labconco | 7491400 | Sample block |
| Chem-resistant vacuum pump | Labconco | 7584000 | Vacuum pump |
| Chemical trap cannister | Labconco | 7815300 | Trap cannister |
| Solvent insert | Labconco | 7515200 | Solvent trap insert |
| Diaphragm pump | Welch | 7398000 | DryFast vacuum pump |
| Water bath | Fisher | 15-462-15Q | 2 well water bath |
| Gas chromatograph | Various | N/A | For sample analysis |
| Centrifuge | Various | N/A | For sample separation |
| Freeze Dryer | Various | N/A | For sample lyophilization |
| Repipet (6) | BrandTech | 4720440 | For dispensing reagents |
| Vortex | Fisher | 02-215-365 | Analog vortex mixer |
| Teflon centrifuge tubes | Thermo/Nalgene | 3114-0030 | Teflon sample tubes |
| Caps | Thermo/Nalgene | DS3131-0020 | Caps for teflon tubes |
| Test tube | Corning | 9825-16 | 16x100mm tubes |
| Test tube | Corning | 9825-16xx | 16x150mm tubes |
| Caps | Corning | 9998-15 | 15-415 thread black phenolic caps w/PTFE liner |
| Pasteur pipets | Fisher | 13-678-20B | 14.6cm |
| 500 uL glass syringe | Fisher | 13684106LC | Hamilton 81217 |
| Amber vials | Agilent | 5182-0716 | 4mL Amber vials |
| Caps | Agilent | 5182-0717 | Blue screw caps |
| Inserts | Agilent | 5181-3377 | 400uL flat bottom glass inserts |
| Standards | |||
| 19:0 ethyl nonadecanoate (Ethyl nonadecanoate) | VWR | TCN0459-5G | Analytical standard |
| Chemicals | |||
| Dipotassium phosphate (K2HPO4 - ACS grade or better) | Various | N/A | For making Phosphate-Buffer |
| Potassium phosphate monobasic (KH2PO4 - ACS grade or better) | Various | N/A | For making Phosphate-Buffer |
| Methanol (CH3OH - HPLC grade or better) | Various | N/A | For making Reagents 1 & 2 |
| Sodium hydroxide (NaOH - ACS grade or better) | Various | N/A | For making Reagents 1 & 4 |
| Hydrochloric acid (6N HCL) | Various | N/A | For making Reagent 2 |
| Hexane (HPLC grade or better) | Various | N/A | For making Reagent 3 |
| MTBE (Methyl tert-butyl ether - HPLC grade or better) | Various | N/A | For making Reagent 3 |
Ссылки
- Van Der Heijden, M. G. a., Bardgett, R. D., Van Straalen, N. M. The unseen majority: Soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecol Lett. 11 (3), 296-310 (2008).
- Bever, J. D., et al. Rooting theories of plant community ecology in microbial interactions. Trends Ecol Evol. 25 (8), 468-478 (2010).
- Suleiman, A. K. A., Manoeli, L., Boldo, J. T., Pereira, M. G., Roesch, L. F. W. Shifts in soil bacterial community after eight years of land-use change. Syst Appl Microbiol. 36 (2), 137-144 (2013).
- Sayer, E. J., et al. Grassland management influences spatial patterns of soil microbial communities. Soil Biol Biochem. 61, 61-68 (2013).
- Fernandes, M. F., Saxena, J., Dick, R. P. Comparison of Whole-Cell Fatty Acid (MIDI) or Phospholipid Fatty Acid (PLFA) Extractants as Biomarkers to Profile Soil Microbial Communities. Microbial Ecol. 66 (1), 145-157 (2013).
- van der Heijden, M. G. A., Wagg, C. Soil microbial diversity and agro-ecosystem functioning. Plant Soil. 363 (1-2), 1-5 (2013).
- Allison, V. J., Miller, R. M., Jastrow, J. D., Matamala, R., Zak, D. R. Changes in soil microbial community structure in a tallgrass prairie chronosequence. Soil Sci Soc Am J. 69 (5), 1412-1421 (2005).
- Kowalchuk, G. A., Buma, D. S., de Boer, W., Klinkhamer, P. G. L., van Veen, J. A. Effects of above-ground plant species composition and diversity on the diversity of soil-borne microorganisms. A van Leeuw. 81 (1-4), 509-520 (2002).
- Bardgett, R. D., Hobbs, P. J., Frostegard, A. Changes in soil fungal:bacterial biomass ratios following reductions in the intensity of management of an upland grassland. Biol Fert Soils. 22 (3), 261-264 (1996).
- Frostegård, &. #. 1. 9. 7. ;., Tunlid, A., Bååth, E. Use and misuse of PLFA measurements in soils. Soil Biol Biochem. 43 (8), 1621-1625 (2011).
- Haack, S. K., Garchow, I. H., Odelson, D. A., Forney, L. J., Klug, M. J. Accuracy , Reproducibility , and Interpretation of Fatty Acid Methyl Ester Profiles of Model Bacterial Communitiest. Appl Environ Microbiol. 60 (7), 2483-2493 (1994).
- Drenovsky, R. E., Elliott, G. N., Graham, K. J., Scow, K. M. Comparison of phospholipid fatty acid ( PLFA ) and total soil fatty acid methyl esters ( TSFAME ) for characterizing soil microbial communities. Soil Biol Biochem. 36, 1793-1800 (2004).
- Cavigelli, M. A., Robertson, G. P., Klug, M. Fatty acid methyl ester ( FAME ) profiles as measures of soil microbial community structure. Plant Soil. 170, 99-113 (1995).
- Determination of microbial community structure using phospholipid fatty acid profiles. Molecular microbial ecology manual Available from: https://www.researchgate.net/profile/Robert_Findlay2/publication/281208148_Determination_of_microbial_community_structure_using_phospholipid_fatty_acid_profiles/links/55db4f0b08aec156b9afe776.pdf (2004)
- Balser, T. C., Liang, C., Gutknecht, J. L. Linking microbial community analysis and ecosystem studies: A rapid lipd analysis protocol for high throughput. Biol Fert Soils. , (2017).
- Findlay, R. H., King, G. M., Watling, L., Watling, L. E. S. Efficacy of Phospholipid Analysis in Determining Microbial Biomass in Sediments Efficacy of Phospholipid Analysis in Determining Microbial Biomass in Sedimentst. Appl Environ Microbiol. 55 (11), 2888-2893 (1989).
- Willers, C., Jansen van Rensburg, P. J., Claassens, S. Microbial signature lipid biomarker analysis - an approach that is still preferred, even amid various method modifications. J Appl Microbiol. 118 (6), 1251-1263 (2015).
- Zelles, L., Bai, Q. Y., Beck, T., Beese, F. Signature fatty-acids in phospholipids and lipopolysachharides as indicators of microbial biomass and community structure in agricultural soils. Soil Biol Biochem. 24 (4), 317-323 (1992).
- Frostegard, A., Tunlid, A., Baath, E. Phospholipid fatty-acid composition, biomass, and activity of microbial communities from 2 soil types experimentally exposed to different heavy-metals. Appl Environ Microbiol. 59 (11), 3605-3617 (1993).
- Federle, T. W., Dobbins, D. C., Thorntonmanning, J. R., Jones, D. D. Microbial biomass, activity, and community structure in subsurface soils. Ground Water. 24 (3), 365-374 (1986).
- Vestal, J. R., White, D. C. Lipid analysis in microbial ecology - quantitative approaches to the study of microbial communities. BioScience. 39 (8), 535-541 (1989).
- Wilkinson, S. G. Gram negative bacteria. Microbial Lipids. , 299-488 (1988).
- Balser, T. C., Treseder, K., Ekenler, M. Using lipid analysis and hyphal length to quantify AM and saprotrophic fungal abundance along a soil chronosequence. Soil Biol Biochem. 37 (3), 601-604 (2005).
- Buyer, J. S., Sasser, M. High throughput phospholipid fatty acid analysis of soils. Appl Soil Ecol. 61, 127-130 (2012).
- Bligh, E. G., Dyer, W. J. A rapid method of total lipid extraction and purification. Can J Biochem Phys. (37), 911-917 (1959).
- Schutter, M. E., Dick, R. P. Comparison of Fatty Acid Methyl Ester (FAME) Methods for Characterizing Microbial Communities. Soil Sci Soc Am J. 64 (5), 1659-1668 (2000).
- Jandl, G., Leinweber, P., Schulten, H., Ekschmitt, K. Contribution of primary organic matter to the fatty acid pool in agricultural soils. Soil Biol Biochem. 37, 1033-1041 (2005).
- Nielsen, P., Petersen, S. O. Ester-linked polar lipid fatty acid profiles of soil microbial communities: a comparison of extraction methods and evaluation of interference from humic acids. Soil Biol Biochem. 32, 1241-1249 (2000).
- Duncan, D. S., Jewell, K. A., Suen, G., Jackson, R. D. Detection of short-term cropping system-induced changes to soil bacterial communities differs among four molecular characterization methods. Soil Biol Biochem. 96, 160-168 (2016).
- Liang, C., et al. Switchgrass rhizospheres stimulate microbial biomass but deplete microbial necromass in agricultural soils of the upper Midwest, USA. Soil Biol Biochem. 94, 173-180 (2016).
- Jangid, K., et al. Land-use history has a stronger impact on soil microbial community composition than aboveground vegetation and soil properties. Soil Biol Biochem. 43 (10), 2184-2193 (2011).
- Ritz, K., et al. Spatial structure in soil chemical and microbiological properties in an upland grassland. FEMS Microbiol Ecol. 49 (2), 191-205 (2004).
- Carini, P., et al. Relic DNA is abundant in soil and obscures estimates of soil microbial diversity. J Chem Inf Model. 53 (9), 1689-1699 (2013).
- Lennon, J. T., Jones, S. E. Microbial seed banks: The ecological and evolutionary implications of dormancy. Nat Rev Microbiol. 9 (2), 119-130 (2011).
- Gutknecht, J. L. M., Field, C. B., Balser, T. C. Microbial communities and their responses to simulated global change fluctuate greatly over multiple years. Glob Change Biol. 18, 225-269 (2012).
- Pei, Z., et al. Soil and tree species traits both shape soil microbial communities during early growth of Chinese subtropical forests. Soil Biol Biochem. 96, 180-190 (2016).
- Oates, L. G., Duncan, D. S., Sanford, G. R., Liang, C., Jackson, R. D. Bioenergy cropping systems that incorporate native grasses stimulate growth of plant-associated soil microbes in the absence of nitrogen fertilization. Ag Ecosys Environ. 233, 396-403 (2016).
- Bååth, E. The use of neutral lipid fatty acids to indicate the physiological conditions of soil fungi. Microbial Ecol. 45 (4), 373-383 (2003).
- Ngosong, C., Gabriel, E., Ruess, L. Use of the signature Fatty Acid 16:1ω5 as a tool to determine the distribution of arbuscular mycorrhizal fungi in soil. J Lipids. 2012, 236807 (2012).
- Sharma, M. P., Buyer, J. S. Comparison of biochemical and microscopic methods for quantification of arbuscular mycorrhizal fungi in soil and roots. Appl Soil Ecol. 95, 86-89 (2015).
- Oates, L. G., Balser, T. C., Jackson, R. D. Subhumid pasture soil microbial communities affected by presence of grazing, but not grazing management. Appl Soil Ecol. 59, 20-28 (2012).
- Liang, C. Potential legacy effects of biofuel cropping systems on soil microbial communities in southern Wisconsin, USA. Ag Sci. 2 (2), 131-137 (2011).
- Herzberger, A. J., Duncan, D. S., Jackson, R. D. Bouncing Back Plant-Associated Soil Microbes Respond Rapidly to Prairie Establishment. PloS One. 9 (12), 1-14 (2014).
- Fraterrigo, J. M., Balser, T. C., Turner, M. G. Microbial community variation and its relationship with nitrogen mineralization in historically altered forests. Ecology. 87 (3), 570-579 (2006).
- Kao-Kniffin, J., Balser, T. C. Elevated CO2 differentially alters belowground plant and soil microbial community structure in reed canary grass-invaded experimental wetlands. Soil Biol Biochem. 39 (2), 517-525 (2007).
- Mentzer, J. L., Goodman, R. M., Balser, T. C. Microbial response over time to hydrologic and fertilization treatments in a simulated wet prairie. Plant Soil. 284 (1-2), 85-100 (2006).
- Ushio, M., Wagai, R., Balser, T. C., Kitayama, K. Variations in the soil microbial community composition of a tropical montane forest ecosystem: Does tree species matter. Soil Biol Biochem. 40 (10), 2699-2702 (2008).
- Bartelt-Ryser, J., Joshi, J., Schmid, B., Brandl, H., Balser, T. Soil feedbacks of plant diversity on soil microbial communities and subsequent plant growth. Perspect Plant Ecol. 7 (1), 27-49 (2005).
- Fichtner, A., von Oheimb, G., Härdtle, W., Wilken, C., Gutknecht, J. L. M. Effects of anthropogenic disturbances on soil microbial communities in oak forests persist for more than 100 years. Soil Biol Biochem. 70, 79-87 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены