Method Article
Полнопольная оптическая когерентная микроскопия для гистологического анализа стромальных особенностей роговичных трансплантатов
В этой статье
Резюме
Описано использование полнопольной оптической когерентной микроскопии как метода оценки высокого качества донорской стромы роговицы. Этот протокол может быть использован для выявления признаков, свидетельствующих о здоровье или заболевании, и направлен на улучшение скрининга и отбора донорских тканей, а значит, и результатов кератопластики.
Аннотация
Качество донорской стромы роговицы, которая составляет около 90% от общей толщины роговицы, вероятно, будет одним из основных, если не основным, ограничивающим фактором (факторами) успеха глубокой передней пластинчатой и сквозной кератопластики. Это хирургические процедуры, которые включают замену части или всех пораженных слоев роговицы, соответственно, донорской тканью, трансплантатом, взятым у недавно умершего человека. Однако средства оценки стромального качества трансплантатов роговицы в глазных банках ограничены и не имеют возможности количественной оценки показателей заболевания с высоким разрешением. Полнопольная оптическая когерентная микроскопия (FF-OCM), позволяющая получать 3D-визуализацию свежих или фиксированных образцов биологических тканей ex vivo с высоким разрешением, является неинвазивным методом, хорошо подходящим для оценки донорской роговицы. Здесь описан метод качественного и количественного анализа стромы роговицы с использованием FF-OCM. Протокол был успешно применен к нормальной донорской роговице и патологическим кнопкам роговицы и может быть использован для выявления здоровых и патологических особенностей как на макроскопическом, так и на микроскопическом уровне, тем самым облегчая выявление стромальных нарушений, которые могут поставить под угрозу исход кератопластики. Улучшая контроль качества трансплантата, этот протокол может привести к лучшему отбору (и отторжению) донорских тканей и, следовательно, к уменьшению отторжения трансплантата.
Введение
Заболевания роговицы являются одной из основных причин слепоты во всем мире1. Некоторые заболевания можно лечить только хирургическим путем, часто с заменой части (например, ламеллярная кератопластика) или всей (т.е. сквозной кератопластики) больной роговицы донорской тканью, трансплантатом, взятым у недавно умершего человека. При заболеваниях роговицы, которые не влияют на эндотелий (например, кератоконус, стромальные рубцы после инфекционного кератита, травмы и стромальные дистрофии), глубокая передняя пластинчатая кератопластика (DALK) в настоящее время рассматривается как хирургический метод выбора 2,3,4,5. Этот метод позволяет сохранить эндотелий роговицы реципиента, заменяя только центральный эпителий роговицы и строму, что связано с меньшей частотой отторжения трансплантата, отсутствием отторжения эндотелия, меньшей потерей эндотелиальных клеток и благоприятным соотношением затрат и эффективности 6,7,8,9,10,11 . Кроме того, DALK позволяет использовать роговицы с менее чем оптимальным качеством эндотелия в качестве трансплантатов, поскольку этот скомпрометированный слой не будет пересажен12. И наоборот, качество донорской стромы роговицы, вероятно, будет основным ограничивающим фактором для успеха трансплантата и восстановления зрения, поскольку строма является единственным оставшимся донорским слоем роговицы, в то время как донорский эпителий будет заменен эпителием реципиента. К сожалению, средства оценки донорской стромы роговицы в глазных банках ограничены. Обычно они включают исследование донорского глазного яблока с помощью щелевой лампы, когда забор ткани производится путем энуклеации, и исследование донорской стромы13 под световым микроскопом. Некоторые офтальмологические банки начали дополнять такие стандартные процедуры с помощью оптической когерентной томографии в области Фурье (FD-OCT)14.
Офтальмологическая оптическая когерентная томография (ОКТ), являющаяся оптическим аналогом ультразвуковой визуализации15, использует интерференцию широкополосного или перестраиваемого света для генерации оптических участков сетчатки 16 и переднего сегмента17. В ОКТ во временной области, лежащей в основе ранних клинических систем, положение эталонного зеркала изменяется, так что интерференционные картины проявляются всякий раз, когда эталонный луч проходит почти то же количество времени, что и луч, отраженный на различных тканевых границах, при этом А-сканы генерируются в зависимости от времени. В FD-OCT (также называемой спектральной или частотной ОКТ), лежащей в основе большинства современных клинических систем, эталонное зеркало фиксируется в одном положении, и отдельный А-скан со всеми интерференционными картинами, смешанными вместе, снимается одновременно и рассекается на части с помощью анализа Фурье.
В то время как клинические (временные или спектральные) системы ОКТ позволяют просматривать роговицу в поперечном сечении и обнаруживать помутнения стромы с более высоким осевым разрешением, чем биомикроскопия с щелевой лампой, их боковое разрешение ограничено. Конфокальная микроскопия18 позволяет исследовать роговицу с боковым разрешением, приближающимся к гистологическим деталям, но ограничена в осевом направлении.
Полнопольная оптическая когерентная томографическая микроскопия (FF-OCT или FF-OCM)19,20 сочетает в себе элементы как конфокальной микроскопии, так и OCT, достигая бокового разрешения, сравнимого с осевым разрешением около 1 мкм. В частности, FF-OCM использует некогерентные широкополосные источники света (например, галогенную лампу) и оптику с высокой числовой апертурой для получения 2D-томографических изображений без бокового сканирования. Сканируя в направлении глубины, FF-OCM позволяет неинвазивную 3D-визуализацию свежих или фиксированных образцов биологических тканей ex vivo. Он был использован для визуализации роговицы21,22,23. Предоставляя как вид лица с высоким разрешением, так и вид поперечного сечения, FF-OCM предоставляет информацию как о гистологической структуре, так и о клеточных деталях роговицы. Фактически, было показано, что FF-OCM предоставляет структурную информацию, превосходящую гистологию, и может идентифицировать больше индикаторов заболевания, насколько это было возможно при комбинации спектральной области OCT и конфокальной микроскопии24,25.
Здесь мы описываем протокол качественной и количественной оценки донорской стромы роговицы с использованием FF-OCM. Метод основан на гистологическом анализе макроскопических и микроскопических признаков, указывающих на состояние стромы, включая три количественных параметра стромы (толщину слоя Боумена и его изменчивость, а также отражательную способность стромы). Таким образом, описанный протокол применяется к нормальным и аномальным тканям роговицы и позволяет дифференцировать пораженные ткани роговицы от нормальных тканей роговицы человека.
протокол
Все описанные здесь методы были проведены в соответствии с принципами Хельсинкской декларации и соответствовали международным этическим требованиям к тканям человека. Это было проспективное обсервационное исследование случай-контроль. Информированное согласие было получено от пациентов. Никаких изменений во французские стандарты лечения или последующего наблюдения не вносилось. Одобрение Институционального наблюдательного совета (IRB) было получено от Комитета по защите пациентов, Иль-де-Франс V (14944).
1. Выбор и подготовка тканей
- Выберите донорскую роговицу.
- Перенос донорской роговицы, хранящейся в среде 26 для культивирования органов, в среду для культивирования органов с добавлением декстрана в течение 3 дней, чтобы обеспечить детургесценцию27 до визуализации28 FF-OCM (см. Таблицу материалов).
- Подготовьте образцы.
- Поместите роговицу, погруженную в носитель для хранения, в держатель образца эпителием вверх.
- Поместите чистое покрывающее стекло из кремнезема (входит в комплект держателя образца) поверх роговицы и закройте держатель, осторожно поворачивая его основание, пока образец не станет слегка сплющенным и не будет иммобилизован под покровным стеклом, обеспечивая относительно ровную поверхность изображения. Примите меры предосторожности, чтобы избежать пузырьков воздуха.
- Нанесите толстый слой офтальмологического или оптического геля на покровное стекло в качестве иммерсионной среды.
2. Инициализация, настройка и получение изображений FF-OCM
- Инициализируйте устройство.
- Включите устройство, используя выключатель питания на задней панели устройства; Подсветка зеленого светодиода на передней панели устройства указывает на то, что питание включено.
- Включите выделенный компьютер и галогенный источник света, нажав выключатель питания на передней панели.
- Запустите программное обеспечение для сбора данных (см. Таблицу материалов), дважды щелкнув ярлык на рабочем столе.
- Убедитесь, что сцена визуализации свободна, за исключением подвижного лотка. Затем нажмите «ОК», чтобы инициализировать двигатели в командной строке.
- Вытащите лоток и вставьте держатель образца в специальный контейнер, затем осторожно отодвиньте лоток.
- Настройте устройство.
- Введите «идентификатор образца» в специально отведенное и обязательное поле; При необходимости введите «Описание образца» и/или «Описание исследования».
- Нажмите «Получить макроизображение», когда будете готовы, чтобы создать снимок образца, который можно использовать для бокового позиционирования и навигации позже; После того, как вы будете удовлетворены, проверьте изображение по запросу, нажав «Да», после чего устройство перемещает лоток для образцов под объектив и выполняет автоматическую настройку.
- Прежде чем продолжить, убедитесь, что объектив микроскопа хорошо погружен в оптический гель.
- Приобретайте стеки.
- Выберите вкладку «Исследовать», чтобы подготовить приобретение.
- Перед получением стопки изображений перейдите к центру роговицы, с помощью перевода джойстика или ручного выбора на экране (то есть щелкнув и перетащив красный квадрат на полученном макроизображении в нужное место).
- Изменяйте глубину изображения с помощью вращения джойстика, регулировки ползунка или ручного ввода с клавиатуры в графическом пользовательском интерфейсе (GUI) и регулируйте значение усреднения (для оптимальной визуализации роговицы обычно рекомендуется усреднение 40).
ПРИМЕЧАНИЕ: Это делается для определения толщины образца роговицы и усреднения, необходимого для получения изображения по всей толщине роговицы, с указанием первого и последнего местоположения изображения в глубину. Нижняя поверхность покровного стекла создает параллельные интерференционные полосы, которые видны на томографическом изображении (с правой стороны графического интерфейса), которые облегчают определение местоположения поверхности роговицы. - Введите значение поверхности роговицы или местоположение первого изображения в глубину в поле «Глубина».
- Выберите вкладку «Приобрести», чтобы получить изображения.
- Выберите «Расстояние между срезами» (рекомендуемая настройка по умолчанию — 1 мкм, что соответствует осевому разрешению устройства) и введите соответствующее значение толщины роговицы в разделе «Количество срезов».
- Просмотрите параметры и время сбора и, когда они будут удовлетворены, нажмите «ОК», чтобы начать приобретение.
- Во время сбора избегайте любого контакта со столом, на котором расположен FF-OCM.
- Выберите вкладку «Исследовать», чтобы подготовить приобретение.
3. Управление полученными изображениями
- Просмотр и экспорт изображений.
- Запустите программное обеспечение для просмотра FF-OCM (см. Таблицу материалов), дважды щелкнув ярлык на рабочем столе; полученные изображения (идентифицированные по идентификатору образца) отображаются в списке «Краеведение».
- Выберите исследование с соответствующим идентификатором образца, который содержит как макроизображение, так и полученный стек изображений, и «экспортируйте» последний, щелкнув правой кнопкой мыши серию изображений и выбрав формат «DICOM», чтобы сохранить необработанные пиксельные данные и метаданные для дальнейшего анализа.
- Отображение стеков 3D-изображений в режиме грани и поперечного сечения в режиме многоплоскостной реконструкции (MPR) двойным щелчком мыши по серии изображений; Перемещайтесь по изображениям (например, с помощью колесика мыши, прокрутки или ползунка) и выбирайте репрезентативные виды и виды поперечного сечения каждого стека.
- Экспортируйте выбранные виды, нажав на значок в правом нижнем углу окна, используя формат «DICOM».
- Импорт изображений.
- Откройте программное обеспечение для обработки изображений (см. Таблицу материалов), дважды щелкнув ярлык на рабочем столе, и перейдите в раздел «Биоформаты» «Импортер» в разделе «Плагины» для импорта изображений DICOM; убедитесь, что в окне «Параметры импорта биоформатов» выбран параметр «Группировать файлы с похожими именами».
4. Анализ изображений: качественная и количественная оценка морфологии и особенностей стромы
- Оцените толщину стромы и слоя Боумена.
- Измерьте расстояния вручную на поперечных сечениях роговицы, например, в пяти точках, расположенных на равном расстоянии друг от друга в поперечном сечении25.
- Проведите линию между двумя точками известного расстояния (например, слева направо от всего изображения, то есть в соответствии с полем зрения по умолчанию, 1,024 пикселя или 780 мкм), перейдите в «Анализ» и выберите «Установить масштаб», введите «Известное расстояние» и «Единица длины» в соответствующие поля и нажмите «ОК».
- Проведите линию между двумя точками неизвестного расстояния; Считывание измеренной длины или расстояния непосредственно из строки состояния.
- Запишите среднее значение и коэффициент вариации (COV). Толщина слоя Боумена менее 6,5 мкм и COV более 18,6% были связаны с аномальной стромойроговицы 25.
- Измерьте расстояния вручную на поперечных сечениях роговицы, например, в пяти точках, расположенных на равном расстоянии друг от друга в поперечном сечении25.
- Определяют плотность кератоцитов.
- Следующее соглашение конфокальной микроскопии: суммируйте стромальные изображения в группах по 7 штук, чтобы получить срезы сопоставимой толщины. Для этого перейдите на вкладку «Изображение» и выберите «Reslice Z» в разделе «Стопки».
- Учитывают различную (убывающую) плотность клеток при прогрессировании через строму24,25. Для этого строму можно рассматривать как состоящую из 4 областей в зависимости от глубины: (1) самая передняя строма ниже слоя Боумена, что составляет 2% от всей толщины стромы; оставшаяся строма (то есть 98% всей толщины стромы) с тремя зонами одинаковой толщины: (2) передняя строма, (3) средняя строма и (4) задняя строма.
- Для дальнейшего анализа включите все доступные срезы en face для самой передней стромы, 15 изображений для передней стромы, 5 изображений для средней стромы, а также 5 изображений для задней стромы (где количество изображений на область, необходимое для надежного подсчета, было определено с помощью ступенчатого анализа29).
- На каждом изображении en face выберите интересующую область размером 300 мкм x 300 мкм. Чтобы улучшить визуализацию ядра, инвертируйте изображение, используя «Инвертировать» на вкладке «Редактировать», и отрегулируйте контрастность и яркость. Для последнего перейдите в «Изображение» и перейдите в «Яркость / контрастность» в разделе «Анализ».
- Вручную подсчитайте ядра клеток, используя, например, функцию «счетчик клеток»25. Для этого перейдите в «Плагины» и перейдите в «Счетчик ячеек» в разделе «Анализ». Нажмите «Инициализировать», а затем выберите тип счетчика. Затем начните подсчет ядер клеток, нажимая на темные овальные черты на перевернутом изображении, рассматривая те, которые приземляются на границу изображения только для двух из четырех сторон изображения25.
- Запишите плотность клеток с точки зрения плотности площади, то есть в клетках/мм² (разделите количество подсчитанных клеток на 0,09, чтобы преобразовать из клеток/90 000 мкм² в клетки/мм²), следуя соглашению о конфокальной микроскопии, где было показано, что плотность кератоцитов ниже у пациентов (например, с кератоконусом), чем у здоровых добровольцев, и коррелирует с тяжестью заболевания25.
ПРИМЕЧАНИЕ: Необходимы дальнейшие клинические исследования, чтобы определить, требуется ли минимальный порог плотности кератоцитов для получения идеально чистого трансплантата роговицы после трансплантации.
- Оцените стромальную отражательную способность.
- Сгенерируйте профили глубины средней интенсивности стеков стромальных изображений, используя, например, функцию «Профиль оси Z» и/или пользовательское программное обеспечение25,30,31.
ПРИМЕЧАНИЕ: На самом деле это профили глубины амплитуды, поскольку FF-OCM измеряет амплитуду света, обратно рассеянного образцом, а не его интенсивность.- Рассчитайте средний уровень серого для каждого стека.
- Вычтите минимальное значение серого и нормализуйте максимальное значение серого.
- Отображение в логарифмической шкале в зависимости от глубины стромы (% от толщины стромы).
- Аппроксимируем полученный логарифмический профиль линейной линией регрессии, которая минимизирует сумму квадратов остатков (соответствие методом наименьших квадратов).
- Запишите значение R-квадрата (R²) как меру линейности. Значения ниже 0,94 могут быть признаком патологии роговицы25.
ПРИМЕЧАНИЕ: Чтобы дифференцировать неадекватность линейной логарифмической регрессионной модели (или моноэкспоненциальной модели распада) из-за наличия патологии от простого измерительного шума, можно выполнить анализ сигналов с помощью байесовского вывода31. Кроме того, в роговице с линейными логарифмическими (или моноэкспоненциальными) профилями стромальной глубины (например, представленными значениями R-квадрата30 или коэффициентами Бирге 31, близкими к 1), расчет пути без среднего фотона по скорости затухания сигнала может быть использован для дальнейшей количественной оценки степени прозрачности31.
- Сгенерируйте профили глубины средней интенсивности стеков стромальных изображений, используя, например, функцию «Профиль оси Z» и/или пользовательское программное обеспечение25,30,31.
- Оцените видимость других стромальных особенностей и показателей заболевания.
- Проверьте наличие рубцов, фиброзной ткани, чешуек или стрий Фогта.
- Оцените среднюю толщину нервов в строме, если она достаточно заметна для измерения24.
- Выберите одно изображение лица , где стромальный нерв наиболее заметен (обычно в средней стромальной области).
- Измерьте толщину нерва, например, в пяти точках24, затем рассчитайте среднее значение и стандартное отклонение. Толщина нерва выше 9 мкм может быть дополнительным показателем патологии, такой как кератоконус24.
Результаты
Устройство FF-OCM (см. Таблицу материалов)28 и общая установка, используемые в этой рукописи, показаны на рисунке 1. На рисунке 2 показана набухшая донорская роговица человека после хранения в среде для культивирования органов, что дает патофизиологическую модель отечной роговицы и предотвращает получение изображения FF-OCM по всей толщине роговицы из-за ограниченной глубины проникновения. Перенос в питательную среду для органов, дополненную декстраном, вызывает отек и приводит к донорской роговице нормальной толщины, как показано на рисунке 3. Пораженные роговицы можно распознать по морфологическим изменениям и типичным стромальным особенностям, включая уменьшенную и переменную толщину стромы (рис. 4) и/или слоя Боумена (рис. 5). Оценка плотности кератоцитов (рис. 6) и отражательной способности стромы (рис. 7) может дополнительно помочь в гистологическом анализе и дифференциации нормальных и патологических тканей роговицы с помощью FF-OCM, выходящих за рамки возможностей клинических систем OCT (рис. 8).
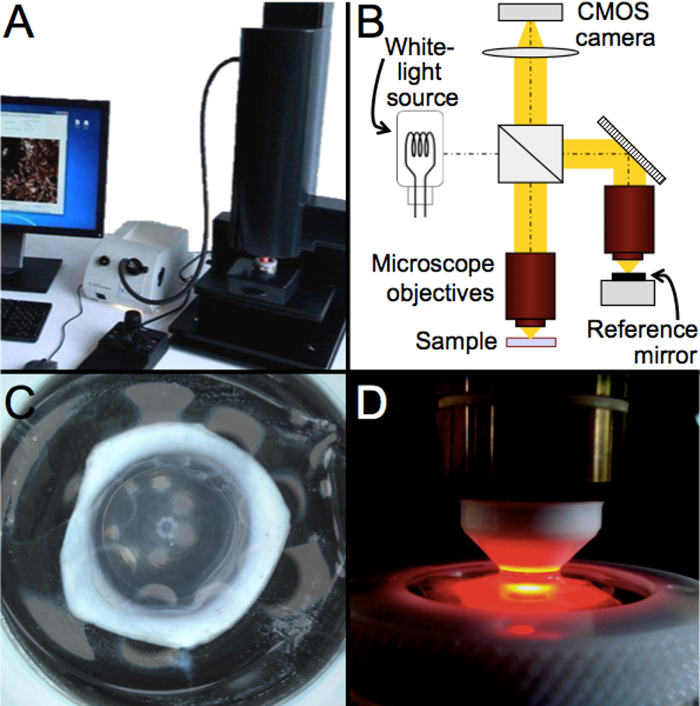
Рисунок 1: Схема и фотографии общей установки и устройства FF-OCM, использованного в данной работе. (A) Фотография устройства FF-OCM (см. Таблицу материалов)28. (B) Схематическая и оптическая настройка устройства. (C) Фотография роговицы донора человека в держателе образца. (D) Увеличьте фокус на иммерсионном объективе и держателе образца. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
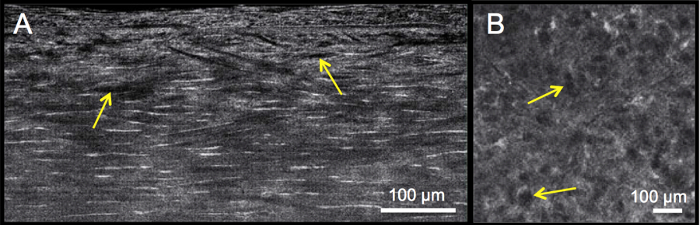
Рисунок 2: Культивируемая органами нормальная роговица человека до детургации. Поперечное сечение (А) и вид на лицо (В, разрез стромы) набухшей («отечной») роговицы, вызванной хранением в среде для культивирования органов, где озера можно увидеть как темные области (как показано стрелками). Толщина роговицы увеличилась вдвое и превысила 1 100 мкм, что не позволяет получать изображения на всю глубину. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
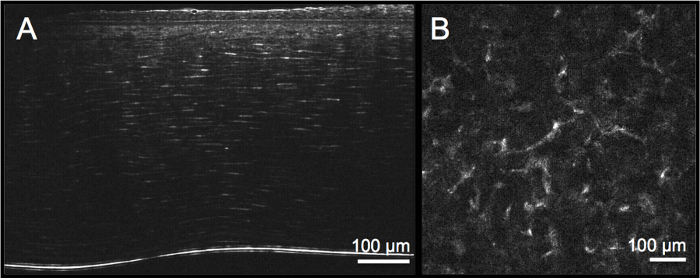
Рисунок 3: Культивируемая органами нормальная роговица человека после детургации. Вид в поперечном сечении через всю роговицу (А) и стромальный вид на поверхность (В) опухшей роговицы, погруженной в среду, дополненную декстраном, показывает регулярно распределенные гиперотражающие (белые) кератоциты. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Общая оценка морфологии и особенностей стромы, включая толщину стромы. По сравнению с нормальной роговицей человека (А), роговицы с кератоконусом (В) имеют уменьшенную и переменную толщину стромы, а также многочисленные параллельные стрии Фогта, которые наблюдаются в виде темных вертикальных полос в поперечном сечении, и толстые стромальные нервы, которые могут быть обнаружены в средних стромальных срезах лица (С). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
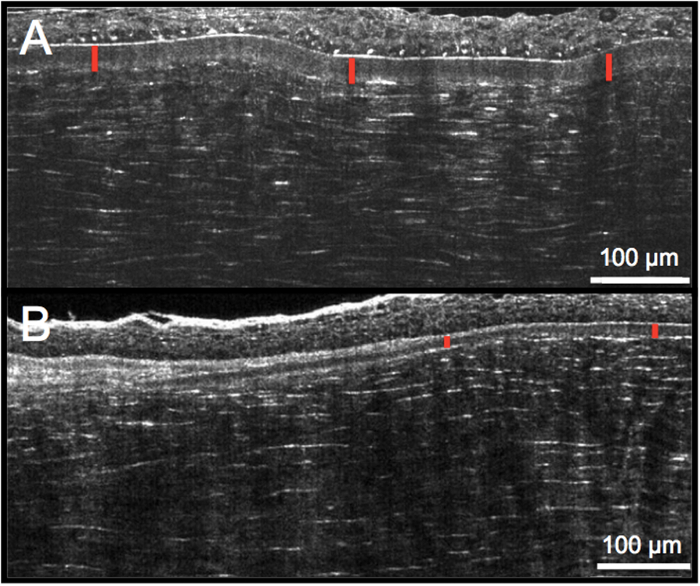
Рисунок 5: Оценка толщины слоя Боумена, который очерчен спереди гиперотражающей эпителиальной базальной мембраной и сзади гиперрефлективными кератоцитами в самой передней строме. По сравнению с нормальной роговицей человека (А), патологическая роговица (например, кератоконус) (В) имеет уменьшенную и переменную толщину слоя Боумена из-за прерывания и рубцевания. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
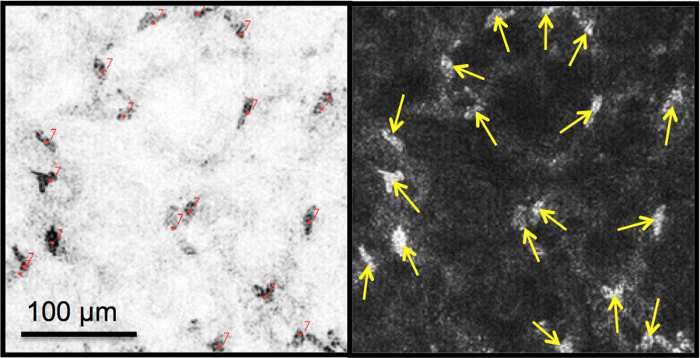
Рисунок 6: Оценка плотности кератоцитов. (A) Ядра кератоцитов вручную подсчитываются на улучшенных и инвертированных изображениях лица после выбора интересующей области размером 300 мкм x 300 мкм. (B) Подсчитанные ядра обозначены стрелками. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
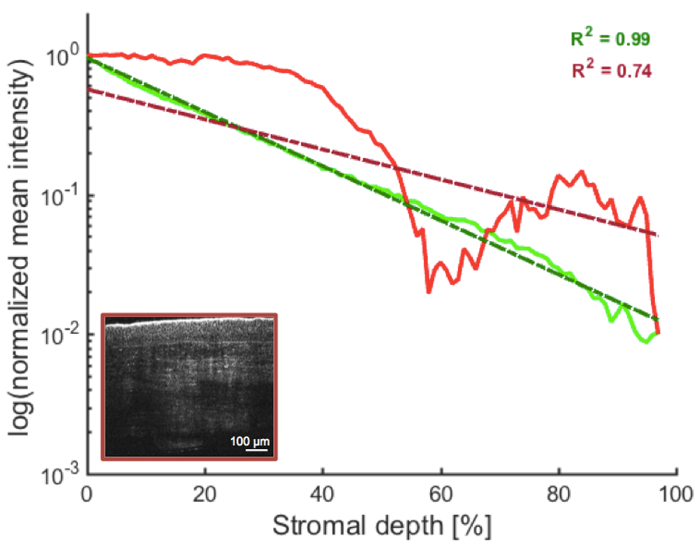
Рисунок 7: Оценка стромальной отражательной способности. Количество обратного рассеянного света уменьшается (экспоненциально) с глубиной в строме нормальных донорских роговиц (см. рис. 3 и рис. 4A), что приводит к линейным логарифмическим профилям глубины, представленным значениями R-квадрата, близкими к 1 (зеленый след). Это может не относиться к патологическим роговицам с стромальными областями повышенного обратного рассеяния света (см. рис. 4B). Наличие таких макроскопических особенностей, как в примере роговицы со стромальным рубцом после инфекционного кератита (изображено на врезке), таким образом, создаст нелинейные логарифмические профили глубины интенсивности, представленные значением R-квадрата ниже определенного порога (например, ниже 0,9425; красный след). Обратите внимание, что логарифмические профили глубины амплитуды на самом деле показаны так, как FF-OCM измеряет амплитуду света, обратно рассеянного образцом, а не его интенсивность. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 8: Демонстрация преимуществ FF-OCM по сравнению с гистологией и спектральной областью OCT. (A) Гистология и (B) соответствующее спектральное ОКТ-изображение, полученное на той же роговице in vivo до кератопластики. (C) Соответствующее поперечное сечение FF-OCM пуговицы роговицы ex vivo после кератопластики, демонстрирующее превосходное разрешение по сравнению с клиническими ОКТ-изображениями в спектральной области. Фиброз также более отчетливо виден на изображениях FF-OCM, чем в гистологии. Высокая плотность кератоцитов в верхней строме хорошо видна как на (C) поперечном сечении, так и на (D) на лице . Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Описанный здесь протокол качественной и количественной оценки донорской стромы роговицы с использованием FF-OCM основан на гистологическом анализе макроскопических и микроскопических признаков, указывающих на состояние стромы, выходящих за рамки возможностей спектральной ОКТ и конфокальной микроскопии21,24,25, и позволяет дифференцировать больных от нормальных тканей человека.
Помимо превосходной оценки качества эндотелия роговицы донора человека с помощью зеркальной микроскопии, оценка качества стромы затруднена в глазных банках и, как правило, ограничивается грубым наблюдением с помощью биомикроскопии с щелевой лампой и / или световой микроскопии в современных протоколах. Отсутствие тонкого разрешения с помощью существующих методов означает не только то, что могут быть выбраны роговицы с некоторыми стромальными заболеваниями, которые ставят под угрозу результат кератопластики, но также и то, что роговицы могут быть отвергнуты из-за помутнения стромы, которые фактически ограничивают переднюю строму или эпителиальные области и все еще могут использоваться для процедур эндотелиальной кератопластики14.
Текущий протокол глазного банка может быть дополнен добавлением FF-OCM, который благодаря своему превосходному разрешению представляет собой мощный и неинвазивный инструмент для завершения оценки качества роговицы, особенно стромы (включая слой Боумена). В отличие от исследования с помощью щелевой лампы, трансплантат остается погруженным в закрытую камеру, заполненную носителем для хранения на протяжении всего получения изображения FF-OCM, что снижает любой потенциальный риск загрязнения.
Для успешного получения изображения с помощью FF-OCM (см. Таблицу материалов) важно, чтобы объектив микроскопа был хорошо погружен в оптический гель, который наносится поверх покровного стекла держателя образца (этап 2.2.3). Кроме того, рекомендуется регулярно проверять калибровку устройства, процедура, которая также должна быть выполнена после неудачной автоматической настройки (шаг 2.2.2) и доступна через «Инструменты и параметры» в программном обеспечении для сбора данных (см. Таблицу материалов). Процедура, которая включает использование калибровочного зеркала в держателе образца, аналогична обычной подготовке образца (см. этап 1.2), за исключением того, что оптический гель следует наносить на зеркало перед позиционированием покровного стекла.
Серия донорских трансплантатов роговицы, которые, как считается, имеют нормальную строму в соответствии с существующими процедурами глазного банка, были использованы для описания протокола в этой рукописи и, в частности, для демонстрации пригодности FF-OCM для точной и надежной оценки качества донорской стромы. Эти нормальные донорские роговицы сравнивали с патологическими роговицами, погруженными в среду хранения, показывая, что гистологический анализ, ставший возможным с помощью FF-OCM нескольких стромальных признаков (проиллюстрированных на рис. 2, рис. 3, рис. 4, рис. 5, рис. 6, рис. 7 и рис. 8) в трансплантатах роговицы, позволяет отличить пораженные ткани роговицы человека от нормальных.
Помимо морфологических изменений, таких как наличие рубцов (рис. 5 и рис. 7), фиброзной ткани (рис. 8), озер (рис. 2), стрий Фогта (рис. 4) или увеличения диаметра стромального нерва (рис. 4), типичные стромальные особенности присутствуют в пораженной роговице. Стромальными параметрами, особенно важными для оценки качества стромы, по-видимому, являются толщина слоя Боумена и его изменчивость, а также отражательная способность стромы. Таким образом, важнейшими шагами в рамках протокола являются шаги 4.1 и 4.3.
Выделяясь во время развития роговицы человека, слой Боумена, в частности, становится отчетливым к 19 неделе беременности и никогда не восстанавливается после рождения32. Таким образом, повреждение слоя Боумена необратимо и служит идеальным индикатором предшествующего стромального повреждения донорской ткани роговицы, включая повреждения, вызванные рефракционной хирургией, инфекционным кератитом, кератоконусом. Такие заболевания роговицы, которые являются противопоказаниями для использования донорской роговицы, связаны с уменьшением и изменением толщины слоя Боумена из-за прерывания и рубцевания (рис. 5) и, вероятно, будут пропущены текущими протоколами глазного банка, когда донорский анамнез точно не известен.
Хотя прозрачность роговицы нарушается после смерти донора из-за посмертного отека роговицы, ожидается, что количество обратно рассеянного света или стромальная отражательная способность будут экспоненциально уменьшаться с глубиной стромы (см. рис. 3 и рис. 4A); в результате логарифм нормализованной отражательной способности стромы будет линейной функцией глубины стромы в нормальных донорских роговицах, представленной значениями R-квадрата, близкими к 1. И наоборот, наличие макроскопических особенностей связано с нелинейными логарифмическими профилями глубины и свидетельствует о стромальной болезни (рис. 4B и рис. 7)25.
Поскольку плотность кератоцитов отвечает за синтез и обновление фибрилл стромального коллагена и внеклеточного матрикса, представляется разумным предположить, что плотность кератоцитов является еще одним важным параметром для оценки качества донорской стромы, и что ткани с очень низким количеством кератоцитов не следует пересаживать. Таким образом, протокол включает в себя точный и надежный метод измерения плотности кератоцитов по изображениям FF-OCM, который может быть легко использован в глазных банках25 и соответствует соглашению конфокальной микроскопии. Обратите внимание, что с помощью FF-OCM плотность кератоцитов также может быть определена путем подсчета кератоцитов непосредственно в поперечном сечении33, что является потенциальным преимуществом по сравнению с конфокальной микроскопией, которая требует, чтобы кератоциты подсчитывались на нескольких срезах на лицевой стороне. Однако, в отличие от живых пациентов, где плотность кератоцитов у пациентов с заболеванием была ниже, чем у нормальных контрольных групп 34,35,36,37, и коррелировала с тяжестью заболевания 34,38, это не имело место в образцах тканей человека ex vivo 25 , и необходимы дальнейшие исследования, чтобы определить, требуется ли минимальное количество кератоцитов в донорской роговице, чтобы привести к хорошему визуальному восстановлению после трансплантации. Низкая плотность кератоцитов в донорской ткани, как и в патологической ткани, может быть объяснена старением, посмертной потерей клеток, вызванной ишемией, и/или хранением донорской ткани 27,39,40,41. Следует также отметить, что нормальные донорские роговицы, которые были получены и визуализированы в этом протоколе, были либо сохранены и отечны, либо опухли, либо были выброшены глазным банком перед трансплантацией из-за плохого качества эндотелия в соответствии со стандартами Ассоциации глазных банков ЕС. Если бы визуализация FF-OCM вместе с описанным протоколом была включена в настройки глазного банка, роговица, как правило, оценивалась бы в более свежем состоянии, чем это было возможно здесь, что может повлиять на плотность кератоцитов.
Описанный здесь протокол для анализа качества стромы может быть расширен для оценки десцеметовой мембраны, которая также может быть разрешена с помощью FF-OCM с точки зрения толщины и структуры21,24. Это может оказаться полезным для отбора тканей для эндотелиальной кератопластики десцеметовой мембраны, где тонкие десцеметовые мембраны может быть труднее отделить от стромы.
В заключение, FF-OCM позволяет точно и надежно оценить строму роговицы донора человека во время хранения. Улучшая качество трансплантата, добавление этого протокола к текущим процедурам банкирования глаз может улучшить скрининг и отбор донорских тканей и, следовательно, результаты кератопластики. Реальная интеграция устройства FF-OCM в рутину глазного банка должна быть облегчена недавними технологическими обновлениями, включая более быстрое получение изображений и большее поле зрения благодаря разработке специальной CMOS-камеры, а также разработке пользовательских стерильных одноразовых кассет для хранения роговицы и обработки во время визуализации.
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Эта работа получила финансирование от Национального агентства исследований (ANR) в рамках гранта PRTS (Projet de Recherche Translationelle en Santé) No ANR-13-PRTS-0009 (V.B.) и от исследовательской и инновационной программы Европейского Союза «Горизонт 2020» в рамках грантового соглашения No 709104 Марии Склодовской-Кюри (K.I.). Авторы благодарят Селин де Соуза за помощь в подсчете клеток и гистологической обработке.
Материалы
| Name | Company | Catalog Number | Comments |
| Light-CT Scanner | LLTech, France | http://www.lltechimaging.com/products-applications/products/ | FF-OCM device used in this manuscript for imaging |
| CorneaJet | EuroBio, France | http://www.eurobio-cornea.com/en/corneamax-10-100-ml-xml-352-822.html | Organ culture medium in which donor corneas are stored |
| CorneaMax | EuroBio, France | http://www.eurobio-cornea.com/en/corneajet-10-50-ml-xml-352-823.html | Dextran-supplemented organ culture medium used for deturgescence |
| Fiji (ImageJ) | National Institute of Health, Bethesda, MD, USA | https://fiji.sc/ | Open source image processing software |
| Matlab | Mathworks, Inc., Natick, MA, USA | https://www.mathworks.com/products/matlab.html | Mathematical computing software |
Ссылки
- Pascolini, D., Mariotti, S. P. Global estimates of visual impairment. Br J Ophthalmol. 96, 614-618 (2010).
- Shimazaki, J., Shimmura, S., Ishioka, M., Tsubota, K. Randomized clinical trial of deep lamellar keratoplasty vs penetrating keratoplasty. Am J Ophthalmol. 134, 159-165 (2002).
- Tsubota, K., Kaido, M., Monden, Y., Satake, Y., Bissen-Miyajima, H., Shimazaki, J. A new surgical technique for deep lamellar keratoplasty with single running suture adjustment. Am J Ophthalmol. 126, 1-8 (1998).
- Busin, M., Zambianchi, L., Arffa, R. C. Microkeratome-assisted lamellar keratoplasty for the surgical treatment of keratoconus. Ophthalmology. 112, 987-997 (2005).
- Amayem, A. F., Anwar, M. Fluid lamellar keratoplasty in keratoconus. Ophthalmology. 107, 76-79 (2000).
- Borderie, V. M., Guilbert, E., Touzeau, O., Laroche, L. Graft rejection and graft failure after anterior lamellar versus penetrating keratoplasty. Am J Ophthalmol. 151, 1024-1029 (2011).
- Borderie, V. M., Sandali, O., Bullet, J., Gaujoux, T., Touzeau, O., Laroche, L. Long-term results of deep anterior lamellar versus penetrating keratoplasty. Ophthalmology. 119, 249-255 (2012).
- Koo, T. S., Finkelstein, E., Tan, D., Mehta, J. S. Incremental cost-utility analysis of deep anterior lamellar keratoplasty compared with penetrating keratoplasty for the treatment of keratoconus. Am J Ophthalmol. 152, 40-47 (2011).
- Bahar, I., Kaiserman, I., Srinivasan, S., Ya-Ping, J., Slomovic, A. R., Rootman, D. S. Comparison of three different techniques of corneal transplantation for keratoconus. Am J Ophthalmol. 146, 905-912 (2008).
- Bahar, I., Kaiserman, I., Srinivasan, S., Ya-Ping, J., Slomovic, A. R., Rootman, D. S. Longterm results of deep anterior lamellar keratoplasty for the treatment of keratoconus. Am J Ophthalmol. 151, 760-767 (2011).
- Cheng, Y. Y., et al. Endothelial cell loss and visual outcome of deep anterior lamellar keratoplasty versus penetrating keratoplasty: a randomized multicenter clinical trial. Ophthalmology. 118, 302-309 (2011).
- Borderie, V. M., Sandali, O., Bullet, J., Guilbert, E., Goldschmidt, P., Laroche, L. Donor tissue selection for anterior lamellar keratoplasty. Cornea. 32, 1105-1109 (2013).
- Borderie, V., Martinache, C., Sabolic, V., Touzeau, O., Laroche, L. Light microscopic evaluation of human donor corneal stroma during organ culture. Acta Ophthalmol Scand. 76, 154-157 (1998).
- Bald, M. R., Stoeger, C., Galloway, J., Tang, M., Holiman, J., Huang, D. Use of fourier-domain optical coherence tomography to evaluate anterior stromal opacities in donor corneas. J Ophthalmol. 2013. 397680, (2013).
- Huang, D., et al. Optical coherence tomography. Science. 254, 1178-1181 (1991).
- Swanson, E. A., et al. In vivo retinal imaging by optical coherence tomography. Opt Lett. 18, 1864-1866 (1993).
- Izatt, J. A., et al. Micrometer-scale resolution imaging of the anterior eye in vivo with optical coherence tomography. Arch Ophthalmol. 112, 1584-1589 (1994).
- Stave, J., Zinser, G., Grummer, G., Guthoff, R. Modified Heidelberg retinal tomograph HRT. Initial results of in vivo presentation of corneal structures. Ophthalmologe. 99, 276-280 (2002).
- Beaurepaire, E., Boccara, A. C., Lebec, M., Blanchot, L., Saint-Jalmes, H. Full-field optical coherence microscopy. Opt Lett. 23, 244-246 (1998).
- Dubois, A., Vabre, L., Boccara, A. C., Beaurepaire, E. High-resolution full-field optical coherence tomography with a Linnik microscope. Appl Opt. 41, 805-812 (2002).
- Ghouali, W., et al. Full-field optical coherence tomography of human donor and pathological corneas. Curr Eye Res. 24, 1-9 (2014).
- Akiba, M., et al. Ultrahigh-resolution imaging of human donor cornea using full-field optical coherence tomography. J Biomed Opt. 12, 041202(2007).
- Latour, G., Georges, G., Lamoine, L. S., Deumie, C., Conrath, J., Hoffart, L. Human graft cornea and laser incisions imaging with micrometer scale resolution full-field optical coherence tomography. J Biomed Opt. 15, 056006(2010).
- Grieve, K., Georgeon, C., Andreiuolo, F., Borderie, M., Ghoubay, D., Rault, J., Borderie, V. M. Imaging microscopic features of keratoconic corneal morphology. Cornea. 35, 1621-1630 (2016).
- Borderie, M., et al. New parameters in assessment of human donor corneal stroma. Acta Ophthalmol. 95. 297, e297-e306 (2017).
- Borderie, V. M., Scheer, S., Touzeau, O., Vedie, F., Carvajal-Gonzalez, S., Laroche, L. Donor organ cultured corneal tissue selection before penetrating keratoplasty. Br J Ophthalmol. 82, 382-388 (1998).
- Borderie, V. M., Baudrimont, M., Lopez, M., Carvajal, S., Laroche, L. Evaluation of the deswelling period in dextran-containing medium after corneal organ culture. Cornea. 16, 215-223 (1997).
- Tech, L. L. , Light-CT Scanner. http://www.lltechimaging.com/products-applications/products (2017).
- Doughty, M. J., Müller, A., Zaman, M. L. Assessment of the reliability of human corneal endothelial cell-density estimates using a noncontact specular microscope. Cornea. 19, 148-158 (2000).
- Irsch, K., Borderie, M., Grieve, K., Plamann, K., Laroche, L., Borderie, V. M. Objective analysis of stromal light backscattering with full-field optical coherence tomographic microscopy shows potential to quantify corneal transparency. Frontiers in Optics. OSA Technical Digest (online), paper FW6A.6. , (2015).
- Bocheux, R., Pernot, P., Borderie, V., Plamann, K., Irsch, K. Quantitative measures of corneal transparency, derived from objective analysis of depth-resolved corneal images, demonstrated with full-field optical coherence tomographic microscopy. PLoS ONE. e0221707. 14, (2019).
- Karimi, A. H., Wong, A., Bizheva, K. Automated detection and cell density assessment of keratocytes in the human corneal stroma from ultrahigh resolution optical coherence tomograms. Biomed Opt Express. 2, 2905-2916 (2011).
- Ku, J. Y., Niederer, R. L., Patel, D. V., Sherwin, T., McGhee, C. N. Laser scanning in vivo confocal analysis of keratocyte density in keratoconus. Ophthalmology. 115, 845-850 (2008).
- Ozgurhan, E. B., Kara, N., Yildirim, A., Bozkurt, E., Uslu, H., Demirok, A. Evaluation of corneal microstructure in keratoconus: a confocal microscopy study. Am J Ophthalmol. 156, 885-893 (2013).
- Erie, J. C., Patel, S. V., McLaren, J. W., Nau, C. B., Hodge, D. O., Bourne, W. M. Keratocyte density in keratoconus. A confocal microscopy study. Am J Ophthalmol. 134, 689-695 (2002).
- Imre, L., Resch, M., Nagymihaly, A. Konfokale In-vivo-Hornhautmikroskopie nach Keratoplastik. Ophthalmology. 102, 140-146 (2005).
- Niederer, R. L., Perumal, D., Sherwin, T., McGhee, C. N. Laser scanning in vivo confocal microscopy reveals reduced innervation and reduction in cell density in all layers of the keratoconic cornea. Invest Ophthalmol Vis Sci. 49, 2964-2970 (2008).
- Patel, S., McLaren, J., Hodge, D., Bourne, W. Normal human keratocyte density and corneal thickness measurement by using confocal microscopy in vivo. Invest Ophthalmol Vis Sci. 42, 333-339 (2001).
- Komuro, A., Hodge, D. O., Gores, G. J., Bourne, W. M. Cell death during corneal storage at 4 degrees. C. Invest Ophthalmol Vis Sci. 40, 2827-2832 (1999).
- Gambato, C., Longhin, E., Catania, A. G., Lazzarini, D., Parrozzani, R., Midena, E. Aging and corneal layers: an in vivo corneal confocal microscopy study. Graefes Arch Clin Exp Ophthalmol. 253, 267-275 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены