Method Article
Обнаружение низких копии число комплексных вирусной ДНК, образованный в Vitro инфекции гепатита B
В этой статье
Резюме
Мы опишем здесь в vitro поколение HBV ДНК через систему инфекции вирусом гепатита B и высокочувствительный обнаружения ее интеграции (1 – 2 экз.), с помощью обратной вложенных ПЦР.
Аннотация
Вирус гепатита в (HBV) является общим кровь патогена, вызывая рак печени и цирроза печени в результате хронической инфекции. Вирус обычно реплицируется через episomal ДНК промежуточных; Однако наблюдается интеграция фрагментов ДНК HBV в хост геномов, несмотря на то, что эта форма не является необходимым для репликации вируса. Точные цели, сроки и механизма(ов), по которой HBV ДНК происходит интеграция пока не ясно, но последние данные показывают, что это происходит очень рано после инфекции. Здесь подробно описаны в vitro поколения и обнаружение ДНК HBV интеграций. Наш протокол конкретно усиливает одной копии вируса клеточной ДНК внедрений и позволяет как абсолютное количественной, так и резолюции сингл база пара последовательности перехода. Этот метод применен к различным HBV-чувствительными типов клеток (включая первичный человека гепатоцитов), различные ГВ мутантов и в сочетании с различными экспозициями наркотиков. Мы предвидим эту технику, став ключевым пробирного определить глубинные механизмы этого клинически значимых явления.
Введение
HBV является двуцепочечной ДНК вируса, которая может привести к пожизненной хронической инфекции, ведущих к цирроз печени и гепатоцеллюлярной карциномой (HCC)1,2,3. Хотя есть несколько молекулярные механизмы вождения HBV сохраняемости4 (например, высокая стабильность эпигеномные вирусный транскрипционный анализ шаблона), уклонение иммунной наблюдения и низкий оборот гепатоцитов в печени и ее связанные риска HCC начало5,6 (например, хроническое воспаление и активации клеточного подчеркнуть пути), плохо изучено интеграции HBV ДНК в геном клетки хост (сообщил механизм для обоих из этих явлений) . Основной причиной является отсутствие подходящих в vitro инфекции систем для ГВ которые позволяют надежное обнаружение событий интеграции. Здесь мы описываем недавно разработала протокол для поколения в пробирке и обнаружения внедрений HBV ДНК, которые могут использоваться для выяснения глубинные механизмы и их последствия.
Репликации HBV и формирование HBV ДНК интеграции ранее рассматривался в деталях7. Вкратце ГВ входит гепатоцитов, используя пептидные Co-transporting натрия Taurocholate (НПБТ) в качестве основных клеточных рецепторов для инфекции8,9. Nucleocapsids ГВ, содержащий круговой ДНК HBV-расслабленной (rcDNA) генома проникает в ядро, где rcDNA преобразуется в episomal ковалентно закрытых круговой ДНК (cccDNA). Ядерный cccDNA действует как транскрипционный анализ шаблон для вирусных мРНК и предварительно геномной РНК (pgRNA)10. HBV полимеразы и pgRNA затем упаковываются в новообразованной nucleocapsids (состоящий из ГВ основной белок димеры). HBV pgRNA, реверс расшифрованный в пределах нуклеокапсидом, что приводит к rcDNA геном или двунитевая линейной ДНК (dslDNA) генома11,12. Эти пожилые nucleocapsids, содержащие HBV ДНК геномов наконец охватило и экспортированы как вирионов.
Инфекция гепатоцитов, запечатанная частиц, содержащих dslDNA молекул может привести к вирусной интеграции в принимающей ячейки генома13, приводит к репликации некомпетентность формы ДНК HBV7,14,15. HBV ДНК интеграция происходит на сайте хромосомных двуцепочечной ДНК перерывы15. Накапливая доказательства свидетельствуют о том, что происходит каждое событие интеграции в основном случайные позиции в пределах принимающей ячейки генома16,17. Кроме того, интеграция HBV ДНК происходит несколько редко, в размере 1 на 104 клетки13,18,19,20. Важные вопросы, касающиеся интеграции HBV ДНК остаются без ответа, особенно относительно точные молекулярные пути участвующих, зависимость от вирусных и принимающих факторы, вирусных антигенов, выразила из интегрированных форм и их возможного вклада для вирусный сохранение7. Мы создали модель в vitro пролить свет на некоторые из этих вопросов.
Редкость HBV ДНК интеграции события (как в отношении интеграции процессоров в клетку и копировать количество каждой уникальной интеграции) в vitro ВГВ модели делают их трудно обнаружить. Митоз клеток ограничен в нашей системе в пробирке , поскольку делящиеся клетки не поддерживают эффективное инфекции. Таким образом в отличие от пациентов печени тканей, где значительные клоновых расширения гепатоцитов происходит18,19,20, очень в тот или иной пул клеток присутствуют несколько копий (1-2) каждого интеграции инфицированных в пробирке . Мы также обнаружили, что интеграция в основном происходит во время первичной инфекции гепатоцитов (а не непрерывно в хронически инфицированных гепатоцитов)13. Соответственно HBV ДНК интеграции не могут быть увеличены просто культивирования клеток на более длительный период.
В целом методы, которые ранее использовались для выявления комплексных HBV ДНК, включая Южный блот гибридизации21,,2223,24,25, Alu-ПЦР26,27 , кассета опосредованной лигирование ПЦР28и весь геном последовательности29,30,,3132,33, не имеют чувствительность обнаружения Одноместный копии интеграций. Мы и другие исследователи использовали обратное вложенных ПЦР (invPCR) для выявления ДНК интеграции hepadnaviral утка, сурок и человека инфицированных печень13,14,18,19, 34,35,36. Другие ввели процедурные изменения в метод invPCR, которые могут изменить генерации ложных сигналов и ограничивают возможности для количественной оценки37. Если проба осуществляется, как описано в настоящем Протоколе, invPCR представляет конкретные и чувствительной assay, который идентифицирует и количественно (в количестве абсолютной копией) несколько HBV ДНК интеграций. Перекрестка HBV-клеточной ДНК применяется в одной пары-разрешение, позволяя биоинформатический исследований вирусных и последовательностей ДНК пребывания в местах интеграции13.
Ранее мы описали38 результаты от invPCR на ДНК HBV-инфицированные ткани, извлеченные из большого круга источников, включая оснастки замороженные ткани печени, парафин врезанных печени секции и образцы чрезвычайно малых тканей, изолированные лазер microdissection19. Этот протокол описывает обновленную версию invPCR assay с помощью ДНК, извлеченные из клеток тканей культуры, полученных после в vitro инфекцию, в котором генерируются низкая копирования количество внедрений (1 – 2 копий на интеграции). HBV ДНК интеграций формируется в vitro напоминают те нашли в тканях пациента в отношении их распределение над клеточного генома и соединения в течение вирусных последовательности, которая является комплексной13,16, предлагая сопоставимых путь к внутри инфицированных печени.
протокол
1. сотовый инфекции и экстракции ДНК
- Поддерживать культурный Huh7-НПБТ клетки8,9 в Дульбекко изменение Eagle среднего (DMEM) с 10% v/v плода бычьим сывороточным, 1 x пенициллина/стрептомицина и 2 мм L-глютамина.
Примечание: Это ранее сообщалось в деталях40. - Семенной 2 x 105 клеток/мл Huh7-НПБТ клетки в 12-ну плиту с 1 мл раствора DMEM.
- Если тестирование клетки лечения (например, ингибиторы ГВ), применять их к культуре супернатанта 4 h после посева (за 1 день до ВГВ). Для отрицательного контроля, применяются 200 Нм Myrcludex B (мощным HBV ввода ингибитора41).
- Использовать супернатант42 гепарин колонки очищенного от HepAD3843 как посевным материалом, чтобы заразить клетки на 1000 VGE/ячейку в 500 мкл культуры СМИ (DMEM дополнена 10% v/v плода бычьим сывороточным, 1 x пенициллина/стрептомицина, 2 мм L-глютамина и 2,5% v/v ДМСО), содержащий 4% w/v полиэтиленгликоль 8000 [растворяют в 1 x фосфат амортизированное saline (PBS)].
- Культура клетки в инкубатор 37 ° C (установлена на 5% CO2 и 90% влажности).
- Вымойте клетки дважды с 1 мл стерильного ПБС в 16 – 24 ч после инфекции.
- Замените культуру СМИ каждые 2 дня после инфекции ВГВ до сбора урожая.
- На 3 день после инфекции, лечения клетки с 5 дизопроксил тенофовир мкм и 10 мкм ламивудин ограничить производство ВГВ репликативной промежуточных продуктов, которые мы по invPCR.
- На 5 день после инфекции trypsinize клетки с 200 мкл трипсина-ЭДТА и Ресуспензируйте их в 2 мл DMEM (дополнена 10% v/v плода бычьим сывороточным, 1 x пенициллина/стрептомицина и 2 мм L-глютамин), также содержащий 5 дизопроксил тенофовир мкм и 10 мкм Ламивудин.
- Передача суспензий клеток к пластине 6-Ну чтобы побудить один раунд митоз (которое было сообщено вызвать потерю HBV cccDNA44 и других промежуточных HBV ДНК, которые мы по invPCR).
- На 7 день после инфекции trypsinize расширенной клетки в 400 мкл трипсина-ЭДТА и Ресуспензируйте смеси в 1 мл DMEM. Место подвеска в 1,5 мл, Пелле клетки центрифугированием на 500 g x 5 минут и удалить супернатант путем аспирации.
- (Необязательно) Храните клетки гранул при-20 ° C до тех пор, пока они были готовы для экстракции ДНК.
- Извлечь ДНК из Пелле ячейки, используя набор для экстракции ДНК, в соответствии с инструкциями производителя. Оцените окончательный концентрации ДНК с помощью оптических денситометрия.
Примечание: ДНК урожай в объеме элюции 100 мкл составляет ~ 250-400 нг/мкл.
2. Инверсия ДНК
- Аликвота ~1.5–2.5 мкг ДНК всего извлечь из шага 1 в 200 мкл ПЦР-пробирку. Добавьте соответствующее количество энзима ограничения Мастер микс приведет к 40 мкл реакции тома, содержащего 1 x дайджест реакции буфера (например., CutSmart буфера) и 10 U Ncoя ВЧ.
- Тщательно перемешать реакции и спин вниз в центрифуге небольшой трубки. Инкубируйте реакции энзима ограничения в машину ПЦР при 37 ° C на 1 ч для оптимального пищеварения эффективности.
- Инактивирует энзима ограничения по инкубации при 80 ° C для 20 мин.
- Передача всей энзима ограничения реакция на 1,5 мл. Добавить 400 мкл 1 x T4 ДНК лигаза буфера и 500 U T4 ДНК лигаза и тщательно перемешать. Объем большой реакции поощряет внутри молекулярные (в противоположность между молекулярной) перевязки переваривается фрагментов ДНК.
- Инкубируйте реакции перешнуровки при комнатной температуре на 2 ч для обеспечения полной перевязки.
- Инактивирует T4 ДНК лигаза при 70 ° C для 20 мин.
- Добавьте 10 мкл 10% w/v лаурилсульфат натрия для обеспечения полной инактивации лигаза T4.
- Смешать трубы, пульс vortexing и кратко вращаться вниз реакция смеси. Добавьте NaCl в конечной концентрации 100 мм и декстрана (35 – 45 кДа) до конечной концентрации 90 мкг/мл. Смешать трубы, пульс vortexing и кратко вращаться вниз реакция смеси.
- Добавьте 900 мкл, 100% этанола и перемешать путем инверсии. Осадок ДНК при-20 ° C на ночь.
- Пелле осажденный ДНК центрифугированием в 14.000 x g 15 мин удалить супернатант аспирации с пипеткой P200. Помойте лепешка с 500 мкл 70% v/v этанола и центрифугирования в 14.000 x g за 15 мин.
- Удалите этанола, аспирации с пипеткой P200. Просушите Пелле ДНК при комнатной температуре в течение 20 мин.
- Растворяют гранулы в 20 мкл H2O. добавить 20 мкл энзима ограничения Мастер микс приведет к 40 мкл реакции тома, содержащего 1 x дайджест реакции буфера, 5 U BsiHKAI и 5 U Sph-HF. инкубировать реакции энзима ограничения в тепло блок при 37 ° C (оптимальная температура для Sph-HF) за 1 ч.
- Кратко вращаться вниз реакция смеси. Инкубируйте реакции энзима ограничения в блоке тепла при 65 ° С (оптимальная температура для BsiHKAI) за 1 ч.
- Кратко вращаться вниз реакция смеси.
- Храните Перевернутый ДНК при-20 ° C до следующего шага.
3. вложенные PCR
- Удаление потенциальных ампликонов от многоразового кремния мат печать с использованием раствора деградации ДНК, мат с ДНК свободной воды тщательно промойте и просушите при комнатной температуре при подготовке смеси ПЦР.
- Подготовка 1 мл 1 x PCR смеси, содержащие внешние вперед (5'-TTC GCT TCA CCT КТГ CAC G-3') и обратного (5'-AAA GGA CGT КХЦ ГКГ ЦАГ-3') грунты в концентрации 0,5 мкм.
- Добавьте 170 мкл 1 x PCR смеси в скважины A1 и E1 в 96-луночных ПЦР-планшете.
- Добавьте 120 мкл 1 x PCR смеси в скважины B1 до H1.
- Добавить 10 мкл Перевернутый ДНК из шага 2 Уэллс A1 и E1 (2 различных Перевернутый образцы могут быть проанализированы на пластину же ПЦР). Смесь реакции в каждой скважине, нежно закупорить каждый около 10 раз с помощью P1000, равным 100 мкл.
- Серийно разбавленных пробах скважин A1 по D1 в соотношении 1:3 перечисляя 60 мкл на каждом шагу. Смешайте скважин на каждом шаге аккуратно закупорить их о 10 раз с помощью P1000, равным 100 мкл. Избегайте формирования пузырьков. Повторите шаг 3.6 для хорошо E1, разбавления до хорошо H1.
- Аликвота 10 мкл реакционной смеси с помощью многоканальных дозаторов из скважин A1-H1 в скважины A2-H2, A3-H3, и так далее до достижения скважин А12-H12 96-луночных пластины. Крышка ПЦР с сухой кремний коврик от шаг 3.1, нажав твердо.
- Установите пластину в машину ПЦР и запустите следующую программу: 10 мин при 95 ° C; 35 циклов 15 s при 95 ° C, 15 s на 54 ° C и 3 мин при 72 ° C; 7 мин при 72 ° C; затем удерживая пластины при комнатной температуре.
- Тепла булавки репликатора 96-контактный в раскаленные с помощью горелки Бунзена и затем остыть по крайней мере 5 минут при комнатной температуре.
- Заполнить скважин второй пластины ПЦР с 10 мкл 1 x PCR смеси (содержащие буфер нагрузки готовый гель) и внутренний вперед (5'-CGC ГПТ кляп АКК АКК GTG А-3') и обратного (5'-CAC СМЖЛ CTA ГЦА GCC ГПТ G-3') на 0,5 мкм.
- Осторожно удалите кремний коврик из ПЦР-планшете пластину 96-луночных от первого раунда PCR и избежать перекрестного загрязнения между скважинами.
- Используете охлажденную replicator передать пластину недавно aliquoted 96-луночных продукты PCR 96-луночных пластины из первого раунда ПЦР. Осуществляют вложенных ПЦР, используя те же условия, что и в шаге 3.8, за исключением изменения первоначального денатурации шаг на 95 ° C от 10 мин до 2 мин.
4. ПЦР продукта изоляции и извлечения геля
- Анализ продуктов ПЦР электрофорезом геля, используя 96-луночных с 1,3% w/v геля агарозы. Для 100 мл геля агарозы запустите на 200 V для 10 – 15 мин.
- Акцизный полос ДНК из гелей агарозы, с помощью одноразовых питьевой соломинки. Для каждого продукта PCR место соломы и геля агарозы Подключите 1,5 мл трубку и обрезать солома размером с ножницами.
Примечание: Это достаточно изолировать полос только от тех разведений, которые могут быть решены одной продукты PCR. - (Необязательно) Храните трубы при-20 ° C для последующего извлечения.
- Извлечения вилки агарозы в каждую пробирку, сжимая в конце фрагмента соломы. Добавьте 300 мкл буфера извлечения геля и 5 мкл гель извлечения стеклянный шарик навоза в каждую пробирку.
- Извлечь продукты PCR согласно инструкции производителя для комплекта извлечения геля (за исключением используя половину томов для мытья шаги) и элюировать ДНК из бисера с 30 мкл воды.
- Представить очищенная ДНК для Сэнгер последовательности (согласно инструкциям производителя) грунтом вперед, используемых в втором раунде вложенных ПЦР.
5. последовательность анализа
- Подтвердите вирус клеточной ДНК развязок, анализ нуклеотидных взрыва (с использованием параметров по умолчанию, приведение к коллекции всего нуклеотидов).
Примечание: Представитель результаты подробно в рисунке 3 ниже.- Если только наблюдается частичное выравнивание последовательности, отделка 5' последовательности ДНК HBV перед повторным запуском BLAST анализ.
- Применяются строгие критерии для определения, если данная последовательность представляет подлинной интеграции junction следующим:
- Включает только последовательности содержащие > 20 bp сотовой последовательности для клеточного генома уверенно сопоставления.
- Игнорировать любые последовательности, которые содержат ограничения сайтов любого ферментов, используемых в рамках 10 bp предполагаемый вирус клеточной интеграции Джанкшен, как они, вероятно, представляют в vitro лигирование события, а не подлинной интеграции развязок.
- Игнорировать любые последовательности с очевидным разнородных пиковые уровни флюоресценции по обе стороны от перекрестка предполагается интеграция в последовательности хроматографы, как эти, скорее всего, артефакты, порожденных перекрестного заражения во время виртуализации реакции или капиллярной хроматографии.
- Определите уникальную интеграцию событий как те с точным ГВ и клеточных последовательностей на стыке вирус клеток.
Примечание: Повторение событий уникальная интеграция может быть результатом клоновых расширения клеток, содержащих эти интеграции или перекрестного заражения во время ПЦР (которые могут быть проверены с помощью отрицательной контроль реакции, более подробно в результатах представительных ниже). Ожидается, что неоднократные интеграции в конкретных клеточных последовательностей отображать различные ГВ терминала сайты для каждого события, интеграции, как не гомологичных прихода в конце пути используется15.
- Рассчитайте частоту интеграции путем умножения на коэффициент разбавления Перевернутый ДНК шаблонов на количество вируса клеточной развязок, обнаруженных в этом разрежения, следуют нормализации количество общего ввода ДНК в реакция инверсии. Как правило, интеграции частота составляет порядка 1:104 клетки.
Результаты
Схематическое представление метода invPCR показано на рисунке 1. Электрофорез геля агарозы пример из успешных invPCR показано на рисунке 2 , до и после изоляции продукта PCR. Рисунок 3 показывает взрыв анализ вывода из шага 5.1 в случае (i) усиление вирус клеточной ДНК соединения и (ii) усиления промежуточного репликативной HBV ДНК.
Ожидаемые результаты от положительных элементов управления: Huh7-НПБТ клетки, инфицированные с гепарином очищенная HBV запасы, как описано выше (рис. 1) может служить в качестве позитивного элемента управления. В этом случае один продукты PCR должно быть достигнуто путем разбавления второй или третий 1:3 каждого образца (соответствующий ~ 104 ячейки эквиваленты за разрежения, рис. 2). На этих разведений примерно 50% продукции будет представлять истинный вирус клеточной ДНК развязок, в то время как другая половина представляет амплификации ДНК HBV интермедиаты (рис. 3).
В предыдущих исследованиях13мы нашли несколько случаев повторных вирус клеточной развязок, предложив не Сотовые геномной сайты преференциальных HBV ДНК интеграции. Мы также считаем, что >80% стыков вирус клеток происходят между нуклеотидов 1732 и 1832 (согласно нуклеотидов нумерация генотип гепатита D, GenBank присоединения #U95551.1), где последний представляет правой конечной формы dslDNA ГВ. Последовательности развязок истинный вирус клеток найдены через наш метод в экспериментах в vitro публично доступны на GenBank (присоединение номера MH057851 MH058006).
Ожидаемые результаты от негативных элементов: неинфицированных клеток Huh7-НПБТ или прививку Huh7-НПБТ клетки, предварительно обработанных с Myrcludex B может действовать как негативный контроль. InvPCR анализ ДНК, извлеченные из этих клеток следует производить без продуктов ПЦР. Запуск этих отрицательных контрольных образцов на пластину же PCR как положительных образцов позволяет для тестирования перекрестного загрязнения во время процесса вложенные PCR. Наиболее жесткие тест для перекрестного загрязнения является отрицательной контрольной пробы в скважинах A-D и положительный пример в скважинах E-H на плиту 96-луночных. В этом случае наиболее концентрированным разрежения положительный пример выполняется в непосредственно прилегающих к наименее концентрированный разбавления негативные образца строки. Если продуктов амплификации наблюдаются в отрицательной контрольных образцов, Институт мер, предложенных в ходе обсуждения для сведения к минимуму загрязнения события.
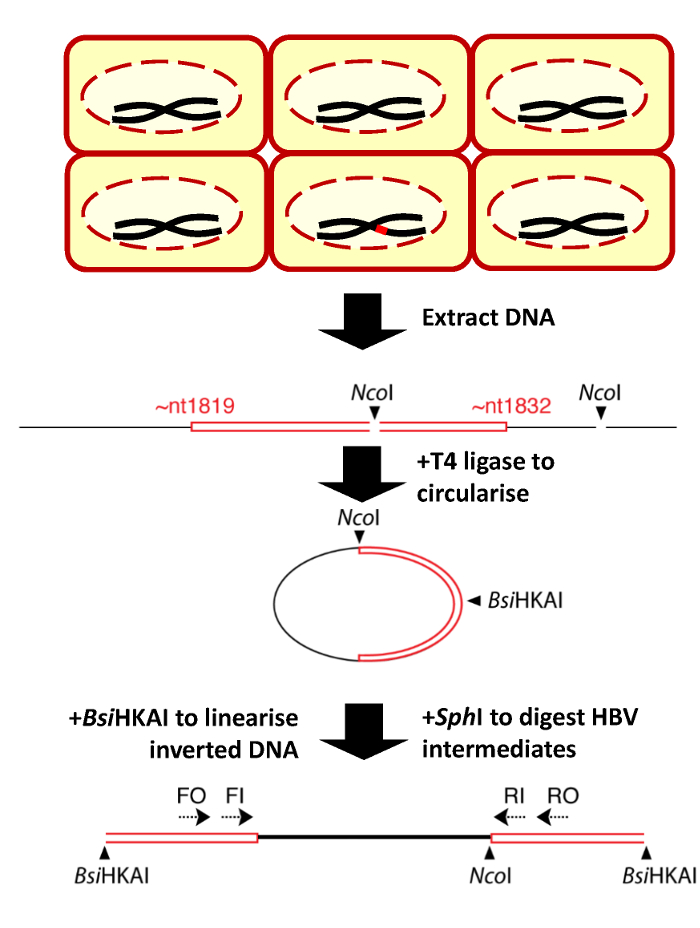
Рисунок 1: схема рис invPCR процесса для выявления ДНК HBV интеграций. После инфекции ВГВ, только меньшинство Huh7-НПБТ клетки содержат HBV dslDNA (красный) интегрированы в геном клетки хост (красный), изображенные в верхней части. Общая ДНК затем извлекаются из клеток (шаг 1), Перевернутый (шаг 2) и усиливается вложенных ПЦР (шаг 3). Показаны являются относительные позиции энзима ограничения сайтов (НКОя и BsiHKAI) в стыке подакцизным вирус клеточной ДНК. На рисунке показана адаптирована от предыдущего издания13. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
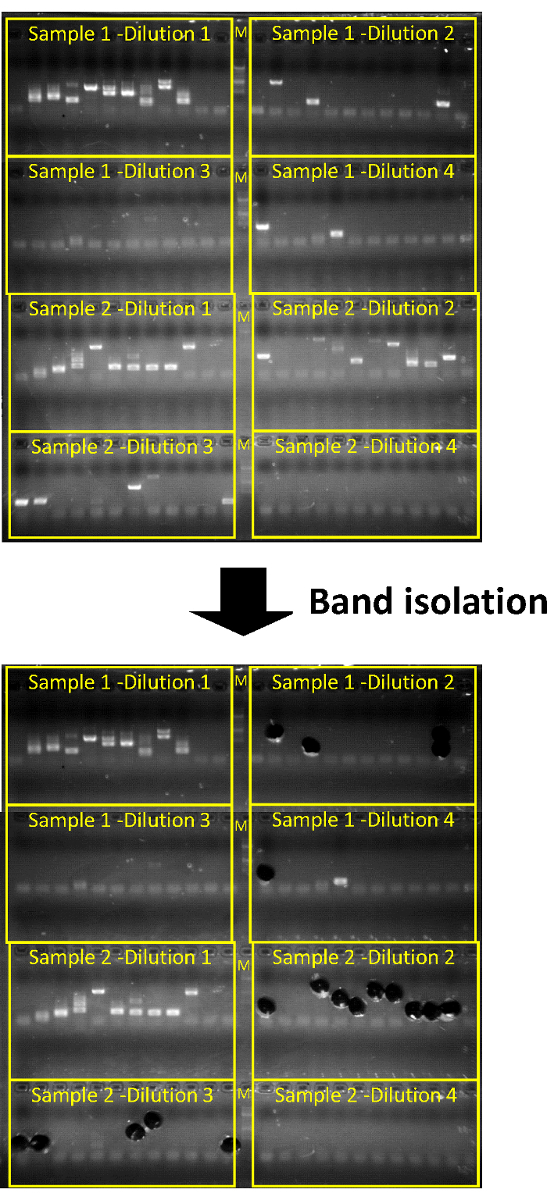
Рисунок 2: гель агарозы электрофореза и последующих гель добыча успешной invPCR. «M» представляет маркер лестница ДНК. Каждая строка 12 представляет технические реплицирует на одного разрежения на ПЦР-планшете. Два Перевернутый образцы ДНК может запускаться на ПЦР пластины/агарозном геле. Продукты PCR для каждого разведения следует титровать, в ~ 1:3 соотношение. Добыча продукции из двух наименее концентрированный разведений, где одной полосы может быть легко изолированных обычно достаточно, как HBV ДНК интеграции ставка определяется конечной точки титрования. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
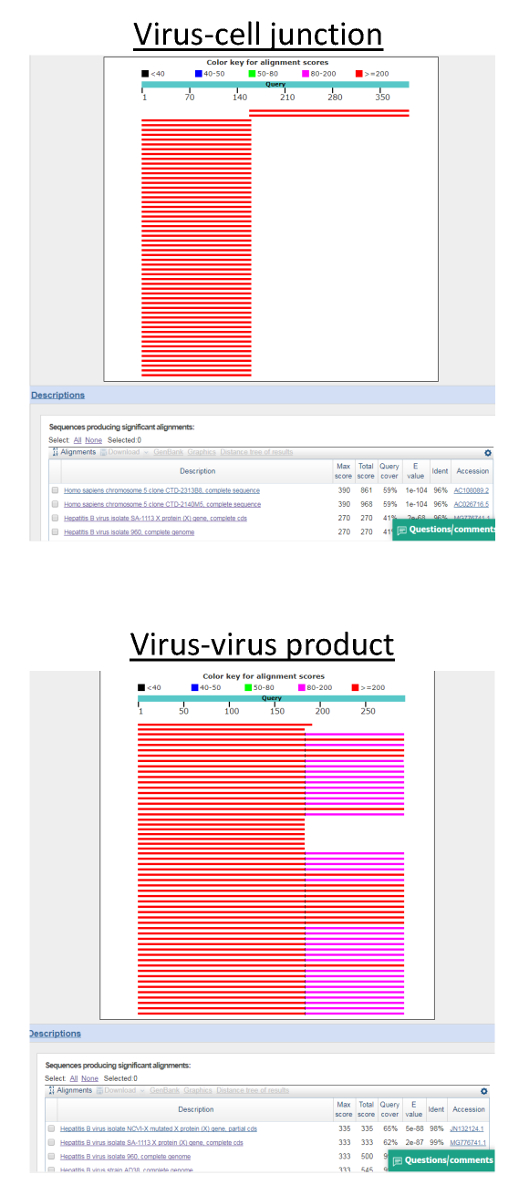
Рисунок 3: BLAST анализ последовательностей продукта invPCR. Как долго участки последовательности создаются из Сэнгер, виртуализации, источник последовательностей ДНК как правило однозначна. Сильный выравнивание ГВ и клеточных геномов наблюдается в различных областях FASTA последовательности файла, созданного из Sanger виртуализации на верхней панели, предложив истинный вирус клеточной ДНК соединения. В нижней панели последовательность выравнивает только фрагментов генома HBV, предлагая продукт, порожденных амплификации переставить HBV ДНК генома. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Перед выполнением протокола, важно отметить, что этот invPCR assay высокочувствительный метод, способный усилительных единичных экземпляров шаблона дна. Таким образом ограничение загрязнения продуктов PCR имеет первостепенное значение. Общие стратегии ограничить загрязнение продукта PCR включают следующее. (i) создания физически отдельные области для различных этапов метода. Каждая область должна иметь отдельные лаборатории пальто, и перчатки должны быть изменены при перемещении между этими областями. Мы перечислили эти области ниже в порядке от наиболее до наименее вероятно быть загрязнены: ПЦР продукта добычи и последовательности реакции set-up зона (пост ПЦР); Добавление шаблона ПЦР и пылали контактный передачи области (мы использовали ПЦР вытяжки с Обеззараживание УФ-лампа с хорошими результатами); Район добычи и инверсии ДНК (pre ПЦР); и зона «ДНК бесплатный шаблон» используется исключительно для подготовки запасов и ПЦР решения. (ii) быть осведомлены о потока воздуха в лаборатории как потенциальной движущей перекрестного загрязнения. В частности, перекрестное загрязнение PCR реакций на этапе передачи обожженные ПИН, скорее всего, происходят и будет привести к неточной квантификации интеграции частоты. Вытяжки ПЦР может использоваться для ограничения этих кросс токи. Отрицательный контроль скважины (например, Myrcludex B-лечение образцы или без шаблона элементов управления) в PCR может использоваться также для тестирования для перекрестного загрязнения. (iii) ограничить потенциальные загрязнители ПЦР на пипетки и рабочие поверхности, регулярно вытирая их с раствором деградации ДНК.
Протокол, указанный здесь организуется для обнаружения интеграция известных инфекционных HBV клона, созданный из HepAD38 клеток линии42. Если посевные используется другой последовательности ДНК HBV (например, от пациента сыворотки), затем геном ГВ следует сначала виртуализации для подтверждения совместимости праймеры PCR и инверсии дизайн. В ранее опубликованных исследований19мы использовали 3 комплекта грунты, которые связывают сохранены HBV ДНК последовательности фланкируя ожидаемых сайт HBV ДНК интеграции развязок. Другие последовательностей праймера и протоколы были описаны для определения геномной последовательности HBV44,45,46,,4748 и могут успешно работать.
Кроме того могут использоваться различные HBV-чувствительными клетки (например, основного человеческого гепатоцитов, дифференцированных HepaRG, HepG2-НПБТ); Однако мы обнаружили, что Huh7-НПБТ клетки обеспечивают наибольшее соотношение сигнал шум, при рассмотрении количество вируса клеточной ДНК перекрестки, которые усиливаются по сравнению с промежуточных ДНК вирус, что усиленный13. В частности неизлечимо дифференцированных клеток, таких как основного человеческого гепатоцитов или дифференцированных HepaRG не эффективно проходят митоз, что приводит к высоким уровнем мы HBV ДНК репликативной интермедиатов оставшиеся внутри клетки. Мы обнаружили, что ~ 90% усиливается последовательности представляют HBV ДНК перестановок (и не интеграции мероприятий) в неизлечимо дифференцированных клеток, по сравнению с 70-50% в линии клеток гепатомы13. Эти продукты, как правило, геномы HBV ДНК, содержащие большие изъятия в поверхность и основные открытые чтения фреймов, или они могут представлять HBV квази видов с дополнительной Ncoя сайта перед Sphя на сайте. Усиление этих видов ГВ (включая схема) были описаны подробно ранее13.
Есть несколько недостатков этого метода. Благодаря кропотливой и многодневные характер этого протокола invPCR не подходит для высокой пропускной способности анализ большого числа проб. Кроме того как он полагается на ограничение разрежения титрования, наш метод не очень точным в количественной оценке; Хотя, она должна легко измерить уровень журнала изменений в интеграции частоты.
Кроме того наши инверсии протокол только подходит для обнаружения интеграций, происходящих между регионе DR2 и ДР1 HBV генома, как большинство HBV интеграции происходят в этом регионе49. NGS анализ тканей пациента HBV показал, что значительного меньшинства (до ~ 50%) могут возникать за пределами этого региона49. Новые конструкции invPCR теоретически способны обнаруживать эти другие сайты интеграции, хотя они не (насколько нам известно) были проведены еще. В этой связи, ввиду необходимости энзима ограничения сайтов требуется вниз по течению от перекрестка последовательности вирус клеток для инверсии реакции, invPCR не обнаружить все интеграций, происходящие в регионах DR2 и ДР1 генома ГВ (то есть, мы подсчитали, что ~ 10% всех внедрений обнаруживаются с помощью в silico моделирования13). Однако при применении к целенаправленной пакет образцов с небольшим количеством различных методов лечения, invPCR является одним из только практические методы для обнаружения комплексной HBV ДНК в одной резолюции база пара.
Поэтому мы предусматриваем применения этого метода, где ключевую роль в поиске вирусный (через мутации посевным материалом ГВ), клеточный (нокаут или гиперэкспрессия конкретных клеточных генов, или через применение различных препаратов) и экологических ( Например, воздействие Оксидативный стресс) факторы, которые вызывают HBV ДНК интеграции. С этим методом и недавно разработанных систем инфекции HBV мы включить беспрецедентный контроль этих факторов, так что они могут быть хорошо изолированы и лучше характеризуется. Мы также ожидаем, что это приведет к ключевых понимание последствий клеточных ДНК HBV интеграции, в том числе в какой мере вирусных антигенов (например, HBx или HBsAg50) выражаются с интегрированной форме, что контролирует это выражение, и ли или не ГВ интеграции значительно изменяет сотовой фенотип к более про онкогенных государства. Результаты этих будущих исследований будет иметь глубокое влияние на терапевтические стратегии, используемые для лечения хронического гепатита B и на базовое понимание самого вируса.
Раскрытие информации
У.е. — созаявителя и соизобретателем патентов, защиты Myrcludex B как ингибитор запись HBV/HDV. Т.т. объявляет отсутствие конфликта интересов.
Благодарности
Эта работа получила финансирование от немецкого центра инфекции исследований (DZIF), проекты 5.807 ТТУ гепатит и 5.704, TRR179 Deutsche Forschungsgemeinschaft (DFG) (TP 15) и Австралийский центр по ВИЧ и гепатит вирусологии исследований.
Мы в долгу перед профессор Уильям Мэйсон за его участие в разработке оригинального метода invPCR и демонстрации его нам. Мы хотели бы поблагодарить Drs. Yi Ni и Florian A. Lempp реагентов (клеточных линий и HBV посевным материалом). Мы признаем Anja Рипперт, Франциска Schlund, Сара Энгельгардта и д-р Катрин Schöneweis для оказания технической помощи. Мы благодарны, Мириам Kleinig для корректуры и профессора Николая Shackel и Ральф Bartenschlager для непрерывной поддержки.
Материалы
| Name | Company | Catalog Number | Comments |
| Dulbecco’s PBS | PAA | H15-002 | |
| DMEM medium | Thermo Fisher Scientific | 41965 | |
| Fetal bovine serum | PAA | A15-151 | Heat-inactivate before use |
| Penicillin, 10,000 U/mL; Streptomycin 10mg/ml, 100× | PAA | P11-010 | |
| L-glutamine, 200 mM | PAA | M11-004 | |
| Trypsin, 0.5 mg/mL; EDTA, 0.22 mg/mL, 1× | PAA | L11-004 | |
| PEG, MW 8000 | Sigma-Aldrich | 89510 | Stock at 40% w/v in 1xPBS, autoclave before use |
| DMSO for spectroscopy | Merck | 102950 | |
| Tenofovir disoproxil | Sigma-Aldrich | CDS021622 | Dissolve in DMSO |
| Lamivudine | Sigma-Aldrich | L1295 | Dissolve in DMSO |
| NucleoSpin Tissue kit | Macherey Nagel | 740952.250 | |
| NanoDrop 2000/2000c Spectrolphotometer | Thermo Fisher Scientific | ND-2000 | |
| NcoI-HF | NEB | R3193L | |
| T4 DNA ligase | NEB | M0202T | |
| Sodium dodecyl sulfate | Sigma-Aldrich | L3771 | |
| Sodium Chloride | Sigma-Aldrich | 433209 | |
| Dextran (35-45 kDa) | Sigma-Aldrich | D1662-10G | |
| Absolute Ethanol | Sigma-Aldrich | 32205-1L-D | |
| BsiHKAI | NEB | R0570L | |
| SphI-HF | NEB | R3182L | |
| Amplitaq Gold Taq kit | Thermo Fisher Scientific | 4331816 | Use for first nest PCR |
| Silicon sealing Mats for 96-Well PCR Plates | Biorad | 2239442 | |
| DNAZap PCR DNA Degradation Solution | Thermo Fisher Scientific | AM9890 | |
| 96-well PCR plates | Sigma Aldrich | CLS6509 SIGMA | |
| 96-pin replicator | Thermo Fisher Scientific | 250520 | |
| GoTaq Flexi PCR kit | Promega | M8295 | Use for second nest PCR, use green buffer for easy loading of agarose gel |
| Biozym LE Agarose | Biozym | 840004 | |
| QIAEX II Gel extraction kit | QIAGEN | 20051 |
Ссылки
- Lin, X., et al. Chronic hepatitis B virus infection in the Asia-Pacific region and Africa: review of disease progression. Journal of Gastroenterology and Hepatology. 20 (6), 833-843 (2005).
- Iloeje, U. H., et al. Predicting cirrhosis risk based on the level of circulating hepatitis B viral load. Gastroenterology. 130 (3), 678-686 (2006).
- Huang, Y. T., et al. Lifetime risk and sex difference of hepatocellular carcinoma among patients with chronic hepatitis B and C. Journal of Clinical Oncology. 29 (27), 3643-3650 (2011).
- Nassal, M. HBV cccDNA: viral persistence reservoir and key obstacle for a cure of chronic hepatitis B. Gut. 64 (12), 1972-1984 (2015).
- Tu, T., Budzinska, M. A., Shackel, N. A., Jilbert, A. R. Conceptual models for the initiation of hepatitis B virus-associated hepatocellular carcinoma. Liver International. 35 (7), 1786-1800 (2015).
- Tu, T., Buhler, S., Bartenschlager, R. Chronic viral hepatitis and its association with liver cancer. Biological Chemistry. 398 (8), 817-837 (2017).
- Tu, T., Budzinska, M. A., Shackel, N. A., Urban, S. HBV DNA Integration: Molecular Mechanisms and Clinical Implications. Viruses. 9 (4), (2017).
- Yan, H., et al. Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus. eLife. 1, e00049 (2012).
- Ni, Y., et al. Hepatitis B and D viruses exploit sodium taurocholate co-transporting polypeptide for species-specific entry into hepatocytes. Gastroenterology. 146 (4), 1070-1083 (2014).
- Tuttleman, J. S., Pourcel, C., Summers, J. Formation of the pool of covalently closed circular viral DNA in hepadnavirus-infected cells. Cell. 47 (3), 451-460 (1986).
- Staprans, S., Loeb, D. D., Ganem, D. Mutations affecting hepadnavirus plus-strand DNA synthesis dissociate primer cleavage from translocation and reveal the origin of linear viral DNA. Journal of Virology. 65 (3), 1255-1262 (1991).
- Wang, G. H., Seeger, C. The reverse transcriptase of hepatitis B virus acts as a protein primer for viral DNA synthesis. Cell. 71 (4), 663-670 (1992).
- Tu, T., Budzinska, M. A., Vondran, F. W. R., Shackel, N. A., Urban, S. Hepatitis B virus DNA integration occurs early in the viral life cycle in an in vitro infection model via NTCP-dependent uptake of enveloped virus particles. Journal of Virology. , (2018).
- Yang, W., Summers, J. Integration of hepadnavirus DNA in infected liver: evidence for a linear precursor. Journal of Virology. 73 (12), 9710-9717 (1999).
- Bill, C. A., Summers, J. Genomic DNA double-strand breaks are targets for hepadnaviral DNA integration. Proceedings of the National Academy of Sciences of the United States of America. 101 (30), 11135-11140 (2004).
- Budzinska, M., Shackel, N. A., Urban, S., Tu, T. Sequence Analysis of Integrated Hepatitis B Virus DNA during HBeAg-Seroconversion. Emerging Microbes and Infections. , (2018).
- Budzinska, M., Shackel, N. A., Urban, S., Tu, T. Cellular genomic sites of HBV DNA integration. Genes. , (2018).
- Mason, W. S., Liu, C., Aldrich, C. E., Litwin, S., Yeh, M. M. Clonal expansion of normal-appearing human hepatocytes during chronic hepatitis B virus infection. Journal of Virology. 84 (16), 8308-8315 (2010).
- Tu, T., et al. Clonal expansion of hepatocytes with a selective advantage occurs during all stages of chronic hepatitis B virus infection. Journal of Viral Hepatitis. 22 (9), 737-753 (2015).
- Mason, W. S., et al. HBV DNA Integration and Clonal Hepatocyte Expansion in Chronic Hepatitis B Patients Considered Immune Tolerant. Gastroenterology. 151 (5), 986-998 (2016).
- Shafritz, D. A., Shouval, D., Sherman, H. I., Hadziyannis, S. J., Kew, M. C. Integration of hepatitis B virus DNA into the genome of liver cells in chronic liver disease and hepatocellular carcinoma. Studies in percutaneous liver biopsies and post-mortem tissue specimens. New England Journal of Medicine. 305 (18), 1067-1073 (1981).
- Hino, O., et al. Detection of hepatitis B virus DNA in hepatocellular carcinomas in Japan. Hepatology. 4 (1), 90-95 (1984).
- Fowler, M. J., et al. Integration of HBV-DNA may not be a prerequisite for the maintenance of the state of malignant transformation. An analysis of 110 liver biopsies. Journal of Hepatology. 2 (2), 218-229 (1986).
- Chen, J. Y., Harrison, T. J., Lee, C. S., Chen, D. S., Zuckerman, A. J. Detection of hepatitis B virus DNA in hepatocellular carcinoma: analysis by hybridization with subgenomic DNA fragments. Hepatology. 8 (3), 518-523 (1988).
- Esumi, M., Tanaka, Y., Tozuka, S., Shikata, T. Clonal state of human hepatocellular carcinoma and non-tumorous hepatocytes. Cancer Chemotherapy and Pharmacology. 23 Suppl, S1-S3 (1989).
- Murakami, Y., et al. Large scaled analysis of hepatitis B virus (HBV) DNA integration in HBV related hepatocellular carcinomas. Gut. 54 (8), 1162-1168 (2005).
- Kimbi, G. C., Kramvis, A., Kew, M. C. Integration of hepatitis B virus DNA into chromosomal DNA during acute hepatitis B. World Journal of Gastroenterology. 11 (41), 6416-6421 (2005).
- Tamori, A., et al. Alteration of gene expression in human hepatocellular carcinoma with integrated hepatitis B virus DNA. Clinical Cancer Research. 11 (16), 5821-5826 (2005).
- Sung, W. K., et al. Genome-wide survey of recurrent HBV integration in hepatocellular carcinoma. Nature Genetics. 44 (7), 765-769 (2012).
- Fujimoto, A., et al. Whole-genome sequencing of liver cancers identifies etiological influences on mutation patterns and recurrent mutations in chromatin regulators. Nature Genetics. 44 (7), 760-764 (2012).
- Jiang, S., et al. Re-evaluation of the Carcinogenic Significance of Hepatitis B Virus Integration in Hepatocarcinogenesis. Proceedings of the National Academy of Sciences of the United States of America. 7 (9), e40363 (2012).
- Jiang, Z., et al. The effects of hepatitis B virus integration into the genomes of hepatocellular carcinoma patients. Genome Research. 22 (4), 593-601 (2012).
- Kan, Z., et al. Whole-genome sequencing identifies recurrent mutations in hepatocellular carcinoma. Genome Research. 23 (9), 1422-1433 (2013).
- Summers, J., et al. Hepatocyte turnover during resolution of a transient hepadnaviral infection. Proceedings of the National Academy of Sciences of the United States of America. 100 (20), 11652-11659 (2003).
- Mason, W. S., Jilbert, A. R., Summers, J. Clonal expansion of hepatocytes during chronic woodchuck hepatitis virus infection. Proceedings of the National Academy of Sciences of the United States of America. 102 (4), 1139-1144 (2005).
- Mason, W. S., et al. Detection of clonally expanded hepatocytes in chimpanzees with chronic hepatitis B virus infection. Journal of Virology. 83 (17), 8396-8408 (2009).
- Chauhan, R., Churchill, N. D., Mulrooney-Cousins, P. M., Michalak, T. I. Initial sites of hepadnavirus integration into host genome in human hepatocytes and in the woodchuck model of hepatitis B-associated hepatocellular carcinoma. Oncogenesis. 6 (4), e317 (2017).
- Tu, T., Jilbert, A. R. Detection of Hepatocyte Clones Containing Integrated Hepatitis B Virus DNA Using Inverse Nested PCR. Methods in Molecular Biology. 1540, 97-118 (2017).
- Ni, Y., Urban, S. Hepatitis B Virus Infection of HepaRG Cells, HepaRG-hNTCP Cells, and Primary Human Hepatocytes. Methods in Molecular Biology. 1540, 15-25 (2017).
- Schulze, A., Schieck, A., Ni, Y., Mier, W., Urban, S. Fine mapping of pre-S sequence requirements for hepatitis B virus large envelope protein-mediated receptor interaction. Journal of Virology. 84 (4), 1989-2000 (2010).
- Lempp, F. A., et al. Evidence that hepatitis B virus replication in mouse cells is limited by the lack of a host cell dependency factor. Journal of Hepatology. 64 (3), 556-564 (2016).
- Ladner, S. K., et al. Inducible expression of human hepatitis B virus (HBV) in stably transfected hepatoblastoma cells: a novel system for screening potential inhibitors of HBV replication. Antimicrobial Agents and Chemotherapy. 41 (8), 1715-1720 (1997).
- Allweiss, L., et al. Proliferation of primary human hepatocytes and prevention of hepatitis B virus reinfection efficiently deplete nuclear cccDNA in vivo. Gut. , (2017).
- Yang, Z. T., et al. Characterization of Full-Length Genomes of Hepatitis B Virus Quasispecies in Sera of Patients at Different Phases of Infection. Journal of Clinical Microbiology. 53 (7), 2203-2214 (2015).
- Chook, J. B., et al. Universal Primers for Detection and Sequencing of Hepatitis B Virus Genomes across Genotypes A to G. Journal of Clinical Microbiology. 53 (6), 1831-1835 (2015).
- Li, F., et al. Whole genome characterization of hepatitis B virus quasispecies with massively parallel pyrosequencing. Clinical Microbiology and Infection. 21 (3), 280-287 (2015).
- Zhou, T. C., et al. Evolution of full-length genomes of HBV quasispecies in sera of patients with a coexistence of HBsAg and anti-HBs antibodies. Scientific Reports. 7 (1), 661 (2017).
- Long, Q. X., Hu, J. L., Huang, A. L. Deep Sequencing of the Hepatitis B Virus Genome: Analysis of Multiple Samples by Implementation of the Illumina Platform. Methods in Molecular Biology. 1540, 211-218 (2017).
- Li, X., et al. The function of targeted host genes determines the oncogenicity of HBV integration in hepatocellular carcinoma. Journal of Hepatology. 60 (5), 975-984 (2014).
- Wooddell, C. I., et al. RNAi-based treatment of chronically infected patients and chimpanzees reveals that integrated hepatitis B virus DNA is a source of HBsAg. Science Translational Medicine. 9 (409), (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены