Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Фотогенерации N-гетероциклические карбенов: применение в фотоиндуцированной кольцо открытие метатеза полимеризации
В этой статье
Резюме
Мы описываем протокол к photogenerate N-гетероциклические карбенов (NHCs), УФ-облучения системы соль 2-isopropylthioxanthone/имидазолия тетрафенилборатом. Предлагаются методы характеризуют photoreleased НХК и разъяснению фотохимического механизм. Протоколы для фотополимеризации метатеза кольцо открытие в miniemulsion и решение иллюстрируют потенциал этой системы photogenerating НХК 2-компонента.
Аннотация
Мы приводим метод для создания N-гетероциклические Карбены (НХК) 1,3-dimesitylimidazol-2-ylidene (IME) под УФ облучения на 365 Нм характеризуют редакторы и определить соответствующий механизм фотохимических окислителей. Затем мы опишем протокол для выполнения кольцо открытие метатеза полимеризации (ROMP) в растворе и в miniemulsion, с помощью этой системы НХК photogenerating. Для photogenerate IMes используется система, включающая 2-isopropylthioxanthone (ITX) как сенсибилизатор и 1,3-dimesitylimidazolium тетрафенилборатом (IMesH BPh4–+) в защищенной форме НХК. IMesH BPh4– +можно получить за один шаг, анион обмен между 1,3-dimesitylimidazolium хлорид и натрия тетрафенилборатом. Реальном времени установившегося фотолиз установки описано, какие подсказки, что фотохимическая реакция протекает в два последовательных шагов: 1) ITX триплет, Фото уменьшен анион боратов и 2) последующие протонный перенос происходит от имидазолия катиона для производить ожидаемых IMes НХК. Два отдельных характеристик протоколы реализованы. Во-первых CS2 добавляется реакция СМИ фотогенерации НХК путем формирования IMes-CS2 аддукт доказательств. Во-вторых количество НХК выпущен в situ количественно с помощью кислотно основного титрования. Обсуждается также использование этой системы генерации фото НХК для ВОЗНЯ норборненом. В растворе фотополимеризации эксперимент проводится путем смешивания ITX, BPh IMesH+4–, [RuCl2(p цимол)]2 и норборненом Cl2CH2, то решение в УФ облучения реактор. В рассредоточенной среде miniemulsion мономера сначала формируется то облученных внутри кольцевой реактор для производства стабильных poly(norbornene) латекса.
Введение
В химии N-гетероциклические карбенов (NHCs) видов выполнять двоякую роль лигандов и organocatalyst1. В первом случае введение NHCs привело дизайн металла переход катализаторов повышения активности и стабильности2. В последнем случае NHCs оказались превосходной катализаторов для коллектора органических реакций3,4. Несмотря на это универсальность обработка голые NHCs по-прежнему серьезной проблемой5и производить эти Высокореактивная соединений, так что они выпустили в situ и «по требованию» является весьма привлекательной целью. Следовательно несколько стратегий были разработаны выпустить НХК в реакции средств массовой информации, которые в основном полагаются на использование термолабильных прародителями6,,78. Удивительно хотя это может раскрыть Роман поколения photoinitiated реакций, полезные для синтеза высокомолекулярных соединений или препаративной органической химии6, поколения, используя свет как стимул едва исследовано. Недавно первый фото генерации системы способны производить НХК был открыт9. Он состоит из двух компонентов: 2-isopropylthioxanthone (ITX) как фоточувствительные видов и 1,3-dimesitylimidazolium тетрафенилборатом (IMesH BPh4–+) как НХК защищенные формы. Следовательно, в нижеследующих пунктах, мы приводим метод для создания НХК 1,3-dimesitylimidazol-2-ylidene (IME) под УФ облучения на 365 Нм, характеризуют его и определить фотохимического механизм. Затем мы опишем протокол для выполнения кольцо открытие метатеза полимеризации (ROMP) в растворе и в miniemulsion, с помощью этой системы photogenerating НХК.
В первой части мы приводим сводный протокол производить IMesH BPh4–+. Этот протокол основан на анион метатеза между соответствующего имидазолия хлорид (IMesH Cl–+) и тетрафенилборатом натрия (NaBPh4). Затем чтобы продемонстрировать в месте формирования НХК, два протокола, связанных с облучением в 365 описаны Нм IMesH BPh4–решение /ITX в photoreactor+. Первый состоит из мониторинга deprotonation имидазолия катионита IMesH+ через 1H ЯМР спектроскопии. Прямых доказательств для формирования желаемого НХК (IME) предоставляется в второй метод, где редакторы-CS adduct2 успешно изолированные, очищенный и характеризуется.
Во втором разделе описываются два протокола, которые проливают свет на фотохимические механизма с участием НХК двухкомпонентный photogenerating системы BPh IMesH+4–/ITX. Во-первых оригинальный эксперимент фотолиз установившемся режиме реального времени показывает, что перенос электрона индуцируется фото возбуждения ITX в присутствии тетрафенилборатом. Электрон доноров свойства этой Борат анион10 диски photoreduction 3ITX * триплет возбужденные состояния в ITX●– радикальной анион через так называемые фото сенсибилизированных реакции. Формирование НХК подтверждает, что ITX●– видов может далее абстрактная протона от IMesH+ для получения желаемого НХК. Основываясь на титрование кислоты/базы с помощью фенола Красного pH индикатор качестве титранта, второй оригинальный Протокол реализован, позволяет определить доходность выпущенных НХК.
В третьем разделе мы описываем протокол, в котором вышеупомянутых photogenerated редакторы могут быть использованы в фотополимеризации. Основной интерес представляет кольцо открытие метатеза полимеризации (ROMP), потому что эта реакция все еще находится на предварительном этапе развития в отношении photoinitiation11,12. Первоначально ограниченные нечетко и высокочувствительный вольфрама комплексов, фотоиндуцированной КОЛЕСЯТ (photoROMP) был продлен до более стабильные комплексы на основе W, Ru и Os переходных металлов. Несмотря на разнообразие precatalysts почти все photoROMP процессы используют прямого возбуждения один фотоактивного precatalyst13. Напротив, мы используем излучения для создания НХК imidazolidene лиганда (IME), который впоследствии может реагировать с не фотоактивного precatalyst Ru [RuCl2(p-цимол)]2 димер9. В этом методе фотогенерации НХК лигандом диски в местах формирования комплекса НХК высокоактивный рутений Арин, известный как RuCl2(p-cymene)(IMes) (УННВ катализатор)14,15. Используя этот косвенный методологии, два отдельных photoROMP по норборненом (Nb) являются эксперименты: 1) в растворе (дихлорметаном) и 2) в водном дисперсной системы от мономера miniemulsion16.
протокол
1. НХК Photogenerating система: Синтез и реакционная способность
- Синтез 1,3-dimesitylimidazolium тетрафенилборатом (IMesH BPh4–+)
- Подготовка раствора хлорида 1,3-dimesitylimidazolium (IMesH Cl–+) в этаноле.
- Добавьте 1.00 g (2,93 ммоль) 1,3-dimesitylimidazolium хлорида 50 мл вокруг нижней колбе с баром перемешать.
- Растворите 1,3-dimesitylimidazolium хлорида в 30 мл этанола.
- Приготовление раствора натрия тетрафенилборатом (NaBPh4) в этаноле.
- Добавление 1,35 г (3.92 ммоль) натрия тетрафенилборатом 50 мл вокруг нижней колбе с баром перемешать.
- Растворяют тетрафенилборатом натрия в 30 мл этанола.
- Поколение 1,3-dimesitylimidazolium тетрафенилборатом (IMesH BPh4–+)
- Добавьте (каплям) раствор тетрафенилборатом натрия в раствор хлорида 1,3-dimesitylimidazolium при помешивании.
- Перемешайте смесь реакции для 10 мин при комнатной температуре.
- Удалить панель перемешать и фильтр белый осадок, используя фильтр вакуум и фриттированных стекла размера пор 3.
- Вымойте осадок с 30 мл этанола и фильтровать его (фриттированных стекло фильтр с размером пор 3). Вымойте осадок с 30 мл деионизированной воды и фильтровать его (фриттированных стекло фильтр с размером пор 3).
- Сухой белый осадок при 60 ° C 15 ч. анализ продукта 1H, 13C ЯМР в ДМСО d6 согласно сообщалось ранее процедуры9.
- Подготовка раствора хлорида 1,3-dimesitylimidazolium (IMesH Cl–+) в этаноле.
- Фотогенерации НХК 1,3-dimesitylimidazol-2-ylidene, также известный как IMes, УФ облучением dimesitylimidazolium тетрафенилборатом присутствии isopropylthioxanthone (ITX)
- Добавить 39 мг (0,062 ммоль, 2 экв.) от 1,3-dimesitylimidazolium тетрафенилборатом, 7.8 мг (0,031 ммоль, 1 экв) ITX, и 0,5 мл транс ТГФ (ранее сохраненные над 3 Å молекулярные сита) в трубе ЯМР.
- Место ЯМР трубки внутри фотохимического реактора с круговой массив 16 люминесцентных ламп излучающих Монохроматическое излучение на 365 Нм и излучают за 10 мин.
- Мониторинг deprotonation IMesH BPh4– +, 1H ЯМР спектроскопии
- Анализ deprotonation IMesH+ в редакторы IME на 1H ЯМР.
Примечание: 1H ЯМР спектрах были записаны при 25 ° C на ЯМР-спектрометр, частотой 400 МГц TMS был использован в качестве внутренних стандартов для калибровки химических сдвигов в 1H ЯМР.- Калибровка параметров интеграции так что в 1H ЯМР спектрах CH3 синглетно 1,3-dimesitylimidazolium тетрафенилборатом (δ = 2.0 ppm) соответствует шести.
- Определить значение интеграции области N-CH-N сигнала (δ = 8,4-9.4 ppm) для того, чтобы оценить степень IMesH+ deprotonation. Значение интеграции должна варьироваться от 1 (когда не deprotonation произошло, до облучения) до 0 (когда была проведена полная deprotonation IMesH+ ).
- Анализ deprotonation IMesH+ в редакторы IME на 1H ЯМР.
- Формирование, изоляции и характеристика adduct 1,3-dimesitylimidazoliumdithio карбоксилатных (IMes-CS2)
- Добавьте 0.02 мл сероуглерод в трубке как облученных ЯМР. Реакция средств массовой информации изменения в цвете от оранжевый/коричневого до темно-красного, указывающее формирования IMes-CS2 аддукт.
- Пусть это реагировать на 12 ч. Красный осадок формы, назначенные в редакторы-CS2 аддукт.
- Фильтр красный осадок (фриттированных стекло фильтр с размером пор 3) и сушить под воздуха при комнатной температуре в течение 12 ч.
- Солюбилизировать последнего красного тела в 0,5 мл транс ДМСО. Подтвердите химической структуры 1H, 13C ЯМР спектроскопии.
Предупреждение: сероуглерод высоко токсичен и должны быть обработаны с осторожностью под вытяжного шкафа.
2. фотохимического механизм
- В реальном времени Фотообесцвечивание IMesH BPh4–/ITX+
- Подготовка Стоковый раствор ITX, добавив 0,76 мг (3 x 10-3 ммоль) ITX до 15 мл сухого Ацетонитрил (ранее сохраненные за 3е молекулярные сита).
- Передача с 3 мл раствора ITX в ячейку кварцевые УФ покрыты с резиновой пробкой, содержащие 1.10 мг IMesH+BPh4– (1.8 x 10-3 ммоль) и перемешивания micromagnet. Молярное соотношение ITX:IMesH+BPh4– – 1:3.
- Дега решение по восходящей азота за 10 мин, затем облучить решение на 365 Нм с лампой Hg-Xe среднего давления при непрерывном помешивании (63 МВт см-2, мощность 75 МВт).
- Следить за изменением УФ поглощения на 365 Нм во время облучения с помощью спектрометра после прохождения передаваемых актиноиды луч.
- Применить ту же процедуру (2.1.1-2.1.4 меры) для других экспериментов, но заменить IMesH BPh4– +с другими quenchers: IMesH+Cl– (0.61 мг, 1.8 x 10-3 ммоль) или NaBPh4 (0.62 mg, 1.8 x 10-3 ммоль).
- Количественная оценка photogenerated НХК, спектрофотометрический титрования
- Добавить 1,85 мг dimesitylimidazolium тетрафенилборатом (3 x 10-4 ммоль, 3 экв.) и 0,25 мг ITX (10-4 ммоль, 1 экв.) до 10 мл сухого ацетонитриле.
- Перевод 2 мл этого свежеприготовленного раствора в обычных спектроскопических кварц ячейку, ограничен с резиновой перегородки.
- Очистить бесцветный смесь с азотом прежде чем подвергать кювета для 365 нм светодиодные прожектора (мощностью 65 МВт) за 1 мин.
- После каждого времени облучения добавьте постепенно порции 0,1 мл раствора фенола красного (PR) (2 x 10-4 М в сухой ацетонитриле) в кювете. Этот последний titrating решения был подготовлен заранее.
- Запись спектр UV-vis после каждого добавления 0,1 мл раствора PR до достижения 1 мл.
Примечание: Индикатор решение первоначально прозрачен и содержит форму бис протонированный H2PR. После ее добавления кислоты/база реакции с НХК приводит к образованию розовый двухвалентные анион PR2 - с максимум поглощения в 580 Нм. Заговоре поглощения в 580 Нм в зависимости от объема титранта дает два пересекающихся прямых линий, свидетельствует о конечной точки титрования. - Повторите эту же процедуру (шаги 2.2.1-2.2.5) с же ITX/IMesH+BPh4– решение облученных для больше времени: 2 мин, 5 мин и 10 мин. Каждый раз должен быть подготовлен новый образец IMesH+PH4–/ITX.
Примечание: В точке эквивалентности в кислотно основного титрования: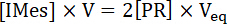 (1)
(1)
Где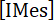 -концентрация photogenerated, редакторы IME выпущен в кювет УФ, V является начальный объем IMesH+BPh4–/ITX решения, [PR]-концентрация PR и Veq является общий объем PR добавил в кювете УФ на конечной точки титрования. Таким образом доходность IMes, освобожден после облучения IMesH+BPh4–/ITX решение получается из уравнения (2):
-концентрация photogenerated, редакторы IME выпущен в кювет УФ, V является начальный объем IMesH+BPh4–/ITX решения, [PR]-концентрация PR и Veq является общий объем PR добавил в кювете УФ на конечной точки титрования. Таким образом доходность IMes, освобожден после облучения IMesH+BPh4–/ITX решение получается из уравнения (2):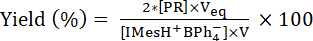 (2)
(2)
Где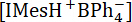 является начальной концентрации IMesH BPh4–+.
является начальной концентрации IMesH BPh4–+.
Проверяется действительность этого способа титрования свободного решения редакторы IME (1 x 10-4 M в ацетонитриле) используя аналогичное решение Ацетонитрил PR в качестве титранта (2 x 10-4 М).
3. фотоиндуцированной кольцо-открытие метатеза полимеризации
- PhotoROMP Nb в растворе
- Добавить 1 g (11 ммоль, 540 экв) НБ, 120 мг (0,196 ммоль, 10 экв.) от 1,3-dimesitylimidazolium тетрафенилборатом, 12 мг (19.6 ммоль, 1 экв.) из dichloro(para-cymene) димер рутений и 25 мг (0.098 ммоль, 5 экв.) из ITX в 20 мл пробирку с баром перемешать.
- Растворяют твердые 10 мл дихлорметана и крышка трубки с резиновой перегородки.
- Очистить смесь восходящей азота газом через иголку шприца для 15 мин.
- Поместите трубку внутри фотохимического реактора с круговой массив 16 люминесцентных ламп (излучающих на 365 Нм) и облучение на 10 мин. Это решение становится вязкой, о том, что это высокомолекулярный вес polyNb образуется.
- Осадок полимера, поливая решение в 300 мл метанола.
- Фильтрации полимеров (фриттированных стекло фильтр с размером пор 3) и высушить при 60 ° C для 8 h.
- Анализировать полимера, 1H ЯМР согласно сообщил процедуры9 , растворяя около 10 мг полимера в 0,5 мл CD2Cl2.
- Анализировать полимера, размер гель-проникающей хроматографии согласно сообщил процедуры9, используя ТГФ как элюента и растворяя 10 мг полимера в 1 мл ТГФ.
- PhotoROMP Nb в miniemulsion
- Подготовка Nb miniemulsion.
- Распустить 15,0 g нейтральный ПАВ оксиэтилированных (100) стеариловый эфир в 150 мл milliQ воды
- Ввести водной фазе в кольцевой photoreactor LED, закрыт с резиновыми перегородки и место реактора под герметичной sonication зонда.
- Дега решение восходящей азотом в течение 1 ч.
- Смешайте 4.94 g Nb (5.2 x 10-2 моль; 510 экв; 25 w %), 2,85 мл гексадекан (10 w %) и 6 мл дихлорэтан (32,5% w) в 50 мл вокруг нижней колбе закрыт с rotaflo. Дега решение с циклом морозостойкость насоса.
- Добавьте 6 мл дихлорэтан (32,5% w) в второй 50 мл раунд нижней колбе закрыт с rotaflo. Дега решение путем замораживания насос оттаивания. Добавить 162 мг 1,3-dimesitylimidazolium тетрафенилборатом (2.6 x 10-4 моль, 5 экв.), 33 мг ITX (1.3 10-4 моль, 2,5 экв.) и 30 мг dichloro(p-cymene)ruthenium(II) димер (4.9 x 10-5 моль, 1 экв) в инертной атмосфере ( бардачком) в колбу.
- Смешать два органических растворов, содержащих мономера и каталитического смесь под флюсом азота и ввести 15 g органических окончательного решения внутри photoreactor, содержащие водной фазе при помешивании.
- Смешайте два этапа в течение 1 ч в форме грубо macroemulsion. Sonicate в течение 10 мин (50% потребляемой электроэнергии; импульса по времени: 5 s, время отключения: 5 s) в форме miniemulsion.
- Фотополимеризации NB miniemulsion.
- Замените герметичные sonication зонд, светильник оснащен системой водяного охлаждения и охраняются облицовки труб под флюсом азота.
- Место закрытого реактора внутри photocabinet для предотвращения воздействия УФ-излучения.
- Облучить мономера miniemulsion для 100 мин для получения полимеров латекса. Во время облучения, размер частиц и мономера преобразования может быть определена как объяснено ниже.
- Определение размера частиц, преобразования и молекулярный вес.
- Соберите 4 мл miniemulsion образца процессе облучения.
- 20 мкл miniemulsion, в Кювета стеклянная, содержащих 5 мл воды подготовить образец разбавленный 250 x для анализа частиц размером до динамического рассеяния света (DLS).
- Растворить 100 мкл miniemulsion в 500 мкл ТГФ для измерения конверсии Nb газовая хроматография (GC), с гексадекан как внутренний стандарт (GC удержания раз: tGCNb = 1,77 мин; tGCДодекан = 13,25 мин).
- Осадок остальная часть образца в 20 мл ацетона. Фильтр полимера. Сухого полимера под вакуумом и измерить молекулярный вес, размер гель-проникающей хроматографии (сек) [в тетрагидрофуран (THF) (1 мл мин-1) с трихлорбензол как маркер потока, используя оба рефрактометрический и УФ-детекторы].
ПРЕДУПРЕЖДЕНИЕ (часть 1-3): возможно опасные источники света излучающих в УФ и видимом диапазонах используются в описанных экспериментах. Эти лампы могут представлять разумно предвидимых риска причинения вреда глаз и кожи лаборатории членов. Следовательно все возможные меры следует положить в место, экспериментатор уменьшить риски для как низко как является практически осуществимым. Список общих мер включает изоляции источника света внутри защитный кожух (photocabinet, например), обучение всех работников, размещение опасных источников света в хорошо назначенных лабораторий или вытяжных с ограниченным доступом, предоставляя подходящие защитные маски (защитные очки блокируют УФ облучения являются достаточными для всех описанных протоколы) и соответствующие знаки оповещения и безопасности.
- Подготовка Nb miniemulsion.
Результаты
Этап 1.1 описывается эффективный анион метатеза между 1,3-dimesitylimidazolium хлорид (IMesH Cl–+) и тетрафенилборатом (NaBPh4) натрия приносить 1,3-dimesitylimidazolium тетрафенилборатом (IMesH BPh + 4–). Желаемый photolatent НХК получается отличная доходность (98%).
Обсуждение
Сообщалось, вот простой и универсальный протокол для in situ поколения НХК после УФ облучения на 365 Нм. Анион реакции обмена между 1,3-dimesitylimidazolium хлорид и натрия тетрафенилборатом обеспечивает простой доступ к НХК, защищены от IMesH BPh4– +в количественных урожайности. Тем не м?...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Финансовой поддержке французского национального исследования агентства (НРУ программа: 2016 DS0304, номер договора: АНР-16-CE07-0016) и французское министерство научных исследований (докторской Грант Эмелин шаблоне) были с благодарностью.
Материалы
| Name | Company | Catalog Number | Comments |
| Material | |||
| Dimesitylimidazolium chloride, 97% | ABCR | AB130859 | |
| Sodium tetraphenylborate, 99% | ABCR | AB118843 | |
| Dichloro(p-cymene) ruthenium dimer, 98% | ABCR | AB113524 | |
| Norbornene, 99% | ABCR | AB171849 | |
| Isopropythioxanthone, 97% | Sigma Aldrich | 406317 | |
| Carbon disulfide, 99.9% | Sigma Aldrich | 335266 | |
| Dichloromethane | Sigma Aldrich | 270997 | |
| Ethanol | VWR | 20821.31 | |
| Deuterated DMSO | Eurisotop | D010FE | |
| Deuterated THF | Eurisotop | D149CB | |
| 1,2-Dichloroethane | Sigma Aldrich | 284505 | |
| Brij S 100 | Sigma Aldrich | 466387 | |
| Hexadecane | Sigma Aldrich | H6703 | |
| Phenol red, 98% | Sigma Aldrich | P4633 | |
| Acetonitrile | VWR | 83639.290 | |
| 1,3-Bis(mesityl)imidazol-2-ylidene, 97% | Sigma Aldrich | 696188 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Rayonet photochemical reactor | Southern New England Ultraviolet Company | RPR-200 | |
| UV lamps for photochemical reactor | Southern New England Ultraviolet Company | RPR-3500A | |
| 1H and 13C NMR spectrometer | Bruker | Avance III HD spectrometer | |
| Sonication probe | BioBlock | Vibra-cell | |
| Gas chromatography | Varian | GC3900 | |
| LED Lamp and Photo-cabinet | Peschl ultraviolet | novaLIGHT TLED100-365 | |
| Dynamic Light Scattering | Malvern | zetasizer Nano ZS | |
| 365 nm UV-LED light source coupled with a flexible light-guide | Hamamastu | LC-L1V3 | |
| UV/vis spectrometer | Perkin Elmer | Lambda 35 | |
| Hg- Xe lamp with filter centred at 365 nm | Hamamastu | LC-9588/01A | |
| Radiometer | Ocean Optics | USB4000 | |
Ссылки
- . . N-Heterocyclic carbenes: from laboratory curiosities to efficient synthetic tools. , (2017).
- Díez-González, S., Marion, N., Nolan, S. P. N-Heterocyclic Carbenes in Late Transition Metal Catalysis. Chemical Reviews. 109 (8), 3612-3676 (2009).
- Fevre, M., Pinaud, J., Gnanou, Y., Vignolle, J., Taton, D. N-Heterocyclic carbenes (NHCs) as organocatalysts and structural components in metal-free polymer synthesis. Chemical Society Review. 42 (5), 2142-2172 (2013).
- Naumann, S., Dove, A. P. N-Heterocyclic carbenes as organocatalysts for polymerizations: trends and frontiers. Polymer Chemistry. 6 (17), 3185-3200 (2015).
- Naumann, S., Buchmeiser, M. R. Liberation of N-heterocyclic carbenes (NHCs) from thermally labile progenitors: protected NHCs as versatile tools in organo- and polymerization catalysis. Catalysis Science Technology. 4 (8), 2466-2479 (2014).
- Naumann, S., Buchmeiser, M. R. Latent and Delayed Action Polymerization Systems. Macromolecular Rapid Communication. 35 (7), 682-701 (2014).
- Neilson, B. M., Bielawski, C. W. Photoswitchable NHC-promoted ring-opening polymerizations. Chemical Communication. 49 (48), 5453-5455 (2013).
- Teator, A. J., Tian, Y., Chen, M., Lee, J. K., Bielawski, C. W. An Isolable, Photoswitchable N-Heterocyclic Carbene: On-Demand Reversible Ammonia Activation. Angewandt Chemie International Edition. 54 (39), 11559-11563 (2015).
- Pinaud, J., et al. In Situ Generated Ruthenium-Arene Catalyst for Photoactivated Ring-Opening Metathesis Polymerization through Photolatent N-Heterocyclic Carbene Ligand. Chemistry - A European Journal. 24 (2), 337-341 (2018).
- Konishi, T., Sasaki, Y., Fujitsuka, M., Toba, Y., Moriyama, H., Ito, O. Persistent C60 anion-radical formation via photoinduced electron transfer from tetraphenylborate and triphenylbutylborate. Journal of the Chemical Society, Perkin Transactions. 2 (3), 551-556 (1999).
- Ogawa, K. A., Goetz, A. E., Boydston, A. J. Developments in Externally Regulated Ring-Opening Metathesis Polymerization. Synletter. 27 (2), 203-214 (2016).
- Eivgia, O., Lemcoff, N. G. Turning the Light On: Recent Developments in Photoinduced Olefin Metathesis. Synthesis. 50 (1), 49-63 (2018).
- Monsaert, S., Vila, A. L., Drozdzak, R., Van Der Voort, P., Verpoort, F. Latent olefin metathesis catalysts. Chemical Society Review. 38 (12), 3360-3372 (2009).
- Delaude, L., Demonceau, A., Noels, A. F. Synthesis and Application of New N-Heterocyclic Carbene Ruthenium Complexes in Catalysis: A Case Study. Current Organic Chemistry. 10 (2), 203-215 (2006).
- Delaude, L., Demonceau, A. Retracing the evolution of monometallic ruthenium-arene catalysts for C-C bond formation. Dalton Transaction. 41 (31), 9257-9268 (2012).
- Asua, J. M. Miniemulsion polymerization. Progress in Polymer Science. 27 (7), 1283-1346 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены