Method Article
Высок объём Assay оценить и количественно нейтрофилов внеклеточного ловушку формирования
В этой статье
Резюме
Этот протокол описывает весьма чувствительной и высокой пропускной способности нейтрофилов внеклеточного ловушки (нетто) assay для полуавтоматического количественная оценка ex vivo NET формирования трехмерных confocal микроскопии иммунофлуоресценции. Этот протокол может использоваться для оценки чистой формирования и деградации после различных раздражителей и может использоваться для изучения потенциальных NET-целевой терапии.
Аннотация
Нейтрофильные внеклеточного ловушки (сеток) являются иммуногенность внеклеточного структуры ДНК, которые могут быть выпущенным нейтрофилов на широкий спектр триггеров. Сеток были продемонстрированы в качестве важных принимающей защитный механизм, который ловушки и убивает микроорганизмы. С другой стороны они были вовлечены в различных системных аутоиммунных заболеваний. Сети являются иммуногенность и токсичных структуры, которые содержат совокупность соответствующих autoantigens, включая цитоплазматических антител анти нейтрофилов (ANCA)-ассоциированные васкулиты (AAV) и системной красной волчанкой (СКВ). Различные формы сетей может быть наведено в зависимости от стимула. Количество сетей могут быть количественно с помощью различных методов, включая измерение выпуска ДНК в supernatants, измерения ДНК complexed с NET-молекул как миелопероксидаза (МПО) или нейтрофилов эластазы (NE), измерения присутствия citrullinated Гистоны микроскопии флуоресцирования, или обнаружения гранулярных поток NET-компонентов, которые все имеют различные функции относительно их специфику, чувствительность, объективность и количества. Здесь — это протокол для количественной оценки ex vivo NET формирования высокочувствительных, высок объём способом с помощью трехмерных иммунофлюоресценции confocal микроскопии. Этот протокол может применяться для решения различных вопросов исследования о чистой формирования и деградации в здоровье и болезни.
Введение
Формирование нейтрофилов внеклеточного ловушки (сеток) является процесс, в котором нейтрофилов освобождение их ДНК в внеклеточной трехмерные (3D) веб-как структура, complexed с широким спектром антимикробной и опасных молекул, гранулированных и цитоплазматических ферментов, пептидов и белков. Эти иммуногенность и токсичных структуры имеют важную Физиологическая роль в иммунной защиты здоровых людей, захват и убийства инфекционных возбудителей1. Однако, они также продемонстрировали включиться в тромбоз2 и различных системных аутоиммунных заболеваний, включая цитоплазматических антител анти нейтрофилов (ANCA)-связанные васкулит (AAV)3, системная красная волчанка (СКВ )4,5, антифосфолипидными синдром (APS)2,6, ревматоидный артрит (РА), псориаз и подагра7,8,9.
В пробирке NET формирования широко изучены с химического соединения phorbol 12-миристат 13-ацетат (PMA), который вызывает массовые NET формирования. Однако наиболее физиологические стимулы вызывают гораздо более низкие уровни чистых формирования10. Учиться NET-триггеров, например, параметра аутоиммунное заболевание стандартизированных, чувствительных, высок объём количественных пробирного необходима для выявления и количественной оценки чистой формирования. Количественная оценка сетей оказался сложным и в настоящее время осуществляется различными методами, каждый с их собственные преимущества и ограничения11. Часто используемым методом является обнаружение ДНК в supernatants12, который является целью, но не различать происхождения ДНК (apoptotic, некротические, сетей) и поэтому не очень специфичен для сеток. Во-вторых энзим соединенный иммуноферментного анализа (ELISAs) о ДНК complexed с NET-специфических белков, например, миелопероксидаза (МПО) или нейтрофилов эластазы (NE), являются более конкретный подход для выявления сетей и были продемонстрированы хорошо коррелируют с citrullinated гистон-3 (CitH3) положительных сеток13. Однако не известно, является ли этот метод является достаточно чувствительным, чтобы забрать всех сетей (например, МПО, NE и CitH3 отрицательный сеток). Третий подход — иммунофлуоресценции, которая используется для обнаружения совместно локализация NET-связанных молекул (NE, МПО, CitH3) с внеклеточной ДНК для количественного определения сети. Этот метод обычно специфичен для сеток, но он не может применяться в качестве метода высокой пропускной способности и не является задачей из-за смещения наблюдателя. Кроме того, этот метод не учитывает MPO, NE-, CitH3-отрицательных сеток, которые часто присутствуют в зависимости от используемых NET-триггер14,15. Потока цитометрии подходы обнаружения сетей через измененные вперед/сбоку точечной (FSC/SSC), указанием отек ядра в NET-Тин нейтрофилов16. Этот метод не учитывает различные формы формирования чистой, были определены, которые не могут быть связаны с набухания ядра, например жизненно NET формирования17. И наконец конфокальная микроскопия иммунофлуоресценции был применен для визуализации и количественной оценки чистой формирования, непосредственно окрашивание внеклеточной ДНК клетки непроницаемый краски, пятна внеклеточной ДНК12,18. Как правило, 5-10 мощных поля вручную выбрал и оценки, которая охватывает 1-5% каждой скважины в 96-луночных пластина11,17. Ручной выбор изображений не всегда является объективным, склонны к предвзятости и не привлекательны для высокой пропускной способности анализа. Недавно был разработан автоматизированный, высок объём чистой квантификация assay, который образы 11% скважины на основе 3D, охватывающих 13 мкм через Z-штабелироваться конфокальный иммунофлуоресценции, что ведет к весьма чувствительной технологией для оценки сетей по сравнению с традиционными методами10. Текущий отчет описывает последний протокол для количественного определения чистой формирования через автоматизированный, высокочувствительный assay с использованием 3D confocal микроскопии, который достигает образ площадь 45% каждой скважины и охватывает 27 мкм через Z-стеки. Этот протокол является подходящей для количественного определения, с высокой чувствительностью, низкий уровень чистой формирования в объективной и беспристрастной основе.
протокол
Всех больных и здоровых элементов согласились участвовать в биобанке LUMC. Оба biobanking исследования были утверждены Комитетом по этическим LUMC.
1. изоляция здорового нейтрофилов
- Получите 20 мл периферической крови здоровых доноров в две трубы с покрытием ЭДТА 10 мл.
- 10 мл крови в стерильных 50 мл трубки и добавить-фосфатный буфер (PBS) до 32.5 мл.
-
Добавьте градиент плотности (например,., Ficoll-amidotrizoaat) под клетки.
- Занять до 14 мл плотности градиента с 10 мл пипетки и пипетки контроллер.
- Место, накапайте на нижней части Тюбик 50 мл.
- Возьмите накапайте контроллер от пипетки, позволяя градиент плотности потока из пипетки самотеком, пока не будет достигнута максимальная капиллярного эффекта (1-2 мл будет слева), без использования двигателя.
- Удаление пипетки, поместив большой палец на вершине пипетки, тем самым предотвращая градиент плотности от вытекания во время удаления пипетки.
- Спин трубы для 20 минут, 912 x g и комнатной температуре (RT) без ускорения или торможения.
Примечание: Красные кровяные клетки (РБК) и нейтрофилов имеют высокую плотность и в нижней части Тюбик 50 мл. Мононуклеаров периферической крови (получения) разлученных и поверх градиент плотности как белый кольцо. PBS-разбавленной плазмы будет выше репликацию. При необходимости получения могут быть изолированы путем передачи белый кольцо новый Тюбик 50 мл с дополнительной стирки шаги с PBS. - Осторожно удалите белые кольца, во-первых, содержащие репликацию после удаления PBS-разбавленной плазмы и, наконец, плотность градиентного слоя как можно больше.
-
Чтобы изолировать нейтрофилов из смеси нейтрофилов/эритроцитов, лизируют эритроцитов холодной стерильной дистиллированной водой.
- Возьмите холодной стерильной дистиллированной воды бутылку и 10 x сосредоточены PBS настой из холодильника.
- Работать быстро, на этот шаг. Добавьте 36 мл холодной стерильной дистиллированной воды непосредственно поверх гранулы и один раз тщательно перемешать. Добавьте 4 мл 10 x PBS после 20 s сделать изотонический раствор. Один раз тщательно перемешать.
- Спиновые метро за 5 минут на 739 x g и 4 ° C (для удаления эритроцитов). Нейтрофилы будет в белые гранулы.
- Тщательно удалить супернатант. Снова выполните шаг 1.6.2 и убедитесь, что правильно приостанавливается гранулы.
- Спиновые метро за 5 минут на 328 x g и 4 ° C.
- Тщательно удалить супернатант и Ресуспензируйте гранулы в 5 мл ФСБ. Граф нейтрофилы и держать их на льду.
Примечание: Ожидаемый доход от 1 трубки крови (10 мл) — примерно 15-75 миллионов нейтрофилов.
2. красный люминесцентные клеток маркировки нейтрофилов
- Сделайте нейтрофилов подвески 10-20 миллионов нейтрофилов в 2 мл PBS в 15 мл.
- Сделайте раствор 2 мл PBS с 4 мкл 2 мкм красный люминесцентные клеток компоновщика (см. Таблицу материалы) в различных 15 мл. Аккуратно добавить в нейтрофильные подвеска и тщательно перемешать.
- Инкубируйте в темноте для ровно 25 мин при 37 ° C маркировать нейтрофилы с красной флуоресцентной клеток компоновщика.
- Инактивирует маркировки, добавляя среду RPMI 1640, содержащую 10% тепла инактивированная плода бычьим сывороточным (ФТС) на RT до 15 мл и смесь раз тщательно. Убедитесь, что гранулы тщательно высокомобильна если образуются гранулы.
- Спиновые метро за 5 минут на 328 x g и RT.
- Удалить супернатант и Ресуспензируйте Пелле в 5 мл свободного фенола Красного RPMI 1640 средних, содержащий 2% FCS и 10% P/S на RT. рассчитывать нейтрофилы.
Примечание: После красной флуоресцентной клеток маркировки может произойти потеря клеток 50%.
3. индукция формирования нейтрофилов внеклеточного ловушка
- Сделать клеток перерыва 0,42 x 106 клеток/мл в фенола Красного RPMI 1640 средних FCS содержащий 2% и 10% P/S.
- Добавление 37500 нейтрофилов в 90 мкл в колодец в черный 96-луночных, плоской нижней пластине.
- 10 мкл выбранной стимулов (например, сера пациента), в трех экземплярах для достижения концентрации 10% в колодец. Всегда включайте отрицательный контроль (средний) в трех экземплярах.
- Инкубируйте в темноте при 37 ° C на требуемое время, начиная от 30 мин до 2, 4 или 6 ч инкубации для 4 h предлагается.
- Рассчитайте объем необходимых для добавления 25 мкл 5 мкм непроницаемой ДНК красителя (см. Таблицу материалы), до конечной концентрации 1 мкм в колодец. При необходимости сделайте predilution RPMI 1640 средних FCS содержащий 2% и 10% P/S для получения концентрации 5 мкм.
- 25 мкл 5 мкм непроницаемой ДНК краситель 15 мин, до конца время инкубации. Продолжать инкубации для еще 15 минут при 37 ° C в темноте.
- Очень тщательно удалить супернатант (~ 125 мкл) и хранить при необходимости. 100 мкл параформальдегида 4% (PFA). Хранить в темноте и немедленно продолжить с шага 4.
4. Чистая Визуализация с Confocal микроскопии иммунофлуоресценции 3D высоким содержанием, с высоким разрешением
-
Настройте параметры на confocal микроскопа иммунофлюоресценции, нажав на приобретение установки.
- Перейдите на вкладку Настройка .
- Выберите цель и камеры. Выберите 10 X АПО лямбда цель приобретения режиме конфокального 60 мкм обскуры.
- Нажмите на пластину и выбрать 96-луночных пластиковые пластины. Выберите сайты для посещения и выбрать фиксированное количество сайтов. Заполните 3 столбцами и 3 строками без перекрытия (0 мкм), которые охватывают в общей сложности 45% хорошо.
- Нажмите на приобретение. Выберите включить лазерных упором. При необходимости выберите Получить Z серии/временных рядов .
- Нажмите на сайте автофокус.
- Нажмите на фокус на нижней плиты | Off-Set, толщина дна. Для первоначального хорошо найти образец, выберите первую скважину приобрел. Для сайта автофокусом выберите все сайты.
- Нажмите на длинах волн.
- Количество волн выберите 2. Для уточнения уровня коррекции затенение TL выберите 2.
- Для волны 1 Выберите красный Техас.
- Для вариантов, автофокусом, выберите лазер с Z-смещение, пост лазерной смещение 1.1 µm. Использование Z-стек с пользовательский диапазон 200-10.
- Для волны 2 Выберите FITC.
- Для вариантов, автофокусом выберите лазер с Z-смещение от w1 0 мкм. Использование Z-стек с пользовательский диапазон 200-10.
- Для приобретения опции выберите серии Z и 2D проекцию изображения максимум. Для приобретения опции, выберите коррекция теней | От.
- Выберите серии Z. Выберите количество шагов: 10. Выберите размер шага: 3 мм (полный диапазон будет 27 мкм).
-
Установите пластину в конфокальной микроскопии иммунофлуоресценции.
- Перейдите на вкладку Запуск .
- Заполнить пластины имя и описание и выбрать место хранения.
- Выберите скважин, которые должны быть приобретены.
- Перейдите на вкладку Запуск .
- Выберите время экспозиции для Техас красный и FITC.
- Нажмите на Приобрести пластины начать приобретение, который займет примерно 1 час на пластину.
5. Анализ чистой формирования
- Использование обработки программа, предназначенная для анализа научных многомерных образов (см. Таблицу материалы) для анализа чистой формирования изображений.
- Перенесите данные приобретенные изображения на отдельный жесткий диск.
-
Выберите цвет, добавив инструмент.
- Выберите w1 и выберите папку на жестком диске, где хранятся данные.
- Выберите w2 и выберите папку на жестком диске, где хранятся данные.
Примечание: Используйте стандартный макрос, который использует w1 в имя файла для добавления красный цвет на красный Техас изображения и w2 для добавления зеленый цвет на FITC изображения.
-
Выберите макрос анализа.
- Выберите w1, пороговое значение (интенсивность порог), который обычно составляет 10. Выберите значение нужного пикселя (порог размера, например, 100).
- Выберите w2, пороговое значение (интенсивность порог), который обычно составляет 10. Выберите значение нужного пикселя (порог размера, например, 500).
- Выберите пункт назначения для файла электронной таблицы, выполнение анализа и затем сохранять файлы журнала.
- Анализ данных в электронную таблицу.
Результаты
Формирование нейтрофилов внеклеточного ловушка (нетто) количественно 3D образом путем определения количественных показателей окрашенных внеклеточной ДНК над 10 Z-стеки с 3 мкм расстояние, начав в фокальной плоскости в каждой скважине. Путем измерения кумулятивного области, чувствительность увеличивается пробирного (Рисунок 1A). Изолированные нейтрофилов имеют среднее чистоты 98,7% с стандартным отклонением (SD) 1,10% в 14 различных пробах разных изоляции. Средний процент красных кровяных клеток 1,04% ± 1,1% SD и средний процент моноциты 0,085% SD ± 0,17% (данные не показаны). Общая площадь окрашенных нейтрофилов imaged количественно только в фокальной плоскости в каждой скважине, которая значительно коррелируют с общей нейтрофилов в каждой скважине с коэффициент корреляции Пирсона 0,99 (95% доверительный интервал [ДИ] 0.985-0,997, p < 0.0001) (рис. 1B). Представитель результаты количественной оценки чистой формирования в нейтрофилах стимулируется с 10% сыворотки больных AAV или средних (MED) как отрицательный контроль, выраженный в виде совокупного окрашенных внеклеточной ДНК области более 10 Z-стеки за образ нейтрофилов (Рисунок 1 C). показаны снимки представитель изображений кератоз нейтрофилов (рисунок 2A) и сеток в AAV-стимулирует нейтрофилов (рис. 2B).
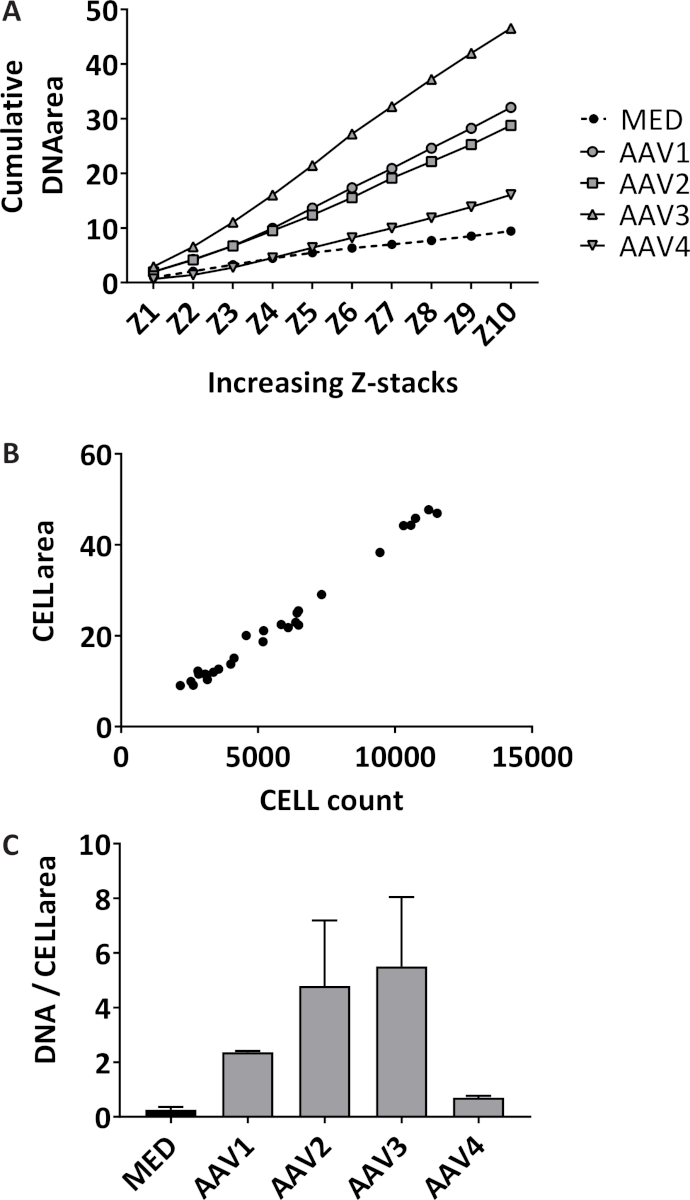
Рисунок 1: количественная оценка чистой формирования путем измерения внеклеточной ДНК и нейтрофилов. (A) области совокупности количественно над 10 Z-стеки для каждой хорошо для кератоз нейтрофилов (MED) и нейтрофилы стимулируется с 10% сыворотки АНКА связанные васкулита (AAV) пациентов (n = 4) количественно с помощью программы обработки изображений. Каждый стимул был испытан в трех экземплярах, каждая точка представляет значение медианы. (B) количество области и клеток красных флуоресцентных маркированных клеток были количественно в фокальной плоскости каждой скважины в программе обработки изображений (R2 = 0,99, p < 0.0001). (C) чистой формирования выражается как совокупное площади на образ нейтрофилов (область ячейки). Среднее ± Среднеквадратичная ошибка среднего значения (SEM) каждого экземплярах строится на раздражитель. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
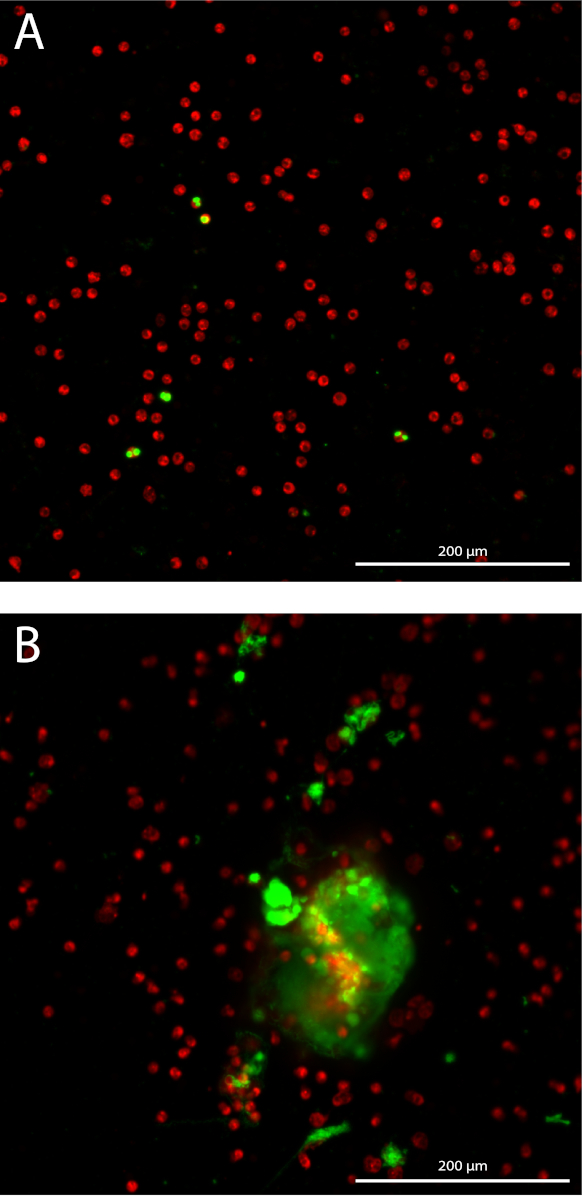
Рисунок 2: снимки чистой квантификация assay. Флуоресцентный помечены нейтрофилов показаны красным цветом, и окрашенных внеклеточной ДНК показано зеленым цветом. 10 x цель плана АПО лямбда. (A) кератоз нейтрофилов. (B) нейтрофилов стимулируется с AAV сыворотки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Наиболее важной частью этого анализа является необходимость использования свежевыделенных нейтрофилов для каждого эксперимента, потому что нейтрофилы недолговечны и умереть, когда заморожены. Это требует здорового донора каждый раз, которые могут затрагивать некоторые вариации из-за характеристик доноров. Один из этих вариантов является состояние активации нейтрофилов. Нейтрофилы может быть активирован уже vivo до изоляции. Кроме того нейтрофилов может быть активирован на этапах изоляции во время Лизис эритроцитов, поэтому обработчик опытных нейтрофилов необходима для сведения к минимуму активации нейтрофилов. В общем изоляции нейтрофилов должны быть выполнены как можно скорее после крови и эксперимент не должно быть пауз, чтобы избежать чрезмерного спонтанной активации. Во-вторых следует избегать грубого обращения нейтрофилов. Таким образом заметным преимуществом описанных протокола является минимальным дозирования вмешательства после нейтрофилы являются семенами в 96-луночных пластине. Важно отметить, что состояние активации нейтрофилов лучше всего оценивать кератоз состояния, в котором этот assay чутко может обнаружить низкий уровень чистой формирования. Еще одним фактором, который может повлиять на пробу является использование FCS в среде. Процент FCS был уменьшен с 10% до 2% чтобы избежать возможного подавления чистой формирования на антиоксидантной активности19,20 или возможной активацию нейтрофилов несмотря на тепловой инактивации. Не был судим культуры без FCS или с различными типами использования средств массовой информации. Кератоз или средней управления всегда принимаются вдоль при выполнении assay иметь указание фонового сигнала (например, состояние активации нейтрофилов). Увеличение раза для каждой стимул, по сравнению с кератоз образец отображается для достижения устойчивых результатов через различные эксперименты, используя тот же раздражитель.
Важным фактором для возможного высокий фон окрашивание внеклеточной ДНК, который связан с процесс формирования сети. Настоящий assay попытки сократить это, удалив внеклеточной ДНК окрашивание сразу после короткого инкубационного периода 15 мин и анализируя пластину непосредственно после фиксации. Таким образом, очень важно использовать расширенные Конфокальный микроскоп, который имеет достаточно скорости и аналитические возможности захватить 96-луночных пластины в течение 1-2 ч. Автоматизированная рекомендуется настройка времени экспозиции и фокус. Таким образом параметр микроскоп может варьироваться между каждой выборки и экспериментировать в отношении интенсивности цветовой порог, который необходим для качества общего оптимального изображения. Последний влияний, которые возможного возможность правильно подсчитать нейтрофилов и сеток и оптимальные настройки поэтому должны быть подтверждены с помощью нескольких контрольных образцов (например, сыворотки здоровых элементов управления). В ходе анализа захваченных изображений Использование пиксель порог и порог размера в программе анализа позволяет для лучшего выбора чистой формирования.
Внеклеточной ДНК, производный от чистой формирования может быть результатом смерти различных путей, включая NETosis, necroptosis, pyroptosis, ferroptosis или даже литические процесс жизненно NET формирования1. Таким образом ограничение настоящего анализа является, что путем пятнать только для внеклеточной ДНК нет никакой разницы между чистой формирования и другие пути смерти соответствующие ячейки. Это позволяет добиться этого с помощью либо селективных ингибиторов собственный смерти пути дискриминацию между различными формами, лежащие в основе чистой формирования или подтвердить по отдельным immunostainings наличие конкретных NET маркеров, такие как citH3 и СВ, Совместное локализованы с ДНК. Для этого анализа10недавно был подтвержден Сопредседатель локализации внеклеточной ДНК с citH3 и Св. Преимущество избежания NET определенных маркеров в этот assay, позволяет оценить всех форм формирования чистой, ведущих к экструзии ДНК нейтрофилами как полный и максимально объективными с потенциалом высокопроизводительного скрининга. Применимость этого протокола было показано в изучении низкого уровня чистой индукции, опосредованных иммунных комплексов в аутоиммунное заболевание в котором способность обнаруживать качественные и количественные различия может быть более важным, чем тип процесса участие в10,21,22. Иллюстрирующих, что этот роман NET квантификация assay может быть добавленной стоимости для различных исследователей для изучения различных аспектов чистой формирования. Небольшие изменения в assay легко реализуются: корректировка периода стимуляции, использование маркера любимых чистой сосредоточиться на одной конкретной смерть путь, ведущий к чистой формирования, использования различных увеличение или использования различных чистых критериев в количественная оценка и анализ.
В заключение Протокол относится высокочувствительных широко применимым для полуавтоматического количественной оценки чистой формирования для оценки ex vivo индукции сеток на различные раздражители.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Работа Eline J. Арендс и ю.к. Onno Teng поддерживается голландского Фонда почек (17OKG04), клинические стипендий от Нидерландской организации научных исследований (90713460). Лаура S. ван Дам работа поддерживается Фондом для исследований в ревматологии (FOREUM).
Материалы
| Name | Company | Catalog Number | Comments |
| Aqua Sterile H2O | B. Braun, Melsungen, Germany | 12604052 | |
| Fetal bovine serum (FCS) | Bodinco, Alkmaar, The Netherlands | Used in high concentrations it could influcence NET formation | |
| Ficoll 5.7% - amidotrizoaat 9% density 1.077 g/mL | LUMC, Leiden, The Netherlands | 97902861 | |
| Immunofluorescence confocal microscope | Image Xpress Micro Confocal (Molecular Devices, Sunnyvale, CA, USA) | ||
| Neutralization PBS (10x) | Gibco, Paisley, UK | 70011-036 | |
| Penicillin/streptomycin (p/s) | Gibco, Paisley, UK | 15070063 | |
| Phenol red free RPMI 1640 (1x) | Gibco, Paisley, UK | 11835-063 | Phenol red can interfere with the immunofluorescence signal |
| Phosphate-buffered saline (PBS) | B. Braun, Melsungen, Germany | 174628062 | |
| PKH26 2 μM Red fluorescent cell linker | Sigma Aldrich Saint-Louis, MO, USA | PKH26GL-1KT | PKH are patented fluorescent dyes and a cell labeling technology named after their discoverer Paul Karl Horan |
| Program for scientific multidimensional images analysis | ImageJ, Research Services Branch, National Institute of Mental Health, Bethesda, Maryland, USA | ||
| RPMI medium 1640 (1x) | Gibco, Paisley, UK | 52400-025 | |
| Sytox green 5 mM Impermeable DNA dye | Gibco, Paisley, UK | 57020 | |
| Trypan blue stain 0.4% | Sigma Aldrich, Germany | 17942E | |
| 96 well, black, flat bottom, tissue culture treated plate | Falcon, NY, USA | 353219 |
Ссылки
- Jorgensen, I., Rayamajhi, M., Miao, E. A. Programmed cell death as a defence against infection. Nature Reviews Immunology. 17 (3), 151-164 (2017).
- Rao, A. N., Kazzaz, N. M., Knight, J. S. Do neutrophil extracellular traps contribute to the heightened risk of thrombosis in inflammatory diseases? World Journal of Cardiology. 7 (12), 829-842 (2015).
- Kessenbrock, K., et al. Netting neutrophils in autoimmune small-vessel vasculitis. Nature Medicine. 15 (6), 623-625 (2009).
- Garcia-Romo, G. S., et al. Netting neutrophils are major inducers of type I IFN production in pediatric systemic lupus erythematosus. Science Translational Medicine. 3 (73), 73ra20(2011).
- Lande, R., et al. Neutrophils activate plasmacytoid dendritic cells by releasing self-DNA-peptide complexes in systemic lupus erythematosus. Science Translational Medicine. 3 (73), 73ra19(2011).
- Meng, H., Yalavarthi, S., et al. In Vivo Role of Neutrophil Extracellular Traps in Antiphospholipid Antibody-Mediated Venous Thrombosis. Arthritis & Rheumatology. 69 (3), 655-667 (2017).
- Desai, J., et al. Particles of different sizes and shapes induce neutrophil necroptosis followed by the release of neutrophil extracellular trap-like chromatin. Scientific Reports - Nature. 7 (1), 15003(2017).
- Desai, J., et al. PMA and crystal-induced neutrophil extracellular trap formation involves RIPK1-RIPK3-MLKL signaling. European Journal of Immunology. 46 (1), 223-229 (2016).
- Apel, F., Zychlinsky, A., Kenny, E. F. The role of neutrophil extracellular traps in rheumatic diseases. Nature Reviews Rheumatology. , (2018).
- Kraaij, T., et al. A novel method for high-throughput detection and quantification of neutrophil extracellular traps reveals ROS-independent NET release with immune complexes. Autoimmunity Reviews. 15 (6), 577-584 (2016).
- Masuda, S., et al. NETosis markers: Quest for specific, objective, and quantitative markers. Clinica Chimica Acta. 459, 89-93 (2016).
- Brinkmann, V., Goosmann, C., Kuhn, L. I., Zychlinsky, A. Automatic quantification of in vitro NET formation. Frontiers in Immunology. 3, 413(2012).
- Nakazawa, D., et al. Enhanced formation and disordered regulation of NETs in myeloperoxidase-ANCA-associated microscopic polyangiitis. Journals of the American Society of Nephrology. 25 (5), 990-997 (2014).
- Konig, M. F., Andrade, F. A Critical Reappraisal of Neutrophil Extracellular Traps and NETosis Mimics Based on Differential Requirements for Protein Citrullination. Frontiers in Immunology. 7, 461(2016).
- Kenny, E. F., et al. Diverse stimuli engage different neutrophil extracellular trap pathways. Elife. 6, (2017).
- Zhao, W., Fogg, D. K., Kaplan, M. J. A novel image-based quantitative method for the characterization of NETosis. Journal of Immunological Methods. 423, 104-110 (2015).
- Pilsczek, F. H., et al. A novel mechanism of rapid nuclear neutrophil extracellular trap formation in response to Staphylococcus aureus. The Journal of Immunology. 185 (12), 7413-7425 (2010).
- Tanaka, K., et al. In vivo characterization of neutrophil extracellular traps in various organs of a murine sepsis model. PLoS One. 9 (11), e111888(2014).
- Fuchs, T. A., et al. Novel cell death program leads to neutrophil extracellular traps. Journal of Cell Biology. 176 (2), 231-241 (2007).
- von Köckritz-Blickwede, M., Chow, O., Nizet, V. Fetal calf serum contains heat-stable nucleases that degrade neutrophil extracellular traps. Blood. 114 (25), 5245-5246 (2009).
- Kraaij, T., et al. Excessive neutrophil extracellular trap formation in ANCA-associated vasculitis is independent of ANCA. Kidney International. , (2018).
- Kraaij, T., et al. The NET-effect of combining rituximab with belimumab in severe systemic lupus erythematosus. Journal of Autoimmunity. , (2018).
- Hahn, J., Schauer, C., et al. Aggregated neutrophil extracellular traps resolve inflammation by proteolysis of cytokines and chemokines and protection from antiproteases. The FASEB Journal. (Aug 21), (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены