Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оценка кишечного трансцитоза изолятов бактериемии новорожденных Escherichia coli
В этой статье
Резюме
Кишечная палочка вызывает сепсис у новорожденных, которые глотают бактерии во время рождения. Процесс, связанный со способностью кишечной палочки перемещаться из кишечнорастворимого тракта в кровоток, плохо изучен. Эта модель in vitro оценивает способность штаммов E. coli путешествовать через эпителиальные клетки кишечника.
Аннотация
Новорожденные глотают материнские штаммы E. coli , которые колонизируют их кишечный тракт во время родов. Штаммы E. coli со способностью перемещаться по кишечнику вторгаются в кровоток новорожденного, вызывая опасную для жизни бактериемию. Методология, представленная здесь, использует поляризованные эпителиальные клетки кишечника, выращенные на полупроницаемых вставках, для оценки трансцитоза изолятов бактериемии E. coli новорожденных in vitro. Этот метод использует установленную линию клеток кишечника T84, которая обладает способностью расти до слияния и образовывать плотные соединения и десмосомы. После достижения слияния зрелые монослои T84 развивают трансэпителиальное сопротивление (TEER), которое можно количественно оценить с помощью вольтметра. Значения TEER обратно коррелируют с параклеточной проницаемостью внеклеточных компонентов, включая бактерии, через монослой кишечника. Трансклеточный проход бактерий (трансцитоз), с другой стороны, не обязательно изменяет измерения TEER. В этой модели прохождение бактерий через кишечный монослой количественно оценивается на срок до 6 ч после заражения, и повторные измерения TEER производятся для мониторинга параклеточной проницаемости. Кроме того, этот метод облегчает использование таких методов, как иммуноокрашивание, для изучения структурных изменений в плотных соединениях и других белках клеточной адгезии во время бактериального трансцитоза через поляризованный эпителий. Использование этой модели способствует характеристике механизмов, с помощью которых неонатальная трансцитоза E. coli через эпителий кишечника вызывает бактериемию.
Введение
Кишечная палочка является наиболее распространенной причиной раннего сепсиса у новорожденных 1,2,3. Смертность от неонатальной бактериемии E. coli может достигать 40%, а менингит является возможным осложнением, которое связано с тяжелыми нарушениями развития нервнойсистемы2. Прием внутрь материнских штаммов кишечной палочки новорожденным может привести к неонатальной бактериемии; этот процесс был воспроизведен на животных моделях 2,4. После попадания в организм патогенные бактерии перемещаются из просвета кишечника новорожденных через кишечный барьер и попадают в кровоток, вызывая септицемию. Неонатальные инвазивные штаммы E. coli, которые продуцируют бактериемию, различаются по своей способности вторгаться в эпителиальные клетки кишечника 1,5. Однако их способность трансцитозировать эпителий кишечника после инвазии не была полностью охарактеризована.
Эта модель кишечного трансцитоза является полезным методом in vitro для эмуляции прохождения бактерий через эпителий кишечника. Общей целью методов, представленных в этой рукописи, является сравнение способности неонатальных изолятов E. coli трансцитозировать эпителий кишечника. Модель, описанная здесь, использует клетки T84, которые являются увековеченными клетками аденокарциномы кишечника человека 6,7. Клетки Т84 выращивают до слияния на полупроницаемой мембране с двумя отдельными отсеками. Обоснование использования этой техники заключается в том, что, как это происходит in vivo, эти клетки кишечника поляризуются и развивают зрелые плотные соединения 6,8. Сторона, соприкасающаяся с мембраной, становится базальной. Противоположная сторона клеток становится апикальной стороной, напоминающей просвет кишечника, куда прилипают и вторгаются проглоченные патогены. Трансвелловая мембрана проницаема для бактерий, но поляризованные клетки кишечника образуют плотные соединения, которые ухудшают движение бактерий параклеток9. Таким образом, этот метод обеспечивает преимущество контролируемой среды in vitro с использованием клеточной линии человека для изучения процесса бактериального трансцитоза, включая трансклеточный путь. В то время как существуют другие методы исследования трансцитоза бактерий через эпителий кишечника, метод трансвелла, представленный здесь, обеспечивает большую легкость и доступность. Доступны альтернативные методы, такие как использование образцов ex vivo, установленных в системах камер Ussing. Тем не менее, они используют образцы тканей, которые могут быть недоступны, особенно если исследование направлено на изучение физиологии человека10. Кишечные органоиды представляют собой еще один пример альтернативы in vitro для изучения взаимодействия хозяина и бактерии11. В то время как органоидные монослои также могут быть использованы в системе трансвелл для изучения бактериального трансцитоза, они требуют выделения и роста стволовых клеток и использования специфических факторов роста для индуцирования дифференцировки12. Таким образом, их использование является более трудоемким и сопряжено с большими затратами по сравнению с методом трансвелла, описанным в данной рукописи.
Оценка прохождения бактерий через эпителий кишечника с использованием этой системы трансвелл in vitro была успешно выполнена для различных патогенов. Эти исследования показали полезность трансвелл-системы с использованием клеток Т84 для характеристики трансцитоза бактерий через поляризованный эпителий кишечника 13,14,15. Однако применение этого трансвелл-метода для сравнения трансцитозной способности неонатальных штаммов E. coli, продуцирующих бактериемию, подробно не описано. Эта рукопись предоставляет другим исследователям стандартный протокол трансвелла, который является надежным и простым в использовании и не требует слишком дорогих ресурсов.
Чтобы сравнить способность неонатальных инвазивных штаммов E. coli трансцитозировать эпителий кишечника, апикальная сторона монослоя эпителия кишечника может быть инфицирована известным количеством бактериальных клеток. После инкубации среда на базальной стороне эпителия может быть собрана, а бактерии количественно определены для определения количества бактериального трансцитоза с течением времени. В этой рукописи представленные методы используются для изучения трансцитозной способности неонатальных клинических штаммов E. coli, полученных от новорожденных, госпитализированных с бактериемией. Критерии включения для отбора этих неонатальных клинических изолятов для исследований трансцитоза были опубликованы ранее 1,2,16. Когда этот метод выполняется с использованием различных штаммов кишечной палочки, можно сравнить их трансцитозные способности. Благодаря этому процессу модель кишечного трансцитоза предоставляет ценные данные для характеристики факторов вирулентности E. coli, которые способствуют многоступенчатому процессу, который завершается развитием неонатальной бактериемии.
протокол
ПРИМЕЧАНИЕ: Выполните все манипуляции с клетками, бактериями, пластинами и реагентами T84 в шкафу безопасности уровня биобезопасности 2 (BSL-2), чтобы избежать загрязнения. Используйте отдельные области и инкубаторы для всей работы с участием стерильных клеток T84, инфицированных клеток T84 и E. coli. Клинические изоляты E. coli, протестированные с помощью методов, описанных здесь, были получены в соответствии с руководящими принципами Институционального наблюдательного совета в нашем учреждении 1,16.
1. Подготовка трансцитозных вставок с Т84-клетками (примерно за 1-2 недели до эксперимента)
- Выращивайте клетки T84 в тканевой культуральной среде (TCM + антибиотики), состоящей из модифицированной орлиной среды Dulbecco: питательной смеси F-12 Ham (1: 1, конечная концентрация: 50% каждая), 5% фетальной бычьей сыворотки и 1% (100 Ед / мл) смеси двойного антибиотика пенициллина / стрептомицина. Инкубируют клетки при 37 °C с 5% CO2.
ПРИМЕЧАНИЕ: Вариация этой среды без пенициллина/стрептомицина (ТКМ без антибиотиков) используется для более поздних этапов (раздел 2 и далее) в процедуре. Убедитесь, что для каждого шага используется правильная формулировка. - Работая внутри шкафа биобезопасности (BSC), засейте клетки T84 в полиэтилентерефталатные мембранные клеточные трансвелл-вставки с порами 3 мкм, сделанными для 24-луночных пластин. Включите трансвеллентные реплики для каждого желаемого экспериментального состояния плюс неинфицированные контрольные элементы для мониторинга возможного загрязнения.
- В 24-луночной пластине, предназначенной для хранения трансвеллеров, заполните нужное количество собирающих лунок 1 мл ТКМ+ антибиотиков.
- В каждый колодец поместите по одной трансвеллерной вставке.
- Засейте эти вставки 1 х 105 Т84 клетками, взвешенными в 500 мкл ТКМ + антибиотики. Количественное определение количества клеток с помощью гемоцитометра с синим пятном трипана или автоматизированного счетчика клеток17.
- Инкубируйте трансвеллинговые пластины, содержащие семенные вставки, в тех же условиях, в которых были выращены клетки.
- Проверьте с помощью световой микроскопии, что монослои начали сливаться после посева вставки, примерно через 48 ч после посева.
- Каждые 2 дня после посева измеряйте и регистрируйте трансэпителиальное электрическое сопротивление (TEER) с помощью эпителиального вольт/омметра (EVOM) для оценки зрелости монослоя. Как только вставки достигают TEER не менее 1000 Ω·см2, они считаются готовыми к анализу18.
ПРИМЕЧАНИЕ: Вставкам обычно требуется 7-10 дней, чтобы достичь этого TEER после посева. Клетки T84 покажут 100% слияние при световой микроскопии, как только это сопротивление будет достигнуто.- Храните датчик EVOM с электродами, погруженными в 0,15 М ККл, когда они не используются.
- Перед измерением TEER обеззаражьте электродный зонд, погрузив его в 5 мл 70% этанола в коническую трубку объемом 50 мл на 10-15 мин. Снимите зонд, стряхните избыток этанола и дайте ему высохнуть на воздухе внутри BSC в течение 10 минут. Удерживать в пробирке этанол.
- Проверьте EVOM и зонд, поместив сухой обеззараженный зонд в стерильный колодец, содержащий 1 мл ТКМ + антибиотиков со стерильной вставкой внутри, содержащей 500 мкл ТКМ + антибиотики. Убедитесь, что показания EVOM составляют <200 Ω. Запишите это пустое значение, чтобы использовать его в более поздних расчетах сопротивления, описанных в шаге 1.3.6.
- Извлеките зонд из пробирки ТКМ + антибиотики. Сохраняйте эту трубку для хранения зонда на протяжении всего эксперимента.
- Осторожно опустите зонд в первую вставку с длинным электродом в коллекторном колодце и коротким электродом внутри вставки. Позвольте длинному электроду коснуться нижней части собирающего колодца, но не нажимайте вниз, так как это может нарушить эпителиальный монослой.
- Повторите этот процесс, чтобы измерить и записать сопротивление в Омах (Ω) для каждой вставки. Когда закончите, обеззаражьте зонд в этаноле, погрузив его еще на 10-15 минут. Затем переместите обеззараженный зонд обратно в раствор KCl для хранения. Вычтите сопротивление заготовки, полученное на этапе 1.3.3, из каждого значения, полученного от каждой вставки, содержащей ячейки Т84. Умножьте результирующее сопротивление (Ω) для каждой вставки на площадь нижней части каждой вставки (см2), чтобы получить окончательное измерение TEER (Ω·см2).
- Как только TEER достигает не менее 1000 Ω·см2, эпителиальный монослой созревает и готов к анализу инфекции.
- По мере созревания TEER обеспечивайте клетки свежей средой каждые 1-2 дня.
- В новой 24-луночной пластине добавьте 1 мл ТКМ + антибиотиков в одну лунку для каждой готовящейся семенной вставки.
- Используя стерильные щипцы, аккуратно перенесите вставки в вновь пополненные колодцы.
- Замените носитель во вставках.
- Извлеките старый носитель из вкладышей, наклонив пластину и используя собственный вакуумный аспиратор, чтобы аккуратно удалить носитель с помощью наконечника пипетки вдоль боковой стороны вставки. Аспиратор позволяет регулировать низкоуровневое всасывание, чтобы предотвратить разрушение клеток. Не допускайте, чтобы кончик пипетки касался нижней части вставки, так как это нарушит развитие эпителиального монослоя.
- Добавьте 500 мкл ТКМ + антибиотиков в вкладыши. Визуализируйте монослой с помощью световой микроскопии, чтобы убедиться, что он остается нетронутым.
- Каждые 1-2 дня измеряйте TEER на каждой вставке, как описано выше на этапах 1.3.2-1.3.6.
2. Подготовка Т84-клеток за 1 день до эксперимента с использованием ТКМ без антибиотиков
- Измерьте и запишите TEER за день до эксперимента.
- Замените ТКМ таким же образом, как и во время предварительной подготовки и обслуживания клеток. Однако ТКМ без антибиотиков используется вместо этого при подготовке к инфекции (1 мл в пластинке хорошо и 500 мкл во вставке).
3. Культуры кишечной палочки (начаты за 1 день до эксперимента)
ВНИМАНИЕ: Используйте меры предосторожности уровня биобезопасности 2 (BSL-2) при работе с патогенными клиническими штаммами кишечной палочки .
- Возьмите меченую коническую трубку объемом 15 мл с 5 мл стерильного лизогенного бульона (LB) и используйте стерильную петлю для прививки отвара одной колонией из одного бактериального штамма (E. coli). Повторите этот процесс, создав одну пробирку для ночной культуры для каждого тестируемого штамма.
- Инкубировать культуру на ночь, ослабив колпачки трубок, в шейкере инкубатора (250 об/мин, 37 °C).
4. Подготовка инокулята E. coli , эпителиальных клеток и материалов (утром в день эксперимента)
ПРИМЕЧАНИЕ: Используйте ТКМ без антибиотиков, нагретых до 37 °C с этого момента.
- Добавьте 250 мкл с каждой ночной культуры LB к 25 мл ТКМ без антибиотиков в конической пробирке объемом 50 мл (по одной на отдельный штамм). Держите колпачки трубок ослабленными. Поместите эти новые культуральные трубки в шейкер при тех же настройках (250 об/мин, 37 °C) ровно на 2 часа. Выполните оставшиеся подшаги во время ожидания.
- Измерьте TEER на каждой вставке, как описано на этапах 1.3.2-1.3.6. Запишите их как ТЕЭР в момент времени (t) = 0 ч.
- Переместите вставки в скважины в новой пластине и измените среду с помощью методики, описанной на этапе 1.4.3. Однако на этот раз заполните новые коллекторные колодцы 500 мкл ТКМ без антибиотиков и заполните вкладыши 400 мкл ТКМ без антибиотиков. Храните вставки внутри инкубатора культуры тканей до момента заражения.
- Установите достаточное количество квадратных агаровых пластин LB для нагрева до комнатной температуры (RT) для последующего покрытия и количественной оценки бактерий.
5. Инокуляция клеток (начало эксперимента)
- Ровно через 2 ч удалите утренние бактериальные культуры из шейкера и центрифугируйте их в течение 10 мин (1 900 х г, 4 °C).
ПРИМЕЧАНИЕ: Для всех следующих шагов держите все бактериальные суспензии на льду, чтобы свести к минимуму рост. - Повторное суспендирование гранул бактерий в ТКМ без антибиотиков. Используйте спектрофотометр для регулировки оптической плотности (OD) до 0,7-0,9 и дополнительно разбавляйте ТКМ без антибиотиков до концентрации 1 х 106 колониеобразующих единиц (КОЕ)/мл (примерно 1:100 разведения). Используйте эту бактериальную суспензию, чтобы заразить каждую вставку 1 х 105 КОЕ на объем 100 мкл.
- Пометьте трансвеллерную пластину и заразите каждую вставку 100 мкл инокулята с поправкой на OD (в общей сложности 1 x 105 КОЕ на вставку). Теперь анализ начался. Запишите время и запишите его как t = 0 ч.
- Нанесите бактериальную суспензию inoculum для количественной оценки КОЕ/мл с использованием метода разбавления трека, покрывая 10 мкл аликвот на квадратных пластинах агара LB19.
6. Количественная оценка трансцитоза
- Каждые 30 мин после прививки заполняйте новые лунки 500 мкл ТКМ без антибиотиков. Перенесите вставки в эти новые колодцы, используя различный набор стерильных щипцов для каждого отдельного бактериального штамма.
- Соберите среду из использованного колодца для каждой вставки в отдельные маркированные тубы. Поместите эти трубки на лед. Верните трансвеллинговые пластины в инкубатор между временными точками.
- Для каждой вставки объедините собранные среды от t = 0,5 ч, t = 1 ч, t = 1,5 ч и t = 2 ч и кратковременно вихрь. Нанесите собранные среды на пластины агара LB с помощью метода разбавления трека для количественной оценки количества бактерий, трансцитозированных в первые 2 ч эксперимента.
ПРИМЕЧАНИЕ: Извлечение бактерий каждые 30 минут и хранение их на льду обеспечивает минимальный рост бактерий в собирающих лунках и проведение измерений преимущественно трансцитозированных бактерий. - Поместите помеченные пластины агара LB в бактериальный инкубатор при 37 °C без дополнительного CO2 и верните трансвеллентную пластину T84 в инкубатор культуры тканей.
- При t = 4 ч повторите шаг 6,3, объединив собранные среды из t = 2,5 ч, t = 3 ч, t = 3,5 ч и t = 4 ч.
- При t = 6 ч повторите шаг 6,3, объединив собранные среды из t= 4,5 ч, t = 5 ч, t = 5,5 ч и t = 6 ч. Кроме того, при t = 6 ч накладывают среду из контрольных скважин.
7. Окончание эксперимента
- Измерьте и запишите TEER в конце эксперимента, t = 6 ч. Используйте процедуру, описанную в шагах 1.3.2-1.3.6.
- Обеззараживайте зонд, погружая его в 70% этанол на 10-15 мин. Отбросьте вставки или сохраните/обработайте их для дополнительных применений, если это необходимо. Позвольте агаровым пластинам LB инкубироваться в течение ночи и дезинфицировать и / или безопасно утилизировать все другие используемые материалы.
- После ночной инкубации подсчитайте бактериальные колонии вручную на дорожке разбавления пластин LB, чтобы определить количество инокулята и количество трансцитоза E. coli . Убедитесь, что контрольные пластины не показывают роста бактерий.
Результаты
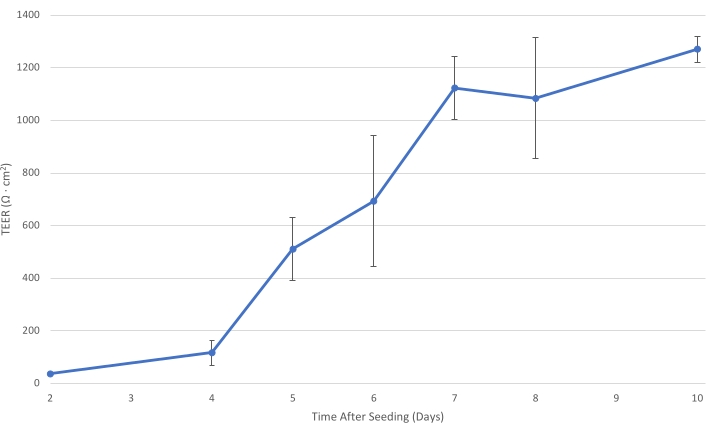
Рисунок 1: T84 TEER с течением времени. По мере созревания клеточного слоя Т84 на вставке электрическое сопротивление монослоя увеличивается. При TEER не менее 1000 Ω·см2 клеточный слой достаточ?...
Обсуждение
Этот метод получен из методов, используемых в гастроэнтерологии и инфекционных заболеваниях20. Модели in vitro кишечного эпителиального барьера были использованы для выяснения механизмов, с помощью которых просветное содержимое взаимодействует с этим соответствующим к...
Раскрытие информации
Никакой.
Благодарности
Эта работа была поддержана студенческим грантом Сары Моррисон, выданным Медицинской школой Университета Миссури-Канзас-Сити для ИИ.
Материалы
| Name | Company | Catalog Number | Comments |
| 10,000 U/ mL Penicillin/Streptomycin Mixture | Fisher Scientific | 15-140-122 | |
| 15 mL sterile conical tubes | MidSci | C15B | |
| 2 mL microcentrifuge tubes | Avant | AVSS2000 | |
| 50 mL sterile polypropylene conical tubes | Falcon | 352070 | |
| Aspirator | Corning | 4930 | |
| Biosafety Cabinets | Labconco | 30441010028343 | Three of these are used in the method: one for sterile tissue work, one for infected tissue work, and one for bacterial work. |
| Centrifuge | Sorvall | Legend RT | |
| Disposable inoculation loops | Fisherbrand | 22363605 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965-084 | |
| Epithelial Volt/Ohm Meter | World Precision Instruments | EVOM2 | |
| Fetal Bovine Serum | Fisher Scientific | 10437028 | |
| Ham's F-12 Nutrient Mixture | Gibco | 11765-047 | |
| Hemacytometer | Sigma Aldrich, Bright Line | Z359629 | |
| Incubator shaker | New Brunswick | Innova 4080 | |
| Incubators | Thermo Scientific | 51030284 | Three of these are used in the method: one for sterile tissue culturing, one for infected tissue culturing, and one for bacterial incubation. |
| Lysogeny broth | Difco | 244610 | |
| Lysogeny broth agar | IBI Scientific | IB49101 | |
| Nikon Eclipse TS2R Microscope | Nikon | ||
| Spectrophotometer | Unico | 1100RS | |
| T84 Intestinal Cells | American Tissue Culture Collection | CCL248 | |
| Tissue culture inserts, with polyethylene trephthalate membrane, 3 µm pores, 24 well format | Falcon | 353096 | |
| Tissue culture plate, 24 wells | Falcon | 353504 | |
| Trypan blue stain | Fisher Scientific | T10282 |
Ссылки
- Shakir, S. M., Goldbeck, J. M., Robison, D., Eckerd, A. M., Chavez-Bueno, S. Genotypic and phenotypic characterization of invasive neonatal Escherichia coli clinical isolates. American Journal of Perinatology. 31 (11), 975-982 (2014).
- Cole, B. K., et al. Route of infection alters virulence of neonatal septicemia Escherichia coli clinical isolates. PloS One. 12 (12), 0189032 (2017).
- Stoll, B. J., et al. Early-onset neonatal sepsis 2015 to 2017, the rise of Escherichia coli, and the need for novel prevention strategies. Journal of the American Medical Association Pediatrics. 174 (7), 200593 (2020).
- Dalgakiran, F., Witcomb, L. A., McCarthy, A. J., Birchenough, G. M., Taylor, P. W. Non-invasive model of neuropathogenic Escherichia coli infection in the neonatal rat. Journal of Visualized Experiments. (92), e52018 (2014).
- Williams, M., et al. Whole-genome sequencing-based phylogeny, antibiotic resistance, and invasive phenotype of Escherichia coli strains colonizing the cervix of women in preterm labor. BMC Microbiology. 21 (1), 330 (2021).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909 (2020).
- Devriese, S., et al. T84 monolayers are superior to Caco-2 as a model system of colonocytes. Histochemistry and Cell Biology. 148 (1), 85-93 (2017).
- Buckley, A., Turner, J. R. Cell biology of tight junction barrier regulation and mucosal disease. Cold Spring Harbor Perspectives in Biology. 10 (1), 029314 (2018).
- Awad, W. A., Hess, C., Hess, M. Enteric pathogens and their toxin-induced disruption of the intestinal barrier through alteration of tight junctions in chickens. Toxins. 9 (2), 60 (2017).
- Vancamelbeke, M., Vermeire, S. The intestinal barrier: A fundamental role in health and disease. Expert Review of Gastroenterology & Hepatology. 11 (9), 821-834 (2017).
- Aguilar, C., et al. Organoids as host models for infection biology - A review of methods. Experimental and Molecular Medicine. 53 (10), 1471-1482 (2021).
- Nickerson, K. P., et al. A versatile human intestinal organoid-derived epithelial monolayer model for the study of enteric pathogens. Microbiology Spectrum. 9 (1), 0000321 (2021).
- Gavin, H. E., Beubier, N. T., Satchell, K. J. The effector domain region of the Vibrio vulnificus MARTX toxin confers biphasic epithelial barrier disruption and is essential for systemic spread from the intestine. PLoS Pathogens. 13 (1), 1006119 (2017).
- Kobayashi, H., et al. Aeromonas sobria serine protease decreases epithelial barrier function in T84 cells and accelerates bacterial translocation across the T84 monolayer in vitro. PloS One. 14 (8), 0221344 (2019).
- Kalischuk, L. D., Inglis, G. D., Buret, A. G. Campylobacter jejuni induces transcellular translocation of commensal bacteria via lipid rafts. Gut Pathogens. 1 (1), 2 (2009).
- Cole, B. K., Ilikj, M., McCloskey, C. B., Chavez-Bueno, S. Antibiotic resistance and molecular characterization of bacteremia Escherichia coli isolates from newborns in the United States. PloS One. 14 (7), 0219352 (2019).
- Cadena-Herrera, D., et al. Validation of three viable-cell counting methods: Manual, semi-automated, and automated. Biotechnology Reports. 7, 9-16 (2015).
- den Hartog, G., et al. Apurinic/apyrimidinic endonuclease 1 restricts the internalization of bacteria into human intestinal epithelial cells through the inhibition of Rac1. Frontiers in Immunology. 11, 553994 (2020).
- Jett, B. D., Hatter, K. L., Huycke, M. M., Gilmore, M. S. Simplified agar plate method for quantifying viable bacteria. Biotechniques. 23 (4), 648-650 (1997).
- Lievin-Le Moal, V., Servin, A. L. Pathogenesis of human enterovirulent bacteria: Lessons from cultured, fully differentiated human colon cancer cell lines. Microbiology and Molecular Biology Reviews. 77 (3), 380-439 (2013).
- Kaczmarek, A., Budzynska, A., Gospodarek, E. Detection of K1 antigen of Escherichia coli rods isolated from pregnant women and neonates. Folia Microbiologica. 59 (5), 419-422 (2014).
- Kalita, A., Hu, J., Torres, A. G. Recent advances in adherence and invasion of pathogenic Escherichia coli. Current Opinion in Infectious Diseases. 27 (5), 459-464 (2014).
- McCool, D. J., Marcon, M. A., Forstner, J. F., Forstner, G. G. The T84 human colonic adenocarcinoma cell line produces mucin in culture and releases it in response to various secretagogues. Biochemical Journal. 267 (2), 491-500 (1990).
- Resta-Lenert, S., Barrett, K. E. Enteroinvasive bacteria alter barrier and transport properties of human intestinal epithelium: Role of iNOS and COX-2. Gastroenterology. 122 (4), 1070-1087 (2002).
- Elatrech, I., et al. Escherichia coli LF82 differentially regulates ROS production and mucin expression in intestinal epithelial T84 cells: Implication of NOX1. Inflammatory Bowel Diseases. 21 (5), 1018-1026 (2015).
- El-Aouar Filho, R. A., et al. Heterogeneous family of cyclomodulins: Smart weapons that allow bacteria to hijack the eukaryotic cell cycle and promote infections. Frontiers in Cellular and Infection Microbiology. 7, 208 (2017).
- Hopkins, A. M., Walsh, S. V., Verkade, P., Boquet, P., Nusrat, A. Constitutive activation of Rho proteins by CNF-1 influences tight junction structure and epithelial barrier function. Journal of Cell Science. 116, 725-742 (2003).
- Shiou, S. R., et al. Erythropoietin protects intestinal epithelial barrier function and lowers the incidence of experimental neonatal necrotizing enterocolitis. Journal of Biological Chemistry. 286 (14), 12123-12132 (2011).
- Newburg, D. S., Ko, J. S., Leone, S., Nanthakumar, N. N. Human milk oligosaccharides and synthetic galactosyloligosaccharides contain 3’-, 4-, and 6'-galactosyllactose and attenuate inflammation in human T84, NCM-460, and H4 cells and intestinal tissue ex vivo. Journal of Nutrition. 146 (2), 358-367 (2016).
- Burns, J. L., Griffith, A., Barry, J. J., Jonas, M., Chi, E. Y. Transcytosis of gastrointestinal epithelial cells by Escherichia coli K1. Pediatric Research. 49 (1), 30-37 (2001).
- Raut, B., Chen, L. J., Hori, T., Kaji, H. An open-source add-on EVOM((R)) device for real-time transepithelial/endothelial electrical resistance measurements in multiple transwell samples. Micromachines. 12 (3), 282 (2021).
- McCarthy, A. J., Stabler, R. A., Taylor, P. W. Genome-wide identification by transposon insertion sequencing of Escherichia coli K1 genes essential for in vitro growth, gastrointestinal colonizing capacity, and survival in serum. Journal of Bacteriology. 200 (7), 00698 (2018).
- Sayoc-Becerra, A., et al. The JAK-inhibitor tofacitinib rescues human intestinal epithelial cells and colonoids from cytokine-induced barrier dysfunction. Inflammatory Bowel Diseases. 26 (3), 407-422 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены