Method Article
Использование визуализации In Vivo для скрининга фенотипов морфогенеза у мутантных штаммов Candida albicans во время активной инфекции у хозяина млекопитающих
В этой статье
Резюме
В этой рукописи описан метод скрининга мутантных библиотек Candida albicans умеренного размера на фенотипы морфогенеза во время активной инфекции у хозяина млекопитающих с использованием неинвазивной конфокальной микроскопии.
Аннотация
Candida albicans является важным патогеном человека. Его способность переключаться между морфологическими формами занимает центральное место в его патогенезе; эти морфологические изменения регулируются сложной сигнальной сетью, контролируемой в ответ на раздражители окружающей среды. Эти регуляторные компоненты были хорошо изучены, но почти во всех исследованиях используются различные стимулы in vitro для запуска филаментации. Чтобы определить, как регулируется морфогенез в процессе патогенеза, мы разработали систему микроскопии in vivo для получения изображений с высоким пространственным разрешением организмов, подвергающихся гифальному образованию внутри хозяина млекопитающих. Протокол, представленный здесь, описывает использование этой системы для скрининга небольших коллекций мутантных штаммов C. albicans , что позволяет нам идентифицировать ключевые регуляторы морфогенеза по мере его возникновения в месте инфекции. Представлены репрезентативные результаты, демонстрирующие, что некоторые регуляторы морфогенеза, такие как транскрипционный регулятор Efg1, имеют последовательные фенотипы in vitro и in vivo, тогда как другие регуляторы, такие как аденилциклаза (Cyr1), имеют значительно отличающиеся фенотипы in vivo по сравнению с in vitro.
Введение
Candida albicans является распространенным грибковым патогеном человека, вызывающим заболевания слизистой оболочки, диссеминированное заболевание и локализованные тканевые инфекции1. Ключевой особенностью физиологии C. albicans является ее сложный полиморфный рост, который связан с его ролью как комменсала и патогена 2,3,4. В богатых питательных условиях in vitro при 30 ° C он обычно растет как яйцевидные почковые дрожжи. Различные триггеры окружающей среды, включая лишение питательных веществ, изменения рН, рост при 37 ° C, воздействие сыворотки и рост при внедрении в агар, приводят к переходу к поляризованной картине роста, что приводит к образованию истинных гиф и / или псевдогиф5. Начало поляризованного роста и результирующий рост нитевидных организмов называют морфогенезом.
Из-за важности морфогенеза в вирулентности организма регуляция гифального образования была широко изучена 6,7. Существует сложная сеть сигнальных путей и транскрипционной регуляции, которая вызывает морфогенез. Несмотря на связь морфогенеза C. albicans с патогенезом, большинство исследований, изучающих морфогенез, использовали стимулы in vitro для запуска гифального образования. Становится все более очевидным, что различные модели нити in vitro не идентичны с точки зрения отдельных стимулируемых регуляторных путей. Кроме того, никакие условия роста in vitro не соответствуют сложной среде хозяина. Учитывая важность C. albicans как патогена человека, целью этого протокола является исследование его морфогенеза во время активной инфекции у хозяина млекопитающих с использованием системы с умеренной пропускной способностью, что позволяет исследователю проверять мутантные библиотеки C. albicans.
Для облегчения этих исследований была разработана система визуализации in vivo, позволяющая получать изображения клеток C. albicans с высоким пространственным разрешением при инфицировании ушной раковины анестезированной мыши с помощью перевернутого конфокального микроскопа 8,9,10. Поскольку кожа ушной раковины довольно тонкая, эти изображения можно получить без необходимости рассечения тканей. Таким образом, количественные данные фенотипа могут быть измерены в месте активных инфекций в ткани хозяина. Протокол, описанный здесь, включает трансформацию эталонного штамма и одного или нескольких мутантных штаммов с различными флуоресцентными кассетами экспрессии белка11,12. Флуоресцентные штаммы, экспрессирующие белок, затем смешивают и совместно вводят внутрикожно. После того, как инфекция установлена, конфокальная визуализация используется для количественной оценки как частоты филаментации, так и длины сформированных нитей. Данные, полученные от мутантных штаммов, нормализуются до данных, полученных от эталонного штамма, который присутствует в той же области ткани, обеспечивая тем самым внутренний контроль. Эта система позволила нам успешно отсеять несколько серий мутантных штаммов C. albicans, многие из которых имеют дефекты морфогенеза in vitro 9,10. Многие из этих штаммов легко нити in vivo, подчеркивая важность моделей in vivo для исследования морфогенеза.
протокол
Исследования в этом протоколе были одобрены Комитетом по институциональному уходу и использованию животных Университета Айовы (IACUC). Обратитесь к руководству CDC по оборудованию и процедурам работы с организмами BSL213.
1. Приготовление штаммов Candida albicans
- Определите подходящий эталонный штамм для использования в качестве положительного контроля. Убедитесь, что этот штамм близко соответствует экспериментальным штаммам с точки зрения его родословной и генетических манипуляций.
ПРИМЕЧАНИЕ: Для репрезентативных экспериментов, представленных здесь, мутанты были созданы из штаммов, описанных в Homann, et al.14, которые были построены из SN152. Эти мутанты являются Arg-. Поэтому эталонным штаммом был выбран SN250, который также был создан из SN152 и также является Arg-. Пищевые стрессоры имеют решающее значение в регуляции поляризованного роста дрожжей Saccharomyces cerevisiae15; они также были вовлечены в филаментацию у C. albicans и других грибов 16,17,18. Поэтому эталонный штамм должен быть сопоставлен для ауксотрофий с экспериментальными штаммами, когда это возможно, чтобы избежать потенциальных смешанных эффектов от пищевого стресса. - Выбирайте флуоресцентные конструкции экспрессии белка. При скрининге различных экспериментальных штаммов создайте эталонный штамм, который экспрессирует один флуоресцентный белок, и используйте другие флуоресцентные белки для маркировки мутантных штаммов.
ПРИМЕЧАНИЕ: Репрезентативные данные, представленные здесь, используют NEON для эталонного штамма и iRFP для мутантных штаммов. Любой флуоресцентный белок может быть использован, если он высоко экспрессирован, относительно яркий и может возбуждаться / обнаруживаться используемым микроскопом. Контрольные эксперименты, сравнивающие эталонные штаммы, экспрессирующие различные флуоресцентные белки, не продемонстрировали какого-либо влияния экспрессии флуоресцентных белков на морфогенез. - Преобразуйте штаммы с помощью флуоресцентных конструкций экспрессии белка.
ПРИМЕЧАНИЕ: Многие учреждения требуют использования мер предосторожности уровня биологической безопасности 2 для работы с C. albicans. Все работы должны выполняться в соответствии с местными правилами безопасности. Независимо от местных правил, исследователи, работающие с C. albicans , должны быть обучены безопасному обращению с организмом.- Преобразование эталонных и экспериментальных штаммов с использованием стандартных протоколов19 ацетата лития.
ПРИМЕЧАНИЕ: В экспериментах, описанных здесь, используются плазмиды pENO1-NEON-NATR и pENO1-iRFP-NATR, щедро предоставленные доктором Робертом Уилером11,12. Плазмиды были линеаризированы с использованием NotI9. - Выбирайте трансформанты на основе роста на нурсеотрицине или другой соответствующей селекционной среде.
- Определите успешные трансформаторы. Выберите небольшой кусочек клеток из каждой колонии с помощью зубочистки, а затем смешайте их с капелькой воды объемом 2,5 мкл на предметном стекле микроскопа. Наложите крышку и осмотрите с увеличением 10x-40x. Исследуйте с помощью конфокальной системы визуализации (используемой для остальной части протокола) или любого стандартного широкопольного флуоресцентного микроскопа. Соответствующие трансформаторы будут иметь яркий сигнал с соответствующими длинами волн возбуждения и излучения.
ПРИМЕЧАНИЕ: Для репрезентативных результатов штаммы, экспрессирующие NEON, визуализировали с помощью вертикального флуоресцентного микроскопа с длиннопроходным фильтром с полосовым фильтром возбуждения 472/30 нм, полосовым эмиссионным фильтром 520/35 нм и одноближным дихроичным делителем пучка 495 нм. Поскольку iRFP не виден глазом, экспрессирующие iRFP штаммы были визуализированы с использованием системы конфокальной микроскопии, используемой для визуализации in vivo , с использованием лазера 638 нм для возбуждения и обнаружения излучения света от 655-755 нм.- В качестве альтернативы, оцените макроскопическую колониальную флуоресценцию с использованием флуоресцентной стереомикроскопии, ручных флуоресцентных систем возбуждения или систем обнаружения флуоресценции, обычно используемых для гелей и вестерн-блотов.
- Создание морозильных запасов выбранных трансформаторов.
- Преобразование эталонных и экспериментальных штаммов с использованием стандартных протоколов19 ацетата лития.
- Инокулируйте твердые среды YPD (дрожжевого экстракта пептона декстрозы) флуоресцентным эталоном, экспрессирующим белок, и экспериментальные штаммы из морозильных запасов за 3 дня до инъекции, используя зубочистку для переноса мазка организмов из морозильной камеры в твердую среду YPD. Инкубировать при 30 °C в течение 2 дней.
- Для каждого штамма прививайте колбу, содержащую 25 мл YPD, клетками C. albicans , взятыми из нескольких колоний за 1 день до инъекции. Сделайте это, используя зубочистку, чтобы перенести мазок организмов из одной колонии в YPD; повторить несколько раз, чтобы получить клетки из нескольких разных колоний. Инкубировать в течение ночи при 30 °C в орбитальном шейкерном инкубаторе при 175 об/мин.
ПРИМЕЧАНИЕ: Важно использовать несколько колоний в качестве источника для инокулята, потому что C. albicans имеет высокую частоту спонтанных генетических изменений. Использование нескольких колоний при запуске культуры инокулята сводит к минимуму вероятность того, что все организмы в инокуляте возникают у родителя со значительными спонтанными изменениями. - В день инъекции:
- Центрифуга 1 мл культуры в течение 2 мин при 500 х г.
- Промыть культуру три раза 1 мл стерильного фосфатно-буферного физиологического раствора Dulbecco (dPBS). После окончательной промывки повторно суспендировать гранулу в 1 мл стерильного дПБС.
- Разбавить образец промытой культуры в 1:100 и посчитать с помощью гемоцитометра.
- Отрегулируйте плотность промытой культуры до 1 х 108 организмов на мл с помощью дПБС.
- Для каждого набора штаммов, подлежащих введению, создайте инокулятивный метод путем смешивания равных объемов эталонного штамма и экспериментального штамма (штаммов). Это поддерживает плотность инокулята на уровне 1 х 108 организмов на мл.
ПРИМЕЧАНИЕ: Количество штаммов, которые могут быть оценены на ухо, ограничено способностью системы микроскопии, используемой для четкого различения сигнала от каждого флуоресцентного белка. - После того, как инокулятив будет приготовлен, приступайте непосредственно к инъекциям животному. Не храните инокулятор перед использованием.
2. Подготовка животных
- Получить одобрение от местного Институционального комитета по уходу за животными и их использованию или соответствующего местного руководящего органа.
- Получите 6-12-недельных мышей от поставщика или программы разведения. Домашние мыши в учреждении, в котором они будут жить на протяжении всего эксперимента в течение как минимум 1 недели до прививки.
ПРИМЕЧАНИЕ: Для репрезентативных результатов использовались 6-недельные самки мышей DBA2/N. - Кормите животных чау без хлорофилла в течение не менее 7 дней до посева.
3. Эпиляция и прививка
- Индуцировать хирургическую плоскость анестезии (рисунок 1).
ВНИМАНИЕ: Вдыхаемые анестетики являются опасными материалами и могут вызывать раздражение глаз или кожи, а также токсичность нервной системы. Необходимо соблюдать все институциональные политики и процедуры, а также общие лабораторные методы обеспечения безопасности при использовании ингаляционных анестетиков. Только лица, обученные использованию ингаляционных анестетиков, могут выполнять эти шаги. Стандартная практика включает в себя ношение перчаток, лабораторного халата, защиту глаз, использование системы падальщика анестезии и тщательный учет в соответствии с институциональными руководящими принципами.- Поместите мышь в предварительно подогретую индукционную камеру анестезии. Держите животное в теплой обстановке во время общей анестезии. Сделайте это с помощью согревающих прокладок, предназначенных для этой цели, и нагретой ступени микроскопа. Не используйте безрецептурную грелку, так как она может перегреться и вызвать ожоги.
- Обеспечьте 2%-3% изофлурана в индукционную камеру до тех пор, пока мышь не потеряет свой корректирующий рефлекс и дыхание не будет медленным и устойчивым. Очистите индукционную камеру анестезии и переведите животное в неребризерный носовой конус, обеспечивающий 1%-2% изофлурана.
- Подтвердите плоскость анестезии с помощью рефлекса защемления пальца ноги или других механизмов проверки. На протяжении всего эксперимента контролируйте дыхательный паттерн животного и плоскость анестезии, а также регулируйте концентрацию анестетика по мере необходимости.
- Нанесите смазку для глаз, чтобы предотвратить высыхание роговицы.
- Эпиляция (Рисунок 1C,D)
- Нанесите безрецептурный крем для депиляции обильно на внутреннюю и внешнюю поверхность обоих ушей с помощью тампона с ватным наконечником.
- Через 2-3 мин (или в соответствии с указаниями производителя) аккуратно протрите ухо сухой марлевой прокладкой, чтобы удалить весь крем и волосы. Протрите еще два раза марлевыми подушечками, насыщенными стерильной водой, чтобы полностью удалить остатки крема для депиляции. Неспособность удалить весь крем для депиляции приведет к раздражению кожи / воспалению.
- Инъекция (рисунок 1E, F)
- Протрите поверхность уха для введения марлевой прокладкой, пропитанной 70% этанолом и дайте высохнуть на воздухе.
- Хорошо перемешайте инокулятор, перевернув несколько раз или вихря.
- Введите 20-30 мкл инокулята в инсулиновый шприц. Удерживая иглу направленной вверх, осторожно постучите по шприцу, чтобы убедиться, что любой воздух в стволе находится наверху. Осторожно выбрасывайте воздух и избыток инокулята обратно в трубку инокулята или отработанную трубку, чтобы плунжер находился на отметке 10 мкл.
- Надев наперсток на палец или большой палец недоминирующей руки, стабилизируйте ухо, обернув его поперек наперстка. В качестве альтернативы, нанесите безрецептурную двустороннюю кожную ленту (модную ленту) на небольшую коническую пластиковую трубку с круглым дном и задрапируйте ухо поперек ленты. Позаботьтесь о том, чтобы при этом не выбить конус носа анестезии. Может быть полезно приклеить носовой конус к рабочей поверхности.
ПРИМЕЧАНИЕ: Внутренняя или внешняя сторона уха может быть введена в зависимости от физического комфорта исследователя. Для микроскопии обязательно поместите мышь так, чтобы сторона вводимого уха была обращена к объективу. - Сохраняя шприцевую иглу почти полностью параллельно коже и избегая каких-либо крупных вен, вставьте кончик иглы в самый внешний слой кожи до тех пор, пока скос не будет просто покрыт.
- Медленно вводят инокулятор внутрикожно. Хорошая внутрикожная инъекция поднимет небольшой пузырь в коже. Держите иглу на месте в течение 15-20 с, прежде чем удалить ее из уха, чтобы свести к минимуму утечку.
- Если нижняя сторона уха животного становится влажной, игла оказывается слишком глубокой и проходит через ухо целиком. В этом случае повторите инъекцию в другой области уха.
- Повторите процесс, используя другое ухо животного. Это может быть сделано с теми же штаммами C. albicans для репликации или с другим набором штаммов C. albicans .
- Если это не визуализация немедленно, поместите животное в нагретую восстановительную камеру. Наблюдайте за животным, пока оно не оправится от анестезии, а затем верните его в клетку.
- Следуя институциональным протоколам, четко пометьте клетку метками биологической опасности и укажите, что животные в клетке заражены Candida albicans.
- Завершите все необходимые записи, связанные с анестезией животных и любой другой необходимой институциональной практикой.
- Размещайте животное в условиях животного объекта с использованием мер предосторожности уровня биологической безопасности животных 2.
4. Количественная оценка морфогенеза in vitro для сравнения с результатами in vivo
- Используя те же промытые культуры, которые использовались для приготовления инокулята, создают разбавление организмов 1:50 в RPMI1640 + 10% термоинактивированной фетальной бычьей сыворотке и инкубируют при 37 °C с кувырканием в течение 4 ч. Альтернативно, могут быть использованы другие среды, которые стимулируют морфогенез in vitro .
- Центрифугируйте образец в течение 5 мин при 500 х г и повторно суспендируйте в 0,5 мл дПБС.
- Разбавьте образец в соотношении 1:10, поместите 2,5 мкл разбавленного образца на предметное стекло микроскопа и накройте его крышкой.
- Исследуйте образец с помощью флуоресцентного микроскопа. Подсчитайте не менее 100 клеток, регистрируя количество дрожжевых и нитевидных клеток для каждого штамма. В репрезентативных результатах, представленных здесь, нитевидная клетка определяется как любая клетка с длиной более чем в два раза превышающей длину материнской клетки.
ПРИМЕЧАНИЕ: Количественная оценка морфогенеза in vitro может быть выполнена в тот же день, что и вакцинация животных. Можно инициировать анализ морфогенеза in vitro при подготовке инокулята к инъекции и выполнить инокуляцию животных в течение 4-часового инкубационного периода. Если все процедуры на животных завершены до окончания 4-часового инкубационного периода, приступают непосредственно к исследованию in vitro стимулированных клеток. Альтернативно, клетки могут быть повторно суспендированы в 3,7% формальдегиде в dPBS (на стадии 4.2) и храниться при 4 °C в течение нескольких дней. Фиксированные организмы затем могут быть количественно определены, как только позволит время. Прививка животных не должна задерживаться для количественного анализа in vitro .
5. Подготовка к визуализации in vivo
- Подготовьте микроскоп (рисунок 2А).
- Включите все оборудование для микроскопии и запустите программное обеспечение для визуализации.
- Если доступно, загрузите все предварительно определенные параметры образа.
- Активируйте лазеры и детекторы, необходимые для обнаружения используемых флуоресцентных белков.
- Включите нагретую ступень микроскопа и дайте ей нагреться до 37 °C.
ПРИМЕЧАНИЕ: Можно использовать микроскоп с полностью закрытой камерой окружающей среды, а не нагретой сценой. - Установите контрольную точку оси Z, плоскость фокусировки которой находится на верхней поверхности крышки. Это можно сделать, заклеив крышку на место над отверстием сцены и положив каплю воды на крышку. Используйте «сухой» объектив с меньшим увеличением (10x), чтобы сфокусироваться на краю капли воды, а затем установите контрольную точку оси Z. Используйте кусок полотенца, чтобы впитать воду из крышки, прежде чем снимать ее со сцены.
- Поверните объектив с очень большим рабочим расстоянием на место и поместите каплю погружной жидкости на объектив. Опустите линзу, чтобы избежать возможных повреждений при размещении крышки.
- Поместите крышку No1.5 на отверстие сцены и заклейте ее на место. Убедитесь, что лента полностью покрывает все края крышки, чтобы предотвратить попадание жидкости под крышкой в микроскоп. Поднимите объектив к исходной точке оси Z таким образом, чтобы иммерсионная жидкость соприкасалась как с объективом, так и с крышкой.
- Подготовьте несколько кусков чувствительной к давлению ленты, чтобы они были готовы к использованию при позиционировании носового конуса и мыши.
- Включите все оборудование для микроскопии и запустите программное обеспечение для визуализации.
- Вызвать общую анестезию у мыши, чтобы она была изображена, как указано выше (шаг 3.1).
- Расположите мышь (рисунок 2B-D).
- Закрепите носовой конус анестезии на стадии микроскопа, расположив носовой конус так, чтобы он полностью закрывал нос животного, когда животное находится в положении для визуализации. Это может быть достигнуто легче с двумя исследователями. Попросите первого исследователя поместить нос анестезированной мыши в носовой конус и переместить мышь в положение для визуализации, продолжая держать носовой конус над носом животного. Попросите другого исследователя заклеить носовой конус и трубку на место, чтобы он стабильно сидел над носом мыши. Как только носовой конус будет заклеен на месте, оставьте его там на оставшуюся часть сеанса визуализации.
- Установив лучшее место для размещения носового конуса, обратите внимание на его положение. Для последующих сеансов визуализации носовой конус может быть закреплен на стадии, прежде чем привести животное к микроскопу.
- Поместите каплю стерильной воды на крышку над объективом.
- Поместите мышь на ступень микроскопа. Убедитесь, что ухо находится поверх капли воды и прилегает к крышке.
- Используйте вторую (верхнюю) крышку, чтобы сплющить ухо.
- Поместите край крышки параллельно телу мыши, при этом край коснется мыши там, где ухо встречается с головой.
- Опустите свободный край крышки на ступень микроскопа шарнирным движением. Когда крышка сталкивается со стадией микроскопа, она выравнивает ухо. Следите за тем, чтобы не создавать складок или гребней в ухе.
- Надежно закрепите верхнюю крышку на месте, чтобы она удерживала достаточное давление, чтобы сохранить ухо плоским. Следите за тем, чтобы не поймать шерсть мыши или усы в ленте.
- Если не используется микроскоп с камерой окружающей среды, свободно накройте тело мыши стерильной драпировкой для поддержания нормотермической среды.
- Определите интересующую область.
- Убедитесь, что цель находится в исходной точке оси Z.
- Используя белый свет / широкоугольную визуализацию, отрегулируйте плоскость фокусировки в ушной ткани. Хорошая стратегия заключается в том, чтобы сосредоточиться на кровеносных сосудах - если можно увидеть красные кровяные клетки, движущиеся в кровеносных сосудах, плоскость фокуса находится внутри ткани.
- Если микроскоп оснащен широкоугольной флуоресцентной способностью, используйте его для определения интересующей области. Если нет, используйте конфокальную визуализацию. В целом, использование широкоугольной микроскопии для выявления областей, представляющих интерес, происходит быстрее и требует меньшего облучения ткани уха.
- Используя фильтрующий куб для обнаружения флуоресцентного белка, экспрессируемого в эталонном штамме, идентифицируйте поле зрения, которое имеет флуоресцентный сигнал от эталонного штамма. Имейте в виду, что рассеянный свет, скорее всего, будет препятствовать способности фокусироваться на отдельных организмах. Целью этого шага является определение области, представляющей интерес для конфокальной визуализации.
- Перейдите на куб фильтра, который будет обнаруживать флуоресцентный белок, экспрессируемый экспериментальным штаммом (штаммами), и проверять их присутствие в выбранном поле зрения.
6. Визуализация
- Определите параметры.
- В то время как программное обеспечение для визуализации находится в реальном конфокальном режиме, изучите область интересов, когда фокальная плоскость перемещается через ось Z. Выберите плоскость оси Z с сильным сигналом от всех используемых флуоресцентных белков.
- Отрегулируйте мощность лазера и/или скорость визуализации для получения достаточно сильного сигнала таким образом, чтобы морфология могла быть определена для всех клеток в поле зрения. Чтобы избежать повреждения тканей, используйте минимально возможную мощность лазера.
ПРИМЕЧАНИЕ: Как и во всех изображениях, существует баланс между мощностью лазера, скоростью захвата и разрешением. Определите настройки, которые четко идентифицируют морфологию организма, балансируя скорость и мощность лазера, чтобы свести к минимуму облучение ткани уха. Поскольку визуализация происходит через внешнюю дерму, для возбуждения требуется более высокая мощность лазера, чем обычно необходима для конфокальной визуализации традиционных образцов, установленных на слайдах. К счастью, уровень пространственного разрешения, необходимый для анализа морфологии, не является экстремальным. Таким образом, получение изображений с достаточным сигналом для определения морфологии организма без повреждения тканей легко достижимо. - Как только эти параметры установлены, используйте их на протяжении всего сеанса визуализации, чтобы служить отправной точкой для последующих сеансов визуализации. Таким образом, полезно сохранить настройки изображения.
ПРИМЕЧАНИЕ: Отдельные области инфекции могут быть более мелкими или более глубокими в ткани. Более глубокие области могут потребовать увеличения мощности лазера. Поскольку этот анализ опирается на пространственное распределение сигнала, а не на его интенсивность, допустимо изменять настройки изображения между полями по мере необходимости.
- Получите изображения.
- Выберите поле зрения, которое имеет четкое образование нитей в эталонном штамме и где большинство организмов распределены настолько, что их морфология может быть определена.
- Установите верхнюю и нижнюю плоскости фокусировки для z-стека. Нет необходимости охватывать всю глубину зараженной области, но имейте в виду, что организмы в верхней или нижней части изображенного объема обычно исключаются из анализа.
- Получайте изображения z-стека, псевдоцветите каждый канал, чтобы различать каждый штамм, и накладывайте каналы. Сохраните изображения.
- Повторите для других полей зрения. Морфогенез может варьироваться от местоположения к месту; поэтому важно получить и проанализировать по крайней мере три поля из каждого уха.
7. Ручной двумерный анализ: частота нити накаливания
- Используйте программное обеспечение для обработки изображений для выполнения максимальной проекции z-стека в двумерное изображение. Инструкции, приведенные здесь, предназначены для FIJI/Image J.
- Открывайте микроскопические изображения с помощью программного обеспечения ImageJ.
- При необходимости нанесите псевдоцвет на каждый канал, чтобы обеспечить прямую идентификацию каждого штамма C. albicans . Для этого нажмите на Image > Lookup Table > LUT Color и выберите выбранный псевдоцвет.
- Преобразуйте стековый файл в двухмерное изображение проекции максимальной интенсивности:
- Выберите файл z-stack. Нажмите на Image > Stacks > Z Projection.
- Выберите верхнюю и нижнюю плоскость и выберите тип проекции Max Intensity.
- Подсчитайте каждый организм, видимый на максимальных проекционных изображениях, по типу штамма (различаемому по цвету канала) и морфологии.
- Организмы, которые значительно перекрывают друг друга или области с очень высокой плотностью организма, будет трудно точно подсчитать. Исключите их из подсчета, но позаботьтесь о том, чтобы не вводить смещение в отношении нитевидных форм, которые с большей вероятностью будут перекрываться.
- Нитевидные формы, выступающие прямо в z-стек или из него, будут выглядеть как небольшие круглые объекты в максимальной проекции. Аналогичным образом, организмы, которые отрезаны границей изображения, могут казаться дрожжами, потому что нить находится вне поля зрения. Таким образом, двумерный анализ всегда будет переоценивать процент дрожжевых форм. Поскольку это будет происходить наравне с эталонным и экспериментальным штаммом (штаммами), всегда сравнивайте экспериментальные результаты с результатами эталонного штамма.
- Выполняйте статистические сравнения результатов в соответствии с экспериментальной конструкцией.
8. Ручной двумерный анализ: длина нити накала
- Для C. albicans образование аберрантных нитей может происходить потому, что: а) меньше «материнских» дрожжевых клеток подвергаются морфогенезу, б) нити растут медленнее или в) нитевидный рост инициируется, но не поддерживается. Чтобы оценить эти возможности, количественно оцените длину кривого пути каждой нити накала в максимальном проекционном изображении в качестве суррогата истинной трехмерной длины (обсуждается ниже).
- Когда почка развивается на материнской клетке, невозможно сказать, станет ли она нитью или дрожжами. Чтобы убедиться, что в этот анализ включены только нитевидные клетки, измеряйте только организмы, в которых дочерняя клетка по крайней мере в два раза длиннее материнской клетки.
- Откройте максимальное проекционное изображение, созданное на шаге 7.
- В наборе инструментов ImageJ щелкните правой кнопкой мыши инструмент «Прямая/сегментированная линия» и выберите параметр «Сегментированная линия». Опция сегментированной линии позволяет пользователю измерять длину нити накала вдоль изогнутого пути, что необходимо, учитывая пластичность нитей C. albicans .
- Измерьте длину нити от шейки бутона до растущего конца нити. Щелкните левой кнопкой мыши на шейке бутона; указатель изменится на небольшой квадрат. Проследите нить накала по ее длине, щелкая по центру нити накала каждый раз, когда происходит кривая, поворот или изменение длинной оси нити накала. Дважды щелкните по растущему кончику нити накала.
- Управление нажатием + M. Откроется всплывающее окно, в котором будут сведены в таблицу измерения площади, среднего, минимального, максимального значения и длины. После измерения каждой нити накала еще раз нажмите Control + M, чтобы добавить текущее измерение в таблицу измерений.
- Когда все нити будут измерены, скопируйте и вставьте измерения длины в файл анализа данных.
- Выполните статистический анализ для оценки распределения длин нитей в эталонном штамме и мутантном штамме.
9. Ручной трехмерный анализ
- Чтобы получить более точное измерение морфогенеза, которое позволяет избежать переоценки дрожжевых форм и может позволить различать псевдогифы и гифы, вручную прокрутите вверх и вниз через z-стек, оценивая морфологию каждого организма в трех измерениях.
- Кроме того, можно создать трехмерное изображение каждого z-стека и проанализировать форму каждого организма при вращении изображения.
10. Автоматизированный анализ
- Используя программное обеспечение для визуализации, автоматизируйте перечисление организмов и их морфологию в двух или трех измерениях.
ПРИМЕЧАНИЕ: Некоторые алгоритмы для различения типов морфологии могут вводить предвзятость. Таким образом, стратегии автоматизации должны быть тщательно проверены по отношению к экспериментальному проектированию. Хорошо спроектированный и проверенный автоматизированный анализ изображений может увеличить пропускную способность этапа анализа.
Результаты
Представленные здесь результаты основаны на ранее опубликованных отчетах 9,10. Целью данного анализа является количественная оценка способности мутантных штаммов C. albicans подвергаться морфогенезу при активных инфекциях. Типичные параметры, которые отличают псевдогифы от гиф, могут быть трудно оценить у организмов, растущих в трех измерениях в сложной среде in vivo. Это особенно верно при рассмотрении двумерных поперечных сечений, созданных конфокальной визуализацией. Поэтому этот скрининговый анализ сосредоточен на выявлении организмов, растущих как нитевидные по сравнению с дрожжами. Для последующих исследований с использованием более глубокого анализа, включая трехмерные реконструкции, этот метод может быть адаптирован для распознавания дрожжей, гиф и псевдогифов.
Экспрессия флуоресцентного белка в эталонном или мутантном штамме C. albicans позволяет легко обнаружить морфологию штамма in vivo (рисунок 3 и рисунок 4). В целом, количественный анализ световой микроскопии лучше всего выполняется, когда мало или ни один из пикселей на изображении насыщен. Для этого протокола, однако, насыщенность изображения часто упрощает анализ. Флуоресцентная локализация белка не является равномерной по всей клетке и часто выше в материнских дрожжах, чем в нитях. К счастью, для исследования морфогенеза пространственное распределение сигнала, а не его интенсивность, определяет результат. Таким образом, получение изображений, в которых многие пиксели насыщены, улучшает способность количественно оценивать морфогенез в этом анализе.
Чтобы проиллюстрировать важность оценки морфогенеза in vivo, представлены репрезентативные результаты для эталонного штамма (SN250) и двух мутантов: у одного отсутствует транскрипционный фактор Efg1, а у другого отсутствует аденилциклаза Cyr1. In vitro ни один из этих штаммов не растет какнити 20,21. При выращивании in vitro в среде RPMI, дополненной 10% сывороткой, эталонный штамм быстро образует нити, тогда как штаммы efg1ΔΔ и cyr1ΔΔ этого не делают (Фиг.3 и Фиг.4). В этих условиях мутант efg1ΔΔ демонстрирует несколько поляризованный рост, причем дочерние клетки слегка удлинены по сравнению с материнскими клетками. Это подчеркивает важность использования четкого определения нити накала. Любое такое определение по умолчанию произвольно, но оно необходимо для последовательной оценки фенотипа. Для этих исследований нитевидная картина роста определяется как организм с самым длинным размером дочерней клетки, более чем в два раза превышающей размер материнской клетки. Используя это определение, удлиненные ячейки efg1ΔΔ не являются нитевидными.
В соответствии со своим фенотипом in vitro , efg1ΔΔ демонстрирует значительный дефект филаментации in vivo: примерно 9% клеток efg1ΔΔ выросли в виде нитей in vivo (рисунок 3). Напротив, 53% мутантных клеток cyr1ΔΔ росли как нити in vivo (рисунок 4). Хотя число мутантных клеток cyr1ΔΔ, подвергающихся филаментации in vivo , было значительно ниже, чем у эталонного штамма, способность мутанта cyr1ΔΔ образовывать нити in vivo представляет собой существенное изменение по сравнению с полным отсутствием морфогенеза in vitro. Визуально нити, образованные мутантом cyr1ΔΔ, оказались короче эталонного штамма. Чтобы оценить это количественно, длину кривого пути нитевидных ячеек измеряли с использованием двумерной проекции изображений in vivo (рисунок 4E). Средняя длина ниточек cyr1ΔΔ была на 29% короче нитей эталонного штамма.
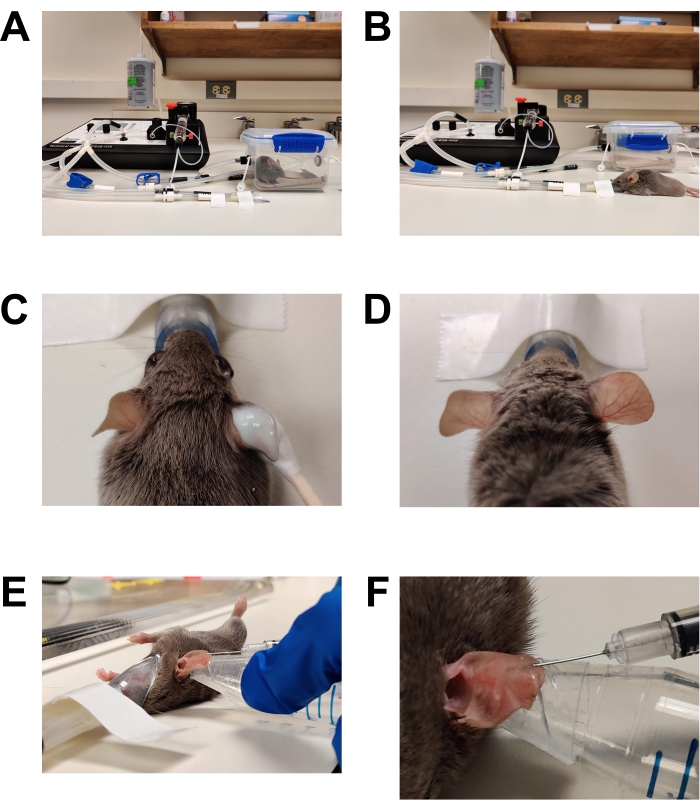
Рисунок 1: Анестезия и инокуляция. (А) Индукция анестезии с использованием индукционной камеры. (B) Анестезия поддерживается с помощью носового конуса, что позволяет перемещать мышь по мере необходимости. (C) Крем для удаления волос наносится с использованием аппликатора с хлопковым наконечником. Глазной смазывающий гель применяется для защиты глаз во время анестезии. (D) Эффективное удаление волос правого уха. Сравните с необработанным левым ухом. (E) Внутрикожное введение C. albicans в ухо мыши. Ухо удерживается на месте с помощью конической трубки, обернутой двусторонней кожной лентой (модной лентой). (F) Крупный план внутрикожной инъекции. В коже образуется бледный пузырь, что является признаком успешного внутрикожного размещения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Подготовка к визуализации. (А) Стадия микроскопа, подготовленная к визуализации. Анестезиологический конус носа закреплен на месте. Крышка приклеивается к сцене, закрывающей отверстие линзы. Доступны дополнительные куски ленты. Нагретую ступень предварительно нагревают до 37 °C (не показано). (B) Помещение анестезированной мыши в анестезирующий носовой конус. (C) Мышь слегка поворачивается так, что сторона уха, которая была привита, обращена к нижнему обтекателю/объективу. Затем ухо сплющивается к нижнему обтекателю и закрепляется на месте, помещая второй закрывающийся лист поверх уха. (D) Верхний чехл прикреплен к сцене, чтобы закрепить ухо на месте относительно ступени микроскопа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Морфология мутантного штамма efg1ΔΔ in vitro и in vivo. (A) Широкоугольное изображение мутантных штаммов WT и efg1ΔΔ после индукции нити in vitro путем выращивания клеток в RPMI + 10% сыворотки при 37 °C в течение 4 ч. Шкала брусков составляет 10 мкм. Контрастность изображения была отрегулирована с помощью программного обеспечения для редактирования фотографий для облегчения просмотра. (B) Процент филаментации in vitro, наблюдаемый в мутантных штаммах WT и efg1ΔΔ. Und = не обнаруживается (нити не обнаружены). Высота стержня представляет собой средний процент нитевидных клеток из трех независимых экспериментов, в которых было количественно определено по меньшей мере 100 клеток. Полосы ошибок указывают на стандартное отклонение (результаты сравниваются t-тестом студента, p < 0,001). (C) Конфокальная микрофотография WT (зеленый) и мутант efg1ΔΔ (красный), растущий in vivo через 24 ч после прививки. Стрелки указывают примеры мутантных клеток efg1ΔΔ, которые соответствуют нашему определению «нитевидных». Шкала представляет собой 50 мкм. (D) Процент филаментации in vivo, наблюдаемый в мутантных штаммах WT и efg1ΔΔ. Высота стержня представляет собой медианный процент нитевидных ячеек из двух независимых экспериментов. Полосы ошибок указывают на стандартное отклонение (результаты сравниваются t-тестом студента, p < 0,001). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
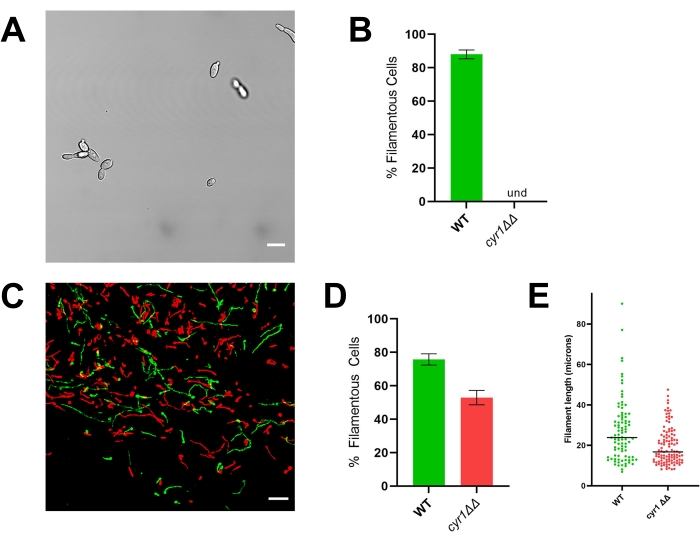
Рисунок 4: Морфология мутантного штамма cyr1ΔΔ in vitro и in vivo. (A) Широкоугольное изображение мутантного штамма cyr1ΔΔ после индукции филаментации in vitro путем выращивания клеток в RPMI + 10% сыворотки при 37 °C в течение 4 ч. Шкала представляет собой 10 мкм. Контрастность изображения была отрегулирована с помощью программного обеспечения для редактирования фотографий для облегчения просмотра. (B) Процент филаментации in vitro, наблюдаемый в мутантных штаммах WT и cyr1ΔΔ. Und = не обнаруживается (нити не обнаружены). Высота стержня представляет собой средний процент нитевидных клеток из трех независимых экспериментов, в которых было количественно определено по меньшей мере 100 клеток. Полосы ошибок указывают на стандартное отклонение (результаты сравниваются t-тестом студента, p < 0,001). (C) Конфокальная микрофотография WT (зеленый) и мутанта cyr1ΔΔ (красный), растущего in vivo через 24 ч после посева. Шкала представляет собой 50 мкм. (D) Процент филаментации in vivo, наблюдаемый в мутантных штаммах WT и cyr1ΔΔ. Высота стержня представляет собой медианный процент нитевидных ячеек из двух независимых экспериментов. Полосы ошибок указывают на стандартное отклонение (результаты сравниваются t-тестом студента, p < 0,001). (E) Распределение длины нити накала in vivo, измеренное длиной кривого пути в двумерной проекции z-стека. Каждая точка представляет длину одной нити. Клетки, растущие в виде дрожжей, не были включены в этот анализ. Бар обозначает среднюю длину нити накала. Распределение длин существенно отличается при анализе с использованием теста Манна-Уитни U (p < 0,001). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Эта модель использует конфокальную микроскопию для получения изображений организмов C. albicans, когда они растут в ткани хозяина млекопитающего, что позволяет нам оценивать фенотипы морфогенеза во время активной инфекции. Процесс морфогенеза занимает центральное место в патогенезе C. albicans и широко изучен с использованием различных анализов in vitro 2,3,4. Однако ни один анализ in vitro не может полностью смоделировать сложную биохимическую и структурную среду хозяина.
Протокол, описанный здесь, ориентирован на использование этой системы визуализации in vivo для скрининга серии / библиотеки мутантов C. albicans для идентификации генов, участвующих в морфогенезе во время инфекции. Использование штаммов C. albicans , экспрессирующих различные флуоресцентные белки, позволяет количественно оценить морфогенез in vivo мутантных штаммов C. albicans по сравнению с морфогенезом эталонного штамма. Сравнение морфогенеза у мутанта с эталонным штаммом в пределах одной и той же области инфекции гарантирует, что организмы подвергаются воздействию идентичных сред. Это позволяет количественно измерить процент клеток, подвергающихся филаментации, а также степень нити. Нормализация измерений мутантного штамма (штаммов) к измерениям эталонного штамма позволяет нам лучше сравнивать производительность одного мутанта с другим.
Репрезентативные результаты, представленные здесь, демонстрируют возможность значительного расхождения между фенотипами in vitro и in vivo . Мутантный штамм C. albicans efg1ΔΔ часто используется в качестве отрицательного контроля для анализов морфогенеза, поскольку он не может нитить почти во всех условиях in vitro 20. Хотя результаты in vivo были очень похожи на результаты in vitro , даже этот сильно затрудненный штамм иногда образовывал нити в среде тканей хозяина (рисунок 3). Это подчеркивает силу среды хозяина в запуске морфогенеза.
Напротив, мутантный штамм cyr1ΔΔ демонстрирует существенное несоответствие между ростом in vitro и in vivo; хотя ни одна из мутантных клеток не подвергается филаментации in vitro, примерно половина клеток растет как нити in vivo (рисунок 4)10,21. Интересно, что эти нити были значительно короче, чем те, которые образовывались эталонным штаммом, предполагая, что CYR1 способствует либо скорости роста нити, либо способности поддерживать фенотип нити. Чтобы облегчить анализ длины нити накала, длину кривого пути нитей измеряли с помощью двумерной проекции изображений. В двумерных проекциях нитей, растущих в трех измерениях, любая нить, растущая на оси, которая не параллельна плоскости xy, будет проецироваться как более короткая, чем ее истинная длина. Поскольку этот ракурс также происходит для эталонного штамма, оценка распределения длин нитей в двумерной проекции по-прежнему позволяет количественно сравнивать эталонные и мутантные штаммы. Анализ длины нити накала в двух, а не трех измерениях требует менее интенсивного анализа изображений; таким образом, он может быть выполнен относительно быстро на типичном настольном компьютере. Использование этого более простого анализа позволяет включить распределение длины нити в протокол скрининга, давая более тонкое понимание способности каждого мутанта подвергаться морфогенезу, не вызывая существенных задержек в пропускной способности.
Представленные здесь репрезентативные исследования проводились с использованием мышей DBA2/N, у которых дефект в системе комплемента, вызывающий неспособность рекрутировать нейтрофилы к месту инфекции C. albicans 22. Целью этих исследований было изучение механизмов регуляции нитей C. albicans в ткани хозяина. Поэтому мышей DBA2/N использовали, чтобы избежать путаницы в результатах из-за восприимчивости или устойчивости отдельного штамма к нейтрофилам. Поскольку реакция нейтрофилов против C. albicans может влиять на филаментацию23, рекрутирование нейтрофилов в место инфекции может повлиять на результаты анализа морфогенеза. Если штамм способен к филаментации in vivo , но сильно ингибируется от филаментации при наличии нейтрофилов, нить будет обнаружена у мышей DBA2 / N, но вряд ли будет замечена при использовании мышей с интактным хемотаксисом нейтрофилов. Таким образом, деформация мыши, используемой в качестве хоста, является важным фактором при использовании этого протокола.
Наблюдение о том, что мутантный штамм efg1ΔΔ не имеет нити in vivo, вряд ли связано с реакциями нейтрофилов хозяина, поскольку этот штамм также не может быть нитью in vitro. Филаментация, наблюдаемая in vivo со штаммом cyr1ΔΔ, диссонирует с его неспособностью к филаментации in vitro. Данные модели рыбок данио инфекции C. albicans указывают на то, что ответные нейтрофилы важны для профилактики морфогенеза24. Поэтому использование мышей DBA2/N, у которых отсутствуют нейтрофильные реакции, вряд ли объясняет увеличение филаментации cyr1ΔΔ in vivo по сравнению с in vitro. Тем не менее, среда in vivo явно влияет на морфогенез штамма cyr1ΔΔ; таким образом, дальнейшее исследование этого штамма может дать важную информацию о регуляции морфогенеза C. albicans во время активных инфекций. Протокол, описанный здесь, разработан как скрининговый анализ для идентификации штаммов, таких как штамм cyr1ΔΔ, который будет использоваться в будущих исследованиях.
Использование системы газовой анестезии с низким потоком очень полезно для этого протокола (рисунок 1A, B). Во время первоначальной разработки этого протокола мышей анестезировали с использованием инъекционного анестетик-коктейля кетамина, смешанного с ксилазином. Хотя можно было выполнить ограниченную визуализацию с помощью этого анестезирующего метода, продолжительность анестезии была непредсказуемой, требуя быстрого завершения сеансов визуализации, чтобы избежать восстановления мыши после анестезии во время визуализации. Традиционные ингаляционные анестетики громоздки и требуют высоких скоростей потока анестезирующих газов, часто требуя их использования в вытяжном шкафу. Таким образом, традиционные ингаляционные анестетики было бы очень трудно использовать с ограничениями пространства конфокального микроскопа без непреднамеренного воздействия на исследователей анестезирующих агентов. Использование низкопоточной ингаляционной анестезиологической системы позволяет проводить последовательную анестезию животного при сохранении безопасной среды для исследователя. Низкопоточный носовой конус позволяет легко позиционировать животное как для инокуляции, так и для микроскопии. Малокалиберные, малообъемные загрузочные трубки позволяют использовать относительно длинные трубки, что позволяет размещать анестезиологический аппарат на достаточном расстоянии, чтобы не мешать микроскопии.
Хлорофилл, присутствующий в типичном мышином чау, приводит к значительной аутофлуоресценциитканей 25. Это создает значительный шум на изображениях, что затрудняет получение высококачественных изображений с высоким пространственным разрешением. Когда животных кормили чау-чау без хлорофилла в течение 7 дней до визуализации, фон от аутофлуоресценции был существенно уменьшен в ткани, но хлорофилл, отложенный в волосах, продолжал оставаться проблематичным. Удаление волос на ушных раковинах с помощью безрецептурного химического крема для депиляции эффективно для минимизации автофлуоресценции в волосах (рисунок 1C, D). Таким образом, сочетание чау-чау без хлорофилла и адекватного удаления волос существенно снизило автофлуоресценцию и значительно улучшило качество изображения. Поскольку шерсть удаляется из уха до визуализации, цвет шерсти животного не влияет на эту систему. Этот протокол был успешно использован для изучения инфекций C. albicans у мышей BALB / c (белый), C57BL / 6 (черный) и DBA2 / N (коричневый). Протокол также может быть использован с нокаутирующими мышами C57BL/6, у которых дефицит различных генов-хозяев; это позволит в будущем исследовать, как иммунная система хозяина млекопитающих влияет на нить. Одной из особенностей этой модели, не обсуждаемой в этом протоколе, является то, что, поскольку эта система визуализации является неинвазивной, одно и то же животное может быть изображено многократно в течение нескольких дней, что позволяет следить за прогрессом индивидуальной инфекции с течением времени. Эта особенность, вероятно, будет играть ключевую роль в будущих исследованиях взаимодействия хозяина и патогена.
Таким образом, этот протокол приводит к получению изображений C. albicans с высоким пространственным разрешением, растущих в ткани живого млекопитающего-хозяина, что позволяет точно оценить морфогенез у мутантных штаммов 8,9,10. Результаты, представленные здесь, демонстрируют, как этот протокол может быть использован для проверки библиотеки мутантов C. albicans. Из протестированных на сегодняшний день мутантов C. albicans большая часть мутантов с известными дефектами морфогенеза in vitro легко подвергается филаментации in vivo 9,10. Это подчеркивает важность включения системы in vivo, подобной этой, в эксперименты, предназначенные для выяснения механизмов патогенеза C. albicans.
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Эта работа была поддержана грантом NIH 1R01AI33409 и кафедрой педиатрии Медицинского колледжа Карвера Университета Айовы.
Материалы
| Name | Company | Catalog Number | Comments |
| #1.5 coverslips | Thermo-Fisher | 20811 | large enough to cover the universal stage opening |
| 0.1 mL Insulin syringes | EXELint | 26018 | Can use syringes that are 5/16"–1/2" long and 29–32 G |
| 3.7% formaldehyde in dPBS | Sigma-Aldrich | SHBJ5734 | |
| 70% Ethanol/30% water | Decon Laboratories | A05061001A | |
| Alcohol prep pads | Covidien | 5110 | Alternative: gauze pads soaked in 70% isopropyl alcohol |
| C.albicans reference strain and experimental strains | SN250 | FGSC Online Catalog | The specific C. albicans strain varies with experiment and the investigators goals. We have used strains derived from SC5314 as well as other clinical isolates. |
| Chlorophyl free mouse chow | Envigo | 2920x | |
| Computer | Dell | Optiplex 7050 | Computer that can run imaging software for acquisition and for analysis of images. A variety of imaging software is available and varies with the specific microscope and user system. |
| Cotton tip applicator | Pro Advantage | 76200 | |
| DBA2/N (6-12 week old mice) | BALB/c and C57/BL6 mice can also be used. The latter allow for the use of widely available knockout mouse models as well as mouse models in which individual cell types, such as phagocytes, are identified by their expression of fluorescent proteins. | ||
| Double sided tape designed to hold fabric to skin (fashion tape) | local pharmacy or grocery store | Double sided adhesive tape designed for keeping clothing in place over human skin. This is typically available over the counter in pharmacies and variety stores. It is important to use this type of tape as it is designed for gentle adherence to skin. Examples: https://www.amazon.com/Womens-Fashion-Clothing-Transparent-Suitable/dp/B08S3TWR3H/ref=sr_1_40?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174406&sprefix= fashion+tape%2Caps%2C70&sr=8-40 https://www.amazon.com/Fearless-Tape-Sensitive-Clothing-Transparent/dp/B07QY8V5XT/ref=sr_1_26?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174320&sprefix= fashion+tape%2Caps%2C70&sr=8-26 https://www.amazon.com/Hollywood-Fashion-Secrets-Tape-Floral/dp/B009RX77MK/ref=sr_1_29?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174406&sprefix= fashion+tape%2Caps%2C70&sr=8-29 | |
| Dulbecco's phosphate buffered saline | Gibco / Thermo-Fisher | 14190-144 | Must be sterile; open a new container for every experiment |
| Fetal bovine serum | Gibco / Thermo-Fisher | 26140-079 | |
| Gauze pad | Pro Advantage | P157112 | |
| Gel eye lurbicant | local pharmacy or grocery store | ||
| ImageJ or FIJI analysis software | NIH | ImageJ (FIJI) | |
| Isoflurane | Akorn | J119005 | |
| Leica DMi8 (SP8 platform) with Leica 11506375 objective lens | Leica | DMi8 (SP8) | The objective lens (Leica 11506375) used here is a 25x water immersion lens to allow us to have a high NA (0.95) while approximating the refractive index of the ear tissue. The microscope (Leica DMi8 (SP8 platform) has 488 nm and 638 nm diode laser lines and is equipped with filter-free spectral detection with computer controlled adjustable bandwidth for detection of emission light. The stage must have enough clearance to allow the objective to reach the bottom coverslip without hitting the stage. |
| Low-flow anesthesia system or traditional anesthesia vaporizer | Kent Scientific International | SomnoSuite | |
| Nair hair remover lotion | local pharmacy or grocery store | Over the counter depilatory cream | |
| Nourseothricin | Jena Bioscience | AB-101L | |
| pENO1-NEON-NATR pENO1-iRFP-NATR plasmids | Fluorescent protein expression transformation constructs generously given to us by Dr. Robert Wheeler (Seman, et al., 2018, Infection and Immunity; Bergeron, et al., 2017, Infection and Immunity) | ||
| Pressure sensitive laboratory tape | Tape & Label Graphic Systems Inc | 1007910 | |
| RPMI1640 cell culture medium | Gibco / Thermo-Fisher | 11875-093 | |
| Thimble, plastic 15 mL conical tube, or Falcon 5 mL round bottom polystyrene tubes | Falcon | 352196 | To safely hold the animals ear during injectinos |
Ссылки
- Lopes, J. P., Lionakis, M. S. Pathogenesis and virulence of Candida albicans. Virulence. 13 (1), 89-121 (2022).
- Saville, S. P., Lazzell, A. L., Monteagudo, C., Lopez-Ribot, J. L. Engineered control of cell morphology in vivo reveals distinct roles for yeast and filamentous forms of Candida albicans during infection. Eukaryotic Cell. 2 (5), 1053-1060 (2003).
- Arita, G. S., et al. Cell wall associated proteins involved in filamentation with impact on the virulence of Candida albicans. Microbiological Research. 258, 126996(2022).
- Rai, L. S., Wijlick, L. V., Bougnoux, M. E., Bachellier-Bassi, S., d'Enfert, C. Regulators of commensal and pathogenic life-styles of an opportunistic fungus-Candida albicans. Yeast. 38 (4), 243-250 (2021).
- Sudbery, P. E. Growth of Candida albicans hyphae. Nature Reviews Microbiology. 9 (10), 737-748 (2011).
- Basso, V., d'Enfert, C., Znaidi, S., Bachellier-Bassi, S. From genes to networks: The regulatory circuitry controlling candida albicans morphogenesis. Current Topics in Microbiology and Immunology. 422, 61-99 (2019).
- Mancera, E., et al. Evolution of the complex transcription network controlling biofilm formation in Candida species. Elife. 10, 64682(2021).
- Mitra, S., Dolan, K., Foster, T. H., Wellington, M. Imaging morphogenesis of Candida albicans during infection in a live animal. Journal of Biomedical Optics. 15 (1), 010504(2010).
- Wakade, R. S., Huang, M., Mitchell, A. P., Wellington, M., Krysan, D. J. Intravital imaging of Candida albicans identifies differential in vitro and in vivo filamentation phenotypes for transcription factor deletion mutants. mSphere. 6 (3), 0043621(2021).
- Wakade, R. S., Kramara, J., Wellington, M., Krysan, D. J. Candida albicans filamentation does not require the cAMP-PKA pathway in vivo. mBio. 13 (3), 0085122(2022).
- Bergeron, A. C., et al. Candida albicans and Pseudomonas aeruginosa interact to enhance virulence of mucosal infection in transparent zebrafish. Infection and Immunity. 85 (11), 00475(2017).
- Seman, B. G., et al. Yeast and filaments have specialized, independent activities in a zebrafish model of Candida albicans infection. Infection and Immunity. 86 (10), 00415-00418 (2018).
- Centers for Disease Control and Prevention. Biosafety in Microbiological and Biomedical Laboratories (BMBL). 6th edition. , Available from: https://www.cdc.gov/labs/BMBL.html (2020).
- Homann, O. R., Dea, J., Noble, S. M., Johnson, A. D. A phenotypic profile of the Candida albicans regulatory network. Plos Genetics. 5 (12), 1000783(2009).
- Cullen, P. J., Sprague, G. F. The regulation of filamentous growth in yeast. Genetics. 190 (1), 23-49 (2012).
- Herrero, A. B., et al. Control of filament formation in Candida albicans by polyamine levels. Infection and Immunity. 67 (9), 4870-4878 (1999).
- Ahmad Hussin, N., et al. Biotin auxotrophy and biotin enhanced germ tube formation in Candida albicans. Microorganisms. 4 (3), 37(2016).
- Nantel, A., et al. Transcription profiling of Candida albicans cells undergoing the yeast-to-hyphal transition. Molecular Biology of the Cell. 13 (10), 3452-3465 (2002).
- Noble, S. M., Johnson, A. D. Strains and strategies for large-scale gene deletion studies of the diploid human fungal pathogen Candida albicans. Eukaryotic Cell. 4 (2), 298-309 (2005).
- Glazier, V. E. EFG1, Everyone's favorite gene in Candida albicans: A comprehensive literature review. Frontiers in Cellular Infection and Microbiology. 12, 855229(2022).
- Huang, G., Huang, Q., Wei, Y., Wang, Y., Du, H. Multiple roles and diverse regulation of the Ras/cAMP/protein kinase A pathway in Candida albicans. Molecular Microbiology. 111 (1), 6-16 (2019).
- Saville, S. P., Lazzell, A. L., Chaturvedi, A. K., Monteagudo, C., Lopez-Ribot, J. L. Use of a genetically engineered strain to evaluate the pathogenic potential of yeast cell and filamentous forms during Candida albicans systemic infection in immunodeficient mice. Infection and Immunity. 76 (1), 97-102 (2008).
- Brothers, K. M., Newman, Z. R., Wheeler, R. T. Live imaging of disseminated candidiasis in zebrafish reveals role of phagocyte oxidase in limiting filamentous growth. Eukaryotic Cell. 10 (7), 932-944 (2011).
- Brothers, K. M., et al. NADPH oxidase-driven phagocyte recruitment controls Candida albicans filamentous growth and prevents mortality. PLoS Pathogens. 9 (10), 1003634(2013).
- Holmes, H., Kennedy, J. C., Pottier, R., Rossi, R., Weagle, G. A recipe for the preparation of a rodent food that eliminates chlorophyll-based tissue fluorescence. Journal of Photochemistry and Photobiology. B: Biology. 29 (2-3), 199(1995).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены