Method Article
Многофотонная лазерная абляция центров организации цитоплазматических микротрубочек в мышиных ооцитах
В этой статье
Резюме
Представлен оптимизированный протокол, позволяющий истощать центры организации цитоплазматических микротрубочек в ооцитах мыши во время метафазы I с использованием фемтосекундного лазера ближнего инфракрасного диапазона.
Аннотация
Верность мейоза ооцитов имеет решающее значение для получения компетентных в развитии эуплоидных яйцеклеток. У млекопитающих ооцит подвергается длительной остановке при профазе I первого мейотического деления. После полового созревания и после мейотического возобновления ядерная мембрана разбирается (разрушение ядерной оболочки), и веретено собирается в основном в центре ооцитов. Первоначальное позиционирование центрального шпинделя имеет важное значение для защиты от аномальных кинетохорно-микротрубочек (МТ) и анеуплоидии. Центрально расположенное веретено мигрирует чувствительным ко времени образом к коре, и это необходимый процесс для выдавливания крошечного полярного тела. В митотических клетках позиционирование веретена зависит от взаимодействия между центросомно-опосредованными астральными МТ и клеточной корой. Напротив, мышиные ооциты не имеют классических центросом и вместо этого содержат многочисленные ацентриолярные МТ-организующие центры (MTOCs). На метафазной стадии I мышиные ооциты имеют два различных набора MTOC: (1) MTOC, которые группируются и сортируются для сборки веретенообразных полюсов (полярные MTOCs), и (2) метафазные цитоплазматические MTOCs (mcMTOCs), которые остаются в цитоплазме и не способствуют непосредственно образованию веретена, но играют решающую роль в регулировании позиционирования веретена и своевременной миграции веретена. Здесь описан метод многофотонной лазерной абляции для селективного истощения эндогенно меченых mcMTOCs в ооцитах, собранных у мышей-репортеров Cep192-eGfp . Этот метод способствует пониманию молекулярных механизмов, лежащих в основе позиционирования и миграции веретена в ооцитах млекопитающих.
Введение
Гаплоидные гаметы (сперматозоиды и ооциты) образуются посредством мейоза, который влечет за собой один раунд репликации ДНК с последующим двумя последовательными делениями, которые необходимы для уменьшения числа хромосом до оплодотворения. У млекопитающих в начале внутриутробной жизни яйцеклетка подвергается длительной остановке (до полового созревания) на диплотеновой стадии профазы I первого мейотического деления, стадии, называемой стадией зародышевого пузырька (GV). После мейотического возобновления яйцеклетка GV подвергается разрушению ядерной оболочки (NEBD), и веретено собирается в основном в центре ооцитов 1,2,3. Позже, ведомый F-актином, веретено своевременно мигрирует из центра ооцитов в кору, чтобы обеспечить очень асимметричное деление, в результате чего получается яйцеклетка с крошечным полярным телом (ПБ)4,5,6.
В митотических клетках центросомы состоят из пары центриолей, окруженных перицентриолярными компонентами материала (PMC), такими как перицентрин, γ-тубулин, Cep152 и Cep1927. Эти центриолсодержащие центросомы способствуют верности биполярного веретенообразного образования8. Однако центриоли теряются во время раннего оогенеза у различных видов, включая грызунов9. Поэтому мышиные ооциты принимают центриоль-независимый веретенообразный путь сборки с использованием многочисленных ацентриолярных микротрубочек (MT) организующих центров (MTOCs)9,10. После мейотического возобновления периноядерные MTOC проходят три различные стадии реконденсации, растяжения и фрагментации на большое количество более мелких MTOC11,12. Затем фрагментированные MOC группируются и сортируются для организации биполярного шпинделя 10,13,14. Другой пул MTOCs расположен в цитоплазме во время NEBD. Некоторые из этих цитоплазматических МТОК мигрируют и образуют веретенообразные полюса (полярные МТОК, пМТОК)10,11. Недавно было обнаружено еще одно подмножество цитоплазматических МТОК, называемое метафазными цитоплазматическими МТОКС (mcMTOCs), которые не способствуют образованию веретенообразных полюсов, но остаются в цитоплазме ооцитов во время метафазы I (Met I)15. Истощение mcMTOCs путем многофотонной лазерной абляции или аномальное увеличение их количества путем ингибирования аутофагии возмущает позиционирование и миграцию веретена и увеличивает частоту анеуплоидии в метафазных II ооцитах15.
Интересно, что mcMTOCs отличаются от pMOC во многих аспектах15. Например, в отличие от pMTOCs, которые в основном происходят из периноядерных MTOCs, mcMTOCs происходят из коры ооцитов. Когда веретено все еще находится в центре ооцитов, mcMTOCs локализуются асимметрично противоположной стороне, в которую веретено мигрирует для экструзии PB15. Астрально-подобные МТ не могут достичь коры головного мозга в относительно большой клетке ооцита. Таким образом, эти mcMTOCs зарождают МТ, чтобы закрепить веретено (через астрально-подобные MOC) к коре. Эти результаты предполагают модель, в которой mcMTOC-ядерная сила MT противодействует F-актин-опосредованной силе, которая управляет миграцией веретена к коре. Баланс между этими двумя противоположными силами необходим для регулирования позиционирования центрального шпинделя и своевременной миграции шпинделя15.
На сегодняшний день все исследованные белки PMC (перицентрин, г-тубулин, Cep192 и aurora kinase A) локализуются в обоих пулах MTOC: mcMTOCs и pMTOCs15. Поэтому не существует химического или генетического подхода к избирательному возмущению mcMTOC без возмущения pMTOC. Эти ограничения можно обойти, выборочно нацеливаясь на mcMTOCs с помощью лазерной абляции. Среди лазерных технологий, разработанных для микроабляции, импульсные многофотонные фемтосекундные лазеры показывают большой потенциал благодаря их прецизионному воздействию, ограниченному фокальной плоскостью, высокой глубине проникновения ближнего инфракрасного света и снижению фототоксичности и теплового повреждения ячейки 16,17,18. В этой работе описывается селективный подход к абляции mcMTOCs в мышиных ооцитах с использованием многофотонного лазера, связанного с инвертированным микроскопом.
протокол
Все методы, описанные здесь, были одобрены Университетом Миссури (Animal Care Quality Assurance Ref. Number 9695). В настоящем исследовании использовались самки мышей cep192-eGFP в возрасте 6-8 недель. Для генерации мышей-репортеров Cep192-eGFP для интеграции гена-репортера EGFP в геном мыши CF-1 использовался CRISPR/Cas9-опосредованный гомологией репарация. Репортер EGFP был слит на C-конце Cep192 (неотъемлемый компонент MTOCs)15. Для поддержания мышиной колонии использовали гомозиготных мышей-репортеров Cep192-eGfp . Все животные содержались в клетках (до четырех животных / клетка) при 21 ° C и влажности 55%, с 12-часовым циклом света / темноты и доступом ad libitum к пище и воде.
1. Сбор ооцитов мыши
- Подготовьте культуральную среду (Chatot, Ziomek и Bavister, CZB19, см. Таблицу материалов) и инкубируйте ее при 37 °C и 5% CO2 в течение ночи.
ПРИМЕЧАНИЕ: Среда CZB может храниться при температуре 4 °C в течение 1 месяца (см. Дополнительный файл 1 для композиции носителя). - Дополните среду CZB глютамином (1 мМ) и милриноном (2,5 мМ) (CZB + M) (см. Таблицу материалов) и поместите ее в инкубатор.
ПРИМЕЧАНИЕ: Милринон является ингибитором фосфодиэстеразы, который поддерживает ооциты, арестованные при профазе I, и предотвращает мейотическое возобновление20. - Подготовьте среду для сбора (минимальную необходимую среду без бикарбоната, MEM), содержащую 3 мг/мл поливинилпиролидона (PVP), 25 мМ HEPES (рН 7,3) (дополнительный файл 1) и милринона (2,5 мМ) (MEM/PVP +M, см. Таблицу материалов).
- Подготовьте коллекционную и культуральную посуду, сделайте четыре микрокапи (100 мкл) коллекционной среды (MEM/PVP+M) и две микрокапли (100 мкл) культуральной (CZB+M) среды в 60 мм и 35 мм чашки Петри соответственно и покройте их минеральным маслом (см. Таблицу материалов). Держите тарелку для сбора на слайде теплее и поставьте чашку культуры в инкубатор при 37 °C и 5% CO2.
- Вводят внутрибрюшинно 5 МЕ сывороточного гонадотропина беременной кобылы (ПМСГ, см. Таблицу материалов) половозрелым (6-8 недель) самкам мышей Cep192-eGFP за 44-48 ч до сбора ооцитов.
- Принесите мышей в жертву при вывихе шейки матки, определите и удалитеяичники 21 и перенесите их в часовой стакан, содержащий предварительно расплавленную среду сбора (MEM /PVP + M) при 37 °C.
- Зафиксируйте завязь, прикоснувшись шприцем объемом 1 мл к нижней части часового стекла и проколов его несколько раз (~ 40 раз на яичник), используя швейные иглы, связанные вместе, чтобы выпустить ооциты в среду.
- Используя пластиковую передаточную пипетку, перенесите всю среду, содержащую кучевые ооцитарные комплексы (КОК), со стадии 1.7 в пустую пластиковую чашку Петри толщиной 100 мм.
- Под стереомикроскопом соберите КОК с помощью стеклянной пипетки Пастера и перенесите их в коллекционную тарелку, содержащую MEM/PVP + M.
- Используя узкую стеклянную пипетку Пастера (диаметром около 100 мкм), механически обнажите ооциты путем мягкого повторяющегося пипетирования с последующим переносом и промывкой их в четырех микрокапсах (100 мкл) MEM / PVP + M (тарелка для сбора) перед их переносом в культурную чашку CZB + M.
- Инкубировать оголенные ооциты в течение 1 ч при 37 °C с 5% CO2 в воздухе.
2. Микроинъекция ооцитов
- Поместите каплю MEM/PVP +M объемом 250 мкл в пластиковую крышку чашки Петри диаметром 100 мм и накройте ее минеральным маслом.
ПРИМЕЧАНИЕ: Крышка чашки Петри имеет нижний ободок, который обеспечивает больше места для регулировки микроманипулятора. - Включите систему микроинъекции (см. Таблицу материалов).
- Поместите микроинжекционное блюдо на стадию нагрева (37 °C) микроскопа.
- Загрузите инъекционную иглу 0,5 мкл кРНК mCh-Cep192с помощью наконечников пипетки микрозагрузчика (см. Таблицу материалов) и прикрепите инъекционную иглу к микроманипулятору.
- Переведите оголенные ооциты (стадия 1.11) в микрокапс объемом 250 мкл (стадия 2.1).
- Под объективом 20x или 40x отрегулируйте положение и фокус инъекции и удержания игл в соответствии с положением ооцитов (рисунок 1).
- Установите блок микроинъекции и установите давление впрыска (pi), давление компенсации (pc) и время инъекции (ti), чтобы иметь возможность вводить 5-10 пл цРНК mCh-Cep192 (для экзогенной маркировки MTOCs).
- Осторожно вводите ооциты, не касаясь ядра.
- После того, как все ооциты введены, промыть их тремя микрокапями CZB + M, перенести их в чашку для культивирования (CZB + M) и инкубировать их в течение 3 ч при 37 °C, чтобы обеспечить экспрессию mCh-Cep192.
3. Созревание ооцитов
- Подготовьте среду созревания, добавив глютамин (1 мМ) в среду CZB, предварительно уравновешенную в инкубаторе с 5% CO2 на воздухе при 37 °C в течение не менее 3 ч.
- Сделайте две микрокапли (100 мкл) среды созревания в чашке Петри 35 мм и накройте их минеральным маслом (чашка созревания).
- Промывайте профазные I-арестованные ооциты не менее трех раз в 100 мкл мильринонов-свободных микрокаппусках CZB, чтобы полностью удалить милринон и обеспечить мейотическое возобновление.
- Переведите ооциты в чашку созревания и инкубируйте их в течение 5 ч (прометафаза I стадия) в увлажненном инкубаторе с 5%СО2 на воздухе при 37 °С.
4. Подготовка ооцитов к абляции и визуализации
- Переложите прометафазу I ооцитов (стадия 3.4) в чашку для культивирования со стеклянным дном, содержащую 100 мкл среды созревания (стадия 3.1), покрытую минеральным маслом.
5. Подготовка микроскопа к абляции
- Не менее чем за 30 мин до абляции включите регулятор температуры для сценического инкубатора (см. Таблицу материалов) и установите его на 37 °C.
- Включите контроллер CO2 и установите его на 5% CO2.
- Выберите 40-кратный апохроматический объектив погружения масла и нанесите небольшую каплю погружного масла.
- Установите стеклянно-нижнюю чашку для культивирования с ооцитами на инкубатор и накройте инкубатор газовой крышкой.
- В программном обеспечении для получения изображений (см. Таблицу материалов) выберите опцию, позволяющую сохранять позиции нескольких этапов (например, «Определить метку и найти эксперимент»). Используя проходящую световую ярко-полевую подсветку, центрируются на отдельных ооцитах и сохраняют их положения.
- В программном обеспечении для получения изображений выберите режим сканирования XYZ , установите формат изображения на 256 x 256 пикселей, установите коэффициент масштабирования 2,5x - 3,0x и выберите частоту сканирования 600 Гц. Это соответствует времени выдержки пикселя приблизительно 1,6 мкс.
- Установите лазерную линию возбуждения 488 нм примерно на 10% мощности лазера (что соответствует 4,0 мкВт на уровне образца) (см. Таблицу материалов) и используйте спектральную полосу пропускания 500-550 нм для наблюдения сигнала GFP от MOC. Для одновременного наблюдения флуоресценции от метки mCherry Cep192 установите лазерную линию возбуждения 585 нм примерно на 8% мощности лазера (что соответствует 10,7 мкВт на уровне образца) и используйте другой детектор, установленный на спектральную полосу пропускания 595-645 нм.
ПРИМЕЧАНИЕ: Полезно использовать детектор пропускаемого света (TLD) конфокального микроскопа для одновременного обнаружения границ ооцитов. - Используя режим сканирования в реальном времени и ручное управление z-приводом, экранируйте ооцит на наличие MTOCs.
- Как только mcMTOC обнаружен, нарисуйте квадратную область интереса (ROI) вокруг него.
6. Абляция mcMTOCs
- Установите фемтосекундный лазер на длину волны 740 нм.
ПРИМЕЧАНИЕ: Длина волны лазера может быть изменена в зависимости от микроскопа и условий лазера. - Используйте электрооптический модулятор многофотонного микроскопа (см. Таблицу материалов) для установки мощности лазера на уровне 70%-80%, соответствующей мощности 60-70 мВт в плоскости образца.
ПРИМЕЧАНИЕ: Если лазер оснащен фемтосекундным импульсным компенсатором, используйте его для коррекции дисперсии групповой задержки (GDD). Коррекция GDD уменьшает количество лазерной мощности, необходимой для эффективной абляции mcMTOC, и сводит к минимуму фотоповреждение яйцеклетки. Управление GDD обычно интегрировано с программным обеспечением для получения изображений коммерческих многофотонных микроскопов. - Используйте тот же формат изображения, коэффициент масштабирования и частоту сканирования, что и на шаге 5.6. Задайте для параметров усреднения линии и кадра значение 1.
- Нажмите на кнопку Scan в программном обеспечении, чтобы выполнить абляцию mcMTOC путем проведения одного лазерного сканирования выбранной ROI.
- Используйте настройки канала из шага 5.7 для просмотра результатов абляции путем сравнения изображений структур, помеченных GFP, сделанных до и после многофотонной лазерной экспозиции. Если абляция проходит успешно, интенсивность флуоресценции GFP в целевом mcMTOC снижается до уровней, наблюдаемых в фоновом режиме.
- Если некоторые фрагменты GFP-маркировочной структуры остаются, повторите шаг 6.4 один или несколько раз, сосредоточившись на различных z-плоскостях mcMTOC.
- Используйте настройки канала из шага 5.7 для проверки эффективности абляции путем полной потери связанных с mcMTOC сигналов mCherry (mCh-Cep192).
- Повторяйте шаги с 5.8 по 6.7 до тех пор, пока все МТОК ооцита (в различных фокальных плоскостях) не будут абляции.
ПРИМЕЧАНИЕ: Этот протокол использует микроинъекцию mCh-Cep192 в качестве стратегии для подтверждения истощения mcMTOC после воздействия многофотонного лазера и исключения возможности того, что потеря флуоресценции GFP вызвана фотоотбеливанием GFP. Однако микроинъекция этого зонда является необязательной и не требуется для процедуры абляции.
Результаты
Многофотонная лазерная абляция обеспечивает эффективный метод селективного абляции внутриклеточных структур. В текущем исследовании использовалась многофотонная лазерная абляция для селективного истощения mcMTOCs в ооцитах мышей. Лазерная абляция эффективно истощала mcMOC, о чем свидетельствует снижение эндогенной флуоресценции GFP в целевых mcMTOCs до уровня, сопоставимого с фоном. Экзогенный mCh-Cep192 в целевых mcMTOCs также был отменен после лазерной абляции. Лазерная абляция mcMTOCs должна выполняться в разных фокальных плоскостях внутри ооцита (где расположены mcMTOCs, рисунок 2), чтобы гарантировать, что все mcMTOCs в ооците истощены (рисунок 3).
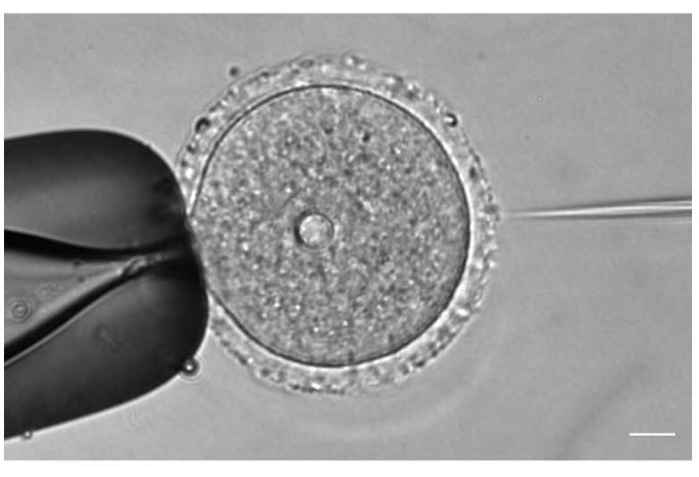
Рисунок 1: Микроинъекция ооцитов. Микроинъекция профазного I-арестованного ооцита мыши с цРНК mCh-Cep192 . Шкала: 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
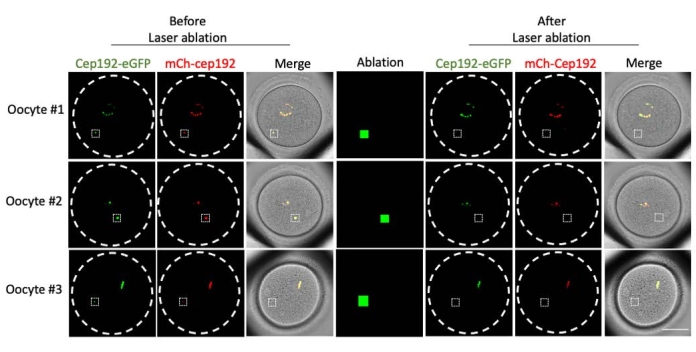
Рисунок 2: Истощение mcMTOCs в мышиных ооцитах. Репрезентативные изображения одиночных фокальных плоскостей. Белые квадраты указывают на mcMTOC до и после многофотонной лазерной абляции. Шкала: 40 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
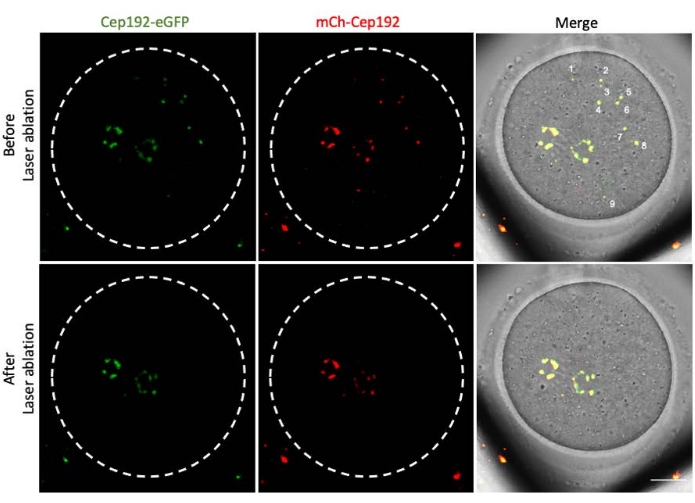
Рисунок 3: Истощение mcMTOCs в разных фокальных плоскостях в мышиной яйцеклетке. Репрезентативные максимальные проекционные изображения макМОК-абляционного мышиного ооцита. Шкала: 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл 1: Композиции Chatot, Ziomek и Bavister (CZB) и минимальной существенной среды без бикарбоната (MEM/PVP). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Существуют различные методы нарушения структур, связанных с цитоскелетом, в клетках 22,23,24,25. Тем не менее, поиск эффективных методов для избирательного возмущения целевой структуры без ущерба для жизнеспособности клеток является сложной задачей. Метод многофотонной лазерной абляции, представленный здесь, является эффективной стратегией для индуцирования селективного механического возмущения mcMTOCs внутри ооцита без изменения жизнеспособности ооцитов.
Лазерная абляция широко используется для понимания молекулярных механизмов, контролирующих сегрегацию хромосом во время митоза и мейоза 22,23,26,27. Из-за относительно большого размера (>80 мм в диаметре) ооцитов млекопитающих по сравнению с соматическими клетками28, абляция их внутриклеточных структур представляет собой проблему. Кроме того, средний объем mcMTOC в метафазных I ооцитах составляет ~ 20 мкм15, что представляет собой дополнительную проблему. Эффективный метод, который обеспечивает более глубокое проникновение в ткани, должен быть принят для преодоления этих проблем. Основным преимуществом использования многофотонного лазера для абляции является его способность проникать глубже в клетку, сводя к минимуму нецелевые эффекты29.
Для проверки эффективности и действенности метода лазерной абляции для истощения целевой структуры рекомендуется использовать флуоресцентно меченый белок для идентификации целевой структуры с течением времени (до и после абляции)23. Важно отметить, что лазерная абляция истощает весь mcMTOC как структуру, и хотя меньшие mcMOC требуют истощения только одного лазерного воздействия, более крупные mcMOC могут потребовать более одного лазерного воздействия в разных фокальных плоскостях. Также рекомендуется фиксировать и иммуномаркировать подмножество контрольных и макМТОК-абляционных ооцитов маркером MTOC (таким как γ-тубулин, перицентрин или Cep192) для дальнейшего подтверждения эффективности абляции mcMTOC. В контрольных ооцитах участки цитоплазмы, непосредственно прилегающие, но не перекрывающиеся с mcMTOCs, будут подвергаться воздействию лазера.
Этот эксперимент требует нескольких абляций mcMTOC при перемещении между различными фокальными плоскостями внутри ооцитов. Поэтому настоятельно рекомендуется практиковать эту технику несколько раз перед выполнением эксперимента, чтобы минимизировать время эксперимента, тем самым повышая жизнеспособность ооцитов. Кроме того, важно использовать минимальную мощность лазера, достаточную для истощения mcMTOCs, не влияя на жизнеспособность ооцитов.
Этот метод имеет некоторые ограничения. Во-первых, многофотонные конфокальные микроскопы относительно дороже, чем обычные конфокальные микроскопы. Во-вторых, возмущение всех mcMTOC в разных фокальных плоскостях занимает больше времени, чем химические или генетические возмущения. В-третьих, этот протокол требует технических навыков для удаления всех mcMTOC в кратчайшие сроки. Тем не менее, после освоения, использование многофотонного лазера обеспечивает отличную стратегию для возмущения нескольких внутриклеточных структур в ооцитах мыши, включая mcMTOCs, способствуя пониманию молекулярных механизмов, регулирующих позиционирование веретена и его своевременную миграцию в ооцитах млекопитающих.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Авторы хотели бы поблагодарить всех членов лаборатории Балбулы за их ценную помощь и обсуждения. Авторы благодарят Мелину Шух за любезное распространение конструкции mCherry-Cep192. Это исследование было поддержано R35GM142537 (NIGMS, NIH) для AZB.
Материалы
| Name | Company | Catalog Number | Comments |
| 4 IN thinwall GL 1.0 OD/.75 ID | World precision instrument | TW100F-4 | Injection needles |
| Borosilicate glass | Fisherbrand | Cat# 13-678-20D | |
| Borosilicate glass capillarities | World Precision Instrument | Cat# TW100-6 | Holding needles |
| Bovine serum albumine | MilliporeSigma | Cat# A4503 | |
| Cage incubator for Leica DMI6000 B microscope | Life Imaging Services GmbH | ||
| Calcium chlrode dihydrate | MilliporeSigma | Cat# C7902 | |
| CO2 controller | Pecon | # 0506.000 | |
| CO2 Cover HP | Pecon | # 0506.020 | |
| DL-Lactic acid | MilliporeSigma | Cat# L7900 | |
| DMi8 | Leica | N/A | Microscope |
| EDTA | MilliporeSigma | Cat# E5134 | |
| Femtojet 4i | Eppendorf | N/A | Microinjector |
| Femtotips Microloader | Fisher scientific | E5242956003 | |
| Gentamicin | MilliporeSigma | Cat# G1272 | |
| Gentamycin | MilliporeSigma | Cat# 1272 | |
| Glass bottom dish | Mat Tek Corporation | Cat# P35G-1.0-20-C | |
| Hepes | MilliporeSigma | Cat# H3784 | |
| Hepes Sodium Salt | MilliporeSigma | Cat # H3784 | |
| Hera Cell vios 160i | Thermo | N/A | CO2 incubator |
| Leica TCP SP8 spectral laser scanning confocal micorscope with inverted stand DMI6000 B | Leica Microsystems, Inc | N/A | |
| L-Glutamine | MilliporeSigma | Cat#G8540 | |
| Magnesium sulfate dihydrate | MilliporeSigma | Cat# M7774 | |
| MaiTai DeepSee Ti-Sapphire femtosecond laser | Spectra-Physics | N/A | |
| mCH-Cep192 cRNA | N/A | ||
| Medium Essential Medium Eagle - MEM | MilliporeSigma | Cat #M0258 | |
| Milrinone | MilliporeSigma | Cat# M4659 | |
| Mineral oil | MilliporeSigma | Cat# M5310 | |
| Minimum essential medium eagle (MEM) | MilliporeSigma | Cat# M0268 - 1L | |
| Mouse: Cep192-eGFP reporter CF-1 | N/A | ||
| Petri dish (100 mm) | Fisherbrand | Cat# FB0875712 | |
| Petri dish (35 mm) | Corning | Cat# 430165 | |
| Petri dish (60 mm) | Falcon | Cat# 351007 | |
| Phenol Red | MilliporeSigma | Cat# P5530 | |
| Polyvinylpyrolidone | MilliporeSigma | Cat# P2307 | |
| Polyvinylpyrolidone (PVP) | MilliporeSigma | Cat# P2307 | |
| Potassium chloride | MilliporeSigma | Cat# P5405 | |
| Potassium phosphate monobasic | MilliporeSigma | Cat# P5655 | |
| Pregnant mare´s serum gonadotropin | Lee BioSolutions | Cat# 493-10-10 | |
| Pyruvic acid | MilliporeSigma | Cat# P4562 | |
| Pyruvic acid | MilliporeSigma | Cat# P4562 | |
| Sewing needles | D.M.C | N/A | N° 5 * 16 Needles |
| Sodium bicarbonate | MilliporeSigma | Cat# S5761 | |
| Sodium chloride | MilliporeSigma | Cat# S5886 | |
| Stage-top heating insert P | Pecon | # 0426.300 | |
| Sterezoom S9i | Leica | N/A | Stereomicroscope |
| Syringe 1 mL | BD company | Cat# 309597 | |
| Taurine | MilliporeSigma | Cat# T0625 | |
| Temperature controller Tempcontrol 37-2 digital | Pecon | # 0503.000 | |
| The Cube temperature controller for the cage incubator | Life Imaging Services GmbH |
Ссылки
- Bennabi, I., Terret, M. E., Verlhac, M. H. Meiotic spindle assembly and chromosome segregation in oocytes. Journal of Cell Biology. 215 (5), 611-619 (2016).
- Hashimoto, N., Kishimoto, T. Regulation of meiotic metaphase by a cytoplasmic maturation-promoting factor during mouse oocyte maturation. Development Biology. 126 (2), 242-252 (1988).
- Kitajima, T. S., Ohsugi, M., Ellenberg, J. Complete kinetochore tracking reveals error-prone homologous chromosome biorientation in mammalian oocytes. Cell. 146 (4), 568-581 (2011).
- Azoury, J., Verlhac, M. H., Dumont, J. Actin filaments: Key players in the control of asymmetric divisions in mouse oocytes. Biology of the Cell. 101 (2), 69-76 (2009).
- Li, H., Guo, F., Rubinstein, B., Li, R. Actin-driven chromosomal motility leads to symmetry breaking in mammalian meiotic oocytes. Nature Cell Biology. 10 (11), 1301-1308 (2008).
- Schuh, M., Ellenberg, J. A new model for asymmetric spindle positioning in mouse oocytes. Current Biology. 18 (24), 1986-1992 (2008).
- Pimenta-Marques, A., Bettencourt-Dias, M. Pericentriolar material. Current Biology. 30 (12), 687-689 (2020).
- Hinchcliffe, E. H. The centrosome and bipolar spindle assembly: Does one have anything to do with the other. Cell Cycle. 10 (22), 3841-3848 (2011).
- Szollosi, D., Calarco, P., Donahue, R. P. Absence of centrioles in the first and second meiotic spindles of mouse oocytes. Journal of Cell Science. 11 (2), 521-541 (1972).
- Schuh, M., Ellenberg, J. Self-organization of MTOCs replaces centrosome function during acentrosomal spindle assembly in live mouse oocytes. Cell. 130 (3), 484-498 (2007).
- Clift, D., Schuh, M. A three-step MTOC fragmentation mechanism facilitates bipolar spindle assembly in mouse oocytes. Nature Communications. 6, 7217 (2015).
- Luksza, M., Queguigner, I., Verlhac, M. H., Brunet, S. Rebuilding MTOCs upon centriole loss during mouse oogenesis. Developmental Biology. 382 (1), 48-56 (2013).
- Balboula, A. Z., et al. Haspin kinase regulates microtubule-organizing center clustering and stability through Aurora kinase C in mouse oocytes. Journal of Cell Science. 129 (19), 3648-3660 (2016).
- Breuer, M., et al. HURP permits MTOC sorting for robust meiotic spindle bipolarity, similar to extra centrosome clustering in cancer cells. Journal of Cell Biology. 191 (7), 1251-1260 (2010).
- Londoño-Vásquez, D., Rodriguez-Lukey, K., Behura, S. K., Balboula, A. Z. Microtubule organizing centers regulate spindle positioning in mouse oocytes. Developmental Cell. 57 (2), 197-211 (2022).
- Konig, K., Riemann, I., Fischer, P., Halbhuber, K. J. Intracellular nanosurgery with near infrared femtosecond laser pulses. Cellular and Molecular Biology. 45 (2), 195-201 (1999).
- Galbraith, J. A., Terasaki, M. Controlled damage in thick specimens by multiphoton excitation. Molecular Biology of the Cell. 14 (5), 1808-1817 (2003).
- Maghelli, N., Tolic-Norrelykke, I. M. Laser ablation of the microtubule cytoskeleton: Setting up and working with an ablation system. Methods in Molecular Biology. 777, 261-271 (2011).
- Chatot, C. L., Ziomek, C. A., Bavister, B. D., Lewis, J. L., Torres, I. An improved culture medium supports development of random-bred 1-cell mouse embryos in vitro. Journal of Reproduction and Fertility. 86 (2), 679-688 (1989).
- Tsafriri, A., Chun, S. Y., Zhang, R., Hsueh, A. J., Conti, M. Oocyte maturation involves compartmentalization and opposing changes of cAMP levels in follicular somatic and germ cells: Studies using selective phosphodiesterase inhibitors. Developmental Biology. 178 (2), 393-402 (1996).
- Greaney, J., Subramanian, G. N., Ye, Y., Homer, H. Isolation and in vitro culture of mouse oocytes. Bio Protocol. 11 (15), 4104 (2021).
- Khodjakov, A., Cole, R. W., Rieder, C. L. A synergy of technologies: Combining laser microsurgery with green fluorescent protein tagging. Cell Motility and the Cytoskeleton. 38 (4), 311-317 (1997).
- Pavin, N., Tolic, I. M. Mechanobiology of the mitotic spindle. Developmental Cell. 56 (2), 192-201 (2021).
- Khodjakov, A., Cole, R. W., Oakley, B. R., Rieder, C. L. Centrosome-independent mitotic spindle formation in vertebrates. Current Biology. 10 (2), 59-67 (2000).
- Aist, J. R., Liang, H., Berns, M. W. Astral and spindle forces in PtK2 cells during anaphase B: a laser microbeam study. Journal of Cell Science. 104, 1207-1216 (1993).
- Bennabi, I., Manil-Segalen, M. Laser Ablation of microtubule-chromosome attachment in mouse oocytes. Methods in Molecular Biology. 1818, 153-161 (2018).
- Milas, A., Jagric, M., Martincic, J., Tolic, I. M. Optogenetic reversible knocksideways, laser ablation, and photoactivation on the mitotic spindle in human cells. Methods in Cell Biology. 145, 191-215 (2018).
- Warzych, E., Lipinska, P. Energy metabolism of follicular environment during oocyte growth and maturation. Journal of Reproduction and Development. 66 (1), 1-7 (2020).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены